外源茉莉酸甲酯对盐胁迫下黄芩种子萌发及幼苗生理特性的影响
李小玲,华智锐
(商洛学院生物医药与食品工程学院,陕西商洛726000)
外源茉莉酸甲酯对盐胁迫下黄芩种子萌发及幼苗生理特性的影响
李小玲,华智锐
(商洛学院生物医药与食品工程学院,陕西商洛726000)
为探讨外源茉莉酸甲酯能否缓解盐胁迫对商洛黄芩的伤害及其适宜浓度,解决土壤盐渍化问题,以商洛黄芩种子为材料,研究0.5%NaCl胁迫处理下,不同浓度茉莉酸甲酯对商洛黄芩种子萌发及幼苗生理特性的影响。结果表明,50 μmol/L茉莉酸甲酯可缓解盐害,显著提高黄芩种子的发芽势、发芽率,提高叶片SOD,POD活性及叶绿素含量,降低MDA含量,可为解决黄芩生产中有关盐胁迫问题及耐盐品种的选育提供理论参考。
黄芩;盐胁迫;茉莉酸甲酯;生理特性
随着温室效应的加剧及人类对耕地的不合理利用,土壤盐渍化问题日益严峻,其已成为限制农业可持续发展的主要因素[1-2]。目前,在干旱地区约有20%的耕地已遭受次生盐渍化的危害[3-4],为了解决这一问题,提高植物的产量及品质,近年来,有许多研究结果发现,通过化学调控手段可以提高植物的耐盐性、缓解盐害对植物生长发育的影响[6-7]。
非生物胁迫下,茉莉酸甲酯(MeJA)作为一种植物生长调节剂及信号分子,其生理效应非常广泛。研究表明,茉莉酸甲酯与植物的抗性密切相关,它作为信号分子参与植物在高温、盐胁迫、干旱、低温等条件下的抗逆反应,茉莉酸甲酯对植物生理特性的影响主要表现为可诱导植物产生蛋白酶抑制剂(PI)和多酚氧化酶(PPO),进而增加各种防御蛋白的活性水平,导致生物碱和酚酸类次生物质的积累,从而形成防御结构[8]。
黄芩别名山茶根、土金茶根,是唇形科黄芩属多年生草本植物[9-10]。黄芩的根入药,味苦、性寒,有清热燥湿、泻火等功效。目前,对于黄芩的研究主要集中在化学成分、药理药效、种质资源等方面[11-13],但对黄芩胁迫生理方面的研究则较少,且关于外源茉莉酸甲酯处理提高黄芩耐盐性的研究至今尚未见报道。
本研究以商洛黄芩种子作为试验材料,通过对其各项生理生化指标的测定,以探讨外源茉莉酸甲酯对商洛黄芩盐害的缓解效应,旨在为利用茉莉酸甲酯缓解黄芩盐害提供理论依据,为解决黄芩栽培中的盐胁迫问题及耐盐品种的选育提供有效途径。
1 材料和方法
1.1 试验材料
试验所用黄芩种子购于陕西天士力植物药业有限责任公司。茉莉酸甲酯购自西安晶博试剂公司,其为化学纯试剂CP级。
1.2 试验方法
1.2.1 盐胁迫浓度的确定将黄芩种子进行培养。每皿中放入80粒种子,将种子播于不同浓度氯化钠溶液(0.2%,0.3%,0.4%,0.5%,0.6%)的培养皿中,共5个处理(S)和1个对照(CK1,蒸馏水),置于生化培养箱(光照16 h/d,相对湿度28%~50%,温度25℃)中进行培养。每2 d浇一次不同盐浓度溶液,直到种子萌发,计算发芽率,筛选出种子萌发受到抑制的最低盐浓度,将其作为盐胁迫试验的处理浓度。
1.2.2 种子萌发生理指标的测定挑取无病虫害、籽粒饱满且大小一致的黄芩种子,先用75%酒精消毒3 min,再用无菌水冲洗3~5次,将此操作重复3次,最后放在55℃的恒温水浴锅中8~12 h。取出后用吸水纸将种子表面的水分吸干,以铺有双层滤纸的培养皿为发芽床,进行种子发芽试验。胁迫所用的NaCl浓度为1.2.1筛选出的盐浓度。试验共设7个处理:水对照(CK1);0.5%NaCl盐对照(CK2);0.5%NaCl+10 μmol/L茉莉酸甲酯(T1);0.5%NaCl+30 μmol/L茉莉酸甲酯(T2);0.5%NaCl+50 μmol/L茉莉酸甲酯(T3);0.5%NaCl+70 μmol/L茉莉酸甲酯(T4);0.5%NaCl+100 μmol/L茉莉酸甲酯(T5)。种子置于生化培养箱(光照16 h/d,相对湿度28%~50%,温度25℃)中进行培养。每2 d浇一次不同浓度的外源物质和一定浓度的NaCl溶液,第5天测定发芽势,第7天测定发芽率。

式中,Gt为在t日的发芽数。
1.2.3 黄芩幼苗各项生理指标的测定[14]
1.2.3.1 叶绿素a、叶绿素b含量利用丙酮提取法测定称取新鲜叶片0.25 g,加纯丙酮5 mL、少许CaCO3和石英砂,研磨成匀浆,再加80%丙酮5 mL,将匀浆转入离心管,离心弃沉淀,上清液用80%丙酮定容至20mL作为提取液。取上述色素提取液1mL,加80%丙酮4 mL稀释后转入比色杯中,以80%丙酮为对照,分别测定663,645 nm处的OD值。色素提取液中叶绿素a、叶绿素b及叶绿素a+b的浓度(mg/L)利用如下公式进行计算。

1.2.3.2 超氧化物歧化酶活性利用比色法测定称取处理的样品各0.25 g,逐一加入5倍于样品量的酶提取液,冰浴中研磨后以纱布过滤,经4 000 r/min离心20 min,上清液依次为各处理的粗酶提取液。测定前在盛有3 mL反应混合液的试管中,加入适量的粗酶液(以使抑制达50%左右的酶浓度为佳),混匀后放在透明试管架上,于光照培养箱中准确照光10 min,迅速测定560 nm下的OD值,以不加酶液的照光管为对照,以蒸馏水调零,计算反应被抑制的百分比。
SOD活力(U/mg)=(对照组OD值-样品OD值)/(对照组OD值×50%×加入粗酶液中的蛋白质含量(mg))(4)
1.2.3.3 过氧化物酶活性利用比色法测定过氧化物酶(POD)存在于植物的各个组织中。在有过氧化氢存在的条件下,POD能使愈创木酚发生氧化反应生成茶褐色物质,这种茶褐色物质在波长470 nm处有吸光值,测量出470 nm波长处的OD值,即可以计算出过氧化物酶的活性。
粗酶液的提取。取商洛黄芩叶片0.25 g,用镊子将其剪碎,放入研钵中,并向研钵中加入5 mL 20mmol/LKH2PO4,研磨成匀浆,再用5mL的KH2PO4溶液清洗。以4 000 r/min离心15 min后,收集上清液存放在冰箱中。
酶活性的测定。取出比色杯2只,在其中1只比色杯中加入反应混合液3 mL,KH2PO41 mL,作为调零对照;另1只比色杯中加入反应混和液3 mL,上述的酶液1 mL,立即开始用秒表计时。在分光光度计470 nm波长下测量OD值,每隔1 min读数一次。用每分钟OD值的变化值来表示酶活性的大小,即以ΔA470/min·鲜质量(g)来表示。
1.2.3.4 丙二醛含量利用TBA法测定在逆境胁迫条件下,植物受到伤害时,会发生膜质过氧化反应而产生丙二醛(MDA)。植物的逆境和MDA含量有很大的关系。在测量植物体内MDA含量时,经常在酸性条件下用植物体中的MDA和硫代巴比妥酸(TBA)加热发生显色反应,产生红棕色的三甲川(3,5,5-三甲基恶唑2,4-二酮)产物。3,5,5-三甲基恶唑2,4-二酮的最大吸收波长在532 nm处。但是,在测量植物中的MDA含量时,会受到其他产物的影响,其中影响最严重的是可溶性糖。可溶性糖也可以和硫代巴比妥酸发生显色反应,其反应的产物在波长450,532 nm处都有吸收。植物在受到逆境胁迫时,植物体中的可溶性糖含量会增加。因此,在测定植物体中MDA含量时一定要排除可溶性糖含量的干扰。测定出植物在波长532,450 nm处的OD值,就可计算出植物中的MDA含量。
MDA的提取。取商洛黄芩叶片0.25 g,用镊子将其剪碎。向研钵中加入2 mL三氯乙酸(TCA)和少量石英砂,进行研磨,再加入8 mL的TCA进行充分研磨。匀浆液在3 000 r/min下离心10 min,上清液即为样品提取液。
显色反应及测定。吸取2 mL提取液加入到试管中,再加入2 mL 0.6%的TBA溶液,混匀,并在试管上加塞,放在沸水中煮沸12~15 min后,用冷水快速冷却,并在3 000 r/min下离心,取出上清液。测定在532,450 nm波长处的OD值,即可计算出MDA的含量。对照管用2 mL的蒸馏水来代替提取液校零。

2 结果与分析
2.1 盐胁迫浓度的确定
由图1可知,随着盐处理浓度的升高,种子的发芽率随之降低,这是因为NaCl使得黄芩种子细胞膜破坏,从而导致保护酶系统破坏及渗透调节物质含量降低,最终导致黄芩种子发芽率降低,S5处理的发芽率达到最低,其不适宜黄芩生长。所以,S4为抑制能力最强的浓度。

2.2 不同浓度茉莉酸甲酯对商洛黄芩种子萌发的影响
由表1可知,与CK1相比,盐胁迫后,黄芩种子的发芽率和发芽势明显降低,表明0.5%NaCl处理显著抑制了黄芩种子的正常萌发。当用不同浓度的茉莉酸甲酯(10~100 μmol/L)处理后,黄芩种子发芽率高于盐胁迫对照(CK2)而低于蒸馏水对照(CK1),其中,经过50 μmol/L的MeJA处理后(T3)的结果最为明显,发芽率和发芽势分别达到36.8%和30.5%,说明适宜浓度的茉莉酸甲酯可有效缓解盐胁迫对黄芩种子萌发造成的伤害,但过高浓度的茉莉酸甲酯对种子萌发又起明显的抑制作用。
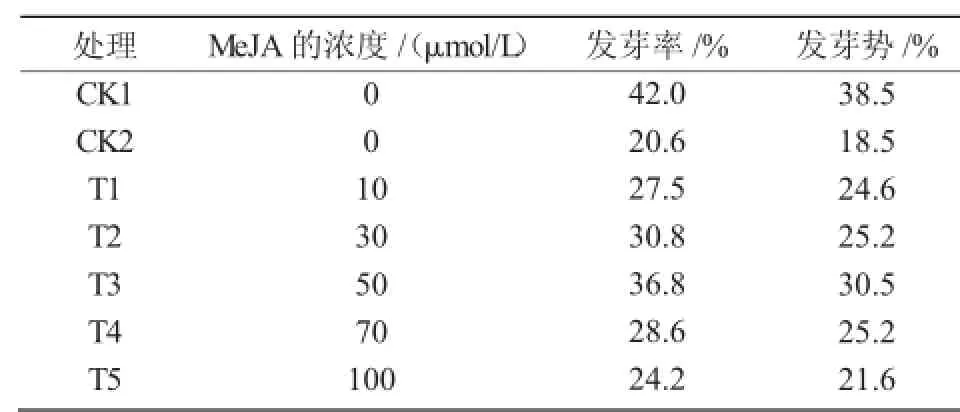
表1 不同浓度茉莉酸甲酯(MeJA)对盐胁迫下黄芩种子发芽率和发芽势的影响
2.3 不同浓度茉莉酸甲酯对商洛黄芩超氧化物歧化酶(SOD)活性的影响
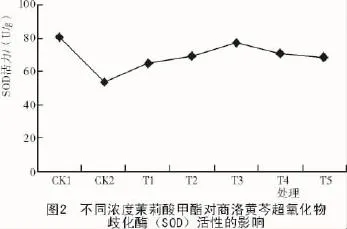
由图2可知,CK2与CK1相比,SOD活性降低了27.6 U/g,说明盐胁迫使黄芩幼苗叶片细胞内的SOD活性降低。经不同浓度的MeJA处理后,黄芩幼苗叶片内SOD活性呈现先上升后下降的趋势,其中,T3时SOD活性最高,达到77 U/g,MeJA处理的SOD活性增强效果最为明显。盐胁迫降低了黄芩幼苗SOD活性,适宜浓度的茉莉酸甲酯能有效地增强黄芩幼苗叶片中的SOD活性,从而缓解盐胁迫下黄芩幼苗生长所受到的伤害程度。
2.4 不同浓度茉莉酸甲酯对商洛黄芩过氧化物酶(POD)活性的影响
由图3可知,CK2与CK1相比,POD活性降低了0.035 U/(g·min),说明盐胁迫明显抑制了黄芩幼苗叶片细胞内的POD活性。经不同浓度的MeJA处理后,POD活性呈现先升后降的趋势,且均高于CK2低于CK1。说明MeJA明显提高了盐胁迫下黄芩幼苗叶片中POD的活性,且在T3时最为明显,效果最好。但随着MeJA浓度的升高,T4,T5的POD活性明显下降,说明一定的MeJA浓度对黄芩POD活性有促进作用,超过一定浓度则会产生抑制作用。

2.5 不同浓度茉莉酸甲酯对商洛黄芩叶绿素a和叶绿素b含量的影响
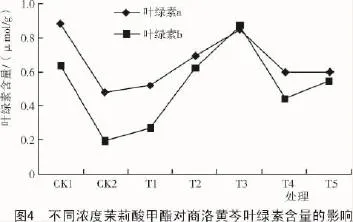
由图4可知,CK1与CK2比较,盐胁迫下黄芩幼苗叶片叶绿素含量显著下降。经外源MeJA处理后,叶绿素a和叶绿素b含量都呈现出先升后降的变化趋势,其中,叶绿素b含量的变化较叶绿素a含量更为明显,且在T3时,2种叶绿素含量均达到最大,说明此浓度的MeJA可促进光合色素的升高,且能有效缓解盐胁迫对黄芩幼苗叶片光合色素合成的抑制效应。
2.6 不同浓度茉莉酸甲酯对商洛黄芩丙二醛(MDA)含量的影响
由图5可知,CK2与CK1相比,盐胁迫下黄芩幼苗叶片MDA含量提高,说明盐胁迫后膜系统受到破坏,与CK2相比,通过添加低浓度的茉莉酸甲酯能显著降低黄芩幼苗MDA含量,缓解对膜的破坏,其中,T3时MDA含量降低最大,抑制效果最为明显;当浓度为70 μmol/L时反而提高了MDA含量,说明高浓度的外源物质则加重盐胁迫对植物的伤害,所以一定浓度的外源MeJA能够有效降低黄芩幼苗叶片MDA的含量,从而缓解盐胁迫下黄芩幼苗生长所受到的伤害程度。

3 讨论
盐胁迫下植物体内活性氧的积累是导致植物盐害的主要原因之一,活性氧导致膜质过氧化作用,进而破坏细胞膜的结构及功能。盐胁迫下,植物体内叶绿素生物合成和各种酶的产生受到抑制,而植物对盐胁迫的响应之一就是保护酶(SOD,POD)活性的变化。MDA是活性氧启动的细胞膜脂质过氧化产物之一,膜脂的过氧化作用可直接导致细胞膜结构和功能的破坏,MDA含量的高低反映了活性氧代谢及对细胞膜破坏的程度。
本研究结果表明,茉莉酸甲酯提高了非生物胁迫下植物幼苗叶片的最大光化学效率,还使得超氧化物歧化酶(SOD)和过氧化物酶(POD)活性升高,丙二醛(MDA)含量降低,表明MeJA作为一种植物生长调节物质,对缓解逆境对植物的损伤具有一定的作用[15]。有研究表明,SOD,POD活性的升高可清除体内过剩的活性氧,维持活性氧产生及清除之间的平衡,保护膜结构,提高植物的抗逆性[16]。
MeJA不仅可以提高植物的抗逆性,而且对植物的生理调节有抑制作用,当MeJA浓度超过抵御非生物胁迫作用浓度时,MeJA就会促进植物体内乙烯的生成、促进叶片衰老、叶片脱落、气孔关闭,抑制植物种子萌发、营养生长、花芽形成、叶绿素形成和光合作用等[17-18]。
目前,不同外源物质对盐胁迫条件下植物生长发育影响的研究已成为热点[19-20],植物的耐盐抗盐性是植物体内诸多影响因素综合作用的体现[21-22],不仅受多个基因的调控,还受到外界环境因子的影响和制约。添加外源物质是一种成本较低的缓解盐胁迫的方式,有助于研究植物的耐盐抗盐机制和恶劣环境中植物生长发育情况,也有利于新型植物肥料的开发利用[6]。本试验结果表明,50 μmol/L的茉莉酸甲酯有助于商洛黄芩的生长,但对于大面积栽培商洛黄芩,此浓度只可作为参考,因为各项生理指标相关研究必须结合植物自身结构特点和环境因素,才能准确地综合评价外源物质缓解盐害的能力。所以,对于外源茉莉酸甲酯在生产实践中是否适合大面积种植使用及其具体的适宜使用浓度,还需进一步研究探讨。
[1]王遵亲.中国盐渍化[M].北京:科学出版社,1993.
[2]郝金标,张福锁,田长彦.新疆盐生植物[M].北京:科学出版社,2006.
[3]宁建凤,郑青松,杨绍海,等.高盐胁迫对罗布麻生长及离子平衡的影响[J].应用生态学报,2010,21(2):325-330.
[4]赵勐,范海,赵可夫.NaCl,KCl和NaNO3对盐递碱蓬生长以及植物体内离子组成和分布的效应[J].植物生理学通讯,2008,44(2):263-267.
[5]Kovda V A.Loss of productive land due to salinazation[J].Ambio,1983,2(1):91-93.
[6]尹相博,李青,王绍武.外源物质缓解盐胁迫下植物幼苗生长的研究进展[J].黑龙江农业科学,2013,23(11):147-150.
[7]徐茂军,董菊芳,张刚.NO对金丝桃悬浮细胞生长及金丝桃素生物合成的促进作用研究[J].生物工程学报,2005,21(13):66-70.
[8]Fung R W M,Wang C Y,Smith D L,et al.MeSA and MeJAincrease steady-state transcript levels of alternative oxidase and resistance against chilling injury in sweet peppers(Capsicum annuum L.)[J]. Plant Science,2004,166(22):711-719.
[9]钱江.黄芩苷对过氧化脂质生成的抑制作用[J].中国药材大学学报,1995,22(5):308-310.
[10]吴晓玲,胡海英,邓光存.黄芩愈伤组织诱导条件的研究[J].生物技术,2005,12(2):1-2.
[11]徐丹洋,陈佩东,张丽,等.黄芩的化学成分研究[J].中国实验方剂学杂志,2011,17(1):78-80.
[12]张瑜,武斌,许建卫.黄芩药理作用的研究进展[J].医学综述,2013,19(6):1091-1093.
[13]崔璐,谷红霞,路俊仙,等.黄芩种质资源与栽培现状分析[J].中医药学报,2010,38(1):69-72.
[14]高俊凤.植物生理学试验技术[M].西安:世界图书出版公司,2000.
[15]邹清成,朱开元,刘慧春,等.外源茉莉酸甲酯对非生物胁迫下蝴蝶兰幼苗叶绿素荧光和抗氧化指标的影响[J].植物生理学报,2011(9):913-917.
[16]陈培琴,郁松林,詹妍妮,等.茉莉酸对葡萄幼苗耐热性的影响[J].石河子大学学报,2006,24(1):87-91.
[17]郑艳冰,吴琼.茉莉酸类化合物的抗逆生理作用研究进展[J].生物技术,2010,13(2):1-2.
[18]张春平,何平,杜丹丹,等.外源Ca2+及NO供体硝普钠(SNP)对盐胁迫下紫苏种子萌发及幼苗抗氧化酶活性的影响[J].中国中药杂志,2010,35(23):3114-3119.
[19]汪新文.茉莉酸参与植物逆境胁迫的研究进展[J].安徽农学通报,2008,14(6):29-35.
[20]惠红霞,许兴,李前荣.外源甜菜碱对盐胁迫下枸杞光合功能的改善[J].西北植物学报,2003,23(12):2137-2422.
[21]Munns R,Tester M.Annual Review of Plant Biology[J].Science,2008,59(5):651-652.
[22]任丽丽,任春明,赵自国.植物耐盐性研究进展[J].山西农业科学,2010,38(5):87-90.
Effects of Exogenous Methyl Jasmonate on the Scutellaria baicalensis Seed Germination and Seedling Physiological Characteristics under Salt Stress
LI Xiaoling,HUAZhirui
(College of Biology Pharmacy and Food Engineering,Shangluo University,Shangluo726000,China)
To explore the effect of exogenous methyl jasmonate ester on the damage of salt stress on the root and the appropriate concentration of Scutellaria baicalensi in Shangluo,solve the problem of soil salinization,this paper was taking the seed of Shangluo Scutellaria baicalensis as material,studied 0.5%processing under NaCl stress,different concentration of methyl jasmonic on the effect of Shangluo Scutellaria baicalensis seed germination and seedling physiological characteristics.The results showed that 50 μmol/L methyl jasmonate could alleviate salt injury,significantly improve Scutellaria baicalensis seeds germination potential,germination rate,increase SOD,POD activity and chlorophyll content,decrease the content of MDA.The results can provide theoretical reference for problems of salt stress and salt tolerant varieties in the production of radix.
Scutellaria baicalensis;salt stress;methyl jasmonate;physiological characteristics
S567.23+9
A
1002-2481(2016)11-1603-05
10.3969/j.issn.1002-2481.2016.11.07
2016-06-12
陕西省科技厅农业攻关项目(2009K01-11);陕西省教育厅项目(09JK418)
李小玲(1980-),女,陕西蓝田人,副教授,硕士,主要从事植物生理生态研究工作。

