知母醇提物对INS-1胰岛β细胞功能的影响
张国改,曾平燕,肖雪蓉,冯毅凡,吴霞
(1.广东药科大学 中心实验室,广东 广州 510006; 2.广州市香雪制药股份有限公司,广东 广州 510530)
知母醇提物对INS-1胰岛β细胞功能的影响
张国改1,曾平燕2,肖雪蓉1,冯毅凡1,吴霞1
(1.广东药科大学 中心实验室,广东 广州 510006; 2.广州市香雪制药股份有限公司,广东 广州 510530)
目的 研究知母醇提物对正常和抵抗INS-1胰岛β细胞的增殖及分泌功能的影响,探讨知母醇提物对正常细胞的毒性影响以及对胰岛素抵抗细胞的改善作用。方法 采用MTT法测定知母醇提物对正常INS-1胰岛β细胞的增殖作用;知母醇提物干预正常细胞及胰岛素抵抗INS-1胰岛β细胞,分为溶媒组(ME)、胰岛素分泌模型组(MC)、胰岛素抵抗组(IR)、阳性药格列本脲组(Gli)和罗格列酮组(ROZ)及知母醇提物组,测定各组基础胰岛素分泌(BIS)和葡萄糖刺激的胰岛素分泌(GSIS)值。结果 知母醇提物质量浓度在0.3~30 μg/mL时对正常细胞有明显的增殖作用,与MC组的GSIS比较,差异均有统计学意义(P<0.05或P<0.01);与IR组的BIS和GSIS比较,知母醇提物浓度在3~30 μg/mL能显著促进细胞的BIS能力,同时其质量浓度在0.3~30 μg/mL能显著性促进GSIS功能。结论 知母醇提物在一定浓度范围内对正常INS-1胰岛β细胞的毒性较低,同时能通过促进正常细胞的增殖,增强其胰岛素分泌能力,改善细胞自身的胰岛素抵抗。
知母醇提物; INS-1胰岛β细胞; 增殖; 毒性
中药知母(AnemarrhenaeRhizoma)为百合科植物知母(AnemarrhenaasphodeloidesBge.)的干燥根茎,现代药理研究表明其具有改善记忆力[1]、抗氧化[2]、抗炎[3]、抗肿瘤[4]、降血糖[5]、降脂[6]等多种药理活性。其主要的活性成分包括知母皂苷、双苯吡酮和知母多糖等[7]。知母醇提物主要包括知母皂苷和双苯吡酮。目前,国内外大量文献报道了知母可以促进胰岛素分泌,改善胰岛素抵抗(IR),降低血糖以及维持血糖稳定,用于治疗2型糖尿病,并对糖尿病并发症包括白内障、血脂代谢紊乱等有防治作用[8]。
本实验通过研究知母醇提物对正常INS-1胰岛β细胞的增殖作用,以及胰岛素的分泌功能,摸索给药剂量,探讨其对正常INS-1胰岛β细胞的毒性影响及是否有增强细胞功能等作用;持续高糖刺激INS-1胰岛胰岛β细胞,使其出现IR现象,考察知母醇提物对IR的INS-1细胞的改善作用。
1 材料
1.1 仪器
倒置显微镜(江南显微镜有限公司);BP210分析天平(Sartorius公司);酶标仪(美国Bio-RAD);-80 ℃超低温冰箱(中科美菱公司);KDC-220HR 高速冷冻离心机(科大创新股份有限公司中佳分公司)。
1.2 实验药材与试剂
知母药材购自广州致信药业有限公司,由广东药科大学中药学院刘基柱副教授鉴定为百合科植物知母(AnemarrhenaasphodeloidesBge.)的干燥根茎。RPMI1640培养基、胎牛血清、双抗、丙酮酸钠、β-巯基乙醇、0.05%胰酶-EDTA(Gibco);HEPES(雷根生物);DMSO(Sigma);PBS缓冲溶液(Gibco);MTT粉(广州瑞舒生物科技有限公司);格列苯脲、罗格列酮(左克齐云试剂)。
1.3 细胞
INS-1胰岛β细胞株即大鼠胰岛素瘤细胞株购自中国医学科学院北京协和细胞资源中心。
2 方法
2.1 溶液的配制
完全培养液:取5 mL 100×双抗,50 mL FBS,500 μL HEPES溶液,500 μL 丙酮酸钠溶液,50 μLβ-巯基乙醇,加到450 mL 基础RPMI1640培养液中即可,4 ℃保存,2周有效。细胞冻存液:按照FBS∶DMSO=9∶1(体积比)配置,置于4 ℃预冷,现配现用。刺激INS-1胰岛细胞分泌用葡萄糖母液:准确称取1.68 g葡萄糖粉末,并溶于4 mL PBS,用0.22 μL微孔滤膜过滤并分装,于-20 ℃保存即可。知母醇提物制备参考本实验室课题组前期的研究[9],称取知母药材300 g,粉碎,加入8倍量80%乙醇,加热回流提取2次每次1 h,合并提取液,浓缩干燥即得。知母醇提物溶液:准确称取1 mg 知母醇提物,加入适量的DMSO溶解提取物,配成0.1 mg/μL的母液,于-20 ℃保存。
2.2 MTT法测定INS-1胰岛β细胞生长曲线
取生长状态良好的INS-1胰岛细胞,消化后计数,调整细胞密度至3×104个/ mL,接种于96孔板,设24、48、72、96、120 h这5个时间点,各设6个复孔及相应空白对照。每个时间点取对应孔板,小心弃上清后加入120 μL含MTT溶液的基础培养液(1∶5),37 ℃继续培养4 h,570 nm波长下测定吸光度A值,计算细胞生长曲线。
2.3 MTT法测定知母醇提物对正常INS-1胰岛β细胞增殖的作用
实验分为空白组(KB)、溶媒组(ME,内含0.01%DMSO)、知母醇提物组(ZM),其质量浓度分别为0.3、3、30、60、80、200 μg/mL。取适量对数生长期的细胞,消化后计数,调整细胞密度至1×105个/mL,接种于96孔板,每组设置6个复孔,预培养24 h,分组给药作用48 h后,小心吸弃上清培养液,MTT法,酶标仪570 nm波长下测定吸光度A值。以存活率表示INS-1胰岛细胞的增殖程度:存活率=(实验组A值-调零组A值)/(空白对照组A值-调零组A值)×100 %。
2.4 知母醇提物对正常INS-1胰岛β细胞胰岛素分泌的影响
实验分为溶媒组(ME,内含0.01%DMSO)、胰岛素分泌模型组(MC,内含0.01%DMSO+5.6 mmol/L或16.7 mmol/L葡萄糖)、阳性药(格列苯脲)组(Gli,内含0.15 μmol/L格列苯脲 + 5.6 mmol/L或16.7 mmol/L葡萄糖)、知母醇提物组(分别为30、3、0.3 μg/mL的知母醇提物+ 5.6 mmol/L或16.7 mmol/L葡萄糖)。取对数生长期的细胞,消化后计数,调整细胞密度至1×105个/mL,接种于48孔板,预培养24 h后,按分组给药干预,药物作用48 h后,小心吸弃上清培养液,PBS洗后加入300 μL/孔无糖培养基于培养箱中平衡30 min,基础葡萄糖糖刺激组(BIS),高糖刺激组(GSIS)分别给予5.6 mmol/L、16.7 mmol/L葡萄糖-无糖培养溶液,300 μL/孔;空白组给予相同体积无糖培养基,37 ℃培养1 h后,取上清液,-20 ℃保存待测胰岛素量。
2.5 知母醇提物对IR的INS-1胰岛β细胞分泌的影响
实验分为胰岛素分泌模型组(MC):0.01%DMSO+5.6 mmol/L或16.7 mmol/葡萄糖;胰岛素抵抗模型组(IR):40 mmol/L葡萄糖+0.01%DMSO+5.6 mmol/L或16.7 mmol/L葡萄糖;阳性药(罗格列酮)组(ROZ):40 mmol/L葡萄糖+1.0 μmol/L罗格列酮+ 5.6 mmol/L或16.7 mmol/L葡萄糖;知母醇提物组:30、3、0.3 μg/mL知母醇提物+40 mmol/L葡萄糖+ 5.6 mmol/L或16.7 mmol/L葡萄糖。取对数生长期的细胞,消化后计数,调整细胞密度至1×105个/mL,接种于48孔板。预培养24 h后,小心吸弃上清培养液,按分组给药干预。除胰岛素分泌模型组外,其余各组加入含40 mmol/L葡萄糖的含药培养基,干预48 h后,其余步骤同上。
2.6 数据处理
3 结果
3.1 正常INS-1胰岛β细胞的形态特征
正常的INS-1细胞在显微镜下形态完整,折光性好,细胞膜边缘有明亮的光环,胞质内含有较多黑色点状胰岛素分泌颗粒且呈聚集生长。见图1。
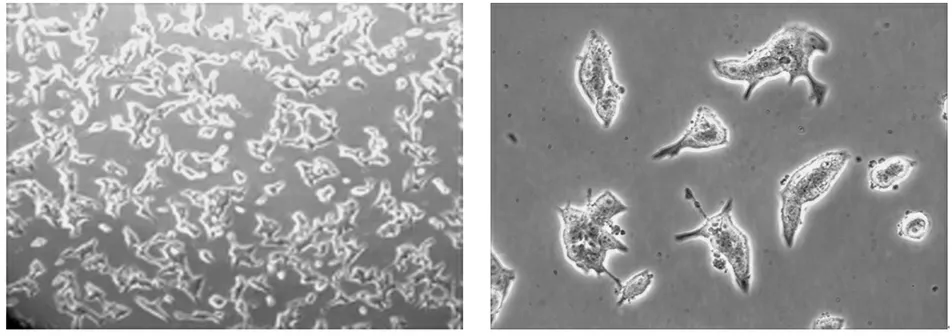
a b
图1 INS-1细胞在显微镜下的形态特征(a. 100×; b. 400×)
Figure 1 Morphology of INS-1 cells under the microscope (a. 100×; b. 400×)
3.2 INS-1胰岛β细胞生长曲线
由图2可见,INS-1细胞约24 h后开始进入对数生长期;48~72 h,细胞呈快速增长,处于对数增长期;72~120 h,细胞基本停止增长,进入平稳期。

0.50.40.30.20.1A57024487296120144t/h
图2 INS-1细胞的生长曲线
Figure 2 Growth curve of INS-1 cells
3.3 知母醇提物对正常INS-1胰岛β细胞的增殖作用
从表1可见,知母醇提物在浓度范围0.3~30 μg/mL时,对INS-1细胞有较为明显的增殖作用(P<0.05或者P<0.01)。但是随着给药浓度的不断增加,知母醇提物对INS-1的增殖作用呈现减弱的趋势。
表1 知母醇提物对正常INS-1细胞的增殖作用


组别剂量/(μg·mL-1)存活率/%空白组-100溶媒组0.01%DMSO100.17±3.81知母醇提物组0.3106.86±5.40*3112.29±6.35**30108.80±5.24**60108.23±5.26**80105.51±3.53*20092.71±6.90*
与空白组比较:*P<0.05,**P<0.01。
3.4 知母醇提物对正常INS-1胰岛β细胞胰岛素释放的影响
知母醇提物对正常 INS-1胰岛β细胞的BIS、GSIS作用结果:(1)与模型组BIS比较,知母醇提物各个浓度均对INS-1细胞的BIS功能无明显影响(P>0.05);(2)与模型组GSIS比较,知母醇提物给药浓度为0.3、30 μg/mL时,显著增强 INS-1细胞的GSIS功能(P<0.05),而在给药浓度为3 μg/mL时表现最为显著(P<0.01)。见表2。
表2 知母醇提物对正常INS-1细胞胰岛素释放的影响


组别剂量/(μg·mL-1)ρ(胰岛素)/(mU·L-1)BISGSIS溶媒组-7.05±0.837.05±0.83模型组-9.16±1.19**12.52±0.34**格列本脲组0.15μmol/L10.91±0.55##14.02±0.27△△知母醇提物组308.60±0.6013.55±0.64△310.19±0.9813.86±0.44△△0.39.22±1.1411.58±0.79△
与溶媒组比较:**P<0.01; 与模型组BIS值比较:##P<0.01; 与模型组GSIS值比较:△P<0.05,△△P<0.01。
3.5 知母醇提物对IR的INS-1胰岛β细胞胰岛素释放的影响
知母醇提物对高糖诱导的IR的INS-1细胞的BIS、GSIS作用结果:(1)与IR模型组BIS比较,知母醇提物在给药浓度为30、3 μg/mL时均能显著促进IR的INS-1细胞的基础分泌能力(P<0.05或P<0.01);(2)与IR模型组GSIS比较,知母醇提物给药浓度为30、0.3 μg/mL均能显著促进IR的INS-1细胞的GSIS功能(P<0.01)。见表3。
表3 知母醇提物对IR的INS-1细胞胰岛素释放的影响


组别c(葡萄糖)/(mmol·L-1)干预剂量/(μg·mL-1)ρ(胰岛素)/(mU·L-1)BISGSIS模型组--9.16±1.1912.52±0.34胰岛素抵抗组40-9.48±0.6610.86±0.64**罗格列酮组401μmol/L11.45±1.21##12.27±0.46△△知母醇提物组403011.11±1.14#14.89±0.85△△40312.94±0.74##11.74±0.65400.310.36±0.7612.70±1.05△△
与模型组比较:**P<0.01; 与IR 的BIS值比较:#P<0.05,##P<0.01; 与IR 的GSIS值比较:△△P<0.01。
4 讨论
4.1 知母醇提物对正常INS-1细胞增殖作用的评价
机体糖代谢异常及胰岛素分泌紊乱与胰岛β细胞数量的减少密切相关[10]。若药物能够促进胰岛β细胞的增殖,即可直接增加细胞数量,间接增加胰岛素分泌量,从而改善糖尿病的糖代谢异常及胰岛素分泌紊乱。本实验发现,在给药浓度0.3~30 μg/mL时,知母醇提物能显著促进INS-1胰岛细胞的增殖,表明中药知母对胰岛β细胞增殖具有明显的促进作用,有利于增加胰岛素分泌细胞总量,提高胰岛素的水平,从而对抗糖尿病时高糖环境对β细胞损伤。
IR作为2型糖尿病(T2DM)另一重要的发病机制,一直受到广泛的关注。近来,研究人员发现IR不只发生在外周靶细胞上,胰岛β细胞本身也有胰岛素信号转导通路,也会发生IR[11]。因此,若能及早改善胰岛β细胞IR,将有利于保护胰岛β细胞功能,延缓T2DM的发生与发展。而T2DM的主要表现为BIS和GSIS能力下降,从实验结果可知,高糖刺激下建立的INS-1细胞胰岛素抵抗模型主要损害了细胞的GSIS能力,而知母醇提物在一定程度上能增强细胞的BIS和GSIS,减轻自身的IR。
4.2 知母醇提物对INS-1细胞的胰岛素分泌作用评价
T2DM发病机理主要归结为两个方面:其一,胰岛细胞损伤、功能异常,导致胰岛素分泌缺陷。即机体长期高血糖使机体胰岛素分泌障碍,加重了胰岛细胞的负荷,最终导致胰岛细胞的损伤,胰岛素分泌功能异常;研究人员认为氧化应激因子如高血糖、高血脂、肥胖等为T2DM高风险发病因子。因此,改善机体的氧化应激状态,减少甚至去除这些氧化应激因子,对T2DM的治疗具有非常重要意义;其二,IR指外周靶组织对胰岛素的敏感性降低以及胰岛β细胞自身过代偿分泌胰岛素导致胰岛素分泌能力减弱。因此,如果能够增强正常胰岛β细胞的胰岛素分泌,使其在高糖刺激下仍能稳定分泌胰岛素,将为T2DM的治疗带来新的契机。
现代药理学研究证明,知母皂苷可以恢复机体胰岛β细胞的功能,增强外周组织对胰岛素的敏感性[12],并可以通过抑制某些受体从而介导代谢通路来调节细胞增殖,减少T2DM并发症[13];双苯吡酮类也被发现具有促进糖尿病大鼠能量代谢,降低IR,调节机体脂质水平等作用[14-15]。根据实验室前期研究结果显示[9],本实验所用知母醇提物含有知母皂苷和双苯吡酮两大类药效成分,与已有报道的相关研究文献一致[7,9]。在给药干预实验研究中发现,知母醇提物可明显促进正常INS-1细胞的增殖,并且对正常INS-1细胞和IR的INS-1细胞增强其释放胰岛素的作用,从而增强正常细胞的功能,当细胞遭遇高糖刺激时减少其产生IR的效应,该实验对研究增强胰岛素细胞功能的药物提供了一定的指导意义。
[1] LEE B,JUNQ K,KIM D H. Timosaponin AIII,a saponin isolated fromAnemarrhenaasphodeloides,ameliorates learning and memory deficits in mice [J]. Pharmacol Biochem Behav,2009,93(2):121-127.
[2] DAR A,FAIZI S,NAQVI S,et al. Analgesic and antioxidant activity of mangiferin and its derivatives:the structure activity relationship [J]. Biol Pharm Bull,2005,28(4):596-600.
[3] KIM J Y,SHIN J S,RYU J H,et al. Anti-inflammatory effect of anemarsaponin B isolated from the rhizomes ofAnemarrhenaasphodeloidesin LPS-induced RAW 264.7 macrophages is mediated by negative regulation of the nuclear factor -κB and p38 pathways [J]. Food Chem Toxicol,2009,47(7):1610-1617.
[5] PRABHU S,JAINU M,SABITHA K E,et al. Role of mangiferin on biochemical alterations and antioxidant status in isoproterenol-induced myocardial infarction in rats [J]. J Ethnopharmacol,2006,107(1):126-133.
[6] 韩兵,李春梅,李敏,等.知母皂苷的降脂及抗动脉粥样硬化作用[J].上海中医药杂志,2006,40(11):68-70.
[7] 王颖异,郭宝林,张立军.知母化学成分的药理研究进展[J].科技导报,2010,28(12):110-115.
[8] 黄芳,徐丽华,郭建明,等.知母提取物的降血糖作用[J].中国生化药物杂志,2005,26(6):332-335.
[9] 吴研.知母提取物的提取及制剂工艺研究[D].广州:广东药学院,2008.
[10] MCTERNAN P G,FISHER F M,VALSAMAKIS G,et al. Resistin and type 2 diabetes:regulation of resistin expression by insulin and rosiglitazone and the effects of recombinant resistin on lipid and glucose metabolism in human differentiated adipocytes [J]. J Clin Endocrinol Metab,2003,88(12):6098-6106.
[11] SAXENA A,VIKRAM N K. Role of selected Indian plants in management of type 2 diabetes:a review [J]. J Altern Complement Med,2004,10(2):369-378.
[12] 李春梅,高永林,李敏,等.知母皂苷对小鼠血糖的影响[J].中药药理与临床,2005,21(4):22-23.
[14] RODRIGUEZ J,DI PIERRO D,GIOA M,et al. Effects of a natural extract fromMangiferaindicaL,and its active compound,mangiferin,on energy state and lipid peroxidation of red blood cells [J]. Biochim Biophys Acta,2006,1760(9):1333-1342.
[15] APONTES P,LIU Z,SU K,et al. Mangiferin stimulates carbohydrate oxidation and protects against metabolic disorders induced by high-fat diets [J]. Diabetes,2014,63(11):3626-3636.
(责任编辑:幸建华)
Effect of alcohol extract of Anemarrhenae Rhizoma on INS-1 islet β cells
ZHANG Guogai1,ZENG Pingyan2,XIAO Xuerong1,FENG Yifan1,WU Xia1
(1.CentralLaboratory,GuangdongPharmaceuticalUniversity,Guangzhou510006,China; 2.GuangzhouXiangxuePharmaceuticalCo.,LTD,Guangzhou510530,China)
Objective To study the effect of alcohol extract ofAnemarrhenaeRhizomaon the proliferation and secretary function of normal and resistant INS-1 islet β cells,and investigate the toxic effect of alcohol extract on normal INS-1 islet β cells and improvement effect of alcohol extract on the resistant INS-1 islet β cells. Methods The proliferation of normal INS-1 cells was measured by MTT assay. The normal cells and the insulin-resistant cells were treatment with alcohol extracts. The experiment was divided into different groups,including the vehicle group (ME),insulin secretion model group (MC),insulin resistance group (IR),positive drug glibenclamide urea (Gli) group and rosiglitazone (ROZ) group,and several concentrations of alcohol extract groups. The basal insulin secretion (BIS) and glucose-stimulated insulin secretion (GSIS) values were measured. Results Treatment with alcohol extract ofAnemarrhenaeRhizomaat 0.3~30 μg/mL contributed to the proliferation of normal cells. Compared with MC and alcohol extracts,the difference of GSIS was statistically significant (P<0.05 orP<0.01). Compared with IR,alcohol extracts increased the levels of BIS at 3-30 μg/mL and GSIS at 0.3-30 μg/mL. Conclusion The toxicity of alcohol extracts on normal islet beta cells is low in a certain concentration range. Alcohol extracts could promote the proliferation of normal cells and insulin secretion ability to improve insulin resistance of cells.
alcohol extract ofAnemarrhenaeRhizoma; INS-1 islet β cells; proliferation; toxic effect
2016-09-18
广东省重大科技专项资金资助项目(2013A022100040);广东省医学科学技术研究基金项目(A2015448)
张国改(1989—),女,2014级硕士研究生,Email:zggcbl521@126.com;通信作者:冯毅凡(1963—)男,教授,主要从事现代仪器分析技术在药物分析中的应用与中药分析与质量控制,Email:yffeng@139.com;吴霞(1980—),女,博士,副研究员,主要从事天然药物活性成分和药物分析研究,Email:wxiaxia@163.com。
时间:2016-11-29 11:27
http://www.cnki.net/kcms/detail/44.1413.R.20161129.1127.011.html
R285.5
A
1006-8783(2016)06-0762-05
10.16809/j.cnki.1006-8783.2016091801

