羟基红花黄色素A与芍药苷联合用药对大鼠脑缺血再灌注损伤的保护作用
秦莎莎,余梦黎,廖金明,徐愉林,郑丽娴,朱原,李蕾,姚晖,张继平,韩彬
(1.广东药科大学 中药学院,广东 广州 510006; 2.广东医科大学 药学院,广东 湛江 524023; 3.南方医科大学 中医药学院,广东 广州 510515; 4.南方医科大学 附属佛山医院,广东 佛山 528000)
羟基红花黄色素A与芍药苷联合用药对大鼠脑缺血再灌注损伤的保护作用
秦莎莎1,余梦黎2,廖金明3,徐愉林2,郑丽娴3,朱原3,李蕾1,姚晖4,张继平4,韩彬1
(1.广东药科大学 中药学院,广东 广州 510006; 2.广东医科大学 药学院,广东 湛江 524023; 3.南方医科大学 中医药学院,广东 广州 510515; 4.南方医科大学 附属佛山医院,广东 佛山 528000)
目的 研究羟基红花黄色素A(HSYA)与芍药苷联合用药对急性局灶性脑缺血再灌注(I/R)损伤大鼠的协同保护作用,并探讨其作用机制。方法 110只雄性SD大鼠,随机分为6组:HSYA组(5.0 mg/kg)、芍药苷组(5.0 mg/kg)、HSYA与芍药苷联合用药组(合用组,各5.0 mg/kg)、银杏内酯组(5 mg/kg)、模型组和假手术组。采用改良线栓法复制大鼠大脑中动脉栓塞(MCAO)再灌注模型。脑缺血1 h再灌注6 h后进行神经功能缺失评分及尾静脉注射给药;给药7 d后进行神经功能缺失评分;氯化三苯基四氮唑(TTC)染色法检测脑梗死面积;免疫组化(IHC)法检测磷酸化Akt1蛋白的表达量的变化情况。结果 与假手术组比较,模型组大鼠治疗前评分明显高于假手术组,差异具有统计学意义(P<0.01),说明造模成功;与模型组比较,银杏内酯组、合用组、芍药苷组和HSYA组能不同程度地抑制大鼠体质量下降(P<0.05,P<0.01),改善脑缺血再灌注大鼠的神经功能缺失症状(P<0.05,P<0.01),降低皮质区神经细胞的损伤程度,减小脑梗死面积(P<0.05,P<0.01),促进磷酸化Akt1蛋白的表达(P<0.01);HSYA组、芍药苷组、银杏内酯组磷酸化Akt1蛋白的表达较合用组低(P<0.01)。结论 HSYA与芍药苷联合用药对脑缺血再灌注大鼠的脑损伤具有一定的协同保护作用,二者联合用药的作用优于单独用药,可能与二者联合用药发挥活血化瘀与神经保护作用有关。
脑缺血再灌注损伤;羟基红花黄色素A;芍药苷
脑卒中是全球第二大、中国第一大的致死性疾病,具有死亡率、发病率、致残率和复发率高及并发症多的特点。脑卒中分为缺血性和出血性两类,其中缺血性卒中约占80%。随着中国人口老龄化的进程,急性缺血性脑卒中不仅成为中国第一位死亡原因,且患病率呈上升趋势及年轻化趋势[1-2]。近年研究发现羟基红花黄色素A(HSYA)与芍药苷单独应用具有对抗脑缺血再灌注损伤的作用[3-6],但未见二者联合用药用于预防和治疗脑缺血再灌注损伤的报道。本研究通过改良线栓法复制局灶性脑缺血再灌注模型,观察HSYA与芍药苷联合用药对大鼠脑缺血再灌注损伤的保护作用。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠120只,体质量180~220 g,广州中医药大学(大学城)实验动物中心提供,生产许可证号:SCXK(粤)2013-0020。
1.2 药品及试剂
羟基红花黄色素A(Hydroxy safflower yellow A,HSYA)(质量分数89.5%,成都康邦生物科技有限公司,批号160301);芍药苷(质量分数98%,南京泽朗生物科技有限公司,批号20150723);银杏内酯注射液(成都百裕科技制药有限公司,批号08150404);Akt(Phospho-Ser473)抗体(Abcam公司,批号GR240003-Ⅱ);4%(φ)多聚甲醛(广州昂飞生物科技有限公司,批号153814);TTC试剂(Sigma公司,批号206-07-6)。
1.3 主要仪器
高速低温离心机(美国 Thermo 公司);Elx800TM酶标仪(美国伯腾仪器有限公司);电子分析天平(上海精密科学仪器有限公司)。
1.4 模型构建与分组、给药
雄性SD大鼠120只,随机分为6组:HSYA组(5.0 mg/kg)、芍药苷组(5.0 mg/kg)、HSYA与芍药苷联合用药组(各5.0 mg/kg)、银杏内酯组(5 mg/kg)、模型组和假手术组(假手术组10只,模型组20只,其余每组20只)。适应性饲养1周后,禁食不禁水12 h,参照文献[7]方法沿颈部正中线纵向切口,分离右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。使线栓通过CCA分叉部进入ICA,结扎ICA切口和栓线,1 h后抽出栓线,再灌注6 h,造成大脑中动脉栓塞(MCAO)动物模型。假手术组暴露右侧颈部血管,不进行栓塞处理,其余同手术组。给药前观察大鼠体征,对大鼠神经功能缺失进行评分。评分标准:无神经病学征象为0分;提尾时左前肢不能完全伸直为1分;向左侧转圈为2分;向左侧跌倒为3分;无自发活动及意识障碍者为4分。造模成功的标志是评分为1~4分的大鼠,不成功者予以剔除。脑缺血再灌注6 h后尾静脉注射给药,每天1次,连续给药7 d,假手术组和模型组给予等量注射用生理盐水。取材前后进行神经功能评分。
1.5 大鼠脑梗死面积测定
末次给药2 h后,再次进行神经功能缺失评分后麻醉大鼠,颈椎脱臼处死大鼠,快速开颅取脑,去掉嗅球、低位脑干和小脑,-20 ℃冰箱中冷冻15 min后取出,参照文献[8]方法进行TTC染色。经染色后非缺血区为红色,缺血区为白色。用Image-Pro Plus 6.0图像分析软件测量红、白区域面积,计算梗死面积比。梗死面积比=Σ梗死面积/Σ全脑片面积。
1.6 大鼠皮质区病理学观察
参照文献[9]的方法进行大鼠脑组织HE染色,光镜下观察皮质区神经细胞的形态学变化。
1.7 大鼠脑梗死区p-Akt表达的测定
大鼠颈椎脱臼处死后,开颅取脑,制作石蜡块及切片,然后严格按照试剂盒的步骤操作,进行免疫组化的制片。应用Image-Pro Plus6.0 软件选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的吸光度值(A)。
1.8 统计学处理
2 结果
2.1 大鼠的一般状况
假手术组大鼠毛发有光泽,饮食饮水正常,精神状态佳,手术24 h后体质量持续上升。模型组大鼠毛发无光泽,饮食饮水减少,精神萎靡,手术后大部分大鼠的体质量持续降低,严重者左侧前肢残废,左眼变瞎。各给药组大鼠的表现介于假手术大鼠与模型组之间。合用组大鼠的外在表现较HSYA组和芍药苷组大鼠好。
2.2 HSYA与芍药苷联合用药对MCAO再灌注大鼠治疗24 h体质量变化的影响
与假手术组比较,模型组大鼠术后24 h内体质量明显减轻,差异有统计学意义(P<0.01);与模型组比较,银杏内酯组、合用组、芍药苷组、HSYA组大鼠术后24 h内体质量明显增加,差异有统计学意义(P<0.05,P<0.01),说明各给药组可以不同程度地抑制局灶性脑缺血再灌注大鼠体质量下降;与合用组比较,芍药苷组、HSYA组大鼠术后体质量明显减轻,差异有统计学意义(P<0.05,P<0.01),说明HSYA与芍药苷联合用药效果较二者单独给药效果好。见表1。
表1 HSYA与芍药苷联合用药对大鼠治疗24 h体质量变化的影响


组别n治疗24h体质量变化率/%假手术组10-3.94±1.57模型组15-16.81±2.73##银杏内酯组12-13.11±2.84**合用组11-11.99±2.40**芍药苷组13-14.67±1.42*&&HSYA组12-14.31±1.98**&
与假手术组比较:##P<0.01; 与模型组比较:*P<0.05,**P<0.01; 与合用组比较:&P<0.05,&&P<0.01。
2.3 HSYA与芍药苷联合用药对MCAO再灌注大鼠治疗前后神经功能缺失评分的影响
与假手术组比较,模型组大鼠治疗前评分明显高于假手术组,差异具有统计学意义(P<0.01),说明造模成功。与模型组比较,HSYA组、芍药苷组、合用组、银杏内酯组大鼠治疗前后神经功能缺失评分变化均有显著变化,差异有统计学意义(P<0.01),说明各给药组具有不同程度的改善局灶性脑缺血再灌注大鼠神经功能缺失的作用。见表2。
表2 HSYA与芍药苷联合用药对大鼠神经功能缺失评分的影响


组别n治疗前评分治疗后评分治疗前后评分变化假手术组10000模型组101.80±0.63##1.30±0.48##0.30±0.82银杏内酯组82.13±0.990.75±0.47*1.25±0.89**合用组112.00±0.770.46±0.69**1.73±0.65**芍药苷组92.00±0.500.78±0.44*1.22±0.44**HSYA组92.11±0.930.78±0.67*1.44±0.53**
与假手术组比较:##P<0.01; 与模型组比较:*P<0.05,**P<0.01。
2.4 HSYA与芍药苷联合用药对MCAO再灌注大鼠脑梗死面积的影响
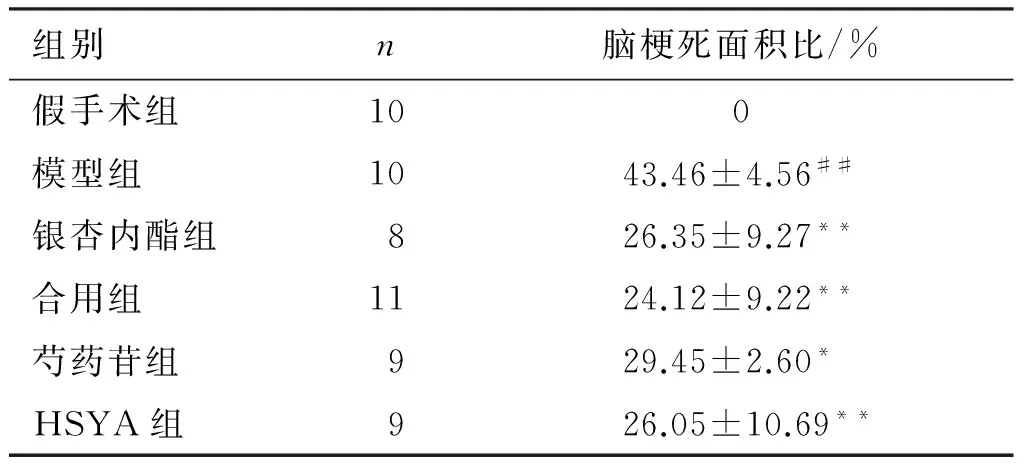
与假手术组比较,模型组的脑梗死面积显著增大,差异有统计学意义(P<0.01),说明造模成功;与模型组比较,银杏内酯组、合用组、芍药苷组、HSYA组的脑梗死面积均显著减小,差异有统计学意义(P<0.05,P<0.01),见表3、图1。
表3 HSYA与芍药苷联合用药对大鼠脑梗死面积的影响

组别n脑梗死面积比/%假手术组100模型组1043.46±4.56##银杏内酯组826.35±9.27**合用组1124.12±9.22**芍药苷组929.45±2.60*HSYA组926.05±10.69**
与假手术组比较:##P<0.01; 与模型组比较:*P<0.05,**P<0.01。

假手术组模型组银杏内酯组合用组芍药苷组HSYA组
图1 各组大鼠脑缺血再灌注损伤脑组织TTC染色
Figure 1 TTC staining of brain tissue after cerebral ischemia-reperfusion injury in each group
2.5 HSYA与芍药苷联合用药对MCAO再灌注大鼠脑组织皮质区病理学的影响
假手术组脑组织无缺血表现,右侧脑结构完整,皮质区结构清晰完整,未见明显损伤及病变;模型组皮质区大量液化性坏死灶,结构不清晰,神经细胞大量死亡,未见正常神经元细胞;与模型组比较,银杏内酯组、合用组、芍药苷组和HSYA组皮质区液化性坏死灶较小,坏死神经元细胞数量相对较少;与合用组比较,芍药苷组和HSYA组液化性坏死灶较大,坏死神经元细胞数量相对较多。见图2。
2.6 HSYA与芍药苷联合用药对MCAO再灌注大鼠脑梗死区p-Akt(Akt1)表达的影响
与假手术组比较,模型组大鼠脑梗死区p-Akt表达显著增加,差异有统计学意义(P<0.01);与模型组比较,HSYA组、芍药苷组、合用组、银杏内酯组大鼠脑梗死区p-Akt表达显著增加,差异有统计学意义(P<0.01);与合用组比较,HSYA组、芍药苷组、银杏内酯组大鼠脑梗死区p-Akt表达显著降低,差异有统计学意义(P<0.01)。见表4,图3。
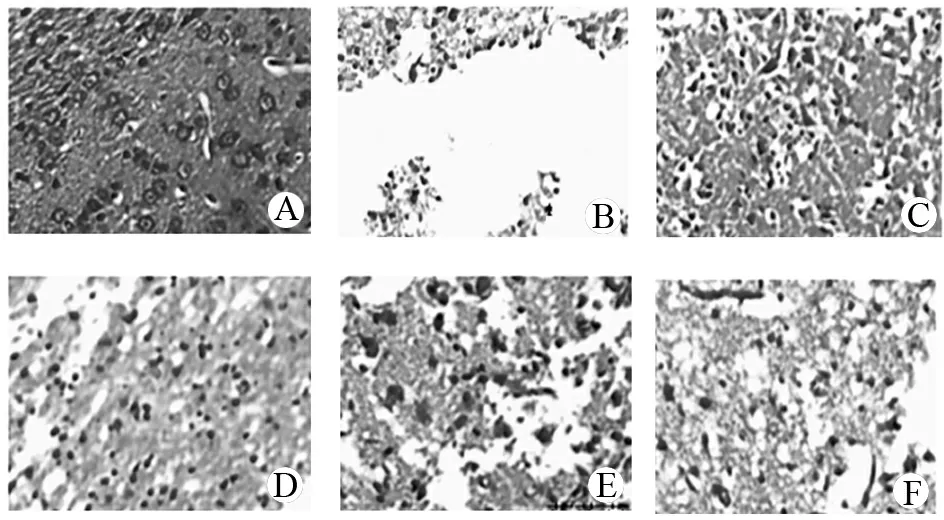
A.假手术组; B.模型组; C.银杏内酯组; D.合用组; E.芍药苷组; F.HSYA组。
图2 各组大鼠海马皮质区神经细胞HE染色(100×)
Figure 2 HE staining of neurons in hippocampal cortex of each group of rats
表4 HSYA与芍药苷联合用药对大鼠脑梗死区p-Akt1表达的影响


组别nA假手术组60.023±0.0013模型组70.040±0.0014##银杏内酯组70.076±0.0030**&&合用组80.104±0.0022**芍药苷组70.069±0.0019**&&HSYA组70.064±0.0039**&&
与假手术组比较:##P<0.01; 与模型组比较:**P<0.01; 与合用组比较:&&P<0.01。
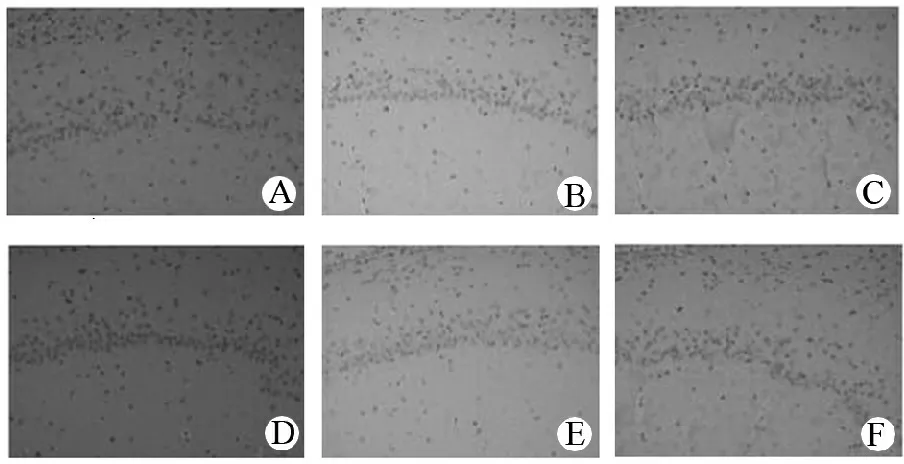
A.假手术组; B.模型组; C.银杏内酯组; D.合用组; E.芍药苷组; F.HSYA组。
图3 各组大鼠脑梗死区免疫组化染色(100×)
Figure 3 IHC staining of neurons in hippocampal cortex of each group of rats
3 讨论
脑组织缺血一定时间后再恢复血液灌注,脑组织的损伤反而会进一步的加重,这种损伤即是脑缺血再灌注损伤。脑缺血再灌注损伤在脑血管病的发生、发展过程中起着重要作用,因此保护脑缺血再灌注损伤是治疗脑缺血成功的关键。脑缺血再灌注损伤发生后,从损伤机制上看临床上改善损伤的药物主要为抗血小板聚集、神经保护剂、抗氧化等药物[10-11]。脑缺血疾病主要由血栓形成影响,而缺血后炎症反应可导致神经功能缺失,因此利用抗血小板药物抑制血小板激活,不仅可以预防血栓的形成还可以减轻由血小板激活诱发的炎症反应[12-13]。
有学者[14]提出“以组分配伍来研制现代中药”的新型模式后,中药组分配伍不仅受到中医药学界的关注而且已成为目前方剂配伍研究的热点。中药组分配伍是对应用较为广泛、疗效显著的中药或方剂进行深入的研究,在药效成分已知、作用机制比较明确的前提下,选取中药的有效部位或有效成分,运用现代药理技术对配伍组分进行优化筛选,最终得到具有最佳治疗效果的组成及配比[15]。HSYA与芍药苷对大鼠脑缺血再灌注损伤具有保护作用,但作用机制不同。芍药苷是赤芍的主要有效单体成分,研究证明其具有抗自由基损伤、抗神经毒性、抗血小板聚集、改善微循环、抗氧化及抗惊厥等作用,国内外的进一步研究发现其具有神经保护作用[16]。羟基红花黄色素A( HSYA) 是红花的主要有效单体成分,其主要作用是抗血小板聚集(活血化瘀)[17]。
PI3K/Akt信号通路参与神经系统中神经元及神经胶质细胞的生存、分化,PI3K/Akt的激活对脑缺血再灌注损伤具有神经保护作用[18-19]。Akt是PI3K下游主要信号分子及PI3K信号转导途径中重要的靶激酶,是一种丝氨酸(Ser473)/苏氨酸(Thr308)蛋白激酶[18],是调节细胞生长及抗凋亡的重要分子。Akt1、Akt2及Akt3是Akt的亚型,其作用分别是Akt1促进细胞的增殖、Akt2参与胰岛素调节代谢的过程、Akt3对细胞的生长及分化起着重要的调节作用[19]。在大脑中Akt1、Akt3的表达丰富,在心脏及棕色脂肪组织中Akt2表达较大脑中丰富,因此在大脑中Akt1、Akt3的功能比Akt2更重要[20]。激活的Akt能够向细胞质和细胞核内转运,活化的Akt通过磷酸化作用激活或抑制下游靶蛋白,进而调节细胞的凋亡、增殖、分化、迁移等过程。
本研究发现,给药7 d后各给药组大鼠的脑梗死面积较模型组小,治疗前后神经功能缺失评分变化与模型组相比差异显著,皮质区的病理变化情况与模型组相比损伤较小;脑缺血再灌注模型复制成功后模型组大鼠24 h内体质量明显下降,这与文献[21]报道一致,各给药组与模型组相比24 h内下降较少,给药2~3 d后体质量开始增加。脑梗死面积、神经功能缺失评分和造模后体质量变化情况可以共同作为评判脑缺血造模成功的标准及药物预防及治疗的效果;PI3K/Akt通路的激活对脑缺血再灌注损伤具有重要的保护作用,给药7 d后各给药组大鼠脑梗死区磷酸化Akt1的表达量与模型组相比差异显著,这与文献[ 6,16 ]报道中HSYA、芍药苷对脑缺血再灌注损伤的保护作用一致,合用组大鼠脑梗死区磷酸化Akt1的表达量显著高于HSYA组、芍药苷组及银杏内酯组,表明HSYA与芍药苷联合用药可以上调脑缺血再灌注损伤大鼠脑梗死区磷酸化Akt1的表达,合用效果较单独用药效果好。
本研究结果提示,HSYA与芍药苷联合用药对脑缺血再灌注的损伤具有协同保护作用,这可能与二者联合用药发挥活血化瘀与神经保护的作用有关。
[1] 2015年“世界卒中日”宣传主题及提纲[J].疾病监测,2015,30(10):879-885.
[2] 王陇德.中国脑卒中防治报告[M].北京:中国协和医科大学出版社,2015:23.
[3] TANG N Y,LIU C H,HSIEH C T,et al. The anti- inflammatory effect of paeoniflorin on cerebral infarction induced by ischemia-reperfusion injury in Sprague-Dawley rats [J]. Am J Chin Med,2010,38(1):51-64.
[4] ZHANG Z H,YU L J,HUI X,et al. Hydroxy-safflor yellow A attenuates Abeta(1)(-)(4)(2)-induced inflammaation by modulating the JAK2/STAT3/NF-kappaB pathway[J]. Brain Res,2014,1563:72-80.
[5] JIANG S,SHI Z,LI C,et al. Hydroxysafflor yellow A attenuates ischemia/reperfusion-induced liver injury by suppressing macrophage activation[J]. Int J Clin Exp Pathol,2014,7(5):2595-2608.
[6] CHEN L,XIANG Y,KONG L,et al. Hydroxysafflor yellow A protects against cerebral ischemia reperfusion injury by anti-apoptotic effect through PI3K/Akt/GSK3beta pathway in rat [J]. Neurochem Res,2013,38(11):2268-2275.
[7] SHEN J,ZHU Y,YU H,et al. Buyang Huanwu decoction increases angiopoietin-1 expression and promotes angiogenesis and functional outcome after focal cerebral ischemia[J]. JZUS-B,2014,15(3):272-280.
[8] 姜恩平,王帅群,王卓,等.北五味子总木脂素对脑缺血模型大鼠神经细胞凋亡及p-AKT表达的影响[J].中国中药杂志,2014,39(9):1680-1684.
[9] 黄宇星,胡胜利,邹永杰,等.高压氧预适应对大鼠大脑中动脉闭塞后骨桥蛋白表达的影响[J].第三军医大学学报,2013,23(1):15-19.
[10] 王晓平,倪京满.脑缺血再灌注损伤的研究及药物治疗进展[J].中国新药杂志,2016,25(6):659-663.
[11] 崔小英,于建设,都义日,等.脑缺血再灌注损伤及脑保护药物研究进展[J].河北医药,2016,38(4):596-600.
[12] 李育臣,董玉娟,王建茹,等.银杏叶提取物对脑缺血大鼠脑源性神经营养因子的影响[J].中风与神经疾病杂志,2005,22(1):54-56.
[13] 邢峻豪,杨凌云,李清,等.抗血栓药物的研究进展[J].药学进展,2014,38(3):174-184.
[14] 张伯礼,王永炎.方剂关键科学问题的基础研究-以组分配伍研制现代中药[J].中国天然药物,2005,3(5):258-261.
[15] 郑宏,邹海艳,赵晖,等.方药组分配伍的药效学研究进展[J].环球中医药,2015,8(12):1550-1552.
[16] 孙蓉,栾永福,李晓宇,等.芍药苷抗神经元损伤药理作用研究进展[J].山东中医药大学学报,2016,36(15):454-456.
[17] 袁玉梅,钱晓东,曹恒斌.羟基红花黄色素A抗脑缺血损伤作用研究进展[J].医药导报,2012,31(8):1045-1049.
[18] DOWNWARD J.Mechanisms and consequences of activation of protein kinaseB/Akt[J]. Curr Opin Cell Biol,1998,10(2):262-267.
[19] ZHAO H,SAPOLSKY R M,STEINBERG G K. Phosphoinositide-3-kinase/akt survival signal pathways are implicated in neuronal survival after stroke[J]. Mol Neurobiol,2006,34(3):249-254.
[20] LEE R S,HOUSE C M,CRISTIANO B E,et al. Relative expression levels rather than specific activity plays the major role in determininginvivoAKT isoform substrate specificity[J]. Enzyme Res,2011,2011: 720985.
[21] 陈虎,蔡定芳,陈依萍.评价脑缺血模型的一种辅助指标[J].上海实验动物科学,2003,23(2):105-107.
(责任编辑:幸建华)
Synergistic protective effect of hydroxy safflower yellow A and paeoniflorin on cerebral ischemia reperfusion injury in rats
QIN Shasha1,YU Mengli2,LIAO Jinming3,XU Yulin2,ZHENG Lixian3,ZHU Yuan3,LI Lei1,YAO Hui4,ZHANG Jiping4,HAN Bin1
(1.SchoolofTraditionalChineseMedicine,GuangdongPharmaceuticalUniversity,Guangzhou510006,China; 2.SchoolofPharmacy,GuangdongMedicalUniversity,Zhanjiang524023,China; 3.CollegeofTraditionalChineseMedicine,SouthernMedicalUniversity,Guangzhou510515,China; 4.TheAffiliatedFoshanHospitalofSouthernMedicalUniversity,Foshan528000,China)
Objective To study the synergistic protection and mechanism of hydroxy safflower yellow A(HSYA) and paeoniflorin in acute focal cerebral ischemia reperfusion injury in rats. Methods 110 male SD rats were randomly divided into six groups,including HSYA group(5.0 mg/kg),paeoniflorin group (5.0 mg/kg),HSYA combined with paeoniflorin group (5.0 mg/kg),gingko lactone group(5.0 mg/kg),the model group and the sham group. The model of rat middle cerebral artery occlusion(MCAO) was replicated by modified thread embolism method. Nerve function loss was scored and drugs were administrated by intravenous injection after 1 h cerebral ischemia and 6 h reperfusion. Neurological deficit was revalued after 7 day treatment. The area of cerebral infarction was detected by triphenyl tetrazolium chloride(TTC) staining. The expression of phosphorylated Akt1 protein was identified by immunohistochemistry(IHC). Results Compared with the sham group,the scores of the pre-treatment rats in the operation group were significantly higher than those in the sham-operation group(P<0.01),indicating that the model was successful. Compared with the model group,the loss of body weight,neurological deficits,cortical cell damage and cerebral infarction area were all attenuated,but the expression of phosphorylated Akt1 was increased in four drug-treated groups(P<0.05 orP<0.01). Meanwhile,compared with the combination of HSYA and paeoniflorin group,the expression of phosphorylated Akt1 was lower in other three groups(P<0.01). Conclusion HSYA combined with paeoniflorin displays a synergistic protection against cerebral ischemia and reperfusion injury,which is better than single drug treatment.
cerebral ischemia-reperfusion injury; HSYA; paeoniflorin
2016-09-01
广东省自然科学基金项目(S2013010012284);广东省中医药局课题(20152074);佛山市医学重点专科培育项目(Fspy2-2015008)
秦莎莎(1989—),女, 2014级硕士研究生,Email:1696505488@qq.com;通信作者:张继平(1964—),男,研究员,主要从事中药复方药理研究,Email:fszjping@163.com;韩彬(1964—),男,教授,主要从事方剂配伍及代谢性疾病研究,Email:hblz99@21cn.com。
时间:2016-11-29 11:10
http://www.cnki.net/kcms/detail/44.1413.R.20161129.1110.008.html
R965
A
1006-8783(2016)06-0747-05
10.16809/j.cnki.1006-8783.2016090101

