可溶性CD44s、SF、LDH在鉴别巨幼细胞贫血和骨髓增生异常综合征中的意义
杨洁 杨永宾 李杰 张晓霞 王瑞仓 郝洪岭 李燕 袁军 赵培
可溶性CD44s、SF、LDH在鉴别巨幼细胞贫血和骨髓增生异常综合征中的意义
杨洁 杨永宾 李杰 张晓霞 王瑞仓 郝洪岭 李燕 袁军 赵培
目的 测定巨幼细胞贫血(MA)和骨髓增生异常综合征(MDS)患者的血清可溶性CD44s(solCD44s)、乳酸脱氢酶(LDH)、血清铁蛋白(SF)水平,来探讨此三项指标在MDS与MA的鉴别诊断中的意义。方法112例初诊患者为研究对象,其中MDS患者58例(MDS组),MA患者39例(MA组),健康成年人15例作为对照(对照组)。留取血清标本,采用ELISA法检测血清solCD44s,速率法测定LDH水平及电化学发光免疫分析法(ECLIA)测定SF水平。结果MDS组血清solCD44s水平明显高于对照组与MA组(P<0.05),MA组与对照组比较差异无统计学意义(P>0.05)。MDS组与MA组血清LDH水平均明显高于对照组,两两比较MDS组LDH水平低于 MA组(P<0.05)。MDS组与MA组血清SF水平均明显高于对照组,两两比较MDS组SF水平高于MA组(P<0.05)。结论MDS患者血清可溶性CD44s、SF水平较MA患者明显升高,MDS患者LDH水平低于MA患者。血清可溶性CD44s、LDH、SF可作为MA与MDS鉴别诊断的参考指标。
可溶性 CD44s;巨幼细胞贫血;乳酸脱氢酶;骨髓增生异常综合征
骨髓增生异常综合征(myelodysplasticsyndrome,MDS)是一组以感染、贫血、出血为主要临床表现的克隆性造血干细胞疾病,单独的基因事件(如基因突变等)并不能解释MDS的病程,目前的观点是基因改变和表观遗传修饰共同作用,导致了MDS无效造血、表型异质性、易向白血病转化等特点[1]。巨幼细胞贫血(MA)与MDS血常规都可有贫血、伴或不伴白细胞及血小板减少,临床表现都以贫血为主,骨髓可见病态造血现象,这些表现有很大的相似性,甚至有些MDS表现全血细胞减少,检测血清叶酸和(或)维生素 B12水平低下,无原始细胞比例增高或增高不明显,且未发现染色体克隆性表现,此类MDS早期与MA鉴别有一定困难。因两种疾病治疗与预后截然不同,因此二者的鉴别具有重要的临床意义。CD44是单链膜表面糖蛋白,属于黏附分子家族,它与细胞黏附、淋巴细胞活化和归巢、肿瘤生长和转移密切相关[2]。血清可溶性CD44(solCD44s)是指CD44从细胞表面脱落而释放入血[3],此过程需在蛋白水解酶作用下完成。目前国内外关于实体肿瘤、白血病、恶性淋巴瘤等患者的血清solCD44s水平升高的报道已较多,而血清solCD44s水平在MDS患者升高的报道相对较少[4],到目前为止尚未见到MA患者血清solCD44s水平的研究报道。本研究以MA和MDS患者为主要对象,采用ELISA方法测定此两种疾病患者血清solCD44s水平,速率法测定血清乳酸脱氢酶(LDH)水平和电化学发光免疫分析法测定血清铁蛋白(SF)水平,探讨以上三项指标在MA与MDS鉴别诊断的意义。
1 资料与方法
1.1 一般资料 选取我院2011年2月至2015年2月收治的血液病初诊患者97例,其中MDS 58例,MA 39例。血液病的诊断符合《血液病诊断与治疗标准》[5](张之南主编)。MDS组中男38例,女20例;年龄33~81岁,平均年龄(61±8)岁。MA组中男21例,女18例;年龄39~80岁,平均年龄(40±9)岁。在我院体检的健康成年人15例为对照组,其中男6例,女9例;年龄32~57岁,平均年龄(47±8)岁。3组一般资料具有均衡性。
1.2 仪器与试剂 人solCD44s ELISA 试剂盒(博海生物技术有限公司),全自动酶标仪。
1.3 试验方法
1.3.1 标本采集:治疗前将试验对象及对照组病例采集空腹静脉血3 ml于无抗凝试管,采集后2 h内离心(2 000 r/min,5 min),在EP管内留取上层血清,每管分装为0.5 ml,保留在-80℃冰箱待测。
1.3.2 血清solCD44s水平检测:应用ELISA方法,按说明书将试剂盒从8℃取出,先在室温下平衡30 min后开启,再进行标准品稀释(应用试剂盒提供的原倍标准品,在小试管中进行稀释),然后进行加样、温育、配液、洗涤、加酶、温育、洗涤、显色、终止、测定(注:加终止液后立即将空白孔调零,450 nm波长测量各孔的吸光度,此过程在15 min内完成)。
1.3.3 LDH:速率法测血清LDH,由我院检验科代为完成。
1.3.4 SF:电化学发光免疫分析法测SF,由我院核医学科代为完成。
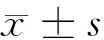
2 结果
2.1 血清solCD44s 的水平比较 对照组血清solCD44s水平为(341.07±64.94)μg/L。MDS组血清solCD44s水平为(564.51±121.96)μg/L,明显高于对照组(P<0.05)。MA 组血清solCD44s水平为(375.93±71.97)μg/L,与对照组相比差异无统计学意义(P>0.05)。MDS 组血清solCD44s水平明显高于 MA组(P<0.05)。见表1。
2.2 血清 LDH测定 血清LDH测定:MA组为(815.97±358.58)U/L,MDS组为(348.97±134.76)U/L,均显著高于对照组(151.83±37.29)U/L,差异有统计学意义(P<0.05)。MA组患者血清LDH水平高于MDS组(P<0.05)。SF测定MA组为(432.17±96.02)ng/ml,MDS组为(673.85±336.51)ng/ml,均显著高于对照组(153.59±67.85)ng/ml,差异有统计学意义(P<0.05)。MA组患者SF水平显著低于MDS组(P<0.05)。见表1。
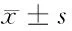

组别血清solCD44s水平(μg/L)血清LDH水平(U/L)SF水平(ng/ml)MA组(n=39)375.93±71.97815.97±358.58*432.17±96.02*MDS组(n=58)564.51±121.96*348.97±134.76*#673.85±336.51*#对照组(n=15)341.07±64.94151.83±37.29153.59±67.85
注:与对照组比较,*P<0.05;与MA组比较,#P<0.05
3 讨论
MA是由于缺乏叶酸和(或)维生素B12,引起脱氧核糖核酸(DNA)合成障碍导致的贫血。MDS是造血干细胞恶性克隆性疾病,属于恶性肿瘤。二者疾病性质不同,治疗及预后也截然不同。MA和MDS在临床上都以贫血为主要表现,伴或不伴出血、感染,外周血象都可有一系、两系或全血细胞减少,常表现大细胞性贫血,骨髓形态学检查都可看到红系、粒系、巨核细胞的生成异常,如巨幼样改变、红细胞大小不均、可见异形红细胞及有核红细胞,粒细胞分叶过多,可见大巨核细胞等,两者容易混淆[6],且主观因素影响较大。所以找到能够鉴别二者的检验指标十分重要。
血清solCD44s是由CD44胞浆外段从细胞表面脱落释放入血而来,此过程需在蛋白水解酶作用下完成,而内生蛋白水解酶则来自于快速增殖的恶性肿瘤细胞,由此造成solCD44s的增高。在细胞与细胞以及细胞与基质间的信号传导及相互作用中,CD44胞浆外段的脱落起到了重要的调控作用[7]。文献报道,CD44高表达于所有AML亚型原始细胞上[8],已有文献报道血清solCD44s水平增高与某些人类肿瘤的不良预后有关[9]。并有相关文献提到恶性血液病患者血清solCD44s水平有所升高[10],如慢性粒细胞白血病(CML)、急性淋巴细胞白血病(ALL)、AML及MDS等,并提出solCD44s可以作为影响MDS生存的一个独立预后因素。CD44的胞外裂解常见于包括髓系肿瘤在内的很多类型的人类肿瘤[11],此过程活跃,受高度调控。已脱落下来的solCD44s,其生物学功能仍被保留[12],即参与细胞活化、抑制肿瘤生长、诱导凋亡。转染的solCD44s可发挥巨大作用,导致细胞增殖,并增加抗凋亡能力,因此认为solCD44s在肿瘤细胞可成为一个新靶点[13]。Moreno等[14]提出,血清solCD44s与肿瘤负荷相关,认为其可成为髓系肿瘤(包括MDS)可靠的肿瘤标志物。本研究中MDS的solCD44s明显高于对照组和MA组,这可能与solCD44s在恶性肿瘤中表达水平较高有关。而MA组与对照组相比无明显统计学意义,这也与其疾病性质相符,因此solCD44s可以作为鉴别MA与MDS的一项辅助指标。
LDH是一种糖酵解酶,广泛存在于人体的各组织中,心肌、骨骼肌、肾脏含量最丰富,红细胞及肿瘤组织中也极为丰富,目前该指标的检测在各大医院广泛开展。正常人血清LDH含量极低,而血清LDH明显升高多见于组织细胞破坏,LDH释放入血。MA与MDS患者在红细胞破坏过多,及骨髓中幼红细胞溶血方面有相似之处,此时LDH释放增加,导致血清LDH升高,但机制却不同。MA是由于叶酸或维生素 B12缺乏致DNA合成障碍,引起细胞核发育障碍,该巨幼细胞易在骨髓内破坏,出现无效性红细胞生成,即骨髓原位溶血、红细胞破坏增加导致了血清LDH增高。肿瘤细胞存在基因调控失调、细胞损伤、能量代谢障碍等特点,目前认为LDH升高与此有关,此机制致肿瘤细胞内LDH释放增多[15],可反映肿瘤增殖活性[16]。MDS起源于早期多能造血干细胞,其发生和进展是一个多步续过程,受损的干、祖细胞逐步成为单克隆造血,伴有基因组不稳定性,基因突变率高[17],易发生继发性细胞遗传学异常,MDS血清LDH升高与能量代谢障碍和细胞损伤相关。MA骨髓中存在大量巨幼细胞和大红细胞,其生存期短,过早破坏,合并原位溶血,以上方面均较MDS突出,这些方面均导致LDH明显升高。
SF是去铁蛋白和Fe3+形成的复合物,是铁的贮存形式。MA患者红细胞破坏增多,骨髓增生紊乱,铁利用障碍,SF轻度增高。而MDS属于恶性肿瘤,肿瘤细胞铁蛋白合成增加,清除障碍[18],加之致癌因子对铁代谢直接或间接的干扰,且MDS患者铁利用障碍、骨髓无效造血、正常造血受抑等都导致SF明显增高。
血清LDH、SF作为MA与MDS鉴别指标的文献报道已不少见[18],但未见solCD44s在MA中表达的研究。本文进行了MA与MDS两种疾病血清solCD44s、LDH、SF的水平测定,认为在MA与MDS二者鉴别中除了结合外周血及骨髓细胞形态、骨髓病理、细胞遗传学以外,此三项指标可以作为协助鉴别的血清学指标,MA的LDH水平高于MDS,solCD44、SF水平低于MDS,参考这些指标有助于提高诊断的准确性。
1 Al Ustwani O,Ford LA,Sait SJ,et al. Myelodysplastic syndromes and autoimmune diseases—case series and review of literature.Leuk Res,2013,37:894-899.
2 Noroozinia F,Fahmideh AN,Yekta Z,et al.Expression of CD44 and P53 in renal cell carcinoma:association with tumor subtypes.Saudi J Kidney Dis Transpl,2014,25:79-84.
3 Bazi V,Horejsi V. Shedding of the CD44 adhesion molecule from leukocytes induced by anti-CD44 monoclonal antibody simulating the effect of a natural receptor ligand. J Immunol,1992,149:747-754.
4 Loeffler-Ragg J,Steurer M,Ulmer H,et al. Elevated levels of serum CD44 and E-cadherin predict an unfavourable outcome in myelodysplastic syndromes. Leukemia,2006,20: 2064-2067.
5 张之南,沈悌主编.血液病诊断及疗效标准. 第3版. 北京: 科学出版社,2007.106-116.
6 吴玲剑,王霄霞.巨幼细胞性贫血与难治性贫血的骨髓病态造血特点分析.检验医学教育,2006,13:44-46.
7 Naor D,Wallach-Dayan S,Zahalka M,et al.Involvement of CD44,a molecule with a thousand faces,in cancer dissemination. Semin Cancer Biol,2008,18:260-267.
8 Legras S,Ganthert U,Stauder R,et al.A strong expression of CD446v correlates with shorter survival patients with acule myeloid leukemia.Blood,1998,91:3401-3413.
9 Okamoto I,Tsuiki H,Kenyon L,et al. Proteolytic cleavage of the CD44 adhesion molecule in multiple human tumors. Am J Pathol,2002,160:441-447.
10 Loeffler-Ragg J,Germing U,Sperr WR,et al. Serum CD44 levels predict survival in patients with low-risk myelodysplastic syndromes. Crit Rev Oncol Hematol,2011,78:150-161.
11 Bendall LJ,Bradstock KF,Gottlieb DJ.Expression of CD44 variant exons in acute myeloid leukemia is more common and more complex than that observed in normal blood,bone marrow or CD341 cells .Leukemia,2000,14:1239-1246.
12 Cichy J,Kulig P,Puré E. Regulation of the release and function of tumor cell-derived soluble CD44. Biochim Biophys Acta,2005,1745: 59-64.
13 Subramaniam V,Gardner H,Jothy S. Soluble CD44 secretion contributes to the acquisition of aggressive tumor phenotype in human colon cancer cells. Exp Mol Pathol,2007,83:341-346.
14 Moreno C,Epunan M,Minguell J. Expression of transmembrane andsoluble forms of CD44H in human myeloid cell lines and its regulation byhyaluronic acid. Haematologica,2000,85:321-322.
15 曹志红,祝焱,彭敏源. 急性白血病LDH及HBDH测定的临床意义.实用预防医学,2007,14:489-490.
16 Reddy PL,Shetty VT,Dutt D,et al. Increased incidence of mitochondrialeytoehrome c-oxidase gene mutations in patients with myelodysplastiesyndromes. Br J Haematol,2002,116:564-575.
17 Nomdedeu M,Maffioli M,Calvo X,et al.Efficacy of lenalidomide in a patient with myelodysplastic syndrome with isolated del(5q) and JAK2V617F mutation .Leuk Res,2011,35:1276-1278.
18 褚金龙,刘艳春,李骏,等. 骨髓增生异常综合征患者血清铁蛋白、叶酸与维生素B12检测及其临床意义. 中国综合临床,2005,21:802-803.
10.3969/j.issn.1002-7386.2016.24.026
050051 石家庄市,河北省人民医院血液科(杨洁、李杰、张晓霞、王瑞仓、郝洪岭、李燕、袁军),普外二科(杨永宾),检验科(赵培)
郝洪岭,050051 石家庄市,河北省人民医院血液科;
E-mail:h0707@163.com
R 551.31
A
1002-7386(2016)24-3773-03
2016-08-05)

