羊口疮病毒陕西分离株B2L基因的克隆、序列分析及原核表达
何亚鹏,张 琪,庞文静,徐丽美,付明哲,许信刚
(西北农林科技大学动物医学院,陕西杨凌 712100)
羊口疮病毒陕西分离株B2L基因的克隆、序列分析及原核表达
何亚鹏,张 琪,庞文静,徐丽美,付明哲*,许信刚*
(西北农林科技大学动物医学院,陕西杨凌 712100)
为了对羊口疮病毒(ORFV)陕西分离株B2L基因进行克隆、序列分析及原核表达,根据GenBank已登录的ORFV(JN565694.1)B2L基因序列,设计合成一对特异性引物,应用PCR技术扩增ORFV B2L基因,并将目的基因连接到原核表达载体pET-28a中,成功构建重组质粒PET28a-B2L,转化大肠埃希菌BL21感受态细胞进行诱导表达,并进行SDS-PAGE和Western blot分析。结果表明,成功克隆了ORFV陕西分离株B2L全基因序列,核苷酸序列分析表明,陕西分离株B2L基因与国内外已报道的ORFV毒株核苷酸同源性超过97.3%,氨基酸同源性超过95.0%。重组菌经IPTG诱导后成功表达分子质量约为42 ku 的重组蛋白,该蛋白能与羊口疮阳性血清特异性结合,具有良好的反应原性。研究结果为ORFV的分子生物学特性研究提供资料,为进一步研制ORFV单克隆抗体及抗体检测ELISA试剂盒奠定了基础。
羊口疮病毒;B2L基因;克隆;序列分析;原核表达
羊口疮(Orf)又称羊接触传染性脓疱皮炎(Contagious pustular dermatitis),是由羊口疮病毒(Orf virus,ORFV)引起的一种急性接触性人兽共患传染病,我国将其列为三类动物疫病[1-2]。羊口疮病毒属于痘病毒科副痘病毒属,病毒粒子大小约为280 nm×170 nm,一般呈椭圆形,也有球形、锥形等,且病毒粒子表面有囊膜包裹。ORFV基因组全长约140 kb,基因组中间是一个长的中心编码区,编码约130个蛋白,两头是相同的反向末端重复序列。羊口疮病毒的编码区又分为中心保守区和末端变异区。中心保守区是病毒完成复制和形成病毒粒子所必需的。两侧非必须的末端变异区种间变异性较大,主要为病毒的毒力基因,因此与病毒的致病性密切相关[3-4]。B2L基因是位于病毒的保守区,基因全长1 137 bp,是一个完整的阅读框,编码蛋白质大小约为42 ku。B2L蛋白是ORFV的病毒粒子囊膜的重要组成部分,是其主要的免疫优势抗原,能够刺激机体产生抗体,清除病原[5-6],大量研究表明B2L蛋白是羊口疮病毒优势抗原之一[7]。本研究扩增出羊口疮病毒陕西分离株B2L基因,进行序列分析及原核表达,为进一步研制羊口疮ELISA抗体检测试剂盒以及基因工程疫苗的研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒、菌种、质粒和细胞株 羊口疮病毒陕西分离株(Shannxi,GenBank accession:KU194469)由西北农林科技大学动物医学院兽医微生物实验室分离鉴定并保存;pEASY-T1 Cloning Kit、感受态细胞Trans5a、BL21菌株为北京全式金生物技术有限公司产品;pET-28a质粒由本实验室保存提供。
1.1.2 主要试剂 2×EsTaqMaster Mix、DNA Marker DL 2 000、Super DNA Marker、广谱蛋白Marker为北京康为世纪生物科技有限公司产品;各种内切酶、T4 DNA连接酶为NEB公司产品;血液/组织/细胞基因组提取试剂盒为天根生化科技(北京)有限公司产品;IPTG为Sigma公司产品;辣根过氧化物酶(HRP)标记的兔抗羊IgG抗体为北京博奥森生物技术有限公司产品;其他试剂均为国产分析纯。
1.1.3 血清 ORFV阳性血清为采自临床免疫过ORFV弱毒疫苗株(山东泰丰生物有限公司产品)的羊血清。
1.2 方法
1.2.1 引物的设计及病毒核酸的提取 根据GenBank 中收录的ORFV(JN565694.1)B2L基因序列,利用Primer 5.0引物分析软件,设计用于扩增ORFV的B2L基因(B2L-F/B2L-R)引物,上游引物B2L-F 5′- CGCGGATCCATGTGGCCGTTCTCCTCC-3′(下划线为BamHⅠ酶切位点);下游引物B2L-R 5′-CCGCTCGAGTTAATTTATTGGTTTGCAGAACTCC -3′(下划线为XhoⅠ酶切位点),扩增长度为1 137 bp,引物由Invitrogen上海贸易有限公司合成。取ORFV细胞培养物200 μL,根据DNA提取试剂盒说明书提取病毒基因组DNA,置-20℃保存备用。
1.2.2 B2L基因的克隆及序列分析 以提取的ORFV基因组DNA为模板,50 μL PCR反应体系:2×ESTaqMastermix 25 μL,上、下游引物各1 μL,模板2 μL,灭菌双蒸水21 μL。PCR反应条件:94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,35个循环,最后72 ℃延伸5 min。核酸凝胶电泳,胶回收目的条带,连接pEASY-T1克隆载体。将含有目的基因B2L的pEASY-T1质粒用BamHⅠ和XhoⅠ双酶切,同时用BamHⅠ和XhoⅠ双酶切pET-28a空质粒,回收酶切产物。将B2L基因亚克隆到pET-28a载体中,挑取单克隆后扩大培养,分别进行PCR和双酶切鉴定,提取阳性质粒送华大基因(北京)测序,将鉴定正确的重组原核表达质粒命名为pET-B2L。
利用NCBI BLAST功能将B2L测序结果与GenBank已收录的羊口疮病毒基因组DNA序列进行比对。利用Internet在线软件预测B2L所编码蛋白的信号肽 (http://www.cbs.dtu.dk/services/SignalP/)和跨膜区(http://www.cbs.dtu.dk/services/TMHMM-2.0/)。利用DNA Star软件预测分析其蛋白的亲水性、抗原指数和表面分布可能性。
1.2.3 重组蛋白B2L的诱导表达及表达条件优化 将pET-B2L和pET-28a空载体分别转化表达感受态细胞BL21,挑取单克隆,37 ℃、220 r/min过夜培养,按1%转接5 mL新鲜LB培养基后,培养至对数期,加入IPTG 至终浓度1.0 mmol/L 诱导培养,分别于诱导后3、4、5、6、7 h收集菌体, 然后进行SDS-PAGE 分析。
1.2.4 重组蛋白B2L表达形式的分析 在最佳诱导条件下,分别取菌液上清、菌体超声裂解上清和沉淀进行SDS-PAGE,分析重组蛋白的表达形式。
1.2.5 目的蛋白的Western blot分析 将重组蛋白表达产物进行常规SDS-PAGE后,250 mA恒流转膜2.5 h。以50 g/L脱脂奶粉室温封闭PVDF膜2 h,分别以1∶500倍稀释的羊口疮阳性血清4 ℃孵育PVDF膜过夜。TBST振荡洗涤3次,每次20 min。将PVDF膜以1∶5 000倍稀释的辣根过氧化物酶(HRP)标记的兔抗羊IgG抗体室温孵育2.5 h,TBST振荡洗涤3次,每次20 min。ECL反应液孵育PVDF膜,暗室压片曝光。同时设立阴性对照。
2 结果
2.1 PCR扩增结果
以提取的病毒基因组DNA为模板,PCR扩增得到1 137 bp的B2L基因,与预期大小相符(图1)。

M.DNA标准DL 2 000;1.B2L扩增产物
M.DNA Marker DL 2 000;1.PCR products of B2L gene
图1 B2L基因PCR扩增结果
Fig.1 PCR results of B2L gene
2.2 重组质粒pET-B2L双酶切鉴定结果
将重组质粒进行BamHⅠ和XhoⅠ双酶切鉴定,均获得与预期大小一致的片段(图2)。
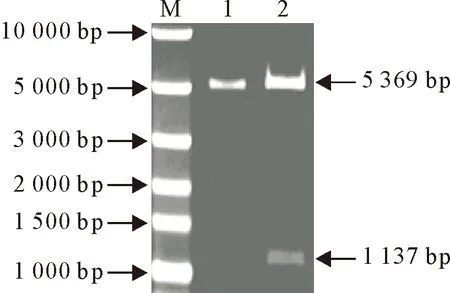
M.DNA 标准 DL 10 000;1.pET-28a双酶切产物;2.pET-B2L双酶切产物
M.DNA Marker DL 10 000;1.Double enzyme digestion products of pET-28a plasmid;2.Double enzyme digestion products of recombanant plasmid pET-B2L
图2 重组质粒酶切鉴定结果
Fig.2 Identification of recombinant plasmids by enzyme digestion
2.3 B2L目的基因同源性及进化树分析
序列测定结果表明,B2L基因大小为1 137 bp,编码378个氨基酸残基。将测定序列上传至GenBank,登录号为KU194469。利用DNA Star 分析软件对该毒株核苷酸序列和推导的氨基酸序列与GenBank中登录的8个ORFV毒株B2L序列进行同源性比较分析。结果表明,ORFV Shaanxi株与其他13株ORFV的B2L核苷酸同源性为97.3%~98.4%,氨基酸序列同源性为95.0%~98.2%(图3)。在分析同源性的基础上进行核苷酸遗传进化分析,并绘制其系统发生进化树(图4)。从进化树上可以看出,ORFV Shaanxi株与Hub株(GU320351.1)、Shanxi株(JN565696.1)、Liaoning株(HQ694773.1)位于一个小分支,亲缘关系最近。
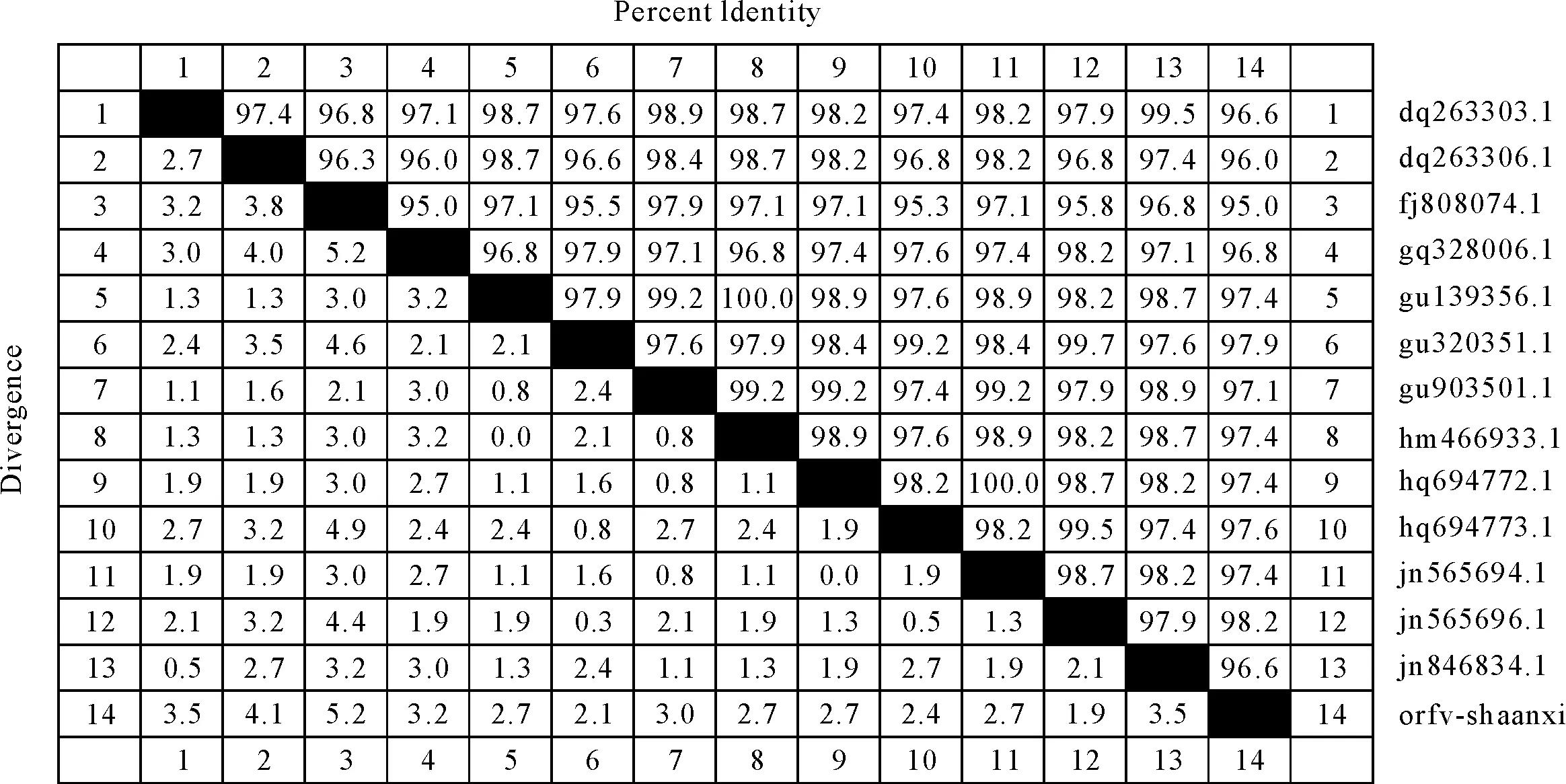
图3 ORFV不同毒株的推导B2L氨基酸同源性比较

图4 ORFV B2L核苷酸序列系统进化树
2.4 B2L基因编码氨基酸亲水性及抗原表位分析
利用Internet在线软件预测B2L的结构,发现该蛋白没有信号肽和跨膜区。利用DNA Star软件分析B2L的亲水性、抗原指数和表面分布可能性。结果表明,ORFV B2L编码的囊膜蛋白在58-67、87-97、103-114、149-168、190-198、206-234、278-285、314-321、337-346、351-359、362-376位的氨基酸残基处有较高的亲水性(图5)。由抗原表位分析图可知,B2L基因编码的囊膜蛋白在第9-15、42-46、56-80、85-98、106-116、160-167、205-235、264-273、278-287、288-298、309-333、337-343、351-378位可能存在抗原表位(图5)。

图5 B2L蛋白的亲水性、抗原指数及抗原表位分析
2.5 重组蛋白诱导表达条件的优化
当IPTG终浓度为1.0 mmol/L时,诱导后3、4、5、6、7 h收集菌体。结果显示,在诱导5 h后,重组蛋白B2L表达量显著增加,在7 h时表达量最大,而pET-28a空质粒对照组和pET-B2L未诱导对照组均没有重组蛋白的表达(图6)。

M.蛋白分子质量标准;1.诱导pET-28a;2.未诱导pET-B2L;3~7.分别诱导3、4、5、6、7 h的pET- B2L
M. Protein molecular weight Marker;1.Induced cells containing pET-28a;2.Uninduced cells containing pET- B2L; 3-7.Cells containing pET-B2L induced for 3,4,5 ,6,7 h,respectively
图6 不同诱导时间对B2L重组蛋白诱导表达的影响
Fig.6 Effects of different induction time on expression of B2L fusion proteins
2.6 重组蛋白B2L表达形式的分析
在最佳诱导条件下,分别取菌液上清、菌体超声裂解上清和沉淀进行SDS-PAGE,在上清中未见预期蛋白条带,在沉淀中可见预期的蛋白条带,表明重组蛋白B2L主要以包涵体的形式存在。
2.7 重组蛋白的Western blot分析
Western blot结果表明,B2L重组蛋白能与羊口疮阳性血清发生特异性反应出现特异性条带,而与阴性对照转染空载体pET-28a的重组菌不反应。

M.蛋白分子质量标准;1~2.B2L重组蛋白;3.pET-28a对照菌
M. Protein molecular weight Marker;1-2.B2L recombinant proteins;3.pET-28a control
图7 B2L重组蛋白的Western blot分析
Fig.7 Western blot analysis of B2L recombinant protein
3 讨论
3.1 B2L序列分析
羊口疮病毒能引起反刍动物和人发病,流行范围广,在我国西部地区广泛流行,春季、夏季多发,可引起羔羊死亡[3,8]。其感染率高,传播速度快,但容易被忽视而对羔羊造成严重危害。ORFV的B2L基因编码主要的免疫囊膜蛋白,该基因较保守,不同分离株同源性在97%以上,常被用于建立病毒PCR鉴定方法[9-10]。B2L蛋白是ORFV囊膜的重要组成部分,是主要的免疫优势抗原,能够刺激机体产生抗体,清除病原[11-13]。本研究成功地克隆了ORFV Shaanxi株B2L的全长基因(登录号:KU194469),并将其与NCBI上登录的其他ORFV毒株的B2L基因进行了核苷酸序列比较分析。结果表明,分离毒株与其他ORFV毒株的核苷酸同源性均超过97.3%,氨基酸同源性均超过95.0%,其中Shaanxi株与国内Hub株(GU320351.1)、Shanxi株(JN565696.1)、Liaoning株(HQ694773.1)同源性最高。从进化树也可以看出,Shaanxi(KU194469)株在进化树上与与国内Hub株(GU320351.1)、Shanxi株(JN565696.1)、Liaoning株(HQ694773.1)同位于一个小分支。
3.2 亲水性、抗原表位分析
利用DNA Star的Protean软件和在线生物软件预测B2L蛋白序列,B2L编码蛋白质大小为42 ku,B2L蛋白没有信号肽序列和跨膜结构域。亲水性分析表明,ORFV B2L编码的囊膜蛋白在58-67、87-97、103-114、149-168、190-198、206-234、278-285、314-321、337-346、351-359、362-376位的氨基酸残基处有较高的亲水性;由抗原表位分析图可知,B2L基因编码的囊膜蛋白在第9-15、42-46、56-80、85-98、106-116、160-167、205-235、264-273、278-287、288-298、309-333、337-343、351-378位可能存在抗原表位,这说明B2L蛋白具有较强的抗原性和亲水性且抗原性峰值和亲水性峰值基本同步。正是因为B2L蛋白具有良好的抗原性,使其成为临床上诊断ORFV感染的理想抗原,对羊口疮诊断方法的建立和血清学调查有重要价值[14-15]。ORFV-Shaanxi株B2L基因的克隆、序列分析及原核表达,不仅丰富了陕西地区ORFV的流行病学资料,也为国内外关于ORFV的遗传起源、传播路径和流行规律的研究提供了新思路,为新型疫苗和增强免疫效果的研究奠定了基础。
3.3 B2L蛋白原核表达分析
大肠埃希菌表达系统具有过程简单、表达量大等优点。虽然其表达产物多为不溶性包涵体蛋白,且产物无法进行正确的糖基化修饰,但产物可以用来进行免疫性质的研究。本试验将B2L基因克隆于pET-28a原核表达载体,通过条件的优化,在宿主菌BL21中成功诱导表达了ORFV B2L蛋白。表达的B2L蛋白分子质量约为42 ku,主要以包涵体的形式存在,与预期结果相符。本试验在大肠埃希菌中表达了B2L蛋白,为ORF诊断抗原的研究、基因工程疫苗的研制以及抗B2L单克隆抗体的研制提供了物质基础。
[1] Duan C,Liao M,Wang H,et al.Identification,phylogenetic evolutionary analysis of GDQY orf virus isolated from Qingyuan City,Guangdong Province,southern China[J].Gene,2015,555(2):260-268.
[2] Zhang K,Xiao Y,Meng Y U,et al.Phylogenetic analysis of three orf virus strains isolated from different districts in Shandong Province,East China[J].J Vet Med Sci,2015,77(12):1639-1645.
[3] 闫丰超,邵 佳,窦永喜.羊口疮病毒分子生物学的研究进展[J].中国兽医科学,2013(1):103-109.
[4] Fleming S B,Wise L M,Mercer A A.Molecular genetic analysis of Orf virus:A poxvirus that has adapted to skin.[J].Viruses,2015,7(3):1505-1539.
[5] Khalafalla A I,El-Sabagh I M.Phylogenetic analysis of eight Sudanese camel contagious ecthyma viruses based on B2L gene sequence[J].Virol J,2015,12(1):1-9.
[6] Zhao K,He W,Wei G,et al.Orf virus DNA vaccines expressing ORFV 011 and ORFV 059 chimeric protein enhances immunogenicity[J].Virol J,2011,8(1):1-12.
[7] El-Tholoth M,Elnaker Y F,Shiha G.Phylogenetic analysis of B2L gene of Egyptian orf virus from naturally infected sheep[J].Virus Dis,2015,26(3):147-150.
[8] 杨海波,孟庆玲,乔 军,等.羊口疮病毒新疆流行株的分离鉴定及其遗传进化分析[J].西北农林科技大学学报:自然科学版,2015(2):14-22.
[9] 张 瑜,高晶晖,张立强,等.杨凌某羊场羊口疮病毒的分离鉴定[J].动物医学进展,2015,36(1):61-65.
[10] 邓 宇.口疮病毒XC13株的分离鉴定[J].中国兽医科学,2015(5):469-473.
[11] 赵文博,李瑞航,贺鹏亮,等.羊口疮病毒B2L基因克隆及表达[J].黑龙江大庆:黑龙江八一农垦大学学报,2015(2):42-45.
[12] 刘 方.杨凌地区羊口疮流行病学调查、病毒分离鉴定及相关基因的生物信息学分析[D].陕西杨凌:西北农林科技大学,2014.
[13] Weber O,Siegling A,Friebe A,et al.Inactivated parapoxvirus ovis (Orf virus) has antiviral activity against hepatitis B virus and herpes simplex virus.[J].J Gen Virol,2003,84(7):1843-1852.
[14] Gelaye E,Achenbach J E,Jenberie S,et al.Molecular characterization of orf virus from sheep and goats in Ethiopia,2008-2013[J].Virol J,2016,13(1):1-12.
[15] Spyrou V,Valiakos G.Orf virus infection in sheep or goats[J].Vet Microbiol,2015,181(1-2):178-182.
Cloning,Sequence Analysis and Prokaryotic Expression of B2L Gene of Orf Virus Shaanxi Strain
HE Ya-peng,ZHANG Qi,PANG Wen-jing,XU Li-mei,FU Ming-zhe,XU Xin-gang
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
According to the published sequence of B2L gene of ORFV(JN565694.1),a pair of specific primers were designed and synthesized for cloning,sequence analysis and prokaryotic expression of B2L gene of Orf virus Shannxi strain. The B2L gene was amplified by PCR from Orf virus of Shaanxi strain.B2L gene sequence was analyzed and cloned into pET-28a vector.The prokaryotic expression plasmid pET-B2L containing B2L gene was successfully constructed.The expression of recombinant plasmid pET-B2L inE.coliBL21competent cells was induced and detected by SDS-PAGE and Western blot.B2L gene sequence was successfully obtained.Nucleotide sequence analysis showed that B2L gene of Shaanxi strain is similar to some domestic and foreign strains.Nucleotide sequence similarity is more than 97.3%,amino acid sequence similarity is more than 95.0%.SDS-PAGE analysis showed that 42 ku recombinanti protein was expressed by IPTG induction.Western blot analysis showed that the recombinant fusion protein had good reactiongenicity.The result provided the reference for studying molecular biology characteristics of ORFV.Furthermore,the B2L protein can be used to prepare monoclonal antibody and ELISA detection kit.
Orf virus;B2L gene; clone;sequence analysis;prokaryotic expression
2016-05-03
陕西省重点产业创新链项目(2016KTZDNY02-06);陕西省农业科技创新与攻关项目(2016NY-092);西北农林科技大学试验示范站(基地)科技成果推广项目(TGZX2015-32)
何亚鹏(1990-),男,河南内乡人,硕士,主要从事分子病原学与免疫学研究。*通讯作者
S852.659.1
A
1007-5038(2016)12-0019-05

