氯化异香豆素类化合物的合成
蓝 擎,张 敏,向 佩,张 岩
(广西大学化学化工学院, 广西高校应用化学技术与资源开发重点实验室, 广西南宁530004)
氯化异香豆素类化合物的合成
蓝 擎,张 敏,向 佩,张 岩
(广西大学化学化工学院, 广西高校应用化学技术与资源开发重点实验室, 广西南宁530004)
异香豆素是一些天然产物的基本骨架结构,这些化合物具有多种良好的生物活性,如抗癌、杀菌、消炎等。然而由于有效合成方法的缺失,寻找一条方便快捷的合成路线对异香豆素类化合物的合成,具有重要意义。以取代的邻羧基苯乙酸为原料,与三氯氧磷发生关环反应得到3-氯代的异香豆素衍生物。或者在质子酸的催化作用下使邻羧基苯乙酸与不同的醇进行酯化,可以选择性的得到相应的苯乙酸酯后,在五氯化磷的作用下进行关环,合成一系列3-烷氧基-4-氯异香豆素类化合物,并对合成路线条件进行了探索,获得了令人满意的收率。这些化合物的结构均利用IR和1H NMR等多种手段进行鉴定,并研究了UV、IR光谱性质。
邻羧基苯乙酸;异香豆素;合成
异香豆素,学名1H-2-苯并吡喃-1-酮,广泛分布于自然界中,是一些天然产物的重要结构单元。 Shi等[1]从美洲大蠊中分离了4种新型的异香豆素类化合物,对肝癌细胞 HepG2 和 MCF-7的繁殖都具有很好的抑制作用。 Damasceno等[2]从食虫植物中提取新型异香豆素类化合物,发现其具有良好的抗氧化活性。此外,其他研究也表明异香豆素类衍生物具有优良的消炎[3]、抗菌[4]和抑制蛋白酶[5]等重要生理活性。
然而从天然产物中提取异香豆素类化合物含量低、过程复杂,生产成本高且产能低下,导致价格居高不下,迫切的需要对其进行人工合成的研究。从合适的原料出发,利用简短的合成路线[6],降低其生产成本,是一种合理的思路。Hara等[7]通过使用铑对苯酰胺2位碳上的C—H键进行活化,将苯酰胺与1-羰基二氧环戊烷采用一锅法,合成了一系列新型的异香豆素化合物。Prakash等[8]通过使用钌作为催化剂,使酐和炔烃发生脱羧反应,合成出一系列3,4位取代基的异香豆素。Zhang等[9]以苯甲酸,醋酸乙烯为原料,以铑(Ⅲ)为催化剂,发生氧化偶联反应,得到一系列3-位取代的异香豆素类化合物。Ma等[10]以邻羧基苯甲醛,二羟基苯甲酰类化合物为原料,通过Passerini-羟醛缩合合成异香豆素。Yoo[11]以苯炔,端炔和二氧化碳为原料,在NHC-铜络合物的催化下,发生偶联反应,合成异香豆素类化合物。这些反应往往需要使用过渡金属作为催化剂进行合成,催化剂成本较高。
本文以廉价易得的取代的邻羧基苯乙酸为原料,经过简短的反应步骤,采用三氯氧磷和五氯化磷为关环试剂,合成了一系列取代的异香豆素衍生物,并对产物的结构进行了鉴定,也对其紫外光谱等性质进行了研究。实验结果表明可以从取代的邻羧基苯乙酸,经过一步简单的反应,得到3位氯代异香豆素类化合物2a~2c。或者经过两步简单的反应,得到3-烷氧基-4-氯代异香豆素类化合物4a~4f。详细的合成路线如图1所示:
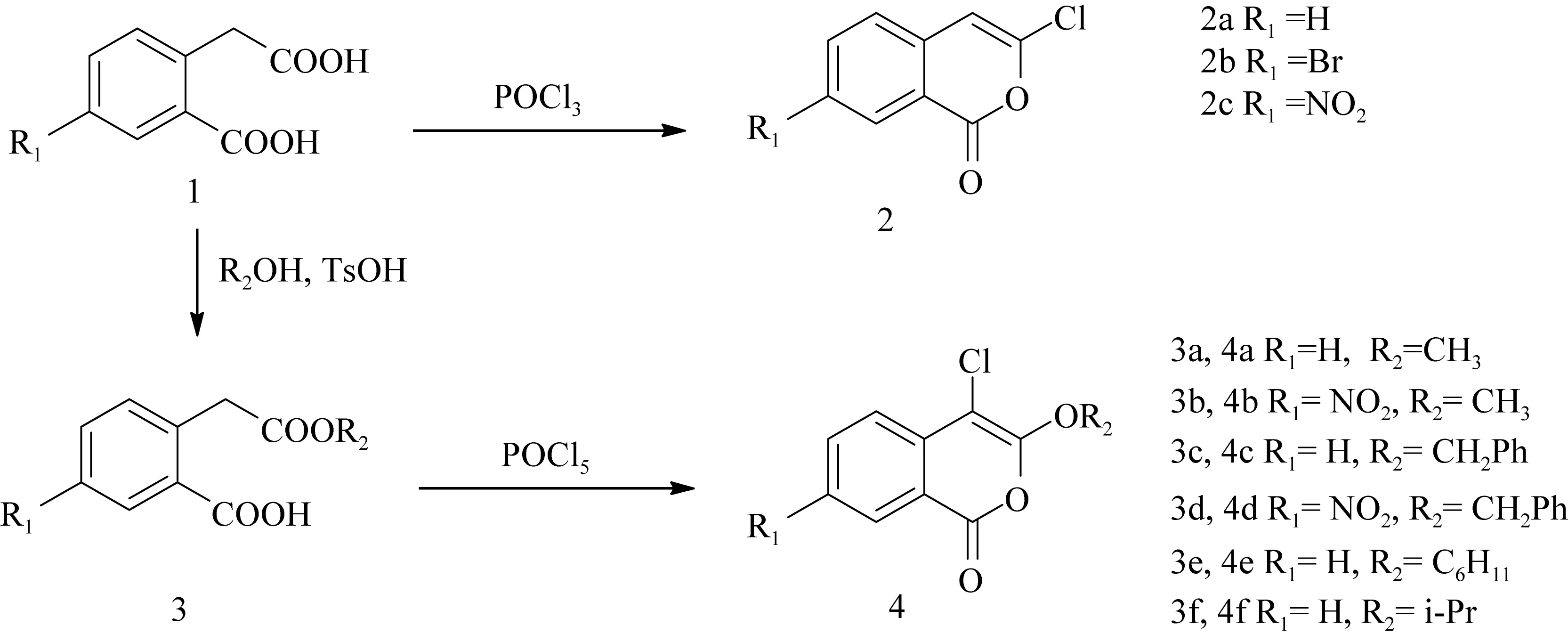
图1 异香豆素2和4的合成路线Fig.1 Synthesis of isocoumarin 2 and 4
1 实验部分
1.1 试剂与仪器
邻羧基苯乙酸按照文献[12]从茚制备;硝基和溴取代邻羧基苯乙酸从邻羧基苯乙酸分别根据文献[13]和文献[14]制备, 其他试剂均为分析纯。
所需仪器:旋转蒸发仪YER-52C, SHZ-D(Ⅲ)循环水式真空泵, DF-101S集热式恒温加热磁力搅拌器, L6S紫外分光光度器, Nicolet Nexus 470 FT-IR红外光谱仪,电热恒温鼓风干燥箱DHG9140A,电子天平TLE204E, Bruker Advance III HD 600核磁共振仪。
1.2 合成步骤
1.2.1 3-氯异香豆素的合成(2a)
参照文献[15], 将邻羧基苯乙酸1.8 g(0.01 mol),三氯氧磷1.7 mL(0.02 mol)加入带干燥管的50 mL三颈瓶中,在磁力搅拌下加热至90 ℃,保持温度反应3 h,冷却至室温后,加入碎冰块猝灭反应,有褐色固体析出,抽滤、洗涤并干燥得到粗产品。粗产品经过柱层析提取(V石油醚∶V乙酸乙酯=97∶3),得到0.98 g白色固体,产率为54.4%。
1.2.2 化合物2b~2c的合成。
化合物2b~2c均可以按照上述方法制得,产率分别为37.2%, 17.5%。
1.2.3 邻羧基苯乙酸甲脂的合成(3a)
参照文献[16], 将邻羧基苯乙酸1.8 g(0.01 mol),对甲苯磺酸0.1 g,甲醇0.9 mL(0.02 mol),三氯甲烷50 mL加入三颈瓶中,回流反应4 h,冷却至室温后,用去离子水50 mL×3清洗有机层,干燥后减压浓缩,得到黄色粗产品,粗产品经过重结晶(V丙酮∶V石油醚=2∶1)得到1.78 g白色固体,产率为92.2%。
1.2.4 化合物3b~3f的合成。
化合物3b, 3f可以按照上述方法制得,收率为79.3%, 82.3%;而3c, 3d, 3e则需要将溶剂换为苯,采用水分离器将反应生成的水分出,并延长反应时间到12 h,才可以得到较好收率,分别为81.2%, 75.4%和79.6%。
1.2.5 3-甲氧基-4-异香豆素的合成(4a)
参照文献[17], 将邻羧基苯乙酸甲脂1.9 g(0.01 mol),五氯化磷6.2 g (0.03 mol),苯60 mL加入三颈瓶中,在搅拌下回流16 h,冷却至室温,用去离子水猝灭五氯化磷,分别用饱和碳酸氢钠60 mL,饱和食盐水60 mL洗涤有机相,干燥后减压浓缩,得到红色油状粗产品,粗产品通过柱层析得到1.7 g黄色固体,产率为81.3%。
1.2.6 化合物4b~4f的合成。
化合物4b~4f可以按照上述方法制得,收率分别为73.5%, 56.7%, 60.1%, 51.2%和60.2%。
2 结果与讨论
2.1 邻羧基苯乙酸酯化反应研究
2.1.1 邻羧基苯乙酸酯化反应催化剂的选择
本文选取了对甲苯磺酸,浓硫酸,膨润土三种常用的酯化反应催化剂,并对三种催化剂对邻羧基苯乙酸的甲酯化催化效率进行考察,试图筛选出一种高效的催化剂。具体实验结果如表1所示:
表1 酯化催化剂选择实验表
Tab.1 Screening of esterification catalyst

催化剂名称反应时间/h溶剂温度/℃酯化产率/%TsOH2甲醇65822H2SO46甲醇65793膨润土7甲醇65897
根据不同催化剂的使用情况,使用膨润土作为催化剂时甲酯化率最高,并且酯化率高达89.7%,但是由于其需反应时间过长及反应后处理较为繁琐,选用了同样有较好催化效果、反应时间简短且后处理简便的对甲苯磺酸作为酯化催化剂。
2.1.2 邻羧基苯乙酸酯化反应溶剂的选择
在酯化反应中,对酯化产率影响较大的因素除了催化剂外,溶剂也是影响酯化率的一个重要因素。为此,分别使用不同的溶剂对邻羧基苯乙酸的甲酯化和苄脂化进行试验,其结果如表2和表3所示:
表2 邻羧基苯乙酸甲酯化溶剂筛选
Tab.2 Screening of solvent for the methyl esterification of homophthalic acid
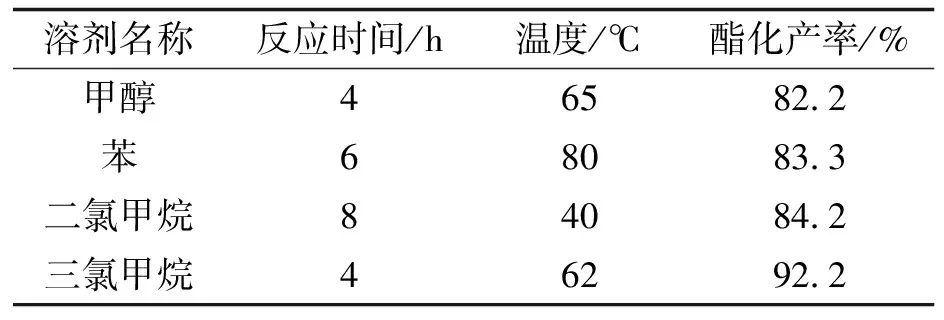
溶剂名称反应时间/h温度/℃酯化产率/%甲醇465822苯680833二氯甲烷840842三氯甲烷462922
表3 邻羧基苯乙酸苄酯化溶剂筛选
Tab.3 Screening of benzyl esterification of homophthalic acid
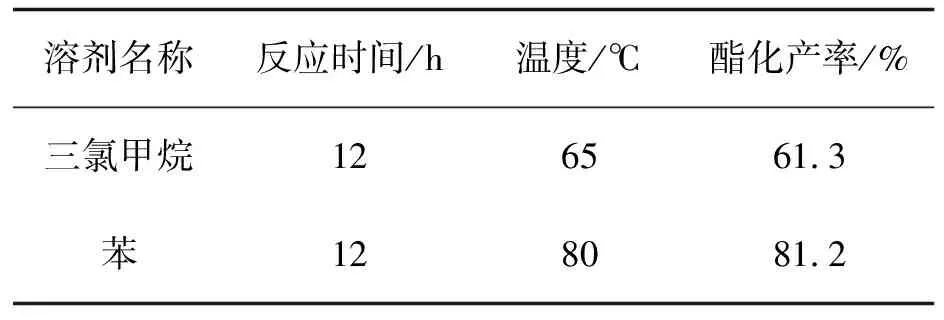
溶剂名称反应时间/h温度/℃酯化产率/%三氯甲烷1265613苯1280812
根据不同的甲酯化溶剂,三氯甲烷最适合用于作为甲酯化的溶剂,但是在如苄醇等高级醇的酯化反应中,由于酯化活性的降低,反应产生的水对反应进行的影响越发明显,需要在酯化反应时进行水分离操作。
所以本文选择对甲苯磺酸作为反应催化剂,在进行如甲醇、异丙醇等低级醇时选用三氯甲烷为溶剂,而在进行如苄醇等高级醇中选用苯作为溶剂并进行分水。
需要指出的是,在上述各种酯化反应条件中,由于邻羧基苯乙酸中两个羧基的活性具有显著差异,酯化反应总是高选择性的发生在苯乙酸的位置。
2.2 关环反应的条件选择
2.2.1 邻羧基苯乙酸甲脂关环的溶剂讨论
根据文献[17]中提到苯或甲苯都可作为关环时的溶剂,分别使用两种溶剂对邻羧基苯乙酸甲酯与五氯化磷的关环反应进行了对比,其实验结果如表4所示:
表4 关环反应溶剂选择
Tab.4 Screening of solvents for ring closure reaction

溶剂反应时间/h反应温度/℃产率/%甲苯16120N/A苯1690792
根据实验结果,在使用五氯化磷作为关环试剂时,在回流条件下,选用甲苯作为溶剂时,可能由于反应温度的过高,导致反应活性太高,产生了多种副反应,致使产物较为复杂且收率极低。所以选用了苯作为邻羧基苯乙酸甲脂关环的溶剂,可以有效地生成3-甲氧基-4-氯异香豆素。在其他邻羧基苯乙酸脂的关环中使用苯作为溶剂,同样取得了较好的收率。
2.2.2 邻羧基苯乙酸酰化关环试剂的选用
对于邻羧基苯乙酸酰化关环为3-位氯化的异香豆素反应,为了选用一种合适的酰化关环试剂,分别使用POCl3, PCl5对邻羧基苯乙酸进行酰化关环实验,其实验结果如表5所示:
表5 邻羧基苯乙酸关环酰化试剂选择
Tab.5 Screening of acylation reagent for ring closure of homophthalic acid

酰基化试剂试剂与原料摩尔比反应温度/℃溶剂产率/%POCl33∶190POCl3544PCl53∶190苯107
从表5的实验结果表明,POCl3更适合用于邻羧基苯乙酸进行关环。其原因有可能是由于PCl5的酰化和氯化作用都强于POCl3, 而酯羰基的反应活性要弱于羧酸上的羰基,所以使用PCl5对羧酸酯进行关环反应;当使用PCl5对邻羧基苯乙酸进行关环时,由于两者反应活性分别高于POCl3和苯乙酸酯,产生多种副反应,很难获得目标产物。所以在对取代的邻羧基苯乙酸关环时,选用POCl3作为酰化剂,并取得较好的收率,约为17.5%~54.4%。相对地,当对邻羧基苯乙酸脂进行关环时,使用酰化作用较强的PCl5,也取得了较好的收率,为51.3%~81.3%。
2.3 产物的光谱性质
2.3.1 产物的紫外光谱讨论
图2为2a~2c三种异香豆素的紫外图谱,从图2中可以看到三种异香豆素在大于300 nm的最大吸收峰的波长值分别为327 nm, 339 nm和331 nm。2b, 2c与2a在大于300 nm的最大吸收波长相比,发生了红移,这是由于—NO2,—Br增大了共轭体系。
图3为4a~4f六种异香豆素化合物的紫外谱图,为了更清楚的看到各个谱线,除4e外,均有向上平移。从图3中可以看出, 4b与4d谱图相似,而4a, 4c, 4e, 4f谱图相似,这可能是由于-NO2对苯环的强吸电子共轭作用作用导致谱图红移且吸收增强, 并且270 nm左右的峰与K带发生简并。

图2 常温下,异香豆素2a~2c紫外图谱
Fig.2 UV-vis spectra of isocoumarins 2a~2c at room temperature
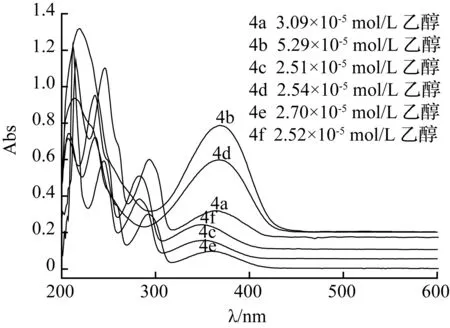
图3 常温下,异香豆素 4a~4f的紫外图谱
Fig.3 UV-vis spectra of isocoumarins 4a~4f at room temperature
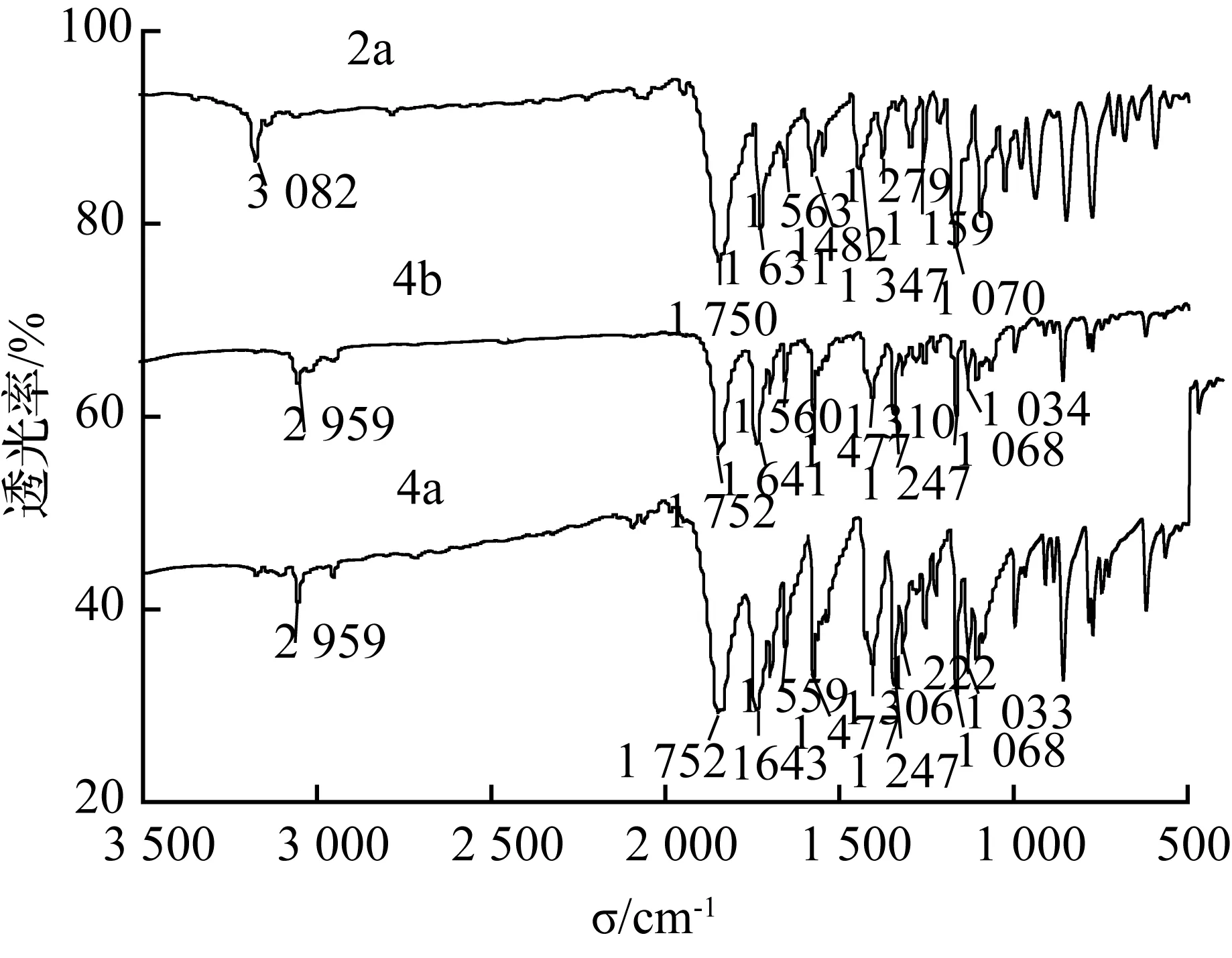
图4 异香豆素2a, 4a, 4b红外光谱图Fig.4 IR Spectra of isocoumarin 2a, 4a and 4b
根据图2和图3, 这9种目标化合物在波长200~250 nm都有K吸收带强吸收,而K带吸收的产生是由于物质具有大的共轭体系产生的,这与异香豆素中苯环与侧环上的双键大共轭体系相验证,而化合物在波长300~400 nm具有R吸收带,这是由于侧环上的C=O键发生n-π*跃迁产生的,这与化合物的结构相验证。
2.3.2 产物的红外谱图讨论
图4为化合物2a,4a,4b的红外谱图,从图4中可以看出,三种化合物在1 750 cm-1, 1 640 cm-1附近均有较强的吸收,这是由于三种化合物中的C=O键产生的伸缩振动动引起的。而三种化合物在1 560 cm-1, 1 447 cm-1附近也有强吸收,这是由苯环骨架振动产生的。三种化合物在1 250 cm-1和1 070 cm-1附近都有较强吸收,这是由于化合物中内酯的C—O—C键的不对称伸缩振动产生的。化合物4a,4b在2 959 cm-1均有吸收,是由于饱和的C—H键的伸缩振动引起的,而在4c中出现了3 082 cm-1,这是由于该化合物存在双键上的不饱和的C—H键伸缩振动产生的。这些吸收带进一步说明这些化合物含有结构单元Ph—CO—O—C=C—,为异香豆素化合物的特征吸收。
综上以上紫外和红外光谱相关性质, 再结合核磁共振谱图,目标产物的结构与实验所得光谱图中所显示的特征吸收都能一一对应,表明本文已经成功的合成了9种异香豆素类化合物。
3 目标化合物的表征
①2a 3-氯异香豆素:白色固体, 产率54.4%,熔点93 ℃~94 ℃。
UV(CH3CH2OH) λmax/nm(ε/[L·(mol·cm)-1]: 232(4.20×104), 244(2.44×104),269(1.40×104), 279(1.04×104), 327(0.60×104)。IR(KBr)/cm-1: 3 082, 1 750, 1 631.19, 1 563.39,1 482.69, 1 451.54, 1 347.75, 1 279.50, 1 198.98, 1 159.83, 1 070.74, 996.28, 927.96, 881.91, 840.86, 752.04, 677.91, 615.02, 583.77, 495.44。1H NMR(600 MHz, CDCl3),δ: 8.25(d,J=7.8 Hz, 1H), 7.73(m, 1H), 7.51(m, 1H), 7.38(d, 1H,J=6 Hz), 6.53(s, 1H)。
②2b 3-氯-7-溴异香豆素:白色固体, 产率37.2%,熔点142 ℃~144 ℃。
UV(CH3CH2OH) λmax/nm(ε/[L·(mol·cm)-1]): 234(4.8×104), 275(2.80×104), 296(2.32×104), 339(0.72×104)。IR(KBr)/cm-1:3 088.87, 3 036.49, 1 743.32, 1 622.34, 1 592.31, 1 544.66, 1 395.26, 1 314.08, 1 263.10, 1 180.52, 1 133.02, 1 078.49, 1 071.45, 1 016.84, 934.94, 853.01, 771.41, 684.49, 513.13。1H NMR(600 MHz, CDCl3),δ: 8.38(s,1H), 7.82(dd, 1H,J1=1.8 Hz,J2=8.4 Hz), 7.26(d, 1H,J=6 Hz), 6.51(s, 1H)。
③2c 7-硝基-3-氯异香豆素:淡黄色固体,产率17.5%,熔点98 ℃~100 ℃。
UV(CH3CH2OH) λmax/nm(ε/[L·(mol·cm)-1]): 207(2.49×104), 210(2.31×104), 232(2.19×104), 331(1.34×104)。IR(KBr)/cm-1: 3 102.38, 3 064.89, 3 031.76, 1 760.30, 1 610.31, 1 558.92, 1 511.64, 1 477.26, 1 426.12, 1 376.12, 1 339.75, 1 305.03, 1 237.31, 1 191.79, 1 139.74, 1 087.17, 1 049.44, 1 016.15, 972.29, 923.91, 876.92, 840.29, 748.73, 686.18, 601.14, 526.89。1H NMR(600 MHz, CDCl3),δ: 9.10(d, 1H,J=1.8 Hz), 8.54(dd, 1H,J1=2.4 Hz,J2=8.4 Hz), 7.56(d, 1H,J=8.4 Hz), 6.65(s, 1H)。
④4a 3-甲氧基-4-氯异香豆素:黄色固体,产率81.3%,熔点97 ℃~99 ℃。
UV(CH3CH2OH) λmax/nm(ε/[L·(mol·cm)-1]): 215(2.49×104), 246(2.38×104), 293(0.11×104), 364(0.38×104)。IR(KBr)/cm-1: 3 079.52, 3 002.97, 2 959.17, 2 857.69, 1 752.00, 1 643.19, 1 601.10, 1 559.66, 1 477.55, 1 438.54, 1 327.22, 1 306.74, 1 247.61, 1 222.70, 1 182.85, 1 156.38, 1 127.46, 1 068.29, 1 033.90, 1 008.40, 991.25, 899.66, 869.94, 812.87, 788.41, 760.90, 687.07, 676.52, 650.68, 630.74, 522.75, 468.03。1H NMR(600 MHz, CDCl3),δ: 8.20(d,J=7.8 Hz, 1H), 7.76(dd,J1=7.8 Hz,J2=7.2 Hz, 1H), 7.71(d,J=8.4 Hz, 1H), 7.39(dd,J1=7.8 Hz,J2=7.2 Hz, 1H), 4.09(s, 3H)。
⑤4b 7-硝基-3-甲氧基-4-氯异香豆素:黄色固体,产率73.5%,熔点129 ℃~132 ℃。
UV(CH3CH2OH) λmax/nm(ε/[L·(mol·cm)-1]): 219(2.08×104), 368(1.12×104)。IR(KBr)/cm-1: 2 959.29, 2 925.48, 2 857.35, 1 752.30, 1 641.37, 1 601.97, 1 601.97, 1 560.32, 1 477.62,1 466.42,1 310.50,1 247.88, 1 223.09, 1 183.30, 1 157.46, 1 127.62, 1 068.67, 1 034.40, 1 008.88, 991.87, 967.96, 899.99, 813.36, 761.96, 687.93, 676.98, 524.04。1H NMR (600 MHz, CDCl3),δ: 9.03(d,J=2.4 Hz, 1H), 8.52(dd,J1=7.8 Hz,J2=7.2 Hz, 1H), 7.83(d,J=9.0 Hz, 1H), 4.17(s, 3H)。
⑥4c 3-苄氧基- 4-氯异香豆素:黄色固体,产率56.7%,熔点81 ℃~83 ℃。
UV(CH3CH2OH) λmax/nm(ε/[L·(mol·cm)-1]): 208(2.76×104), 236(2.68×104),283(1.32×104), 351(0.44×104)。IR(KBr)/cm-1: 3 063.34, 3 034.60, 2 965.17, 1 755.28, 1 635.41,1 603.05,1 553.07,1 475.17, 1 449.00, 1 384.26, 1 292.86, 1 239.04, 1 230.98, 1 208.47, 1 158.72, 1 057.47, 1 030.68, 1 002.64, 973.75, 881.41, 751.64, 687.47, 645.00, 592.25, 516.08。1H NMR(600 MHz,CDCl3),δ: 8.20(dd, 1H,J1=1.2 Hz,J2=7.8 Hz), 7.75(m, 1H), 7.70(m, 1H), 7.50(m, 2H), 7.40(m, 3H), 7.35(m, 1H), 5.42(s, 2H)。
⑦4d 7-硝基-3-苄氧基-4-氯异香豆素: 黄色固体,产率60.1%,熔点150 ℃~152 ℃。
UV(CH3CH2OH) λmax/nm(ε/[L·(mol·cm)-1]): 214(2.96×104), 368(1.60×104)。IR(KBr)/cm-1: 3 102.38, 3 064.89, 3 031.76, 1 760.30, 1 610.31, 1 558.92, 1 511.64, 1 477.26, 1 426.12,1 376.12,1 339.75,1 305.03,1 237.31, 1 191.79, 1 139.74, 1 087.17, 1 049.44, 1 016.15, 972.29, 923.91, 876.92, 840.29, 748.73, 686.18, 601.14, 526.89。1H NMR(600 MHz, CDCl3),δ: 9.01(d, 1H,J=2.4 Hz), 8.51(dd, 1H,J1=2.4 Hz,J2=9 Hz), 7.81(d, 1H,J=8.4 Hz), 7.50(m, 2H), 7.40(m, 3H), 5.49(s, 2H) 。
⑧4e 3-环己氧基-4-氯异香豆素: 黄色固体,产率51.2%,熔点67 ℃~69 ℃。
UV(CH3CH2OH) λmax/nm(ε/[L·(mol·cm)-1]): 212(4.56×104), 245(2.19×104), 292(1.11×104), 360(0.37×104)。IR(KBr)/cm-1:2 936.19, 2 857.36, 1 750.28, 1 637.43, 1 557.86, 1 480.18, 1 455.39,1 365.43, 1 305.26, 1 246.16, 1 218.53, 1 163.12, 1 116.27, 1 056.97, 1 030.43, 1 007.61, 969.49, 892.10, 814.22, 790.90, 754.59, 678.30, 646.68, 525.18。1H NMR (600 MHz, CDCl3),δ: 8.24(d,J=8.0 Hz, 1H), 7.78(m, 2H), 7.45~7.41(m, 1H), 4.85(m, 1H), 1.99(m, 2H), 1.86(m, 2H), 1.71(m, 2H), 1.41(m, 4H)。
⑨4f 3-异丙氧基异-4-氯香豆素:黄色固体,产率60.2%,熔点41 ℃~43 ℃。
UV(CH3CH2OH) λmax/nm(ε/[L·(mol·cm)-1]): 207(2.48×104), 236(3.40×104), 283(1.64×104), 350(0.56×104)。IR(KBr)/cm-1: 2 985.17, 2 935.59, 1 744.66, 1 635.60, 1 606.50, 1 560.21, 1 478.71,1 455.94, 1 380.73, 1 305.75, 1 246.36, 1 246.36, 1 218.98, 1 097.17, 1 056.41, 1 034.67, 969.21, 897.05, 796.58, 757.00, 683.51, 523.93。1H NMR(600 MHz, CDCl3),δ: 8.21(d,J=8.0 Hz, 1H), 7.75(m, 2H), 7.40(m, 1H),5.05(m, 1H), 1.43(d, 6H,J=6.6 Hz)。
4 结 语
邻羧基苯乙酸在三氯氧磷与邻羧基苯乙酸酯五氯化磷的作用下,发生了酰化关环反应,可以获得对应的3-氯代和4-氯代的异香豆素衍生物。所得的3种3-氯异香豆素和6种3-烷氧基-4氯代异香豆素的结构均通过核磁共振和红外光谱进行了结构鉴定。从红外的特征吸收峰1 750、1 640、1 560、1 447、1 250和1 070 cm-1, 可以确定这些化合物含有异香豆素骨架结构单元Ph—CO—O—C=C—。并测定了这些化合物的紫外吸收可见光谱, 发现所有异香豆素在300~350 nm,都有明显的吸收。该研究为氯代异香豆素衍生物的合成提供了一种简便,廉价的新方法。
[1] LUO S L, HUANG J W, WANG Y, et al.Isocoumarins from American cockroach(Periplaneta americana) and their cytotoxic activities[J]. Fitoterapia, 2014, 95: 115-120.
[2] DAMASCENO J, GIUBERTI C S, GONCALVES R C R, et al.Preformulation study and influence of DMSO and propylene glycol on the antioxidant action of isocoumarin paepalantine isolated from Paepalanthus bromelioide[J]. Revista Brasileira de Farmacognosia, 2015, 25(4): 395-400.
[3] ANGAJALA G, NAPOLEON A A, KHAN F N, et al.Synthesis, characterization and pharmacological studies of novel isocoumarins derived from two anti-inflammatory drugs-Diclofenac and Aceclofenac[J]. Journal of the Indian Chemical Society, 2015, 92(4): 603-607.
[4] 李丽,杨锦飞,袁相爱.异香豆素类化合物的合成研究及新进展[J]. 南京师范大学学报(工程技术版),2005,5(2):64-67.
[5] 尹立,邹原,韩伟,等.异香豆素对阿尔茨海默病Aβ蛋白的抑制作用及其机制[J]. 中国医院药学杂志, 2012,32(5):329-332.
[6] 廖静妮,段文贵,马献力,等.N-氨乙基萜品烯马来酰亚胺的合成及生物活性研究[J]. 广西大学学报(自然科学版),2014,39(3):467-472.
[7] HARA Y, ONODERA S, KOCHI T, et al.Catalytic formation of α-aryl ketones by C—H functionalization with cyclic alkenyl carbonates and one-pot synthesis of Isocoumarins[J]. Organic Letters, 2015, 17(19): 4850-4853.
[8] PRAKASH R, SHEKARRO K, GOGOI S, et al.Ruthenium-catalyzed decarbonylative addition reaction of anhydrides with alkynes: a facile synthesis of isocoumarins and α-pyrones[J]. Chemical Communications, 2015, 51(49): 9972-9974.
[9] ZHANG M L, ZHANG H J, HAN T T, et al.Rh (Ⅲ)-catalyzed oxidative coupling of benzoic acids with geminal-substituted vinyl acetates: synthesis of 3-substituted isocoumarins[J]. Journal of Organic Chemistry, 2015, 80(1): 620-627.
[10]MA G H, JIANG B, TU X J, et al.Synthesis of isocoumarins with different substituted patterns via passerini-aldol sequence[J]. Organic Letters, 2014, 16(17): 4504-4507.
[11]YOO W J, NGUYEN T V Q, KOBAYASHI S, et al.Synthesis of isocoumarins through three-component couplings of arynes, terminal alkynes, and carbon dioxide catalyzed by an NHC-copper complex[J]. Angewandte Chemie, International Edition: 2014, 53(38): 10213-10217.
[12]ZHANG H, ZHENG Y Q, GUO J.Synthesis, docking and biological evaluation of isoquinolonic acid derivatives[J]. Chemical Research in Chinese Universities, 2013, 29(6):1110-1114.
[13]BILLAMBOZ M, BAILLY F, BARRECA M L, et al.Design, synthesis, and biological evaluation of a series of 2-Hydroxyisoquinoline-1,3(2H,4H)-diones as dual inhibitors of human immunodeficiency virus type 1 integrase and the reverse transcriptase RNase H domain[J]. Journal of Medicinal Chemistry, 2008, 51(24): 7717-7730.
[14]DELIOMEROGLU M K, OZCAN S, BALCI M, et al.A short and efficient construction of the dibenzo[c, h]chromen-6-one skeleton[J]. ARKIVOC (Gainesville, FL, United States), 2010, 2: 148-160.
[15]KUMAR Y S, DASARADHAN C, PRABAKARAN K, et al.Palladium catalyzed suzuki miyaura cross coupling of 3-chloroisochromen-1-one: synthesis of glomellin and reticulol analogues[J]. Tetrahedron Letters, 2015, 56(7): 941-945.
[16]FENG Z W, ZHAO X Q, BI H, et al.Selective esterification of non-conjugated carboxylic acids in the presence of conjugated or aromatic carboxylic acids over active carbon supported methanesulfonic acid[J]. From Science in China, Series B, Chemistry: 2008, 51(10): 990-992.
[17]HEYNEKAMP J J, HUNSAKER L A, VANDER J T A, et al.Isocoumarin-based inhibitors of pancreatic cholesterol esterase[J]. Bioorganic & Medicinal Chemistry, 2008, 16(9): 5285-5294.
(责任编辑 张晓云 梁碧芬)
Synthesis of some chlorinated isocoumarins
LAN Qing, ZHANG Min, XIANG Pei, ZHANG Yan
(School of Chemistry and Chemical Engineering, Guangxi Colleges and Universities Key Laboratory of Applied Chemistry Technology and Resource Development, Nanning 530004, China)
Isocoumarin is of the key structure which is the pharmacophore motif in some natural products and often exhibits perfect biological activities, such as antitumor, antifungal and anti-inflammation. However, the price of these compounds is usually quite high due to the lack of efficient synthetic methods. It is significant to develop a short and convenient synthetic route for isocoumarin production. In this work, some substituted homophthalic acids were used as the starting materials and 3-chloroisocoumarins was synthesized by the reaction of substituted homophthalic acids with phosphorus oxychloride. Homophthalic acids were also reacted with alcohols to generate selectively phenylacetic acid ester in the presence of Bronsted acid, which was further reacted with phosphorus pentachloride to afford the 3-alkyoxy-4-chloro-isocoumarins. The yields of these isocoumarins were satisfactory under the optimal conditions of the esterification and ring closure reactions. The structures of isocoumarin derivatives were determined by IR and1HNMR spectra and their UV and IR spectroscopic properties were studied.
homophthalic acid; isocoumarin; synthesis
2016-02-22;
2016-03-30
国家自然科学基金资助项目(21462003);广西自然科学基金资助项目(2014GXNSFCA118005);广西科技攻关项目(1348006-4);广西教育厅重点项目(2013ZD003);广西大学科研基金资助项目(XGZ111491)
张 敏(1976—),男,湖北荆州人,广西大学教授;E-mail: zhangminnju@163.com。
蓝擎,张敏,向佩,等.氯化异香豆素类化合物的合成[J].广西大学学报(自然科学版),2016,41(6):2023-2030.
10.13624/j.cnki.issn.1001-7445.2016.2023
O622.6
A
1001-7445(2016)06-2023-08

