2型糖尿病GK大鼠不同小肠段注射葡萄糖对血糖影响的实验研究*
艾小明 郭绍红 杨念印 李胜春 徐 鲲
(南京明基医院普外科 南京医科大学附属医院,南京 210019)
·实验研究·
2型糖尿病GK大鼠不同小肠段注射葡萄糖对血糖影响的实验研究*
艾小明 郭绍红**杨念印 李胜春 徐 鲲①
(南京明基医院普外科 南京医科大学附属医院,南京 210019)
目的 探讨2型糖尿病GK大鼠不同小肠段注射葡萄糖对血糖的影响。 方法 将24只GK大鼠随机分为A、B、C三组,每组8只。测各大鼠体重及尾部静脉血空腹血糖。手术探查小肠全长,将其分为三等分,用7号丝线结扎每段肠管的两端,保留正常的肠系膜血液循环。A组向近侧段小肠腔内注射葡萄糖,B组向中间段小肠腔内注射葡萄糖,C组向远侧段小肠腔内注射葡萄糖,注射量均为1 mg/kg,生理盐水稀释至1 ml。分别测定注射葡萄糖后2、15、45、75、120 min尾部静脉血血糖。 结果 手术过程中5只大鼠死亡(A、B组各2只,C组1只),手术存活率79.2%(19/24)。空腹血糖3组差异无显著性[(12.97±3.12)、(12.11±3.80)及(12.61±3.25)mmol/L,F=0.099,P=0.906]。注射葡萄糖后,A、B、C组血糖均升高。2 min血糖A组[(15.57±3.14)mmol/L]和C组[(14.21±2.74)mmol/L]明显高于B组[(11.67±0.23)mmol/L](P=0.008、0.011),A、C组差异无显著性(P=0.778)。15 min血糖A组[(21.23±3.16)mmol/L]>C组[(16.95±0.29)mmol/L]>B组[(14.06±3.00)mmol/L](P=0.006、0.049)。45 min血糖A组[(25.66±1.53)mmol/L]>C组[(17.63±1.46)mmol/L]>B组[(13.24±0.66)mmol/L](P=0.000、0.000)。75、120 min血糖3组差异无显著性(P>0.05)。 结论采用分段结扎肠管注射葡萄糖的方法观察到2型糖尿病GK大鼠各段小肠均表现出对血糖控制能力差,不同小肠部位控制血糖升高的能力具有差异,短时间内中段小肠对血糖控制效果最好,远段小肠次之,近段小肠控制效果最差。
GK大鼠; 血糖; 小肠; 2型糖尿病; 手术
目前,胃转流术(gastric bypass,GBP)治疗肥胖合并2型糖尿病(type 2 diabetes mellitus,T2DM)已成为一种被广泛认可的外科治疗方法,其对T2DM的缓解率可达82.6%~88.6%[1]。Roux-en-Y胃转流术(Roux-en-Y gastric bypass,RYGB)是目前运用极为广泛的代谢手术术式[2]。手术治疗T2DM取得了可喜的成果,但至今未能完全明确具体机制。近段小肠(十二指肠与近段空肠)和远段小肠(特别是末段回肠)的作用已成为研究的热点,由此产生了前肠和后肠两种假说,并认为小肠在T2DM的发病过程中扮演重要角色[3]。既然研究一致认为胃转流术治疗T2DM与手术改变了胃肠生理通道进而影响到食物生理流向有关,那么理论上整个小肠的任何部位的肠段都有可能是参与血糖调控的关键部位。2型糖尿病大鼠(Goto-Kakizaki rats)(GK大鼠)是一种自发性2型糖尿病大鼠,是目前公认的T2DM模型之一[4],也是建立胃转流术模型的最佳动物。我们的前期实验研究了正常SD大鼠不同小肠段在注入葡萄糖后血糖的动态变化(待发表)。本研究在总结前期实验的基础上,选用GK大鼠作为研究对象,旨在进一步探讨糖尿病大鼠不同小肠段在注入葡萄糖后血糖的动态变化,并推测其调节血糖的机理,为临床手术治疗T2DM提供基础理论依据。
1 材料与方法
1.1 实验动物和主要材料
11~12周龄的GK大鼠24只[常州卡文斯实验动物有限公司,合格证号:SCXK(苏)2011-0003],雄性,体重244~340 g。实验动物饲料为糖尿病大鼠专用饲料(常州卡文斯实验动物有限公司提供)。室温22~24 ℃,12 h交替光照,相对湿度45%~60%,动物自由摄取纯净水。实验前动物适应环境1周。OneTouch SelectSimple血糖仪(美国强生公司)。AEL-200型电子分析天平(日本LIBROR公司)。丙泊酚(意大利阿斯利康制药有限公司),50%葡萄糖、生理盐水(中国大冢制药有限公司)。手术器械由南京明基医院实验室提供。
1.2 实验方法
1.2.1 分组 将24只GK大鼠按1、2、3…24数字序列标记,随机分为A、B、C三组,每组8只。
1.2.2 术前准备 术前禁食12 h,不限饮水。测各组大鼠体重,取尾部静脉血测空腹血糖。
1.2.3 分段结扎肠管 用10%水合氯醛(0.008 ml/g)和1%丙泊酚(0.03 mg/g)腹腔内注射麻醉。麻醉成功后,大鼠取仰卧位,0.5%碘伏消毒,做上腹部正中切口,长约4 cm。进腹探查全小肠长度,并将其均分为三等分,每段小肠的上下端都用7号丝线靠近肠壁结扎,阻止肠腔内液体流动到别的肠腔内,但不影响小肠系膜的血液循环。
1.2.4 肠腔注射葡萄糖和测定血糖 用人体皮试针头穿刺,向小肠腔内注射葡萄糖液体,注射量1 mg/kg(用50%葡萄糖配置,生理盐水稀释至1 ml)。A组向近侧段小肠腔内注射,B组向中间段小肠腔内注射,C组向远侧段小肠腔内注射。分别测定注射葡萄糖后2、15、45、75、120 min尾部静脉血血糖。最后将全部大鼠按脊椎脱臼法处死。
1.3 统计学方法

2 结果
2.1 手术成功率及大鼠存活情况
手术过程中5只大鼠死亡:A组1只术中45 min死于失血量过多,1只术中75 min死于空气栓塞;B组1只术前死于麻醉药物中毒(麻醉药物注入血管),1只术中45 min死于空气栓塞;C组1只术前死于麻醉药物中毒(麻醉药物注入血管)。手术存活率为79.2%(19/24)。死亡大鼠自统计数据中排除。
2.2 3组大鼠血糖变化
3组GK大鼠手术前后血糖水平变化见表1、图1。空腹血糖3组差异无显著性。注射葡萄糖后,A、B、C组血糖均升高。2 min血糖A组和C组明显高于B组,A、C组差异无显著性;15 min和45 min血糖A组>C组>B组;75、120 min血糖3组差异无显著性。
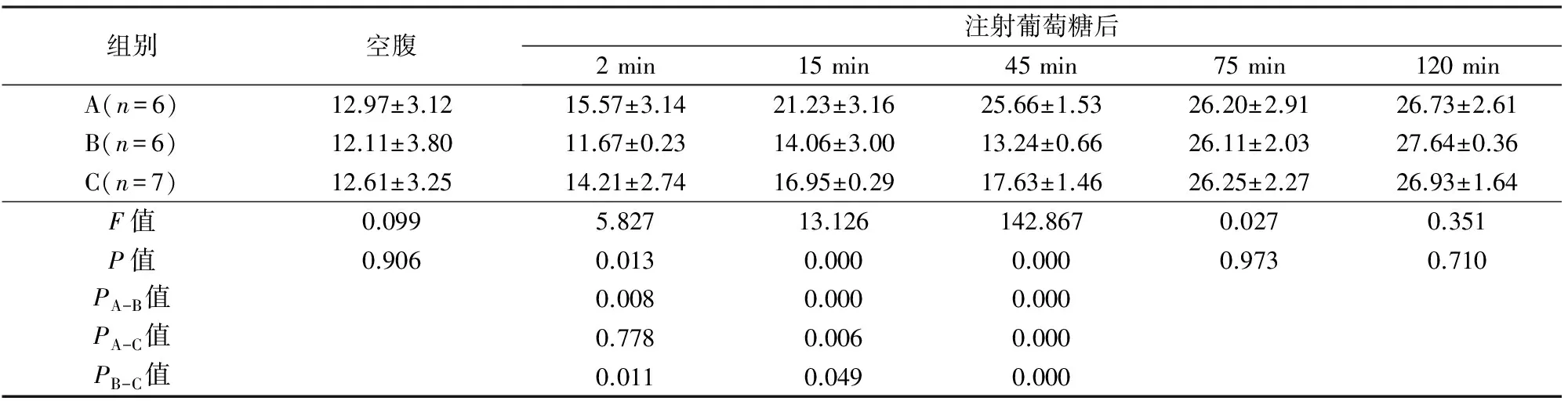
组别空腹注射葡萄糖后2min15min45min75min120minA(n=6)12.97±3.1215.57±3.1421.23±3.1625.66±1.5326.20±2.9126.73±2.61B(n=6)12.11±3.8011.67±0.2314.06±3.0013.24±0.6626.11±2.0327.64±0.36C(n=7)12.61±3.2514.21±2.7416.95±0.2917.63±1.4626.25±2.2726.93±1.64F值0.0995.82713.126142.8670.0270.351P值0.9060.0130.0000.0000.9730.710PA-B值0.0080.0000.000PA-C值0.7780.0060.000PB-C值0.0110.0490.000
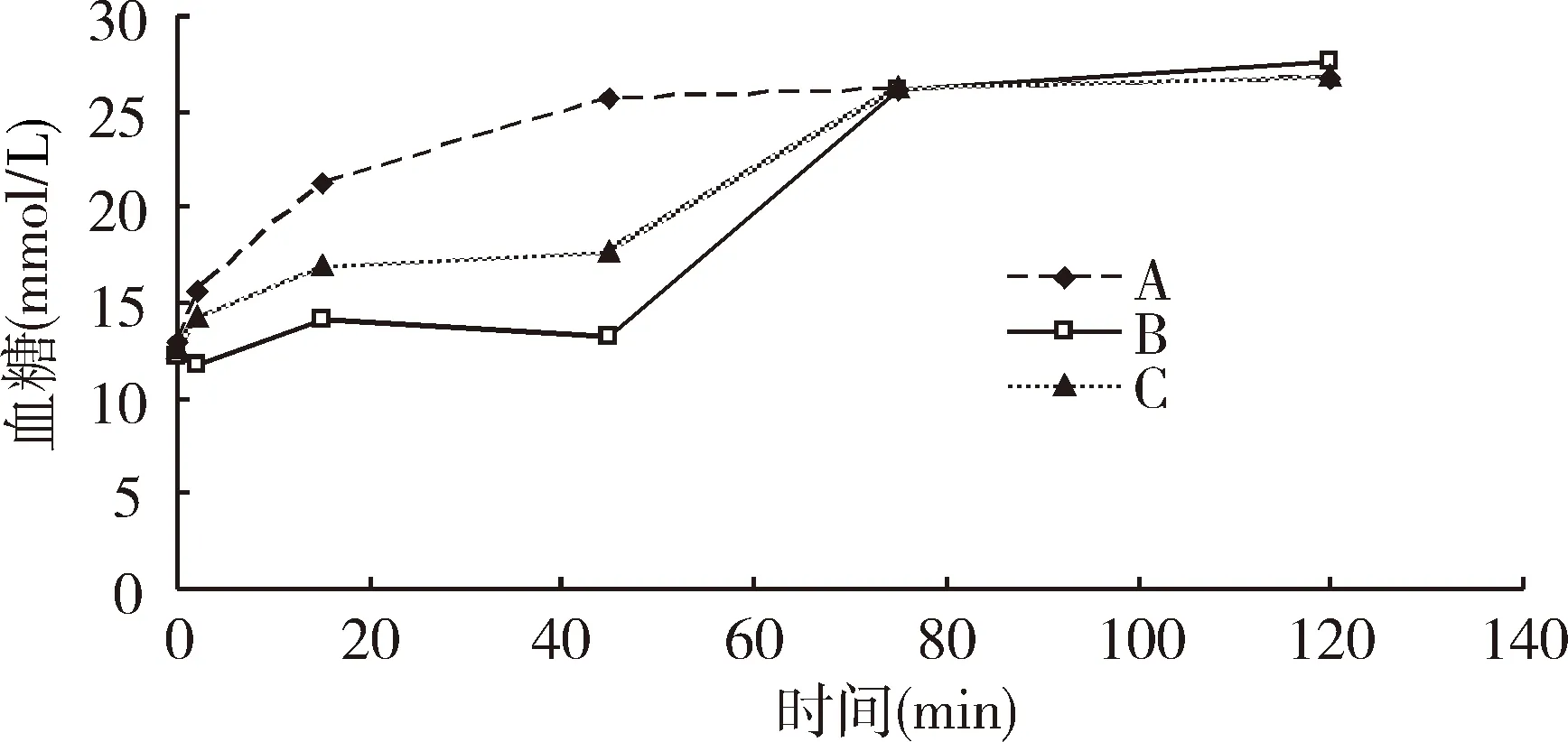
图1 GK大鼠注射葡萄糖前后血糖水平变化(时间“0”为空腹)
3 讨论
T2DM是由于胰岛素相对不足或周围组织对胰岛素敏感性下降引起的血糖升高,同时也存在体内胰岛素分泌水平或峰值下降,在进食后不能引起胰岛素分泌高峰的出现,导致血糖水平升高。目前T2DM的治疗仍以内科综合治疗为主,如口服降糖药物、注射胰岛素、运动与饮食控制等,但许多患者无法达到满意疗效。随着减重手术在国内外的广泛开展,越来越多的临床实践证实,伴有T2DM的病态肥胖患者,在接受减重手术治疗后,糖尿病的病情得到缓解,这一结果为T2DM的治疗提供了新的思路。随着外科手术技术的进步,减重手术,尤其是RYGB和胆胰转流术(biliopancreatic diversion,BPD)作为治疗肥胖合并糖尿病的方法已得到国际承认[5],因而又将其称为“代谢手术”或“糖尿病手术”[6],国际糖尿病联盟确定“代谢手术”作为治疗肥胖合并2型糖尿病的方法[7]。美国2009年糖尿病防治指南中已将胃转流术列入治疗肥胖合并2型糖尿病的标准[8]。2011年中华医学会糖尿病学分会和外科学分会发表了“手术治疗糖尿病专家共识”[9],认可代谢手术是治疗伴有肥胖的T2DM的手段之一,并鼓励内外科合作共同管理接受代谢手术的T2DM患者。
研究证明胃转流术可以使肥胖合并糖尿病获得完全缓解,所以有学者认为T2DM可能是一种小肠外科疾病[4,10]。现代观点认为糖尿病是手术能够治愈的胃肠道疾病即“胃肠型糖尿病”,这一理论认为是胃肠道内分泌调节机制紊乱导致了T2DM发病。代谢手术分为容量限制型、吸收不良型和混合型,RYGB属于混合型。
手术治疗T2DM的机制是研究的热点。手术治疗糖尿病最主要是降低糖尿病患者的胰岛素抵抗,同时也可增加胰岛素早期分泌的能力[11]。目前,我们仍不能完全解释不同术式治疗糖尿病的机制。但仔细审查现有的大量临床研究及动物实验,可大致得出结论,不同减重手术对糖尿病的治疗效果与其对消化道的机械性改变有关[12],可能与手术对胃肠道激素分泌的影响以及由此产生的胰岛素分泌或敏感性改变有关[13]。术后降低血糖的机制研究转向胃肠道激素的作用[14]。胃转流术后营养物质的消化部位从十二指肠、近段空肠转移到远段空肠和回肠,使肠道激素发生显著改变。胃转流术治疗T2DM的机制有多种假说和学说,大多是建立在消化道改道和重建的基础上提出来的,而在胃肠道的黏膜上分布有大量内分泌细胞并分泌各种胃肠道激素,术后胃肠激素的变化被认为是最主要机制[15]。这种胃肠激素与胰岛素分泌之间的关系称肠-胰岛轴(enteroinsular axis)。肠-胰岛轴假说分为前肠假说(foregut hypothesis)及后肠假说(hindgut hypothesis)。该假说认为近段小肠受食物刺激后可能分泌抑制胰岛素的激素(即前肠假说),主要包括抑胃肽(gastric inhibitory peptide,GIP);而远段小肠尤其是末段回肠受食物刺激后可分泌促进胰岛素分泌的激素(即后肠假说),主要包括胰高血糖素样肽1(glucagon like peptide 1,GLP-1)和神经肽YY(peptide YY,PYY),目前认为GLP-1是肠-胰岛轴控制T2DM最核心的介导因子[16]。此外,还有神经内分泌学说、脂肪-胰岛轴假说、炎性介质假说及其他一些激素变化等机制。总而言之,胃肠道功能及内分泌网络二者间并不是各自独立的,而是形成复杂的双相反馈调节系统[17]。
我们前期实验研究显示,从血糖控制方面来看,正常SD大鼠近段小肠控制效果最差,中间段小肠次之,远段小肠效果最好。这些都可能与胃肠道激素分泌的影响有密切关系。本研究结果显示,对于GK糖尿病大鼠,注射葡萄糖后,A(近段)、B(中间段)、C组(远段)血糖均呈升高趋势,对血糖控制能力都很差。但在短时间内(术后2、15、45 min),中间段小肠血糖控制效果最好,远段小肠次之,近段小肠控制效果最差。中间段和远段的差异与正常大鼠的研究结果有所不同。这说明GK大鼠近段小肠控制血糖能力最差,可能是近段小肠存在抵抗胰岛素活性的激素,主要是GIP。远段小肠则可能存在改善胰岛素敏感性的激素,推测主要是GLP-1和PYY。而中间段小肠短时间内控制血糖效果最好,推测也可能与GLP-1和PYY有关。提示我们胃转流手术要重视中段小肠的作用。郭晓博等[18]对GK大鼠不同区段小肠转流的手术模型研究也显示,转流的最佳效应区域是小肠中段,即空肠与回肠交界处为宜,这就需在术中权衡距Treitz韧带切断空肠及引流襻长短的距离,使得转流部位确定为小肠中段而发挥手术最大效应。张晓梅等[19]认为,小肠转流的最佳效应区域位于小肠中段,即空肠与回肠交界处为宜,既保留了手术的降糖作用,又最大限度地减少了营养不良的发生率。
本研究的特点是采用分段结扎肠道注射葡萄糖的方法观察GK糖尿病大鼠不同小肠部位控制血糖升高的能力及差异性。本实验的缺陷是:①选择GK糖尿病大鼠,并不一定能代表人类的实际情况;②是动物实验;③没有对大鼠血液中胃肠道激素的变化及胰岛素的变化进行测定。所以目前还不能直接将本实验结果推断为人体的实际情况。今后需要重点研究糖尿病GK大鼠不同小肠段黏膜和糖尿病相关内分泌激素,以期为外科手术治疗T2DM提供更多的基础理论支持。
1 Buchwald H,Estok R,Fahrbach K,et al.Weight and type 2 diabetes after bariatric surgery:systematic review and meta-analysis.Am J Med,2009,122(3):248-256.
2 Buchwald H,Oien DM.Metabolic/bariatric surgery worldwide 2011.Obes Surg,2013,23(4):427-436.
3 Rubino F.Is type 2 diabetes an operable intestinal disease?A provocative yet reasonable hypothesis.Diabetes Care,2008,31(Suppl 2):S290-S296.
4 Partha B. Programmed disorders of beta-cell development and function as one cause for type 2 diabetes? The GK rat paradigm.Diabetes Metab Res Rev, 2005, 21:495-504.
5 Mingrone G,Panunzi S,De Gaetano A,et al.Bariatric surgery versus conventional medical therapy for type 2 diabetes.N Engl J Med,2012,366(17):1577-1585.
6 邹大进,郑成竹,吴 鸿,等.代谢手术治疗糖尿病专家共识.中华糖尿病杂志,2011,6(3):205-208.
7 Dixon JB,Zimmet P,Alberti KG,et al.Bariatric surgery:an IDF statement for obese type 2 diabetes.Diabet Med,2011,28(6):628-642.
8 林允信,许昌泰.胃旁路手术治疗2型糖尿病研究现状.医学综述,2011,17(6):902-905.
9 中华医学会糖尿病学分会,中华医学会外科学分会.手术治疗糖尿病专家共识.中国实用外科杂志,2011,31(5):367-370.
10 Laferrère B,Swerdlow N,Bawa B,et al.Rise of oxyntomodulin in response to oral glucose after gastric bypass surgery in patients with type 2 diabetes.J Clin Endocrinol Metab,2010,95(8):4072-4076.
11 Dirksen C,Jorgensen NB,Bojsen-Moller KN,et al.Mechanisms of improved glycaemic control after Roux-en-Y gastric bypass.Diabetologia,2012,55(7):1890-1901.
12 Stefater MA,Wilson-Perez HE,Chambers AP,et al.All bariatric surgeries are not created equal:insights from mechanistic comparisons.Endocr Rev,2012,33(4):595-622.
13 Flatt PR.Effective surgical treatment of obesity may be mediated by ablation of the lipogenic gut hormone gastric inhibitory polypeptide (GIP):evidence and clinical opportunity for development of new obesity-diabetes drugs.Diab Vasc Dis Res,2007,4(2):151-153.
14 Lee WJ,Lee YC,Ser KH,et al.Improvement of insulin resistance after obesity surgery:a comparison of gastric banding and bypass procedures.Obes Surg,2008,18(9):1119-1125.
15 Lawson ML,Kirk S,Mitchell T,et al.One-year outcomes of Roux-en-Y gastric bypass for morbidly obese adolescents:a multicenter study from the Pediatric Bariatric Study Group.J Pediatr Surg,2006,41(1):137-143.
16 Stearns AT,Balakrishnan A,Rhoads DB,et al.Rapid upregulation of sodium-glucose transporter SGLT1 in response to intestinal sweet taste stimulation.Ann Surg,2010,251(5):865-871.
17 Nauck MA,Kemmeries G,Holst JJ,et al.Rapid tachyphylaxis of the glucagon-like peptide 1-induced deceleration of gastric emptying in humans.Diabetes,2011,60(5):1561-1565.
18 郭晓博,高宏凯,高艳红,等.保留全胃、不同区段小肠转流术后GK大鼠糖代谢变化规律的研究.中国糖尿病杂志,2010,18(2):92-94.
19 张晓梅,高宏凯,吴致委,等.胃转流术后血糖与胰升血糖素样肽-1改变的实验研究.中国糖尿病杂志,2013,21(2):181-184.
(修回日期:2015-12-03)
(责任编辑:王惠群)
Effects of Glucose Injection at Different Segments of Small Intestine on Blood Glucose Level in Type 2 Diabetes Mellitus Goto-Kakizaki Rats
AiXiaoming,GuoShaohong,YangNianyin,etal.
DepartmentofGeneralSurgery,BenQMedicalCenterofNanjingMedicalUniversity,Nanjing210019,China
Correspondingauthor:GuoShaohong,E-mail:gsh1960@163.com
Objective To evaluate the effect of glucose injection at different segments of small intestine on blood glucose level in Goto-Kakizaki (GK) rats with type 2 diabetes mellitus. Methods Twenty-four GK rats were randomly divided into three groups (Group A, B, and C) with each group of 8 rats. The body weight and values of fasting plasma glucose (FPG) were measured. All the rats underwent an operation. The whole length of small intestine was separated into three segments averagely: proximal, middle, and distal segment,with ligation of silk thread. In the Group A, 50% glucose was injected into the enteric cavity of proximal segment. In the Group B, 50% glucose was injected into the enteric cavity of middle segment. And in the Group C, distal segment. The values of blood glucose were tested at 2 min, 15 min, 45 min, 75 min and 120 min after injection of glucose. Results Five rats died during the operation, including 2 in the Group A, 2 in the Group B, and 1 in C. The survival rate of the operation was 79.2% (19/24). There were no significant differences on the values of FPG among the three groups [(12.97±3.12), (12.11±3.80) and (12.61±3.25) mmol/L,F=0.099,P=0.906]. In general, the values of blood glucose in all the groups were increased substantially after injection of glucose. At 2 min after injection, the values of blood glucose in the Group A [(15.57±3.14) mmol/L] and C [(14.21±2.74) mmol/L] were significantly higher than that in the Group B [(11.67±0.23) mmol/L,P=0.008 and 0.011], meanwhile no significant difference was found between the Group A and C (P=0.778). At 15 min after injection, there could be found significant differences among the three groups [A (21.23±3.16) mmol/L > C (16.95±0.29) mmol/L > B (14.06±3.00) mmol/L,P=0.006 and 0.049]. Furthermore, at 45 min after injection, there also could be found significant differences among the three groups [A (25.66±1.53) mmol/L > C (17.63±1.46) mmol/L > B (13.24±0.66) mmol/L,P=0.000 and 0.000]. However, at 75 and 120 min after injection, there were no significant differences among the three groups (P>0.05). Conclusions All segments of small intestine in GK rats showed bad effects on blood glucose control after injection of glucose. However, during short time intervals (2, 15, 45 min after injection), effect of middle segment of small intestine on blood glucose control was the best, effect of distal segment was moderate, and proximal segment the worst. Different segments of small intestine show different effects on blood glucose control in GK rats.
Goto-Kakizaki rats; Blood glucose; Small intestine; Type 2 diabetes mellitus; Operation
南京市医学科技发展基金项目(YKK10172)
A
1009-6604(2016)01-0068-04
10.3969/j.issn.1009-6604.2016.01.019
2015-04-22)
**通讯作者,E-mail:gsh1960@163.com
①(江苏省中医院普外科,南京 210019)

