血管生长调节因子与卵巢发育的关系
时小艳
(江苏食品药品职业技术学院 医药与健康管理学院,江苏淮安 223003)
血管生长调节因子与卵巢发育的关系
时小艳
(江苏食品药品职业技术学院 医药与健康管理学院,江苏淮安 223003)
旨在探讨血管内皮生长因子( VEGF-120)、促卵泡激素(FSH)、2-甲氧基雌二醇( 2-ME2)、4-羟基雌二醇(4-OHE2)对卵泡生成的影响。通过对比试验,将试验组分别腹腔注射上述 4 种药品,一段时间后,HE染色统计分析卵巢中不同大小卵泡数量的变化、卵泡周围血管发育情况及定量分析VEGF、FLK-1表达情况。结果表明,VEGF-120组和FSH组大卵泡数增加,血管发育良好,VEGF和FLK-1基因表达增加; 2-ME2 和4-OHE2组大卵泡数减少,血管发育情况较差。综合分析发现,血管簇发育良好的卵泡生长状态良好,卵泡的生长与血管的发育存在一定关联。
卵泡生长;血管发育;调节因子
卵泡的发育与血管是密切相关的,每个卵泡可以独立调节血管的生长。小卵泡周围没有血管。随着卵泡直径的增长,卵泡周围的血管分支逐渐增多,用来供给卵泡发育足够的养分。通过更高级的血管网提供优先养分对优势卵泡发育十分重要。血管内皮细胞减少能够导致卵泡颗粒细胞凋亡,进而导致卵泡闭锁。卵泡闭锁在卵泡发育的早期启动,并且贯穿于整个卵泡发育过程[1-2]。在排卵前,始基卵泡及原始卵泡主要依靠间质血管供血,血管网不存在。原始卵泡开始发育后,微血管出现在卵泡膜层,随着原始卵泡发育为窦前卵泡,进一步发育为窦状卵泡,微血管的密度也同步增加,对卵泡发育具有重要作用[3-4]。在卵泡发育过程中,血管生成持续进行,最终形成巨大的微血管网,但是都分布在卵泡膜层,并未突破基膜进入颗粒细胞层。在血管发育过程中,一些因子能调节血管的发育,本文通过小鼠腹腔注射VEGF-120、FSH、 2-ME2、 4-OHE2等因子,以期揭示卵泡的发育与血管生长的关系。
1 材料与方法
1.1 动物来源
2周龄雌性昆明白鼠(12~16 g)及 6 周龄雌性昆明白鼠(17~20 g)均购自南京市青龙山动物繁殖中心。饲养在温度24~26 ℃、光控14 h(光)/10 h(暗)的条件下,自由采食饮水。
1.2 主要试剂和仪器
血管内皮生长因子(VEGF-120)、促卵泡激素(FSH)、2-甲氧基雌二醇(2-ME2)、4-羟基雌二醇(4-OHE2)均购自美国Sigma公司,M-MLV反转录酶(美国Promega公司),TaqDNA聚合酶(TaKaRa公司),SYBR PremixTaqTM荧光定量酶、Trizol(Invitrogen公司),苏木素液、伊红染液等。主要器械为动物称量称、注射器、手术板、手术器械等,均产自中国。电泳仪,北京六一产品;定量PCR仪,美国ABI公司产品。
1.3 卵巢组织切片
将孕鼠用颈椎脱臼法致死,解剖取出卵巢,然后将整个卵巢组织样固定-脱水-透明-浸蜡-包埋-修整-切片。
1.4 卵泡计数
卵泡按显微镜下测量的尺寸大小分为大中小 3 类,其中大卵泡 50~150 μm,中卵泡150~250 μm,大卵泡>250 μm。卵泡计数以卵母细胞核作为标记物,连续 6 μm切片,每隔5 张切片计数。按照上述方法,计数每个卵巢中的各类卵泡。
1.5 发情鉴定
为避免小鼠排卵对卵泡数目的影响,对性成熟的小鼠(6周龄)统一进行发情周期的判定,与发情后期开始注射VEGF-120、FSH、 2-ME2、 4-OHE2等因子,并与发情前将卵巢固定,采用阴道涂片法进行发情鉴定。
阴道涂片法:每天7:00-8:00检查。以左手拇指和食指捏住小鼠尾巴,将小鼠放在铁丝盖上,当其前爪抓住铁丝网时,提起尾巴,抖掉毛上粘的锯末及赃物,如粪便等,再用其余3指轻压其后腰背部,翻起尾巴露出阴道口,然后右手持滴管吸少量生理盐水入阴道口,要尽量不让滴管触及阴道口,以免检查多次引发炎症。当稍放松尾部及腰部时,生理盐水即被吸人阴道,稍后3指轻压腰部,黏液随生理盐水流出,吸人滴管中,滴到载玻片上,稍干燥用甲醇固定5 min,然后用姬姆萨染液染色15 min,随即冲片、干燥、镜检,分别表示发情前期、发情中期、发情后期和发情间期阴道涂片细胞特点。发情前期圆形有核上皮细胞占优势,少量白细胞,有时混有少量无核的角化上皮细胞;发情中期几乎全为无核角化上皮细胞,细胞大而扁平,边缘不整齐;发情后期大量的角化上皮细胞,常聚集成堆,出现许多白细胞及有核上皮细胞;发情间期大量散在的白细胞,有时混有少量圆形有核上皮细胞(图1)。
1.6 注射处理
采用完全随机分组方法,将动物随机分为 5 组,每组5只。对照组、VEGF-120组、FSH组、 2-ME2组、 4-OH2组。对于小鼠需进行发情周期的判断,在小鼠发情后期开始腹腔注射药品,于情期前处死小鼠。其中FSH组每隔12 h注射1次,连续注射2 d。其他组每隔24 h注射1次,连续注射3 d。
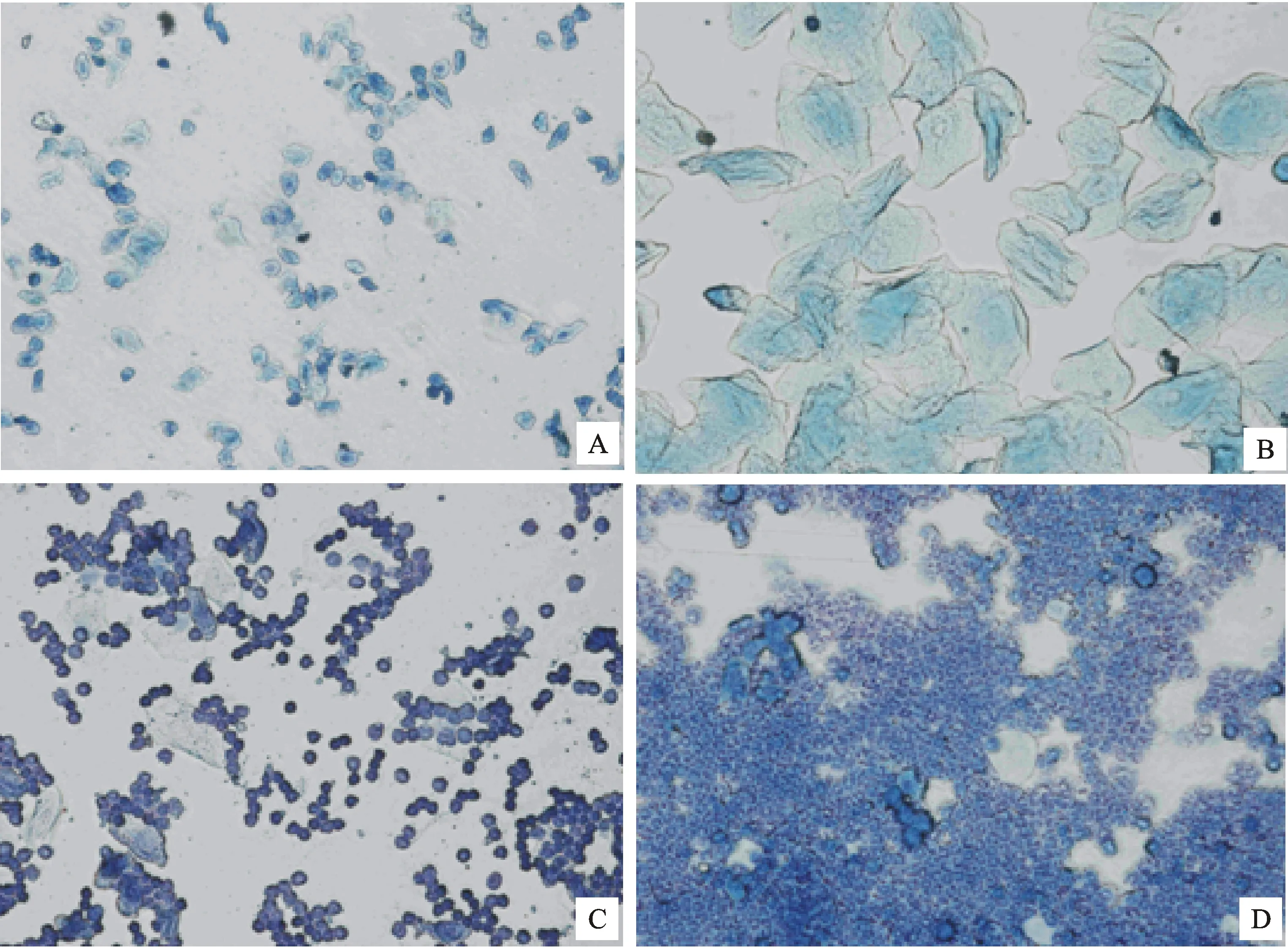
A.发情前期 Early stage of oestrus; B.发情中期 Middle of oestrus; C.发情后期 Llate oestrus; D.发情间期 Interphase of the oestrus
1.7 墨水注射法
为了能更好地观察红细胞分布情况,来分析血管的发育状况,试验采用墨水注射法分析血管的分布。将小鼠左侧静脉断开,从右侧静脉注射纳米碳素墨水,直至小鼠尾巴变为黑色时停止注射,以便墨水进入全身各处血管。随后取小鼠卵巢做切片,HE染色观察卵泡周围血管的分布情况。结果显示,切片中红细胞所在的位置与墨水进入的地方相吻合。统计卵泡周围红细胞的数目,并由此来确定血管的发育情况,红细胞数目越多表示血管发育越好。
1.8 引物设计和荧光实时定量PCR
参照GenBank中β-actin、VEGF、Flk-1mRNA基因序列,应用Oligo 6分子生物学软件,设计 3 对特异性引物(表1)。引物由英俊生物技术有限公司合成。实时定量PCR反应程序:95 ℃预变性1 min;46个循环:95 ℃ 10 s,59 ℃退火10 s,72 ℃ 15 s; 72 ℃延伸 5 min。

表1 实时定量PCR所用引物
1.9 数据分析
应用SPSS10.0统计学软件,选用One-Way ANOVA分析,数据用“平均数±标准差”表示。
2 结果与分析
2.1 各组处理对卵巢质量的影响
与对照相比,性成熟小鼠(图2)注射FSH和VEGF-120后小鼠卵巢质量显著增加(P<0.05), 2-ME2和4-OHE2对卵巢质量作用不明显;FSH注射组与VEGF-120注射组差异不显著; 2-ME2注射组与 4-OH2注射组差异不显著;FSH 注射组和VEGF-120注射组都与 2-ME2注射组和4-OH2注射组差异显著(P<0.05)。

不同小写字母表示不同处理间差异显著(P<0.05),下图同 Different lowercase letters represent significant difference under different treatments at P<0.05,The same as below.
2.1.1 卵巢中大卵泡(大于250 μm)的数量变化 由图3可知,注射FSH和VEGF-120对卵泡数目明显上升(P<0.05),而其他试验组不显著。FSH注射组与VEGF-120注射组差异不显著; 2-ME2注射组与4-OH2注射组差异不显著;FSH 注射组和VEGF-120注射组都与 2-ME2注射组和 4-OH2注射组差异显著(P<0.05);图4为大卵泡的HE染色切片图,箭头指示的是大卵泡所在的位置,可观察到卵泡已经有明显的卵泡腔。
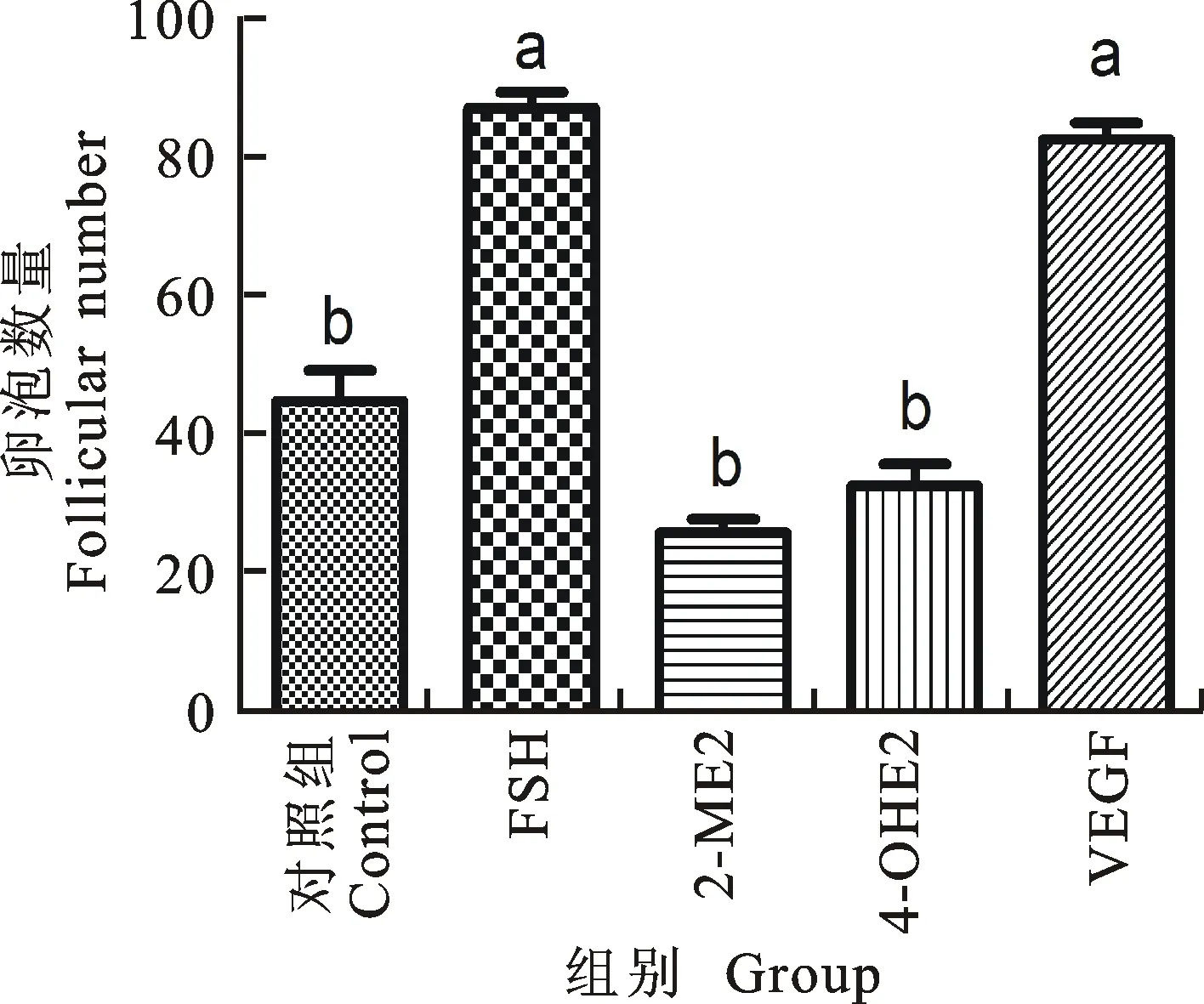
图3 不同处理小鼠的大卵泡数

图4 大卵泡HE切片
2.1.2 卵巢中中卵泡(150~250 μm)的数量变化 如图5所示,与对照组相比注射 2-ME2组中卵泡数目显著下降(P<0.05),VEGF-120组中卵泡数目显著上升(P<0.05);FSH组和VEGF-120组差异不显著; 2-ME2组与4-OH2组差异显著(P<0.05);图6为中卵泡HE切片染色图,箭头指示的是中卵泡所在的位置,可以看出中卵泡的卵泡腔还未发育完全,颗粒细胞层达到 6~8层。
2.1.3 卵巢中小卵泡(50~150 μm)的数量变化 如图7所示,与对照组相比注射VEGF-120组小卵泡数量下降,其他组不显著;FSH组和VEGF-120组差异显著(P<0.05); 2-ME2注射组与 4-OH2注射组差异不显著;FSH组与 2-ME2组和4-OH2组差异不显著,VEGF-120组显著低于 2-ME2组和4-OH2组(P<0.05);图8为小卵泡HE切片图,箭头指示的是小卵泡所在的位置,可以看出小卵泡的颗粒细胞层为2~3层。
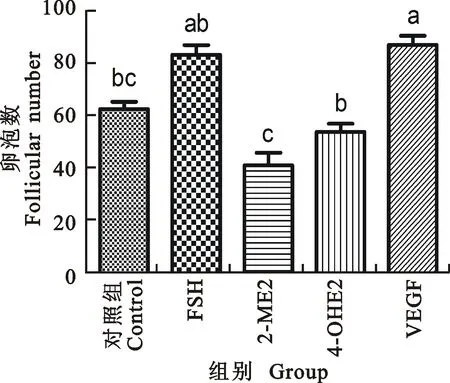
图5 不同处理小鼠的中卵泡数
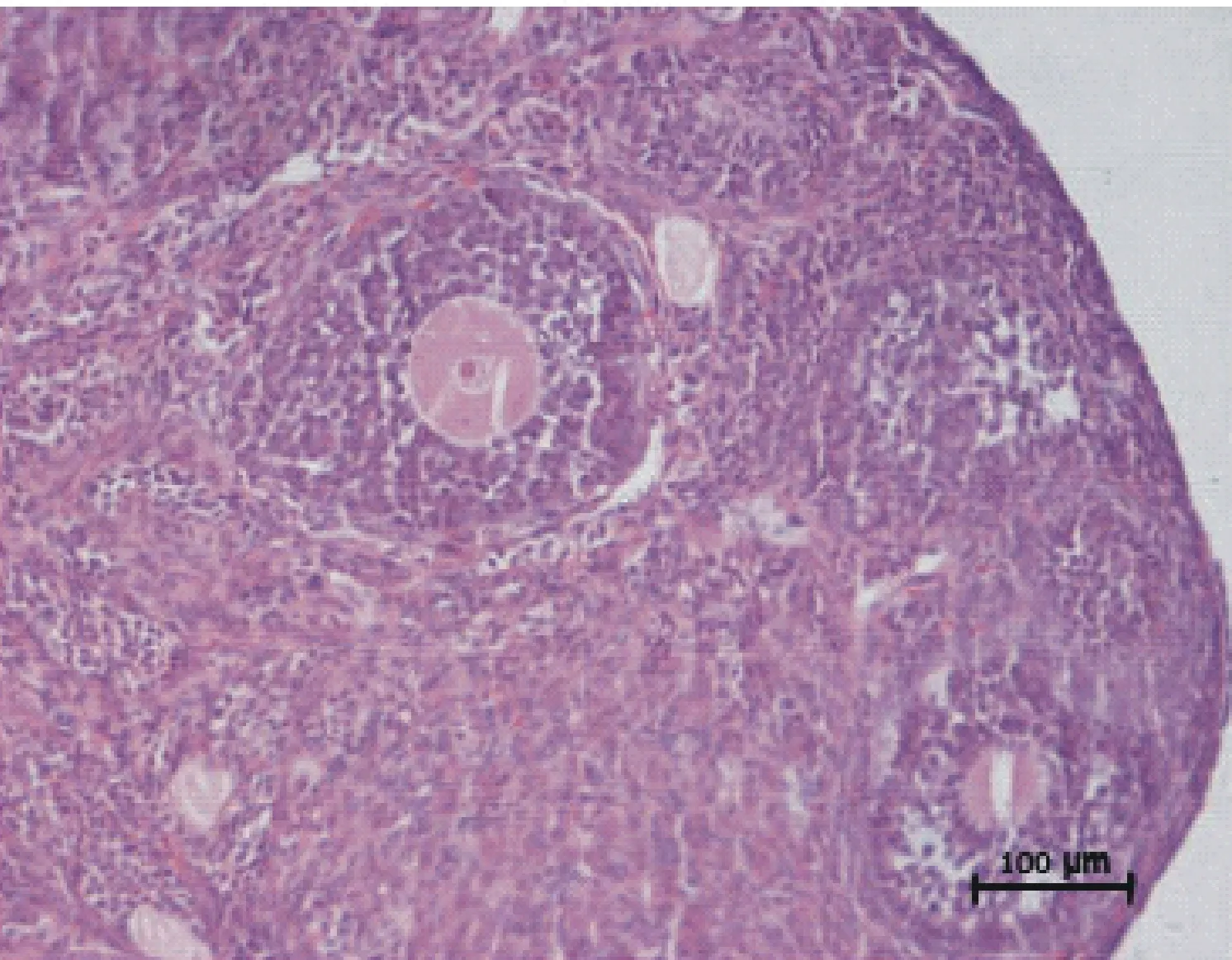
图6 中卵泡HE切片
2.2 不同处理对卵巢卵泡周围血管发育的影响
2.2.1 大卵泡(大于250 μm)周围红细胞数量 如图9所示, 6周龄小鼠注射FSH、VEGF-120后大卵泡周围的红细胞数相对于对照组显著上升(P<0.05),而注射 2-ME2、4-OH2后大卵泡周围的红细胞数相对于对照组显著下降(P<0.05);FSH注射组和VEGF-120注射组大卵泡周围红细胞差异不显著; 2-ME2注射组与4-OH2注射组大卵泡周围血管差异不显著;FSH注射组和VEGF-120注射组对于大卵泡周围血管相对于4-OH2和 2-ME2注射组显著上升(P<0.05)。

图7 不同处理小鼠的小卵泡数

图8 小卵泡HE切片

图9 不同处理小鼠的中卵泡血管
2.2.2 中卵泡(150~250 μm)周围红细胞数量 如图10所示,6周龄小鼠注射药品FSH和VEGF-120后中卵泡周围红细胞数目上升,注射药品 2-ME2后中卵泡周围红细胞数目明显下降,而其他试验组作用不明显。FSH注射组和VEGF-120注射组中卵泡周围红细胞差异不显著; 2-ME2注射组对于中卵泡周围血管相对于 4-OH2注射组显著下降;FSH注射组和VEGF-120注射组对于中卵泡周围血管相对于 2-ME2注射组显著上升(P<0.05),FSH注射组和VEGF-120注射组对于中卵泡周围血管相对于4-OH2注射组显著上升(P<0.05) 。
2.2.3 小卵泡(50~150 μm)周围红细胞数量 如图11所示,6周龄小鼠注射药品 2-ME2后小卵泡周围红细胞数目减少,其他试验组作用不明显。FSH注射组和VEGF-120注射组中卵泡周围红细胞差异不显著; 2-ME2注射组对于中卵泡周围血管相对于4-OH2注射组显著下降;FSH注射组和VEGF-120注射组对于中卵泡周围血管相对于 2-ME2注射组显著上升(P<0.05),FSH注射组和VEGF-120注射组对于中卵泡周围血管相对于4-OH2注射组差异不显著。
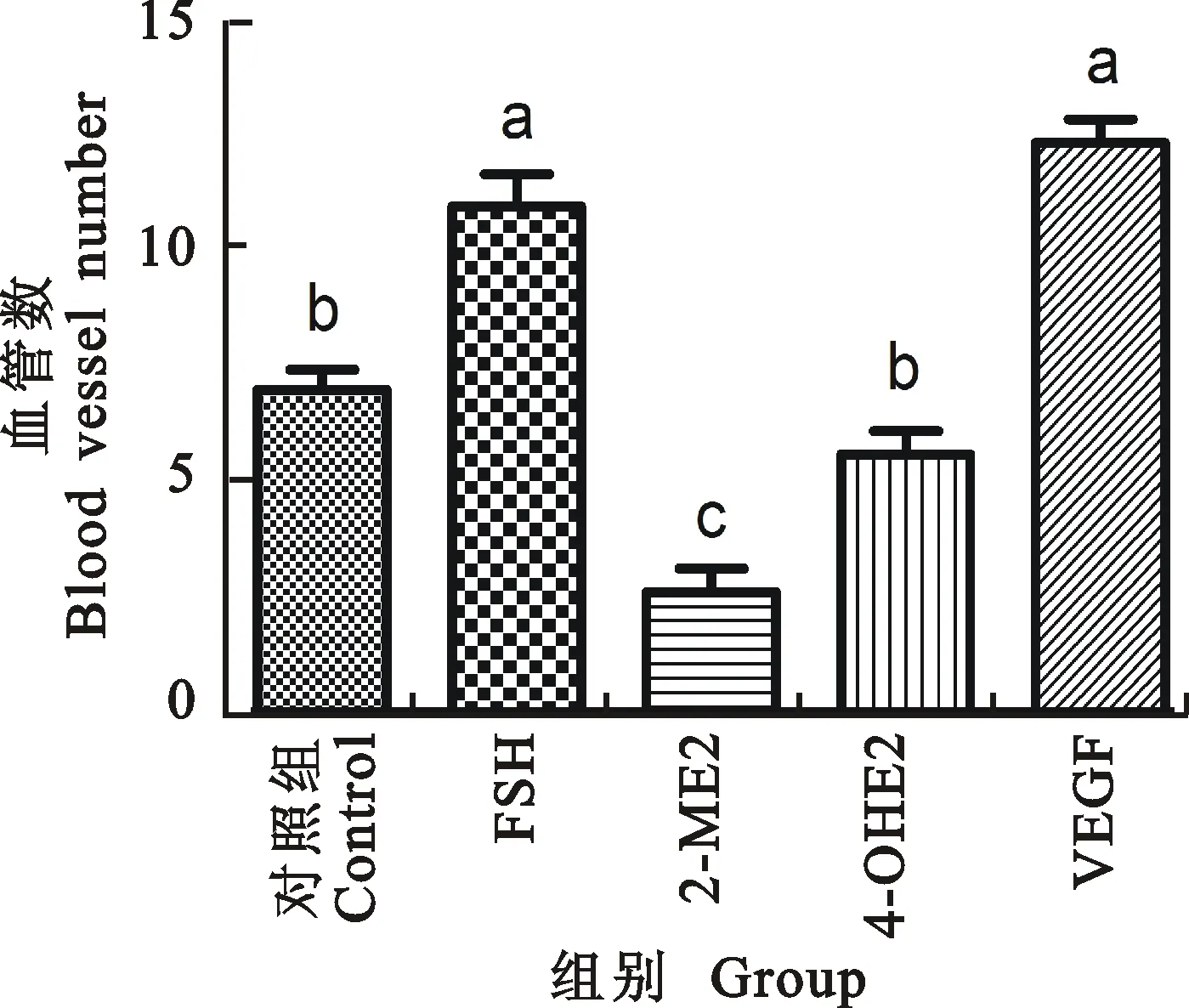
图10 不同处理小鼠的小卵泡血管

图11 VEGF和 FLK-1在颗粒细胞表达情况
2.3 卵巢颗粒细胞中相关基因表达量的变化
2.3.1VEGF和FLK-1在颗粒细胞中表达情况 如图12、图13所示,VEGF和FLK-1均在颗粒细胞中表达。

图12 电泳图
2.3.2VEGF表达量 如图13所示,注射VEGF-120后6周龄小鼠颗粒细胞中VEGF表达量明显上升(P<0.05),4-OH2组的表达量显著下降,其他试验组作用不明显;FSH注射组比VEGF-120注射组表达量显著下降; 2-ME2注射组和4-OH2注射组差异不显著;FSH注射组相对于 2-ME2注射组和4-OH2注射组显著上升,VEGF-120注射组相对于 2-ME2注射组和4-OH2注射组显著上升。
2.3.3FLK-1表达量 如图14所示,注射FSH和VEGF-120后六周龄小鼠颗粒细胞中FLK-1表达量明显上升(P<0.05),其他试验组作用不明显。FSH注射组和VEGF-120注射组表达量差异不显著; 2-ME2注射组和4-OH2注射组差异不显著;FSH注射组和VEGF-120注射组相对于 2-ME2注射组和4-OH2注射组显著上升。

图13 VEGF在不同处理小鼠颗粒细胞中的表达
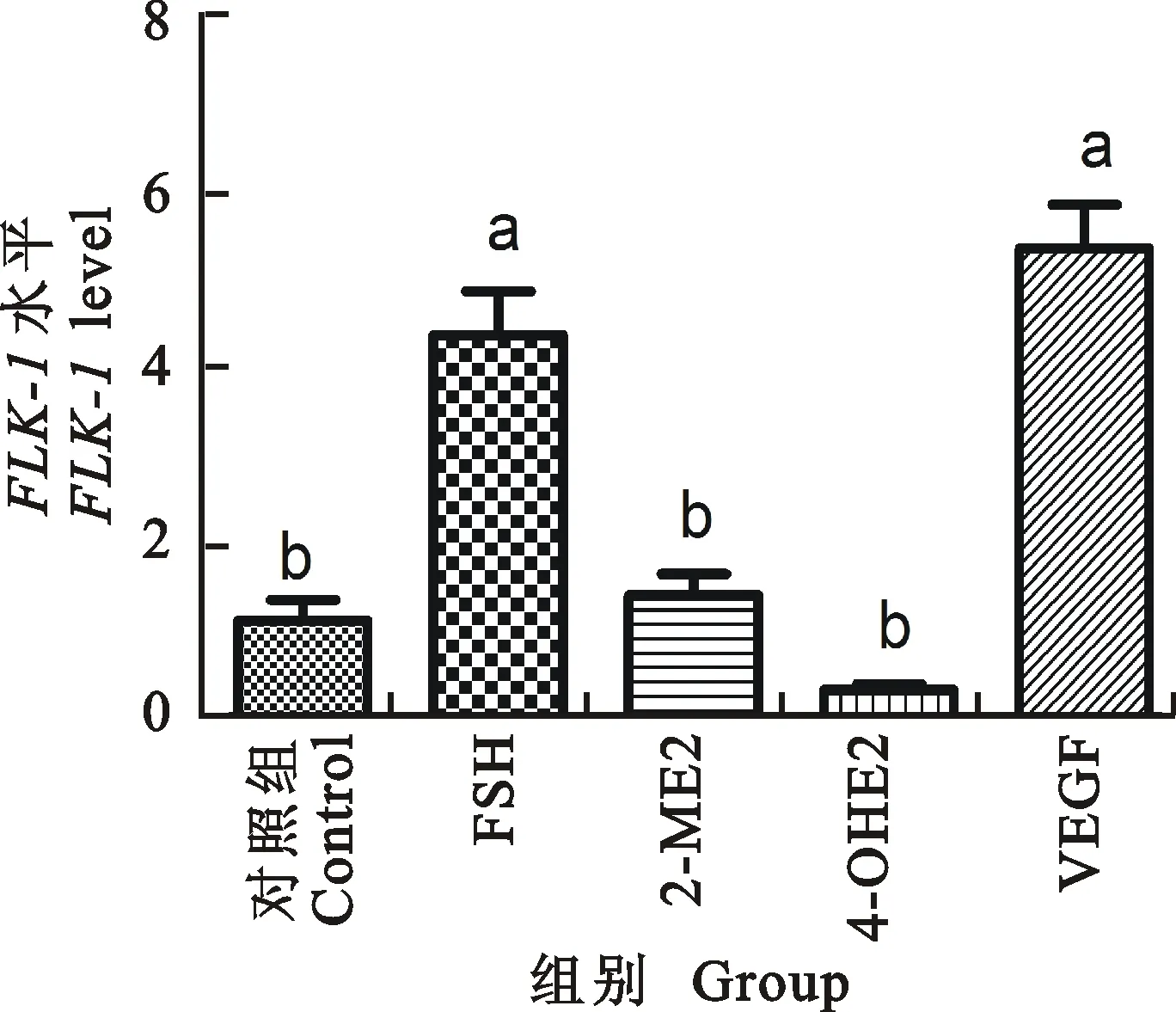
图14 FLK-1在不同处理小鼠颗粒细胞中的表达
Fig.14FLK-1level in granulocyte of different treatment
3 讨 论
本文主要探讨小鼠腹腔注射PBS、FSH、2-ME2、 4-OH2、VEGF-120等试剂后,对小鼠卵泡发育和血管生长的影响,来研究小鼠卵泡和血管发育是否存在一定的联系。
FSH 在雌性动物可促进子宫内膜生长、排卵、刺激多卵泡育等。在自然条件下,单胎动物只有一个卵泡发育成熟至排卵,即使多胎动物也只有部分卵泡发育成熟,其他卵泡在不同发育阶段先后退化,可见正常垂体分泌的FSH 只能保证1个或部分卵泡发育成熟。如果在发情前期给动物注射大量FSH,就能使将要退化的卵泡发育成熟,其排卵量可超过正常排卵数的若干倍[5]。在本试验中注射FSH组的大卵泡数高于其他组,并且血管数高于对照组,卵泡闭锁率却低于其他组。FSH可能通过其与受体间的相互作用增加IGF-1和类固醇水平,从而抑制颗粒细胞的凋亡。有些研究显示,对于发情周期的小鼠卵巢FSH受体在卵泡成熟过程中FSHR表达水平会增加,排卵后迅速下降,在闭锁卵泡及发生凋亡的颗粒细胞中,卵巢FSHR水平明显降低。对于FSH能促进血管发育,可能是FSH在促进卵泡发育的同时,能调节一些血管发育因子的表达,使得血管发育良好,从而为卵泡的发育奠定物质基础。
2-ME2在抗肿瘤的研究比较频繁,细胞凋亡的途径通常有2条:通过细胞外信号激活细胞内的凋亡蛋白酶;细胞应急反应或者凋亡信号首先引起线粒体细胞色素C的释放,其余一些凋亡蛋白因子形成凋亡酶复活物,激活Caspase-3,进而引发Caspase级联反应,活化Caspase可将细胞内的重要蛋白降解,导致细胞凋亡。2-ME主要通过细胞死亡受体途径和线粒体途径导致细胞凋亡。近几年2-ME2在抑制血管发育也有所被了解。2-ME2 可下调低氧诱导因子(HIF-1) 转录后水平蛋白表达, 从而抑制低氧诱导因子(HIF-1) 诱导的VEGF表达。血管内皮生长因子(VEGF)是公认的最重要的靶器官上的促血管增生因子。低氧诱导因子1 (HIF-1) 作为核心转录因子和低氧反应应答的共同路径,可能调控低氧时VEGF的转录表达[6-7]。 2-ME2促进细胞凋亡和抑制血管发育并不是独立的。其在抑制血管作用同时也会促进一些凋亡因子的活化。在本试验中注射2-ME2组的小鼠卵泡周围的血管发育比较差,并且卵泡的闭锁率也相对于其他几组较高,可能由于卵泡的发育需要血液运输来提供其养分, 2-ME2抑制血管的发育,使得卵泡周围血管减少,卵泡得不到充足的养分颗粒细胞发育受到了抑制随即发生了凋亡;从分子机制来讲可能是 2-ME2在阻断VEGF的激活的同时,一些通路也激活,比如AKT信号转导通路导致JNK活化,并间接阻断P53等。通过本试验的研究表明, 4-OH2能抑制血管的发育,但是相对于2-ME2来说,4-OH2抑制能力要弱一些,并且4-OH2也能促进卵泡的凋亡。
VEGF作为血管形成最关键的因子,其能促进血管内皮细胞增值,增加血管通透性来达到促进血管发育的作用[8-9]。FLK-1和FIT-1是VEGF的主要功能受体,它们仅存在于血管内皮细胞中。它们与VEGF结合后有明显的VEGF依赖性Ca2+外流,但是其激活后效果有所不同:FLK-1激活后可引起内皮细胞分裂,迁移;而FIT-1激活后无明显促有丝分裂作用,该受体作用可能与调节内皮细胞与基底膜作用有关。本试验中注射VEGF-120组的小鼠大中卵泡周围的血管发育比其他组要良好,其不仅可以增加自身的VEGF基因表达,还可以增加FLK-1血管生成的受体基因表达。由于小卵泡周围血管很少,这样的小卵泡对VEGF的敏感性可能比较低。由于注射VEGF-120组的大中卵泡血管发育良好,这样给以卵泡的营养物质是比较充足的,所以VEGF-120组的卵泡发育随之也是良好的。
有研究表明卵泡的血管发育对于排卵前的卵泡发育是起着十分重要的作用的,VEGF在卵泡血管形成的不同时期起着不同的作用[10-11]。通过本试验的研究卵泡和血管的发育肯定存在这相互促进或者相互抑制的作用。
综上所述,卵泡周围毛细血管新生对卵泡的生长发育过程有重要的影响,许多细胞因子通过促进血管新生来增强血管通透性,为卵泡的发育提供更多的氧气、激素和营养物质。现代研究发现越来越多的细胞因子参与血管新生的调控,但细胞因子间的相互作用机理还有待于进一步探索。随着对血管新生机制和细胞因子间信号传导研究的深入,以期对卵泡发育进行有效的调控,从而提高卵子质量。
Reference:
[1] SUZUKI T,SASANO H,TAKAYA R,etal.Cyclic changes of vasculature and vascular phenotypes in normal human ovaries[J].HumanReproduction,1998,13(4):953-959.[2] NAKAYAMA M,MANABE N,NISHIHARA S,etal.Species specific differen- ces in apoptotic cell localization in granulosa and theca interna cells during follicular atresia in porcine and bovine ovaries[J].JournalofReproductionandDevelopment,2000,46(1):147-156.
[3] FRASER HM,WULFF C.Angiogenesis in the corpus luteum[J].ReproductiveBiologyandEndocrinlogy,2013,1(8):88-92.
[4] NISHIMURA R,KUDA K.Hypoxia is important for establishing vascularization during corpus luteum formation in cattle[J].JournalofReproductionandDevelopment,2010,56(1):110-106.
[5] TAMMELA T,ENHOLM B,ALITALO K,etal.The biology of vascular endothelial growth factors [J].CardiovascularResearch,2005,65(3):550-563.
[6] ROY H,BHARDWAI S.Biology of vascular endothelial growth factors [J].FEBSLetters,2006,580(12):2879-2887.
[7] HE Y,KARPANEN T,ALITALO K,etal.Role of lymphangiogenic factors in tumor metastasis [J].BiochimBiophysActa,2004,1654(1):3-12.
[8] SHANG WR.2-Methoxyestradiol,an endogenous estradiol metabolite,differentially inhibits granulosa and endothelial cell mitosis:a potential follicular antiangiogenic regulator [J].BiologyofReproduction,2001,23(65):622-627.
[9] PARE BRUNET I ,GLUBB D,EVANS P,etal.Discovery and functional assessment of gene variants in the vascular endothelial growth factor pathway[J].HumanMutation,2013,11(4):224-236.
[10] TANI N,MINAMI S,YAMOTO M,etal.The vascular endothelia1 growth factor/fms like tyro sine kinase system in human ovary during the menstrual cycle and early pregnancy[J].JournalofClinicalEndocrinologyandMetabolism,2013,84(10):3845-3851.
[11] MOOBERRY.New insights into 2-Methoxyestradiol,a promising antiangiogenic and antitumor agent[J].CurrentOpinioninOncology,2003,15(6):425-430.
Received 2014-12-24 Returned 2015-06-18
Foundation item National Key Basic Research and Development Program (973 Program) (No.2007CB947403).
About author SHI Xiaoyan,female,master student,lecturer.Research area:animal genetic.E-mail:jumplianxin@163.com
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Relation of Vascular Endothelial Growth Factor and Ovarian Development
SHI Xiaoyan
(Department of Medicine and Health Management,Jiangsu Food Science College, Huai’an Jiangsu 223003,China)
To investigate effects of vascular endothelial growth factor (VEGF-120),follicle stimulating hormone (FSH), 2-methoxy estradiol ( 2-ME2), estradiol 4-hydroxy(4-OHE2) on folliculogenesis. By contrast test, these 4 kinds of drugs were injected intraperitoneally in the test group .After a period of time, HE staining was analyzed statistically in the number change of different sizes ovarian, expression changes of the vascular and quantitative development ofVEGF,FLK-1.The results showed that the number of large follicles in groupVEGFand group FSH increased, the expression ofVEGFandFLK-1genes increased, the number of large follicles in 2-ME2 and 4-OHE2 groups decreased, and the vascular development was poor. The conclusion was that follicular with good cluster grew well ,follicular growth had a certain correlation with the development of blood vessels.
Follicular growth; Vascular development; Regulation factor
2014-12-24
2015-06-18
国家重点基础研究发展计划(“973”计划)(2007CB947403)。
时小艳,女,讲师,硕士研究生,研究方向为动物遗传育种。E-mail:jumplianxin@163.com
日期:2016-12-12
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161212.1114.004.html
Q38
A
1004-1389(2016)12-1755-07

