单次和连续药饵投喂方式下复方磺胺嘧啶在吉富罗非鱼体内的代谢消除规律
王伟利,肖贺,2,姜兰*,罗理,张瑞泉,谭爱萍,邓玉婷
(1.中国水产科学研究院珠江水产研究所,农业部渔用药物创制重点实验室,广东省水产动物免疫技术重点实验室,广东 广州 510380;2.上海海洋大学水产与生命学院,上海,201306)
单次和连续药饵投喂方式下复方磺胺嘧啶在吉富罗非鱼体内的代谢消除规律
王伟利1,肖贺1,2,姜兰1*,罗理1,张瑞泉1,谭爱萍1,邓玉婷1
(1.中国水产科学研究院珠江水产研究所,农业部渔用药物创制重点实验室,广东省水产动物免疫技术重点实验室,广东 广州 510380;2.上海海洋大学水产与生命学院,上海,201306)
在120 mg/kg单次药饵投喂和首剂量投喂复方磺胺嘧啶(磺胺嘧啶∶甲氧苄啶=5∶1)120 mg/kg后,再按60 mg/kg的剂量连续5 d投喂条件下,采用HPLC法研究了复方磺胺嘧啶在吉富罗非鱼(Oreochromisniloticus)体内的代谢消除规律。结果显示,单次给药下磺胺嘧啶和甲氧苄啶在罗非鱼血浆、肌肉、肾脏和肝脏中的消除半衰期(t1/2ke)分别为16.82 和5.99,23.40 和13.49,13.43和6.53,15.9和11.02 h,甲氧苄啶在各组织中的消除均快于磺胺嘧啶。给药24 h内,药物在各组织中的比值(SD∶TMP)均在1~40∶1(除了肾脏4 h采样点为0.71)的理想抑菌浓度范围内,提示5∶1给药比例在罗非鱼上使用能够达到理想的体内抑菌效果。血浆较组织中具有更高的比值,这与甲氧苄啶在体内的快速分布特性一致。连续给药情况下,磺胺嘧啶的浓度较单次给药情况下显著提高,甲氧苄啶的浓度较单次给药并未显著提高,这可能与甲氧苄啶较快的代谢速率及体内快速分布有关。参考中华人民共和国农业部NY 5070—2002号公告中对水产品中磺胺类药物总量最大残留限量(MRL)为0.1 mg/kg,甲氧苄啶MRL为0.05 mg/kg的规定,单次给药和连续给药情况下,计算的休药期结果一致,建议本实验条件下的休药期不低于12 d。[中国渔业质量与标准,2016,6(1):29-35]
吉富罗非鱼;复方磺胺嘧啶;药物动力学;休药期
磺胺类药物(sulfonamides,SAs) 因其具有抗菌谱广、性质稳定、价格低廉等优点,在水产养殖中应用非常广泛,常用的主要有磺胺嘧啶(sulfadiazine,SD)、磺胺间甲氧嘧啶(sulfamonmethoxine,SMM)和磺胺甲噁唑(sulfamethoxazole,SMZ)等。磺胺类药物对水产动物的竖鳞病、赤皮病、弧菌病、烂鳃病等细菌性疾病均有较好的治疗效果[1]。常与抗菌增效剂甲氧苄啶(trimethoprim)合用,两者分别通过抑制细菌四氢叶酸合成的两个不同阶段来抑制细菌繁殖,联合使用能够降低最小抑菌浓度(MIC),减少耐药菌株的产生,同时扩大药物抗菌谱[2-3]。复方磺胺嘧啶(磺胺嘧啶+甲氧苄啶)和复方甲噁唑(磺胺甲噁唑+甲氧苄啶)为最常用的组方。兽医体外药敏实验表明,磺胺类药物∶甲氧苄啶在1~40∶1范围内具有较好的抗菌效果,而20∶1为最佳抗菌比例[4]。为了达到理想的治疗效果,兽医临床上常将磺胺类药物与甲氧苄啶以质量比5∶1的比例合用[5-6]。该比例同样被使用于水产动物,但未见文献资料描述其合理性。鉴于水生动物与恒温动物生理特性的巨大不同,该给药比例可能并非水生动物的最佳方式。
吉富罗非鱼 (Oreochromisniloticus)俗称非洲鲫鱼,被誉为未来动物性蛋白质的主要来源之一,是世界水产业重点培养的淡水养殖鱼类,也是中国重要的淡水养殖品种[7]。在高密度工厂化养殖过程中,罗非鱼经常受到各种细菌性疾病的侵害,磺胺类药物是常用的防控细菌病害的水产国标药物之一。药物的不合理使用,致使渔药残留问题成为目前中国水产品出口贸易中的重要障碍[8],药动学研究是指导科学合理用药的主要依据。磺胺类药物在水生动物体内的药动学研究报道较多,如磺胺嘧啶在欧洲鳗鲡[9]体内的药动学研究,磺胺二甲嘧啶(DVD)在大菱鲆[10]和银鲫[11]体内的药动学研究,磺胺甲噁唑(SMZ)在草鱼[12]和罗非鱼[13]体内的药动学研究,磺胺间甲氧嘧啶(SMM)在罗非鱼[14]体内的药动学研究等,但均为单一药物在水产动物体内的药代研究,复方磺胺药物的研究报道较少,涉及到药物体内合理比例的研究仅见肖贺等[15]对复方磺胺嘧啶在罗非鱼血浆中的比值进行了探讨。其研究通过对不同温度下血浆中药物比例的讨论,表明温度对于合理的给药间隔、药物在体内比值有重要影响,但其研究中并未涉及不同组织中的药物代谢情况;在生产实践中,复方药物各个组分在水产动物体内,尤其是病灶部位的比例和浓度对于疾病的治疗至关重要。本研究通过对复方药物的药物代谢规律及给药比例进行了探讨,研究结果对于优化给药方案、提高治疗效果、保障食品安全均具有重要意义。
1 材料与方法
1.1 材料
1.1.1 吉富罗非鱼
健康实验吉富罗非鱼200尾,购自珠江水产研究所水产养殖基地,平均体质量为(150±10)g,经对实验鱼进行抽检表明鱼体组织不含复方磺胺嘧啶组分。购入后使用不含任何药物的全价饲料在实验暂养鱼池(150 cm×400 cm)内饲喂15 d。
1.1.2 药品与试剂
磺胺嘧啶(sulfadiazine, SD)对照品,200 mg,含量100%,批号H036110;甲氧苄啶(trimethoprim, TMP)对照品,200 mg,含量100%,批号H0160704;均购自中国兽医药品监察所。SD原粉,纯度为98%,批号611205007,购自佛山市南海北沙制药有限公司;TMP原粉,纯度为98%,批号A-10111211006,购自寿光富康制药有限公司。乙腈和甲醇均为色谱纯,购自迪马公司;三乙胺、乙酸乙酯和磷酸均为分析纯,购自广州化学试剂厂。
1.1.3 仪器与设备
美国Waters 2695高效液相色谱仪,配备2998紫外检测器;美国Organomation Associate公司氮吹浓缩仪;梅特勒-托利多仪器(上海)有限公司分析天平;德国Sigma公司台式高速冷冻离心机;德国IKA公司MS3型振荡器和T18型均质机。
1.2 方法
1.2.1 实验鱼的驯养
实验鱼首先在实验水池内经15 d的暂养后,筛选分组至供氧充足的实验鱼缸内,采用加热棒逐步升至28 ℃。
1.2.2 药饵的制备
按5∶1(m/m)的比例称取适量磺胺嘧啶和甲氧苄啶原粉混匀,与适量吉富罗非鱼粉料搅拌均匀。添加适量的蒸馏水揉制成团,分别称重制备成磺胺嘧啶和甲氧苄啶含量为5%和1%的药饵颗粒。
1.2.3 实验设计
药动学实验:实验吉富罗非鱼按6尾/组,分为10组,给药前1 d停饲。按复方磺胺嘧啶剂量为120 mg/kg[16]单次药饵饲喂,给药过程中不再饲喂饲料;另取6尾饲以空白饲料作对照。分别于给药后0.5、1、2、4、6、8、10、24、48和72 h采集吉富罗非鱼血液、肌肉、肝脏和肾脏样品。空白对照组样品于72 h后采集。
药物残留实验:实验吉富罗非鱼按6尾/组,分为7组,给药前1 d停饲。按复方磺胺嘧啶剂量为120 mg/kg 首次药饵饲喂后,再按复方磺胺嘧啶剂量为60 mg/kg[16]连续饲喂5 d,给药过程中不再饲喂饲料;另取6尾吉富罗非鱼饲以空白饲料作对照;分别于给药后6 h,及1、2、3、5、7和9 d采集肌肉样品。空白对照组样品于9 d后采集。
血浆样品使用5 000 r/min离心5 min,吸取上层血浆置于新的离心管中。血浆及组织样品均置于-20℃冰箱中保存。
1.2.4 色谱条件
色谱柱为Thermo BDS Hypersil C18,150 mm×4.6 mm。检测波长:SD检测波长为266 nm,TMP检测波长为240 nm。流动相为乙腈:水(含0.15%三乙胺和0.15%磷酸)=13∶87(V/V)[17],流速为1 mL/min,进样量为20 μL,柱温为35 ℃。
1.2.5 样品处理方法
参考农业部958号公告-12-2007[18],优化后使用。
血浆样品:取1.0 mL血浆样品至10 mL离心管中,添加3 mL乙腈,振荡1 min,5 000 r/min离心5 min,取上清液,40 ℃水浴下氮气吹干。用1.0 mL流动相溶解,0.22 μm针孔滤膜过滤后上机检测。
肌肉、肝脏、肾脏组织的处理方法:称取2 g肌肉组织(1 g肝脏组织或0.5 g肾脏组织)置于50 mL离心管,添加20 mL乙酸乙酯萃取,均质1 min,5 000 r/min离心5 min,取上清液,下层残渣使用10 mL乙酸乙酯重复萃取一次,合并上清液于40 ℃水浴中氮气吹干。使用1.0 mL流动相溶解,10 mL正己烷除脂后,经0.22 μm针孔滤膜过滤后上机检测。
1.2.6 回收率的确定
准确取1.0 mL血浆或定量的组织样品(2.0 g肌肉、1.0 g肝脏或0.5 g肾脏),分别添加标样制得0.02、1.00、10.00 mg/L(或mg/kg)的加标样品,每个浓度做4个重复。按照1.2.5方法进行处理,测定方法的平均回收率及标准差。
1.2.7 线性关系与检测限(LOD)和定量限(LOQ)的确定
准确取1.0 mL血浆或组织样品(2.0 g肌肉、1.0 g肝脏或0.5 g肾脏),转移至50 mL离心管中,分别加入复方磺胺嘧啶标准液,制备0.005、0.020、0.050、0.100、0.200、0.500、1.000、2.000、5.000和10.000 mg/L(或mg/kg)的混标样品(n=4)。按照1.2.5方法处理,制备工作曲线。以3倍信噪比为检测限,以10倍信噪比为定量限。
1.2.8 数据处理
药物浓度-时间数据经Winnonlin 6.1软件(美国Pharsight公司)拟合;休药期采用WT1.4软件(德国,兽医产品委员会)计算。
2 结果与分析
2.1 线性范围、回收率、检测限及定量限
采用在鱼体各组织匀浆中加标制备复方磺胺嘧啶的标准曲线,外标法定量。结果表明,两种药物在0.05~10.00 mg/L(或mg/kg)的范围内线性关系良好,R2均大于0.99(见表1)。
表1 吉富罗非鱼各组织中磺胺嘧啶(SD)和甲氧苄啶(TMP)测定的线性范围、相关系数、平均回收率、检测限及定量限
Tab.1 The range of linearity, relevant coefficient, average recovery,LOD and LOQ of sulfadiazine and trimethoprim in GIFT

组织Tissue药物Drug线性范围/(mg·L-1或mg·kg-1)Rangeoflinearity相关系数(R2)Relevantcoeffi-cient平均回收率/%Averagerecov-ery检测限/(mg·L-1或mg·kg-1)LOD定量限/(mg·L-1或mg·kg-1)LOQ血浆磺胺嘧啶0.05~10.000.998785±1.520.0050.05肌肉磺胺嘧啶0.05~10.000.993881±2.130.010.05肝脏磺胺嘧啶0.05~10.000.998371±3.530.010.05肾脏磺胺嘧啶0.05~10.000.997583±2.670.010.05血浆甲氧苄啶0.10~10.000.999383±2.630.020.10肌肉甲氧苄啶0.10~10.000.994079±1.930.050.10肝脏甲氧苄啶0.10~10.000.998358±2.730.050.10肾脏甲氧苄啶0.10~10.000.998765±2.690.050.10
2.2 复方磺胺嘧啶在吉富罗非鱼体内的药-时曲线
按照120 mg/kg剂量单次药饵饲喂实验吉富罗非鱼后,发现磺胺嘧啶在其肝脏和肾脏组织中的药-时曲线有双峰现象,首次达峰时间要早于血液和肌肉组织;首次峰值之后药物浓度迅速下降,之后又形成第二个峰值。血液和肌肉组织的药-时曲线未见双峰。磺胺嘧啶在吉富罗非鱼各组织的药-时曲线见图1。甲氧苄啶在吉富罗非鱼肝脏和肾脏中的达峰时间同样早于血浆和肌肉组织,但未见双峰现象(图2)。
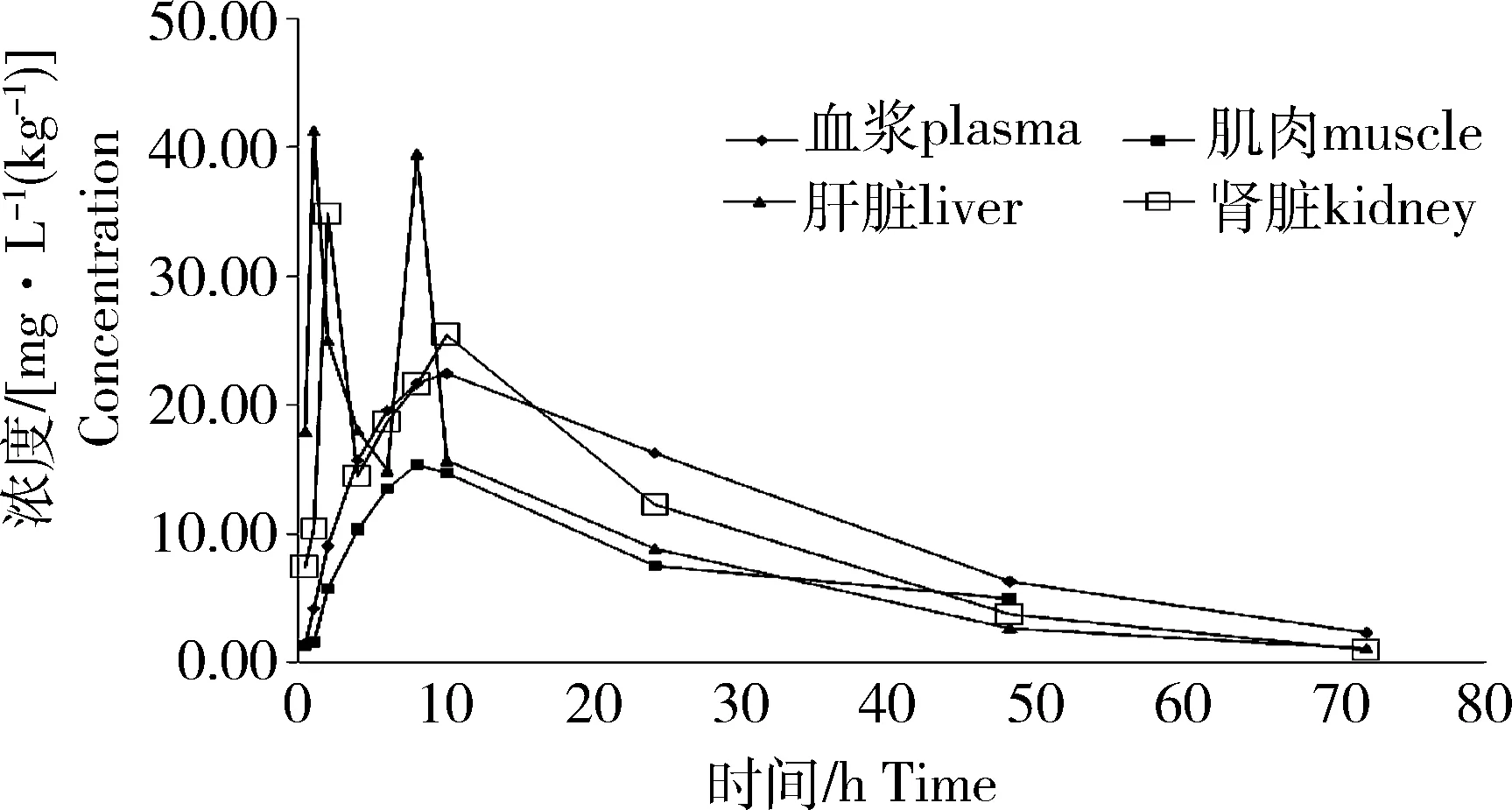
图1 单次饲喂后磺胺嘧啶(SD)在吉富罗非鱼体内的药-时曲线Fig.1 Concentration-time curve ofsulfadiazine in GIFT at single dose
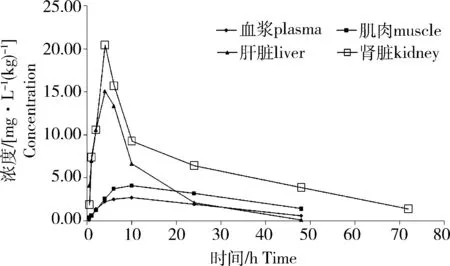
图2 单次饲喂后甲氧嘧啶(TMP)在吉富罗非鱼体内的药-时曲线Fig.2 Concentration-time curve oftrimethoprim in GIFT at single dose
2.3 复方磺胺嘧啶在吉富罗非鱼体内的药动学参数
在28 ℃下,磺胺嘧啶和甲氧苄啶在吉富罗非鱼体内的药动参数见表2。药动学参数显示,磺胺嘧啶在肝脏和肾脏中的第一次达峰时间分别为1和2 h,第二次达峰时间分别为8和10 h;血浆(tmax=10.0)和肌肉(tmax=6.0)达峰时间(tmax)与肝肾组织的第二次达峰时间大致相当;磺胺嘧啶在各组织中的达峰浓度(Cmax):肝脏>肾脏>血浆>肌肉,对应的吸收半衰期(t1/2ke)分别为:15.92、13.43、16.82和23.40 h,肌肉中药物消除最慢。甲氧苄啶在各组织中的Cmax:肝脏>肾脏>肌肉>血浆,肾脏中药物消除最快。甲氧苄啶在各组织中的消除(t1/2ke)均快于磺胺嘧啶。
2.4 吉富罗非鱼体内SD与TMP的含量比
28oC下单次给药后24 h内,除4 h所取的肾脏组织外,吉富罗非鱼各组织测得的SD与TMP含量的比值均在1~40的理想抑菌范围内[4]。血浆中比值随时间延长显著增大,其他组织(肌肉、肝脏和肾脏)24 h内的比值显著低于血浆中比值。
表2 28oC单次给药后磺胺嘧啶(SD)和甲氧苄啶(TMP)在吉富罗非鱼体内的药动学参数
Tab.2 Pharmacokinetics parameter of sulfadiazine and trimethoprim in GIFT following single oral administration at 28 ℃

参数Parameter单位Unit血浆Plasma肌肉Muscle肾脏Kidney肝脏LiverSDTMPSDTMPSDTMPSDTMP吸收半衰期t1/2kah3.052.111.230.67消除半衰期t1/2keh16.825.9923.4013.4913.436.5315.9211.02达峰时间tmax1h10.06.046.012.032.003.641.003.45达峰时间tmax2h10.008.00峰浓度Cmax1mg·L-1或mg·kg-122.432.4515.675.0434.9012.8541.3013.44峰浓度Cmax2mg·L-1或mg·kg-125.4639.70表观曲线下面积AUCmg·L-1·h851.6242.37585.38196.03713.69178.32593.8214.25清除率CL/FL·kg-1·h-10.120.390.020.090.090.160.060.23
注:Cmax为最大浓度;tmax为峰浓度时间;AUC为药物浓度时间曲线下面积;CL/F为总体清除率;t1/2ka为吸收半衰期;t1/2ke为消除半衰期。
表3 吉富罗非鱼不同组织中磺胺嘧啶(SD)与甲氧苄啶(TMP)含量的比值
Tab.3 Ratios of sulfadiazine vs trimethoprim in GIFT
时间/hTime血浆Blood肌肉Muscle肝脏Liver肾脏Kidney0.512.763.014.353.8616.922.355.881.3926.544.552.363.2046.933.951.190.7168.193.601.111.191010.353.592.352.742422.612.354.161.964835.603.4919.370.96
2.5 复方磺胺嘧啶在吉富罗非鱼肌肉中的残留消除
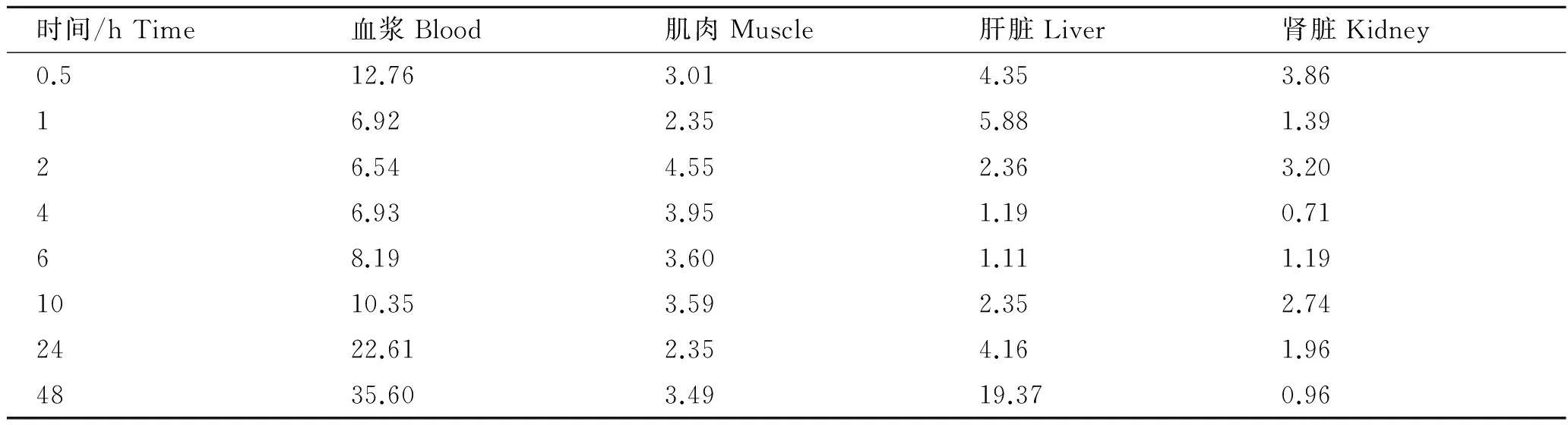
复方磺胺嘧啶在吉富罗非鱼肌肉的消除曲线见图3。连续给药情况下SD的含量较单次给药显著提高,而连续给药情况下TMP浓度较单次给药上升不明显,肌肉中SD和TMP消除趋势一致,分别于给药后 168和 72 h后,低于方法检测限。参考中国农业部NY 5070—2002号公告[19]对磺胺类药物在水产品中的最大残留限量(MRL)为0.1 mg/kg,TMP的MRL为0.05 mg/kg的规定,使用软件 WT 1.4计算复方磺胺嘧啶在吉富罗非鱼肌肉组织中的休药期,连续给药与单次给药情况下一致,均不低于12 d。

图3 复方磺胺嘧啶在吉富罗非鱼肌肉的消除曲线Fig.3 Elimination curve of sulfadiazine andtrimethoprim in muscle of GIFT
3 讨论
3.1 复方磺胺嘧啶的吸收特点
本研究中血浆、肝脏和肾脏中的药物浓度与肌肉中的药物浓度相比始终保持较高水平。这与林丽聪等[9]报道的磺胺嘧啶在欧洲鳗鲡(Anguillaanguilla)体内的药动学结果和艾晓辉等[11]报道的磺胺二甲嘧啶在银鲫(Carassiusauratusgibelio)体内的药动学结果均是一致的。肌肉组织中SD的含量较低,这可能与SD在肌肉组织中的乙酰化程度较高有关[20]。连续给药情况下,肌肉中SD的含量显著提高,TMP的含量较单次给药并未明显提高,这可能与TMP在动物体内的快速分布有关[21-22]。SD在吉富罗非鱼肝脏和肾脏组织中发现双峰现象,推测SD在吉富罗非鱼肝脏中存在“首过效应”。这种现象同样出现于SD在虹鳟鱼(Oncorhynchusmykiss)[23]和欧洲鳗鲡[9]体内代谢规律中;另外,磺胺间甲氧嘧啶在罗非鱼体内的药动学研究[14]及磺胺二甲嘧啶在银鲫体内的药动学研究[11]中也均有发现。但同样为磺胺二甲嘧啶,张长坤等[10]在大菱鲆(Scophthalmusmaximus)体内则未发现双峰现象。肠肝循环和多部位吸收被认为是产生多峰现象最可能的机制。周怀梧[24]认为,摄入的药量与双峰现象有显著相关性。至于仅有部分药物,在部分组织中有双峰现象,分析首先是药物本身的特点,其次可能与实验动物的种属特点有关。药动学中的多峰现象,对于药物的作用强度及消除过程有着显著的影响,加强对其的研究,可以对生产用药提出更合理的建议。
3.2 复方磺胺嘧啶吸收与消除的种属差异
本研究中,在28 ℃下,SD/TMP在吉富罗非鱼的tmax为10.0/6.04 h,t1/2ke为16.82/5.99 h。而韩冰等[25-26]发现20 ℃下,SMZ/TMP在鲫鱼血浆的tmax为5.4/2.6 h,t1/2ke为26.9/27.3 h,同样条件下,SMZ/TPM在松浦镜锂血浆的tmax为2/2.24 h,t1/2ke为50.97/8.35 h;艾晓辉等[12]发现,28 ℃时SMZ在草鱼血浆的tmax为2.06 h,t1/2ke为31.94 h;林丽聪等[9]发现,25 ℃时SD在欧洲鳗鲡血浆中的tmax为21.5 h,t1/2ke为100.51 h。这说明同类药物或相同药物在不同鱼体间药动学参数存在较大的差异。由于实验鱼的品种和大小、温度等均有差异,难以确定哪些是最主要的决定因素[27],但相关参数均大于陆生动物体内的研究结果。复方磺胺在陆生动物体内的吸收和消除远快于水生动物。如VAN等[28]发现,在口服给药后,TMP/SD在马体内(血液)的tmax为3.17/1.83 h,t1/2ke为4.43/12.38 h;BAERT等[5,29]研究发现,TMP/SD在猪和火鸡体内的tmax分别为1.80/2.19 h和1.42/1.64 h,t1/2ke分别为2.73/2.63 h和2.23/3.71 h;Abu-basha等[17]研究发现,TMP/SD在鸵鸟体内的tmax为3.27/2.47 h,t1/2ke为3.83/10.96 h。复方磺胺在水生动物体内较恒温动物体内达峰时间晚,而消除较慢,这可能与水生动物的基础代谢远低于恒温动物有关。该差异体现了水产动物与畜禽的显著不同,因此需要更多的研究来指导水产用药,而不能简单的借鉴畜禽用药。
3.3 不同动物SD/TMP的比值差异
复方药物不同组份之间的比值,对于疗效有重要影响。研究认为,SD与TMP的质量浓度比值在1~40∶1范围内具有较好的抗菌效果,20∶1 为最佳的抗菌比例[4]。本研究中,SD和TMP的消除半衰期(t1/2ke)分别为血浆16.82/5.99 h,肌肉23.40/13.49 h,肝脏15.92/11.02 h和肾脏13.43/6.53 h,SD的消除半衰期均长于TMP的消除半衰期,因此,随着时间的推移,SD/TMP的比值逐渐升高;这与Abu-Basha 等[17]在鸵鸟和Baert等[5]在火鸡体内的研究结果变化趋势一致,但后两者的比值明显偏大,分别为>45∶1和60~85∶1,本研究中,SD与TMP的含量比值在1~40∶1的理想抑菌范围内,但未能维持20∶1最佳的抗菌比例。这说明对于不同种属动物,复方药物的应用比例可能需要调整,而将SD与TMP以5∶1(m/m)比例混合投喂吉富罗非鱼,是可行的。
3.4 药物的残留消除
近年来,日本、欧盟、美国等主要进口国对水产品质量安全要求越来越严格。磺胺类药物由于残留时间长,而在生产应用中受到一定的限制。参考中国农业部NY 5070—2002号公告对水产品中磺胺类药物的 MRL 0.1 mg/kg,甲氧苄啶的 MRL 0.05 mg/kg的规定,模拟生产实践中连续用药情况,在本研究条件下,复方磺胺嘧啶在吉富罗非鱼可食性组织肌肉中的休药期应不低于12 d。考虑到药物在体内的消除受诸多因素的影响,如养殖环境、健康状况、饲料、水温等,在不同条件下休药期应该相应调整。
[1] Bogialli S, Curini R, Corcia A D,et al.Confirmatory analysis of sulfonamide antibacterials in bovine liver and kidney: extraction with hot water and liquid chromatography coupled to a single- or triple-quadrupole mass spectrometer[J].Rapid Commun Mass Sp,2003,17(11):1146-1156.
[2] 陈杖榴.兽医药理学 [M]. 第三版. 北京:中国农业出版社,2009:266-270.
[3] 杨先乐.鱼类药理学[M].中国农业出版社,2011:142-149.
[4] Prescott J F, Baggott J D, Walker R D. Antimicrobial therapy in veterinary medicine, sulfonomides, diaminopyrimidines and their combinations [M].3rd. Ames,Iowa:Iowa State University Press, 2000:290-314.
[5] Baert K, DeBeare S, Croubles S,et al.Pharmacokinetics and oral bioavailability of sulfadiazine and trimethoprim in broiler chickens[J].Vet Res Commun, 2003,27(4):301-309.
[6] Batzias G, Delis G, Koutsoviti-papadopoulou M. Bioavailability and pharmacokinetics of sulfadiazine, N4-acetyl sulfadiazine and trimethoprim following intravenous and intramuscular administration of a sulfadiazine/trimethoprim combination in sheep[J]. Vet Res Commun,2005,29(8):699-712.
[7] 蒋德阳,田淑琴,黄雅杰,等.动物性药物残留对人体的危害及控制措施[J].四川畜牧兽医,2003,30(152):31-32.
[8] 贺艳辉,张红艳,龚赟翀,等. 我国罗非鱼养殖品种及养殖发展分析[J].水产养殖,2009(2):12-13.
[9] 林丽聪,樊海平,廖碧钗,等.磺胺嘧啶在欧洲鳗鲡体内的药代动力学研究[J].检验检疫学刊,2010,20(4):14-17.
[10] 张长坤,王茂剑,宫向红,等.磺胺二甲嘧啶在大菱鲆体内的药代动力学研究[J].海洋湖沼通报, 2010(2):86-90.
[11] 艾晓辉,陈正旺.磺胺二甲嘧啶在银鲫体内的药动学及组织残留研究[J].淡水渔业, 2001,31(6):52-54.
[12] 艾晓辉,刘长征,周运涛.不同水温和给药方式下磺胺甲噁唑在草鱼体内的药动学研究[J].水生生物学报,2005,29(2):210-214.
[13] 袁科平,艾晓辉. 磺胺甲噁唑在罗非鱼体内的药代动力学及组织浓度研究[J]. 水利渔业,2008,03:25-27.
[14] 鞠晶,王伟利,姜兰,等.磺胺间甲氧嘧啶在罗非鱼体内的药物代谢动力学及休药期[J].华中农业大学学报,2015,34(1):103-107.
[15] 肖贺,王伟利,姜兰,等.不同温度下复方磺胺嘧啶在罗非鱼体内的血药浓度比较[J].华南农业大学学报,2014,35(6):13-18.
[16] 黄志斌.新编水产药物/器械应用表解手册[M].江苏:科学技术出版社, 2011:15-16.
[17] Abu-basha E A, Gehring R, Hantash T M,et al.Pharmacokinetics and bioavailability of sulfadiazine and trimethoprim following intravenous, intramuscular and oral administration in ostriches (Struthiocamelus)[J].J Vet Pharmacol Ther, 2009,32(3):258-263.
[18] 中华人民共和国农业部. 农业部958号公告-12-2007水产品中磺胺类药物残留量的测定-液相色谱法[S].北京:中国农业出版社, 2007.
[19] 中华人民共和国农业部. NY5070—2002无公害食品 水产品中渔药残留限量[S].北京:中国农业出版社,2002.
[20] Samuelsen O B,Lunestad B T, Jelment A. Phamracokinetic and efficacy study on bath-administering sulphonamides in Atlantic halibut,Hippogloshippoglossus[J]. J Fish Dis,1997,20(4):287-296.
[21] 操继跃,卢笑丛.兽医药物动力学[M].北京:中国农业出版社, 2005:137.
[22] Garwacki S, Lewicki J, Wiechete kM,et al. A study of the pharmacokinetics and tissue residues of an oral trimethoprim/sulfadiazine formulation in healthy pigs[J].J Vet Pharmacol Ther,1996,19(6),423-430.
[23] 田中二良.水产药详解[M]. 刘世英,雍文岳,译.北京:农业出版社,1982:58-87.
[24] 周怀梧.药物吸收多峰现象的动力学研究[J].现代应用药学,1989,6(2):37-40.
[25] 韩冰,杨洪波,王荻,等.复方磺胺甲噁唑在鲫鱼体内的药代动力学研究[J].西北农林科技大学学报(自然科学版),2015,43(3):13-19.
[26] 韩冰,杨洪波,王荻,等.复方磺胺甲噁唑在松浦镜鲤体内的药动学孔残留消除规律[J].大连海洋大学学报,2014,29(6):618-623.
[27] Rigos G, Alexis M,Andriopoulou A,et al. Pharmacokinetics and tissue distribution of oxytetracycline in sea bass,Dicentrarchuslabrax,at two water temperatures[J].Aquaculture, 2002,210:59-67.
[28] Duijkeren E Van,Ensink J M, Meijer L A. Distribution of orally adminstered trimethoprim and sulfadiazine into noninfected subcutaneous tissue chambers in adult ponies[J].J Vet Pharmacol Ther,2002,25:273-277.
[29] Baert K, Baere S De, CroubelsS,etal.Pharmacokinetics and bioavailability of sulfadiazine and trimethoprim (trimazin 30%) after oral administration in non-fasted young pigs[J]. J Vet Pharmacol Ther, 2001,24(4):295-298.
Pharmacokinetic and residues of compound sulfadiazine in GIFT(Oreochromis niloticus) at single and multiple dosage
WANG Weili1, XIAO He1,2, JIANG Lan1*, LUO Li1, ZHANG Ruiquan1,TAN Aiping1, DENG Yuting1
(1.Key Laboratory of Fishery Drug Development, Ministry of Agriculture; Guangdong Key Laboratory of Aquatic AnimalImmune Techniques; Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangdong 510380,China;2.College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China)
HPLC method was used to study the pharmacokinetics and tissue residual of compound sulfadiazine (sulfadiazine∶ trimethoprim =5∶1) in GIFT after a single dose of 120 mg/kg body weight or an initial dose of 120 mg/kg body weight following a 5 d consecutive dose of 60 mg/kg body weight. Result showed: The elimination half-life (t1/2 ke) in plasma, muscle, kidney and liver were 16.82 and 5.99, 23.40 and 13.49, 13.43 and 6.53, 15.9 and 11.02 h for sulfadiazine and trimethoprim at single-dose, respectively. Trimethoprim was more quickly eliminated than sulfadiazine in all the tissues. The ratio of SD∶TMP were between the optimal ratio of 1~40∶1 within 24 h in each group (expect 0.71 at 4 h in kidney), which indicated the rationality dosage of compound sulfadiazine in GIFT. The ratio was higher in plasma than in tissues, which was consistent with the rapid distribution characteristics of TMP. The concentration of sulfadiazine in multiple dosage had improved significantly than that in single-dose, while the concentration did not increase significantly for TMP. This may be related to the faster metabolism and rapid distribution of TMP. According to the MRL of 0.1 mg/kg for sulfonamides and 0.05 mg/kg for trimethoprim in fishes in the NY 5070—2002 Announcement issued by the Ministry of Agriculture of the People’s Republic of China, the withdrawal time should not be less than 12 d under this experiment condition. [Chinese Fishery Quality and Standards, 2016, 6(1):29-35]Key words:GIFT Nile Tilapia (Oreochromisniloticus); compound sulfadiazine; pharmacokinetics; withdrawal periodCorresponding author:JIANG Lan, fanjianglan@hotmail.com
2015-06-18;接收日期:2015-10-12
公益性行业(农业)科研专项(201203085);广东省鱼病防治专项资金(2012年)
王伟利(1978-),男,硕士,助理研究员,研究方向为药物动力学,yihui-w@163.com 通信作者:姜兰,研究员,研究方向为水产病害防治,fanjianglan@hotmail.com
S948
A
2095-1833(2016)01-0029-07

