不同盐浓度对杨树组培苗抗氧化酶活力的影响
周思言
(响水县农业干部学校,江苏 盐城 224600)
不同盐浓度对杨树组培苗抗氧化酶活力的影响
周思言
(响水县农业干部学校,江苏 盐城 224600)
以NL-895杨组培苗为材料,研究不同浓度的盐胁迫对其几种抗氧化酶活性的影响。结果表明,在50 mmol/L NaCl处理下其具有较高的耐盐性,能够正常生长。在100 mmol/L NaCl处理下受到一定的氧化胁迫,根对盐胁迫比叶更敏感些;在100 mmol/L NaCl盐胁迫10 d时,根中AsA-POD活性、GR活性和叶中CAT活性含量与对照相比,分别上升了82.62%、36.36%、58.05%;盐胁迫20 d时,两种盐浓度处理下的根中CAT活性变化幅度均大于叶。
杨树组培苗;盐胁迫;氧化胁迫;抗氧化酶;耐盐性
杨树(Populus spp.)是重要的造林绿化树种,也是园林绿化、“四旁”绿化、用材和农田防护林的常用树种,具有树干高大通直、生长快、栽培管理简便等特点[1-3]。
江苏省海岸线漫长,海岸带广阔,盐碱地面积大。海堤防护林的建设对树种抗逆性特别是耐盐性的要求较高。盐碱环境胁迫下,植物体由于细胞内活性氧(ROS)的产生增多,引发了活性氧的代谢紊乱,对细胞造成一系列的毒害[4]。植物在长期的适应过程中,为了响应和防御氧化胁迫,形成了一套精细而又复杂的抗氧化系统,其中包括抗氧化酶类和抗氧化剂类。抗氧化酶类包括对ROS起直接作用的过氧化氢酶(CAT)、抗坏血酸过氧化物酶(AsA-POD)、超氧化物歧化酶(SOD)等,还包括维持抗氧化物质还原性所必须的酶类如谷胱甘肽还原酶(GR)等[5]。本文研究了NL-895杨树组培时不同浓度盐胁迫对几种抗氧化酶活性的影响,探讨盐分对苗木危害机理,为杨树新品种的开发利用及扩大种植范围提供技术参考。
1 材料与方法
1.1 材料
试验采用美洲黑杨杂种优良无性系NL-895杨树的组培苗。
1.2 方法
1.2.1 杨树组培苗的培养
先将杨树茎端剪成1 cm左右,然后将其培养在MS+0.2 mg/L 6-BA+0.02 mg/L NAA+0.02 mg/L TDZ +3%蔗糖+0.65%琼脂的分化培养基上,约5~6 d开始于基部长出丛芽;30~40 d后丛芽长至2 cm时,将各个芽苗培养在1/2MS+3%蔗糖+0.65%琼脂的生根培养基上,约5~6 d即可生根,30 d能长至5 cm左右,根系发达;再进行一次继代,继代培养基同生根培养基,约5~6 d均生出须根,继续培养至60 d。
1.2.2 NaCl处理
基本培养基均采用1/2 MS培养基,不加琼脂,液体培养。设置0(CK)、50、100、150、200 mmol/L5个NaCl浓度梯度。NaCl在高压灭菌前加入,选择生长一致的再生芽接种到培养基中,每瓶放1株,每处理10瓶。以上培养条件为高压锅灭菌121℃、20 min,pH为5.8,温度为25℃,湿度为50%~70%,光照为2 000 lux。试验均重复3次,以3次试验所得数据计算平均值和标准误差,采用SPSS18.0软件进行方差分析。
1.2.3 取样
因为150、200 mmol/L NaCl处理的杨树幼苗在5~6 d就开始出现萎蔫症状,最终死亡。因此试验称取待盐处理后10 d和20 d对照、50 mmol/L、100 mmol/L的NaCl处理后的根、叶备用。
1.2.4 测定项目及方法
过氧化氢酶(CAT)活性的测定采用紫外吸收法[6]。抗坏血酸过氧化物酶(AsA-POD)活性的测定采用AsA氧化法[7]。谷胱甘肽还原酶(GR)活性的测定根据李忠光等的方法[8]。
2 结果与分析
2.1 NaCl胁迫对过氧化氢酶(CAT)活性的影响
由图1可知,盐胁迫10 d时,根中CAT活性变化幅度不大;盐胁迫20 d时,根中CAT活性显著上升,且50 mmol/LNaCl胁迫下的根中CAT活性高于100 mmol/LNaCl胁迫的。方差分析表明,在P<0.01下,盐胁迫与对照相比,20 d时,根中CAT活性的差异达到极显著水平。表明短时间内,盐胁迫对杨树根没有显著的影响;随时间的延长,盐胁迫能显著促进杨树根中CAT活性的上升,但是盐浓度增加,促进作用下降。
由图1可知,在盐胁迫10 d时,50 mmol/L NaCl胁迫下的杨树叶中CAT活性比对照下降了41.47%,到20 d时却比对照上升了52.26%;而100 mmol/L NaCl胁迫下的杨树叶中CAT活性在10 d时比对照上升了58.05%,到20 d时却比对照下降了17.10%。虽然50 mmol/LNaCl短时间内能抑制杨树叶中的CAT活性,但随时间的延长却能促进叶中CAT活性的上升;而100 mmol/LNaCl短时间内促进杨树叶中CAT活性上升,随时间的延长,却抑制CAT的活性。
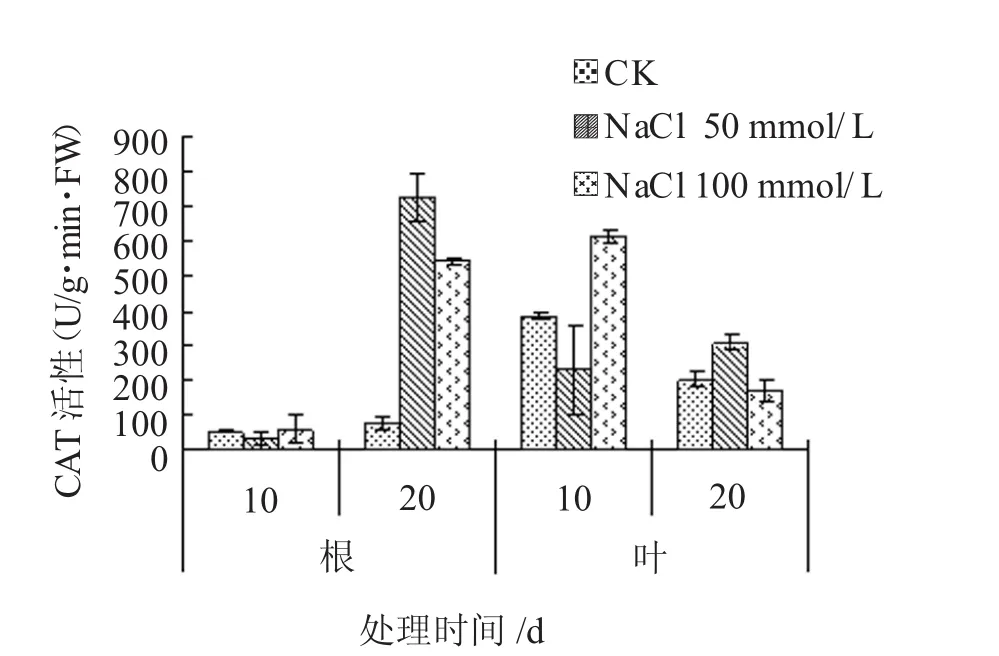
图1 NaCl胁迫对CAT活性的影响
综上所述,50 mmol/L NaCl在10 d内抑制杨树CAT活性,随时间的延长,却促进杨树CAT活性的上升;而100 mmol/L NaCl在10 d内能促进杨树根和叶中CAT活性的上升,随时间的延长,根中促进作用增强,却抑制叶中CAT活性。
2.2 NaCl胁迫对抗坏血酸过氧化物酶(AsA-POD)活性的影响
由图2可见,盐胁迫初期(10 d),50 mmol/L NaCl胁迫下的杨树根中AsA-POD活性比对照上升了43.85%,而100 mmol/L NaCl胁迫的却比对照上升了82.62%。方差分析表明,在P<0.01下,盐胁迫与对照相比,10 d时根中AsA-POD活性的差异达到极显著水平;盐胁迫末期(20 d),盐胁迫下根中AsA-POD活性与对照相比上升幅度不大。因此,盐胁迫能够促进杨树根中AsA-POD活性的增强,但随处理时间的延长,盐胁迫的促进作用明显减弱,且盐浓度越高,AsA-POD活性下降越明显。
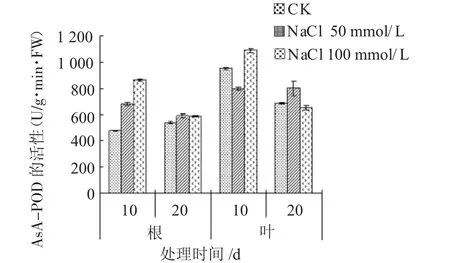
图2 NaCl胁迫对AsA-POD活性的影响
从图2可以看出,盐胁迫初期(10 d),50 mmol/L NaCl胁迫下的杨树叶中AsA-POD活性比对照下降了15.98%,100 mmol/L NaCl胁迫下的杨树叶中AsA-POD活性却比对照上升了14.51%。方差分析表明,在P<0.01下,盐胁迫与对照相比,10 d时叶中AsA-POD活性的差异达到极显著水平。盐胁迫末期(20 d),50 mmol/L NaCl胁迫下的杨树叶中AsA-POD活性比对照上升了 16.42%;而 100 mmol/L NaCl胁迫下的杨树叶中AsA-POD活性比对照下降了 4.94%,却比盐胁迫初期下降了39.94%。方差分析表明,在P<0.05下,盐胁迫与对照相比,20 d时叶中AsA-POD活性的差异达到显著水平。
综上所述,50 mmol/L NaCl在短时间内促进根中AsA-POD活性的增强,抑制叶中AsA-POD活性;但随时间的延长,促进根中AsA-POD活性的作用下降,促进叶中AsA-POD活性的上升。而100 mmol/L NaCl在短时间内能促进杨树AsA-POD活性的上升;随处理时间的延长,根中促进作用下降,抑制叶中AsA-POD活性。表明在盐浓度达到100 mmol/L以上,长时间盐胁迫会使杨树AsA-POD活性下降;且短时间内根对盐处理比叶敏感些,到20 d时,低浓度处理时叶比根敏感些,而高浓度处理时根比叶更敏感。
2.3 NaCl胁迫对谷胱甘肽还原酶(GR)活性的影响
由图3可见,盐胁迫10 d时,50 mmol/L NaCl胁迫下杨树根中GR活性仅比对照下降了9.09%,而100 mmol/L NaCl比对照上升了36.36%;到20 d时,50 mmol/L NaCl胁迫下杨树根中GR活性比对照上升了61.54%,而100 mmol/L NaCl比对照上升了38.46%。因此,随处理时间的延长,盐胁迫促进杨树根中GR活性的上升,且盐浓度增加,促进作用下降。

图3 NaCl胁迫对GR活性的影响
由图3可知,不同盐浓度胁迫在短时间内对杨树叶中GR活性均有促进作用,但不显著。盐胁迫初期(10 d)时,50 mmol/L NaCl胁迫下杨树叶中GR活性与100 mmol/L NaCl相同均仅比对照上升了9.80%;到20 d时,50 mmol/L NaCl胁迫下杨树叶中GR活性比对照下降了49.46%,而100 mmol/L NaCl比对照下降了66.67%。方差分析表明,在P<0.01下,盐胁迫与对照相比,20 d时叶中GR活性的差异达到极显著水平。因此,在盐处理10 d内,NaCl能促进杨树叶中GR活性的上升,随处理时间的延长,则抑制GR活性,且随盐浓度增加,这种抑制作用更明显。50 mmol/LNaCl在盐处理10 d内抑制杨树根中GR活性,却能促进叶中GR活性;但处理时间的延长,则能促进根中GR活性,却抑制叶中GR活性。100 mmol/L NaCl在10 d内促进根叶中GR活性的上升;处理时间的延长,则促进作用下降,甚至抑制叶中GR活性。在盐胁迫20 d时,50 mmol/LNaCl胁迫下根叶中GR活性均高于100 mmol/LNaCl。表明当盐浓度大于100 mmol/L NaCl以上时,杨树GR活性下降得更明显。
3 结论与讨论
试验结果表明,NaCl胁迫下杨树组培苗的几种抗氧化酶的活性发生了一系列的变化。在正常情况下,植物细胞内活性氧的产生与清除处于动态平衡,而当植物在逆境下,由于体内活性氧代谢加强而使活性氧发生积累,当积累超过抗氧化系统的清除能力时,就会导致抗氧化酶活性的降低和膜脂过氧化[9-12]。CAT、AsA-POD等保护酶类在植物体内协同作用清除过量的活性氧,维持活性氧的代谢平衡,保护膜结构,从而使植物在一定程度上忍耐、减缓或抵御逆境胁迫伤害[13]。GR是一种黄素蛋白氧化还原酶,在抗氧化胁迫中的作用体现在通过抗坏血酸、谷胱甘肽循环使植物细胞重要的两种非酶抗氧化剂——抗坏血酸、谷胱甘肽得以再生[14]。
以上分析在一定程度上表明了杨树具有一定的耐盐能力,在50 mmol/LNaCl处理下具有较高的耐盐性,能够正常生长;而在100 mmol/L NaCl处理下受到一定的氧化胁迫;150 mmol/L NaCL和200 mmol/LNaCl处理的杨树幼苗萎蔫死亡,表明此浓度超出杨树可耐受范围。根对盐胁迫比叶更敏感些,因为根系生长在土壤中,直接与盐渍环境接触,受盐分影响最大、最直接。本课题利用NL-895杨树的组培苗研究微环境下不同浓度盐胁迫对杨树生长的影响,仅是从杨树根、叶胁迫后表现出来的几种抗氧化酶活性变化上得出杨树具有一定的抗盐性,这对研究杨树抗盐性方面提供了一定的理论依据,为杨树新品种的开发利用扩大种植范围提供技术参考。然而植物抗盐作用机制是比较复杂的,衡量耐盐性的指标也很多,这还有待于我们从其他方面更全面的分析,并对杨树抗盐性作进一步深入的研究。
[1]Jug A,Hofmann-Schielle C,Makeschin F.Short-rotation plantations of balsam poplars,aspen and willows on former arable land in the Federal Republic of Germany II.Nutritional status and bioelement export by harvested shoot axes[J]. For Ecol Man,1999,121(1-2):67-83.
[2]Li G-Q(李国旗),An S-Q(安树青),Zhang J-L(张纪林).Impact of salt stress on peroxidase activity in Populus deltoids cambium and its consequence[J].Chin J A ppl Ecol(应用生态学报),2003,14(6):871-874(in Chinese).
[3]Li P-Z(李培芝),Fan S-H(范世华),Wang L-H(王力华).Productivity and turnover of fine roots in poplar tree and grass roots.Chin J A ppl Ecol(应用生态学报),2001,2(6): 829-832(in Chinese).
[4]Zhu J K.Salt and drought stress signal transduction in plants [J].Annual Review of Plant Biology,53(1):247.
[5]胡国霞,马莲菊,陈强,等.植物抗氧化系统对水分胁迫及复水响应研究进展 [J].安徽农业科学,2011,39(3): 1278-1280.
[6]郝再彬,苍晶,徐仲.植物生理试验技术[M].北京:高等教育出版社,2000.
[7]李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000.
[8]李忠光,李江鸿,杜朝昆,等.在单一提取系统中同时测定五种植物抗氧化酶[J].云南师范大学学报:自然科学版,2002,22(6):121-124.
[9]Fadzilla N M,Finch R P,Burdon R H.Salinity,oxidative stress and antioxidant responses in shoot culture of rice[J].Exp Bot, 1997(48):325-331.
[10]Hernandez J A,Corpass F J,Gome M,et al.Salt-induced oxidative stress mediated by active oxygen species in pen leaf mitochondria[J].Physiol Plant,1993(89):103-110.
[11]Bandeoglu E,Eyidogan F,YucelM,et al.Anti oxidant responses of shoots and roots of lentil to NaCl-salinity stress. Plant Growth Regul,2004(42):69-77.
[12]Liu Y L,Mao C L,Wang L J.Advances in salt tolerance in plants[J].Commun Plant Physiol,1987(23):1-7.
[13]Liang Y C,Chen Q,Liu Q,et al.Exogenous silicon (Si)increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley (Hordeum vulgare L.) [J].Plant Physiology,2003(160):1157-1164.
[14]秦小琼,贾士荣.植物抗氧化逆境的基因工程[J].农业生物技术学报,1997,4(3):14-24.
(责任编辑:杨婷婷)
Effects of Different Salinities on the Antioxidase Activities of Poplar Tissue Culture Plantlets
ZHOU Siyan
(Agricultural Cadre School of Xiangshui County,Yancheng 224600,Jiangsu,China)
In this paper tissue culture plantlets of poplar variety NL-895 were used as materials to study effects of different salinities on the antioxidase activities.The results showed that the plantlets treated with 50 mmol/L NaCl had relatively high salt tolerance and could grow normally.Those treated with 100 mmol/L NaCl suffered some oxidative stress with the roots being more sensitive to salt stress than the leaves;when salt stressed with 100 mmol/L NaCl for 10d,the active contents of AsA-POD and GR in the roots and the active contents of CAT in the leaves were 82.62%,36.36%and 58.05%higher than those of the control group respectively;when salt-stressed for 20 d, the rangeabilities of CAT in the roots were higher than those in the leaves in the two salinities.
Poplar tissue culture plantlets;Salt stress;Oxidative stress;Antioxidase;Salt tolerance
S792.11
A
2095-0152(2016)06-0017-04
2016-10-17
2016-11-05
周思言(1989-),女,助理工程师,主要从事基层农林技术培训推广工作。E-mail:xsngx2010@163.com

