蛋氨酸水平对罗非鱼蛋白质代谢及血清生化指标的影响
向 枭 周兴华 曾本和 罗 莉 文 华
蛋氨酸水平对罗非鱼蛋白质代谢及血清生化指标的影响
向 枭1周兴华1曾本和1罗 莉2文 华3
(西南大学荣昌校区水产系;淡水鱼类资源与生殖发育教育部重点实验室;水产科学重庆市市级重点实验室1,重庆 402460)
(西南大学动物科技学院2,重庆 400715)
(中国水产科学院长江水产研究所;中国水产科学院淡水生态与健康养殖重点开放实验室3,荆州 434000)
为了探讨不同蛋氨酸水平对罗非鱼生长过程中蛋白质代谢及血液生化指标的影响。通过在半精制基础饲料中添加包膜DL-蛋氨酸,配制成蛋氨酸水平分别为0.26%、0.55%、0.85%、1.14%、1.44%和1.73%的6 种等氮等能(32.09%粗蛋白质,17.82 kJ/g总能)的试验饲料。以初始体质量(66.76 ±2.29)g的罗非鱼为试验对象,每种试验饲料设3个重复,每个重复放养试验鱼25尾,养殖系统为室内养殖系统,每天表观饱食投喂3次,养殖时间为60 d。结果表明,随饲料蛋氨酸水平的增大,罗非鱼的增重率(WGR)、饲料蛋白沉积率(PDR)及脂肪沉积率(LDR)均呈现先上升后下降的趋势。且WGR和LDR均在蛋氨酸水平为1.14%时达到最大(分别为361.91%和107.54%);PDR则在饲料蛋氨酸水平为1.44%时达到最大(47.22%)。随着饲料中蛋氨酸水平的提高,罗非鱼肝脏中的肝脏中谷草转氨酶(AST)、谷丙转氨酶(ALT)活性及AST/ALT比值均呈先升后降的变化趋势。当蛋氨酸添加水平为1.14%时,罗非鱼肝脏中AST、ALT、AST/ALT均达到最高(分别为165.33 U/mg、48.38 U/mg和3.43);肝脏中谷氨酸脱氢酶(GDH)活性及血氨水平均随着饲料中蛋氨酸水平的提高呈先降后升的变化趋势,且当蛋氨酸添加水平为1.14%时均达到最低(分别为103.97 U/mg和564.72 μmol/L)(P <0.05)。随饲料蛋氨酸水平的增加,罗非鱼血清中胆固醇(CHO)、甘油三酷(TG)均随饲料蛋氨酸水平的升高而呈先升高后稳定的变化趋势。说明适宜的蛋氨酸水平有利于促进机体的蛋白质和脂质代谢,提高罗非鱼的生长速度。
罗非鱼 蛋氨酸 蛋白质代谢 生化指标
蛋氨酸是动物都需要的一种必需氨基酸。与动物谷胱甘肽等含硫化合物的代谢有密切的关系。在鱼类的生长发育过程中,蛋氨酸可直接参与蛋白质合成,也可转化成半胱氨酸用于合成鱼体蛋白质,同时蛋氨酸是重要的甲基供体,能为肌酸、胆碱等的合成提供甲基。陈乃松等[1]研究表明,饲料中蛋氨酸水平为1.23%(占饲料蛋白质的2.77%)时,大口黑鲈(Micropterus salmoides)的蛋白沉积率最大。Yan等[2]认为,饲料蛋氨酸水平能显著影响许氏平鲉(Sebastes schlegeli)的蛋白质沉积率;饲料中补充DL-蛋氨酸会显著提高异育银鲫(Carassius auratus gibelio)幼鱼的特定生长率和蛋白质沉积率[3]。蛋氨酸在鱼体内可合成胱氨酸,防止大西洋鲑(Salmo salar L.)脂肪肝等疾病的产生,增加其对脂肪的消化率利用率[4]。杜滢[5]用缺乏蛋氨酸等必需氨基酸的饲料处理小鼠7 d后发现能不同程度地减少其脂肪含量;蛋氨酸[6]和MHA[7]对幼建鲤(Cyprinus carpio Var.Jian)的体蛋白和脂肪沉积率均有极显著或显著的影响。且蛋氨酸是豆粕等鱼类常用植物蛋白质源的第一限制性氨基酸,则其缺乏或添加不足将引起饲料氨基酸不平衡,使饲料可利用率下降,影响蛋白质和脂肪代谢。因此,在饲料中补充适量的蛋氨酸能促进动物生长,增加动物肌肉组织中蛋白质的沉积。本研究以吉富罗非鱼(Genetic Improvement of Farmed Tilapia,Oreochromis niloticus)为研究对象,探讨蛋氨酸水平对吉富罗非鱼生长过程中蛋白质代谢及血清生化指标的影响,旨在为设计吉富罗非鱼养殖中所需的高效、环保的饲料配方提供基础数据。
1 材料与方法
1.1 饲料
以明胶、鱼粉、花生粕、包膜氨基酸混合物(包被材料为卡拉胶、羟甲纤维素钠、α-淀粉作为包膜材料,比例为1∶1∶1)为主要蛋白源,豆油为脂肪源。氨基酸的包膜参照王冠[8]的方法。模拟与罗非鱼全鱼相似的氨基酸组成,除蛋氨酸和甘氨酸(平衡氮)的水平不同外,其余的必需和非必需氨基酸按照罗非鱼全鱼氨基酸组成模式。配制成低蛋氨酸的基础饲料(见表1),并设定为对照组。在基础饲料中分别添加0%、0.3%、0.6%、0.9%、1.2%和1.5%的包膜DL-蛋氨酸,同时用包膜L-甘氨酸节饲料中L-甘氨酸的含量,以0.3%的水平递减,调节饲料中氮的水平。设计6种等氮(粗蛋白含量为32.09% )等能(总能为17.82 kJ/g)的实验饲料。各原料均粉碎过80目筛,称重后混匀,量少的组分采用逐级扩大法混合,用实验室小型绞肉机制成直径为2 mm的硬颗粒料,自然晾干后于-20℃保存。经测定6种试验饲料中蛋氨酸的质量分数分别为0.26%、0.55%、0.85%、1.14%、1.44%和1.73%,占饲料蛋白质的质量分数分别为0.81%、1.71%、2.65%、3.55%、4.49% 和5.39%。饲料的氨基酸组成见表2。
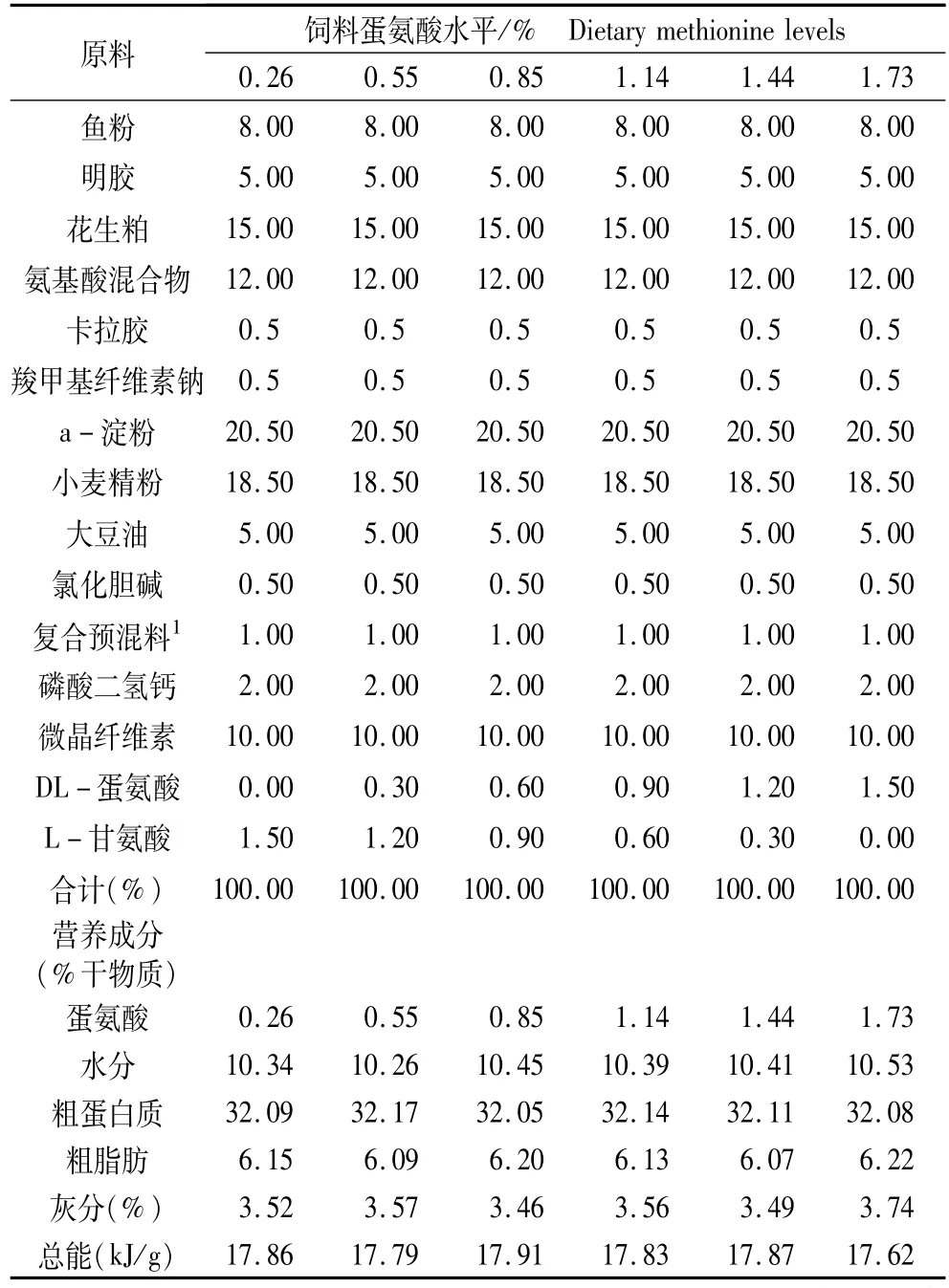
表1 基础饲料配方及主要营养成分(风干基础)
1.2 鱼及饲养管理
罗非鱼购自重庆白市驿渔场,体重(66.76±2.29)g。购回后先用5%的食盐水消毒后放入暂养池,用商品饲料暂养7 d。试验开始前,对暂养鱼进行24 h饥饿处理,选择健康、无伤病的罗非鱼450尾,随机投入18个试验水泥池(150 cm×100 cm×50 cm)中。并随机分成6组,每组3个重复,每个重复25尾鱼,分别投喂6种不同蛋氨酸水平的饲料。每天按鱼体重的3%~5%投喂饲料(根据鱼的摄食情况及水温等环境状况及时调整投喂率),每天8:00、13:00、16:00各投饲1 次,投喂前虹吸清污,饱食后30 min迅速虹吸残饵并风干测定其质量。养殖期间每天换水1次,每次换水量为养殖水体的1/3。试验用水为曝气后的自来水,每日监测水温、水质、试验鱼的摄食行为和死亡数量等。水温维持在28~30 ℃,溶氧高于6.0 mg/L,pH 为7.0 ~7.5,养殖时间60 d。

表2 基础饲料中氨基酸组成分析/%干物质
1.3 样品采集
试验开始和结束前1天停食24 h,对每尾鱼进行体质量及体长测量。每个重复组中随机各取3尾实验鱼,于-80℃下保存,用于鱼体粗蛋白、粗脂肪分析。试验结束后,每个试验组中随机取5尾鱼用50 mg/L的MS-222溶液麻醉,测定体质量和体长后,用1 mL注射器于尾静脉取血,并用离心机(4℃,3 500 r/min)离心15 min,制备血清,用于测定血清生化指标;再在冰盘上解剖并分离出肝脏,用4℃预冷的生理盐水冲洗,然后用滤纸吸干,精度称量肝脏团的质量。加入相当于其重20倍的生理盐水,迅速用冰冻玻璃匀浆器匀浆后用离心机(4℃,3 500 r/min)离心20 min,取上清液作为粗酶提取液,测定肝脏代谢指标。
1.4 指标测定
1.4.1 生长指标的测定
根据测定的数据计算鱼的增重率(weight gain rate,WGR)、蛋白质沉积率(Protein deposition rate,PDR)、脂肪沉积率(Lipid deposition rate,LDR),计算公式:
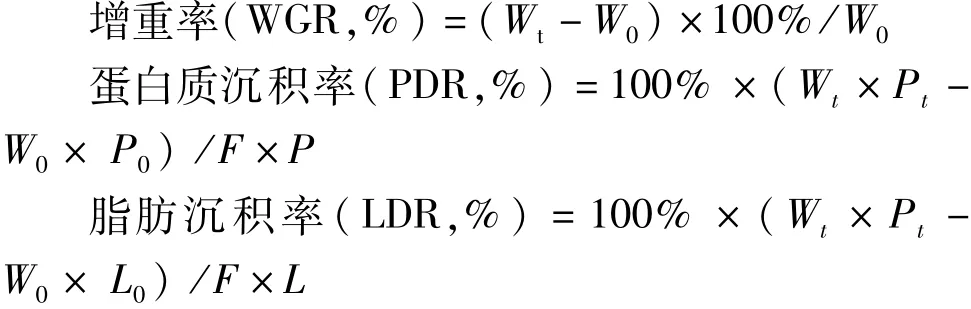
式中:W0为鱼初始体质量/g;Wt为鱼终末体质量/g;P0为鱼初始体蛋白质含量/%;Pt为鱼终末体蛋白质含量/%;P为饲料中粗蛋白质含量/%;L0为鱼初始体脂肪含量/%;Lt为鱼终末体脂肪含量/%;L为饲料中粗脂肪含量/%;F为饲料摄入总质量/g。
1.4.2 饲料及鱼体营养成分的测定
饲料水分、粗蛋白、粗脂肪、灰分和总能级试验鱼粗蛋白的测定参照AOAC的方法[11]。水分采用105℃干燥恒重法;粗蛋白质采用凯氏定氮法;粗脂肪采用索氏提取法;灰分采用马福炉550℃灼烧法;饲料能量采用氧弹热量计(WGR-1,中国)测定。
1.4.3 蛋白质及脂肪代谢指标的测定
肝脏中谷草转氨酶(AST)、谷丙转氨酶(ALT)、谷氨酸脱氢酶(GDH)、血氨、甘油三酷(TG)、胆固醇(CHO)、均采用南京建成生物工程研究所相应试剂盒测定。
1.5 数据处理方法
数据以平均值±标准差(Means±SD)表示,采用SPSSStatistics 19.0统计软件中one-way ANOVA进行方差分析,若组间差异显著,再用Duncan′s进行多重比较,差异显著水平为P<0.05。
2 结果与分析
2.1 蛋氨酸水平对罗非鱼蛋白质和脂肪沉积率的影响
由表3可知,饲料蛋氨酸水平能显著影响罗非鱼的增重率、蛋白质沉积率及脂肪沉积率。随饲料蛋氨酸水平的升高,罗非鱼的增重率(WGR)、蛋白质沉积率(PDR)和脂肪沉积率(LDR)均呈先升后降的变化趋势。在饲料蛋氨酸水平为1.14%时,罗非鱼的WGR及LDR均达到最大。WGR在饲料蛋氨酸水平为0.85%~1.44%时差异不显著(P >0.05);LDR在饲料蛋氨酸水平为1.14%~1.44%时差异不显著外(P>0.05),与其余各试验组差异显著(P<0.05);PDR在饲料蛋氨酸水平为1.44% 时达到最大。除0.85%~1.44%蛋氨酸组差异不显著外(P>0.05),与其余各试验组差异显著(P <0.05)。

表3 蛋氨酸水平对罗非鱼蛋白质和脂肪沉积率的影响(n=3)
2.2 蛋氨酸水平对罗非鱼蛋白质代谢酶的影响
由表4可知,随着饲料中蛋氨酸水平的提高,罗非鱼肝脏中的肝脏中谷草转氨酶(AST)、谷丙转氨酶(ALT)活性及AST/ALT比值均呈先升后降的变化趋势。当蛋氨酸添加水平为1.14%时,鱼肝脏中AST、ALT、AST/ALT 均达到最高。AST、ALT、AST/ALT 除与0.85%蛋氨酸组差异不显著外(P>0.05),与其余各试验组均有显著差异(P<0.05);谷氨酸脱氢酶(GDH)活性则随着饲料中蛋氨酸水平的提高呈先降后升的变化趋势,且当蛋氨酸添加水平为1.14%时达到最低,与其余各试验组差异显著(P<0.05),而0.85%蛋氨酸组与1.44%~1.73%蛋氨酸组的差异不显著(P >0.05)。
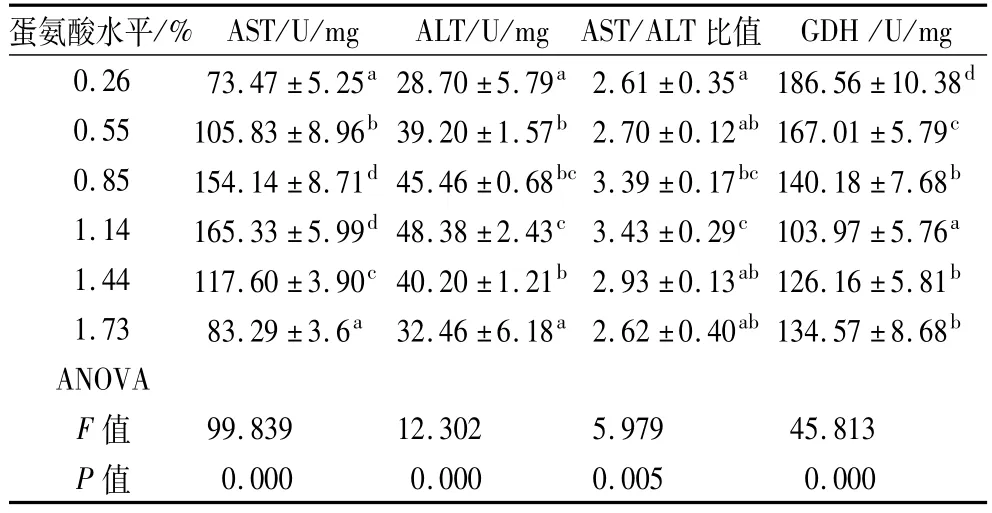
表4 蛋氨酸水平对罗非鱼肝脏蛋白质代谢的影响(n=3)
2.3 蛋氨酸水平对罗非鱼血液生化指标的影响
由表5可知,罗非鱼血氨水平则随饲料蛋氨酸水平的升高而呈先降后升的变化趋势。1.14%蛋氨酸组血氨含量最低,除与0.85%蛋氨酸组差异不显著外(P>0.05),与其余各试验组差异显著(P<0.05);胆固醇(CHO)、甘油三酷(TG)均随饲料蛋氨酸水平的升高而呈先升高后稳定的变化趋势。蛋氨酸水平小于1.14%时,CHO和TG随着蛋氨酸水平的增加而增加(P<0.05),而当蛋氨酸水平大于等于1.14%时,蛋氨酸水平对罗非鱼CHO和TG无显著影响(P >0.05)。

表5 蛋氨酸水平对罗非鱼血液生化指标的影响(n=3)
3 讨论
蛋氨酸是水产动物所需的一种含硫必需氨基酸,与动物体内各种含硫化合物的代谢有密切的关系。当蛋氨酸含量不足时将导致饲料中氨基酸的不平衡,降低饲料利用效率[9]。在以植物蛋白为主的实用饲料中添加适量的结晶D-蛋氨酸能显著改善奥尼罗非鱼(Oreochromis niloticus ×O.aureus)的蛋白沉积率[10];添加DL-蛋氨酸可显著提高异育银鲫幼鱼的蛋白质沉积率[3];且其蛋白质贮积率随饲料蛋氨酸含量增加而增加,而达到最适需求量之后则呈下降趋势[11];Zhou 等[12]研究证明,蛋氨酸能显著影响黑鲷(Sparus macrocephalus)的生长速度和体蛋白沉积率;对大西洋鲑、鲤(Cyprinus carpio)的研究均表明,饲料中蛋氨酸缺乏将显著降低鱼类蛋白质和脂肪的沉积量[13-14]。本试验中饲料蛋氨酸水平对罗非鱼的蛋白质沉积率(PDR)及脂肪沉积率(LDR)有显著的影响。随饲料蛋氨酸水平的升高,罗非鱼的PDR和LDR均呈先升后降的变化趋势,且PDR在饲料蛋氨酸水平为1.44%时达到最大;LDR在饲料蛋氨酸水平为1.14%时达到最大,与向枭等[15]报道的蛋氨酸水平对罗非鱼生长速度和饲料系数影响的结论相一致。这说明饲料中各种氨基酸平衡时,动物体内各种物质的合成代谢大于分解代谢,蛋白质和脂肪的沉积率最高;当蛋氨酸缺乏或不足时,饲料中的氨基酸模式失衡,限制了鱼类对其他氨基酸的利用,加强了多余氨基酸的脱氨基作用,导致体蛋白合成的受限[16]。蛋氨酸是蛋白质合成中核糖体在mRNA起始位置结合的第1个氨基酸。当蛋氨酸缺乏时,单位RNA所合成的蛋白质减少[17],使鱼体合成蛋白质的两减少;蛋氨酸添加过量则导致蛋氨酸的氧化,使有毒的代谢物质积聚[18],从而抑制鱼体蛋白质的沉积。但解缓启[19]认为,蛋氨酸水平对长吻鮠(Leiocassis longirostris)的蛋白质贮积率无显著影响,Rodehustocrd 等[20]发现,虹鳟(Oncorhynchus mykiss)的蛋白质贮积率随蛋氨酸水平的增加呈先增加后逐渐趋于稳定的变化趋势,与本研究结论有一定的差异这可能与鱼的种类、生长阶段、饲料有效成分等有关。
谷草转氨酶(AST)、谷丙转氨酶(ALT)是人和动物体内重要的氨基酸代谢酶[21],在肝脏中负责特定氨基酸的氨基转移,肝脏中AST、ALT的活性能较好地反应动物体内蛋白质和氨基酸的代谢状况。AST、ALT活性升高,尤其是AST/ALT比值的升高表明氨基酸代谢旺盛,蛋白质分解下降而合成加强,有利于氮在体内的蓄积[22]。本试验中,罗非鱼肝脏中的肝脏中AST、ALT活性及AST/ALT比值均随着饲料中蛋氨酸水平的提高呈先升后降的变化趋势,且均在蛋氨酸添加水平为1.14%时达到峰值。说明添加适量的蛋氨酸能促进了罗非鱼体内的氨基酸代谢和蛋白质合成。迟淑艳等[23]研究表明,添加蛋氨酸能显著提高军曹鱼(Rachycentron canadum)AST、ALT活性及AST/ALT比值;显著提高了中期草鱼(Ctenopharyngodon idellus)肝胰脏中AST、ALT活性,且当蛋氨酸水平分别达7.18 g/kg 和12.21 g/kg 时,草鱼肝胰脏中AST 和ALT 活性达到最大[24],柯帅[6]也认为幼建鲤肝脏中AST的活性随蛋氨酸水平的提高呈先升后降的变化趋势,与本研究结果相一致。说明添加一定量的蛋氨酸可促进动物对蛋白质的周转代谢,当氨基酸趋于平衡后,合成代谢高于分解代谢,有利于蛋白质在体内的沉积。
动物代谢过程中,很多氨基酸都是转化为谷氨酸来参与代谢的。因此谷氨酸脱氢酶(GDH)是蛋白质分解代谢和非必需氨基酸合成的关键酶,其活性的高低一定程度上反映了动物体内蛋白质分解代谢的情况[25]。本试验中,罗非鱼肝脏中GDH活性随饲料中蛋氨酸水平的提高呈先降后升的变化趋势。尚晓迪等[26]研究表明,草鱼肝脏中GDH活性与饲料中异亮氨酸的水平呈先降后升的二次回归曲线关系。饲料中蛋氨酸缺乏或过量时,肝脏对氨基酸的分解代谢作用加强,肌肉中的蛋白质合成降低,而当饲料氨基酸趋于平衡时,通过抑制GDH活性而使氨基酸合成体蛋白质的能力增强,肝脏分解氨基酸的速度减慢;氨是水产动物氨基酸分解代谢的主要产物。肝脏代谢过程中所产生的氨将在血液中逐渐累积,最后排出体外。则血氨的浓度与饲料氨基酸的含量有密切的关系[27]。本试验中,罗非鱼血氨水平随饲料蛋氨酸水平的升高而呈先降后升的变化趋势。其原因可能为,当饲料中蛋氨酸水平不足或过量时,饲料氨基酸不平衡而引起氨基酸分解代谢加强,体蛋白质的沉积减少,血氨浓度上升。一定范围内,随着蛋氨酸添加量的增强,饲料氨基酸组成逐渐趋于平衡,则氨基酸合成代谢加强而分解代谢减弱,血氨浓度下降。肖伟伟认为,血氨浓度与肝胰脏AST、ALT活性呈极显著或显著负相关,适宜水平的MHA可显著降低幼建鲤的血氨含量。与本研究结论相一致。
甘油三酯和胆固醇与机体脂肪代谢状况有关[28]。本试验中,罗非鱼血清胆固醇(CHO)、甘油三酷(TG)含量均随蛋氨酸水平的升高而呈先升高后稳定的变化趋势。随着蛋氨酸水平的提高,卵形鲳鲹(Trachinotus Ovatus)血清CHO、TG含量显著提高[29]。饲料蛋氨酸水平为0.64%~1.15% 时,胭脂鱼(Myxocyprinus asiaticus)血清CHO、TG含量先随蛋氨酸水平的提高而显著增加,而后则随氨酸水平的继续增加而趋于稳定[30]。与本试验的结论相一致。含硫氨基酸对人和动物血清脂质含量有明显的影响[31],Susgiyama 等[32]在麦谷蛋白的氨基酸混合物中增加蛋氨酸的含量而除去除胱氨酸,可使大鼠血清中CHO、TG的浓度升高;Oda等[33]研究发现,在大鼠饲料中添加蛋氨酸能使其肝微粒体中胆固醇合成的关键酶3-羟基-3-甲基戊二酞辅酶A还原酶的活性增加。说明蛋氨酸在动物脂质代谢中有重要作用。当蛋氨酸添加量增大后,造成氨基酸组成的不平衡,使被氧化的氨基酸量增加,大量的氨基酸脱氨后进入三羧酸循环被氧化而供能,减少了蛋白质的沉积,而转化成糖和脂肪[34],增大了血清中CHO、TG的浓度。
4 结论
本试验条件下,饲料蛋氨酸水平对罗非鱼蛋白质沉积和代谢,血清中CHO、TG均有显著影响,说明蛋氨酸能有效地改善罗非鱼对饲料蛋白质和脂质的代谢能力,因此,饲料中添加适量的蛋氨酸可增强罗非鱼的代谢能力,提高其生长速度。
[1]陈乃松,马建忠,周恒永,等.大口黑鲈对饲料中蛋氨酸需求量的评定[J].水产学报,2010,34(8):1244-1253
Chen NS,Ma JZ,Zhou H Y,et al.Assessment of dietary methionine requirement in largemaouth bass,Micropter salmoides[J].Journal of Fisheries of China,2010,34.(8):1244-1253
[2]Yan Q,Xie S,Zhu X,et al.Dietary methionine requirement for juvenile rockfish,Sebastes schlegeli [J].Aquaculture Nutrition,2007,13(3):163-169
[3]贾鹏,薛敏,朱选,等.饲料蛋氨酸水平对异育银鲫幼鱼生长性能影响的研究[J].水生生物学报,2013,37(2):217-226
Jia P,Xue M,Zhu X,et al.Effects of dietary methionine levels on the growth performance of juvenile gibel carp (Carassiusauratus gibelio)[J].Acta Hydrobiologica Sinica,2013,37(2):217-226
[4]Nordrum S,Krogdahl Å,RøsjøC,et al.Effects of methionine,cysteine and medium chain triglycerides on nutrient digestibility,absorption of amino acids along the intestinal tract and nutrient retention in Atlantic salmon (Salmo salar L.)under pair-feeding regime [J].Aquaculture,2000,186(3-4):341-360
[5]杜滢.氨基酸调控脂肪代谢的机制研究[D].北京:中国科学院大学,2013
Du Y.Mechanism for lipid metabolism by amino acids[D].Beijing:University of the chinese academy of sciences,2013
[6]柯帅.蛋氨酸对幼建鲤消化功能和免疫功能的影响[D].雅安:四川农业大学,2006
Ke S.The effect of methionine on digestive function and immune function of juvenile Jian carp(Cyprinus carpio Var.jian)[D].Ya an:Sichuan agricultural university,2006
[7]肖伟伟.蛋氨酸羟基类似物对幼建鲤消化吸收能力、抗氧化能力和免疫功能的影响[D].雅安:四川农业大学,2010
Xiao W W.Effect of dietary methionine hydroxy analogue on digestive ability,antioxidative ability and immune function of juvenile Jian carp(Cyprinus carpio Var.jian)[D].Ya′an:Sichuan agricultural university,2010
[8]王冠.晶体氨基酸经微胶囊技术处理后对异育银鲫生长影响的研究[D].上海:上海水产大学,2006
Wang G.Micro-capsule inproving the effect of free amino acid on the growth of Carassius auratus glibelio[D].Shanghai:Shanghai Fisheries University,2006
[9]Takagi S,Shimeno S,Hosokawa H,et a1.Effect of lysine and methionine supplementation to a soy protein concentrate diet for red sea bream Pagrusmajor[J].Fisheries Science,2001,67(6):1088-1096
[10]林仕梅,麦康森,谭北平.实用饲料中添加结晶蛋氨酸对罗非鱼生长、体组成的影响[J].水生生物学报,2008,32(5):742-749
Lin SM,Mai K S,Tan B P.Influence of practical diet supplementation with free D-methionine on the growth and body composition in tilapia oreochromis niloticus× O.aureus[J].Acta Hydrobiologica Sinica,2008,32(5):742-749
[11]周贤君.异育银鲫对晶体赖氨酸和蛋氨酸的利用及需求量研究[D].武汉:华中农业大学,2005
Zhou X J.Utilization of dietary crystalline lysine and methionine and the requirements for gibel carp[D].Wuhan:Huazhong Agricultural University,2005
[12]Zhou F,Xiao J X,Hua Y,et al.Dietary l-methionine requirement of juvenile black sea bream (Sparus macrocephalus)at a constant dietary cystine level[J].Aquaculture Nutrition,2011,17(5):469-481
[13]Sveier,Nordås,Berge,et al.Dietary inclusion of crystalline D-and L-methionine:effects on growth,feed and protein utilization,and digestibility in small and large Atlantic salmon (Salmon salar L.)[J].Aquaculture Nutrition,2001,7(3):169-181
[14]Nwanna L C,Lemme A,Metwally A,et al.Response of common carp (Cyprinus carpio L.)to supplemental DLMethionine and different feeding strategies [J].Aquaculture,2012.356(1-2):365-370
[15]向枭,周兴华,罗莉,等.饲料蛋氨酸水平对吉富罗非鱼生长、饲料利用率和体成分的影响[J].水产学报,2014,38(4):538-549
Xiang X,Zhou X H,Luo L,et al.Effects of dietary methionine levels on the growth performance,feed utilization and body composition of GIFTTilapia(Oreochromis niloticus)[J].Journal of Fisheries of China,2014,38(4):538-549
[16]Rønnestad I,Conceição L E C,Aragão C,et al.Free amino acids are absorbed faster and assimilated more efficiently than protein in postlarval Senegal sole (Solea senegalensis)[J].The Journal of Nutrition,2000,130(11):2809-2812
[17]Garlick P J,Mcnurlan M A,Preedy V R.A rapid and convenient technique for measuring the rate of protein synthesis in tissues by injection of[3H]phenylalanine[J].Biochemical Journal,1980(192):719-723
[18]Murthy R K,Varghese T J.Total sulphur amino acid requirement of the Indian major carp,Labeo rohita (Hamilton)[J].Aquaculture Nutrition,1998,4(1):61-66
[19]解绶启.长吻鮠对赖氨酸和蛋氨酸的需要量及在实用型饲料中补充效果的研究[D].武汉:中国科学院水生生物研究所,1992
Xie SQ.The research of lysine and methionine requirements and supplementary effect in practical feed of Leiocassis longirostris[D].Wuhan:Chinese Academy of Sciences Institute of Hydrobiology,1992
[20]Rodehustocrd M,Pack M.Estimates of essential amino acid requirements from dose-response studies with rainbow trout and broiler chicken:effect of mathematical model[J].Archives of Animal Nutrition 1999,52(3):223-244
[21]Segner H,Verreth J.Metabolic enzyme activities in larvae of the African catfish,Clarias gariepinus:changes in relation to age and nutrition[J].Fish physiology and biochemistry,1995,14(5):385-398
[22]邓君明.动植物蛋白源对牙鲆摄食、生长和蛋白质及脂肪代谢的影响.[D].青岛:中国海洋大学,2006
Den JM.Effects of animal and plant protein sources on feed intake,growth and protein and lipid metabolism of Japanese flounder Paralichthys olibaceus[D].Qingdao:Ocean University of China,2006
[23]迟淑艳,谭北平,董晓慧,等.微胶囊蛋氨酸或晶体蛋氨酸对军曹鱼幼鱼相关酶活性的影响[J].中国水产科学,2011,18(1):110-118
Chi SY,Tan B P,Dong X H,et al.Effect of supplementation microcapsule or crystalline methionine in diets on related enzyme activity of cobia(Rachycentron canadum)[J].Journal of Fishery Sciences of China,2011,18(1):110-118
[24]唐炳荣.蛋氨酸对生长中期草鱼消化吸收能力和抗氧化能力影响的研究[D].雅安:四川农业大学,2012
Tang B R.Effects of dietary methionine on digestive and absorptive ability and antioxidative ability of young grass carp(Ctenopharyngodon idell)[D].Ya′an:Sichuan Agricultural University,2012
[25]Smutna M,Vorlova L,Svobodova Z.Pathobiochemistry of ammonia in the internal environment of fish (review)[J].Acta Veterinaria Brno,2002,71(2):169-181
[26]尚晓迪,罗莉,文华,等.草鱼幼鱼对异亮氨酸的需要量.水产学报[J],2009,33(5):813-822
Shang X D,Luo L,Wen H,et al.Study on isoleucine requirement for juvenile grass carp,Ctenopharyngodon idell[J].Journal of Fisheries of China,2009,33(5):813-822
[27]Walton M J,Cowey CB.Aspects of ammoniogenesis in rainbow trout,Salmo gairdneri[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1977,57(2):143-149
[28]Regost C,Arzel J,Kaushik S J.Partial or total replacement of fish meal by corn gluten meal in diet for turbot(Psetta maxima)[J].Aquaculture,1999,180(1-2):99-117
[29]杜强.卵形鲳鲹赖氨酸和蛋氨酸需求量及饲料中鱼粉替代的研究[D].上海:上海海洋大学,2012
Du Q.Dietary lysine and methionine requirements and substitution of fish meal in diets for juvenile Trachinotus 0vatus[D].Shanghai:Shanghai Ocean University,2012
[30]林郁葱.胭脂鱼幼鱼对赖氨酸和蛋氨酸的最适需要量[D].武汉:华中农业大学,2012 LIN Y C.Study on lysine and methionine requirements for juvenile chinese sucker,Myxocypinus Asiaticus[D].Wu han:Huazhong Agricultural University,2012
[31]郭俊生,赵法极.蛋白质和氨基酸对血脂的影响[J].生理科学进展,1992,23(2):174-176
Guo J S,Zhao F J.Effect of protein and amino acids on blood lipids[J].Progress in Physiological Sciences,1992,23(2):174-176
[32]Sugiyama K,Ohkawa S,Muramatsu K .Relationship between amino acid composition of diet and plasma cholesterol level in growing rats fed a high cholesterol diet[J].Journal of Nutritional Science and Vitaminology,1986,32 (4):413-423
[33]Oda H,Okumura Y,Hitomi Y,et al.Effect of dietary methionine and polychlorinated biphenyls on cholesterol metabolism in rats fed a diet containing soy protein isolate[J].Journal of Nutritional Science and Vitaminology,1989,35(4):333-348
[34]Kim K I,McMillan I,Bayley H S.Determination of amino acid requirements of young pigs using an indicator amino acid[J].British Journal of Nutrition,1983,50(2):369-382.
Effects of Methionine Levels on Protein Metabolism and Serum Biochemical Indices of Tilapia
Xiang Xiao1Zhou Xinghua1Zeng Benhe1Luo Li2Wen Hua3
(Key Laboratory of Freshwater Fish Reproduction and Development,Ministry of Education,Key Laboratory of Aqucatic Science of Chongqing,Department of Fisheries in Rongchang Compust,Southwest University1,Chongqing 402460)
(Department of Fishery Science,Collage of Animal and Technology of Southwest University2,Chongqing 400715)
(Key Laboratory of Freshwater Ecology and Aquaculture,Yangtze River Fisheries Research Institute,Chinese Academy of Fishery Sciences3,Jingzhou 434000)
In order to discuss the effects of different methionine levels on protein metabolism and blood biochemical indices of tilapia in the process of growth,six kines of experience feeds with (32.09%crude protein)and isoenergetic (17.82 kJ/g gross energy)semipurified diets were formulated with the graded methionine levels (0%,0.3%,0.6%,0.9%,1.2%and 1.5%dry diet,respectively),using gelatin,fishmeal,peanut meal and crystalline amino acids mixtures as the main dietary protein sources.Amino acid pattern in diet was to simulate the amino acid pattern found in the whole body protein of Oreochromis niloticus except for methionine.The six trial diets were determined to contain methionine of 0.26%,0.55%,0.85%,1.14%,1.44%and 1.73%dry diet,respectively.Each diet was randomly assigned to triplicate groups of 25 fish and fed to apparent satiation by hand thrice daily
(8:00,13:00 and 16:00)for 60 days.The results showed that the weight gain rate(WGR),protein deposition rate(PDR)and Lipid deposition rate(LDR)all initially increased with increasing dietary methionine levels but then decreased.The WGR,LDR were all highest(361.91%and 107.54%respectively)when the dietary methionine level was 1.14% (P <0.05),the PDR was the highest(47.22%)(P <0.05)when the dietary methionine level was 1.44% (P <0.05).The AST and ALT activities,AST/ALT in liver all initially increased with increasing dietary methionine levels but then decreased.The AST and ALT activities,AST/ALT were all highest(165.33 U/mg、48.38 U/mg and 3.43 respectively)when the dietary methionine level was 1.14% ,at the same time,the GDH activities in liver and the serum ammonia concentration all first decreased with increasing dietary methionine levels but then increased,the GDH activities and serum ammonia concentration were all the lowest(103.97 U/mg and 564.72 μmol/L respectively)when the dietary methionine level was1.14%.The cholesterol(CHO)and triglyceride(TG)in serum first increased with increasing dietary methionine levels and then leveled off.Results of above show that the optimum dietary methionine level could promote the protein and lipid metabolism,enhance the growth of Oreochromis niloticus.
Oreochromis niloticus,methionine,protein metabolism,biochemical indices
S963.3
A
1003-0174(2016)11-0092-08
重庆市基础与前沿研究计划(cstc2013jcyjA 80033),国家罗非鱼现代产业技术体系建设(CARS-49),农业部公益性行业科研专项(2010 03020)
2015-04-02
向枭,男,1973年出生,副教授,水产动物营养与饲料

