冬小麦黄矮病毒的分子生物学鉴定试验研究
杜秋丽
(济南大学泉城学院,山东 烟台 265600)
冬小麦黄矮病毒的分子生物学鉴定试验研究
杜秋丽
(济南大学泉城学院,山东 烟台 265600)
本研究以检测冬小麦黄矮病毒(BYDV-PAV)的分子生物学特征为目的。首先,通过电击法将3种质粒(UV1304、UV1306、UV1304rtd)转化土壤农杆菌(EHA105、4404,GV3101等)。然后,通过机械损伤使含有上述质粒的农杆菌侵染小麦(西农749、小偃6号、张氏3个品种),并将侵染后的小麦放在室外进行处理,至表现出感染病毒的症状时提取病毒RNA并进行检测。经过一段时间的处理后,只有西农749表现出症状,RNA电泳也显示出提取物中存在RNA,但是经过RT-PCR反转录然后再PCR扩增cDNA后进行电泳出现负结果。3种质粒的cDNA电泳结果出现相似现象:以CP5′+MPR1为引物得到的cDNA电泳均无条带;其他引物得到的cDNA电泳均显示相似的条带,而且因引物不同条带位置也不同。
冬小麦黄矮病毒(BYDV-PAV);土壤农杆菌(GV3101);反转录PCR(RT-PCR);聚合酶链式反应(PCR)
1 研究背景和意义
1.1 研究背景
大麦黄矮病毒(Barley Yellow Dwarf Viruses),在全世界均有分布,其寄主广泛,可侵染150多种单子叶植物,特别是大麦、小麦、燕麦、水稻等多种禾谷类作物。每年在全球范围内,此类病毒对粮食生产会造成一定程度的危害,大发生时会导致严重减产。这类病毒除了在经济上的重要性外,它们的基因表达机制、进化与传播介体和寄主的作用机制,几十年来一直吸引着人们的研究兴趣[1~4]。
1.2 研究意义
小麦黄矮病是我国北方麦区的主要病毒病,由大麦黄矮病毒 (Barley Yellow Dwarf Virus,简称BYDV)引起。该病的流行难以预测,发病后又不可治愈,被称为“小麦癌症”,一般年份减产5%~10%,流行年份减产30%以上,历史上因小麦黄矮病毒感染而导致巨大经济损失的实例普遍存在。本试验通过农杆菌介导法侵染冬小麦研究大麦黄矮病毒(BYDV-PAV)的分子生物学特性,并且研究BYDV-PAV在冬小麦中的表达情况,为培育抗病毒冬小麦提供条件。
2 试验材料与方法
2.1 材料与器材
2.1.1 材料
小麦黄矮病毒(PAV)毒源(国外友人提供);反转录酶;TaqDNA聚合酶和连接酶;PCR反应的引物;LB培养基;大肠杆菌DH5α;小麦品种:小偃、西农749、张氏;土壤农杆菌(EHA105、4404,GV3101等);3种质粒(UV1306、UV1304、UV1304rtd)由本实验室测序正确并保存;RT-PCR试剂盒;cDNA电泳所需要的琼脂胶。
2.1.2 器材
恒温培养箱、超净工作台、离心机、电转仪PCR仪、移液枪、微波炉、电泳仪、研钵和冰箱等。
2.1.3 LB培养基的配方
LB培养基的配方为蛋白胨10 g/L、酵母膏5 g/L、NaCl 10 g/L。待完全溶解后用5 mol/L的NaCl溶液调节pH值到7.0,加水定容至1 L,1.034 Pa高压蒸汽灭菌20 min。配制固体培养基时,每200 mLLB中加入3~4 g琼脂。
2.1.4 土壤农杆菌感受态细胞的制备
①将所选用的农杆菌菌株(EHA105、4404,GV3101等)从活化的平板上挑取单菌落,接种到加有3~5 mL LB培养基的试管中摇过夜培养。②按1%比例接种扩大培养。③5 000 rpm,5 min。收集菌体,用ddH2O洗6遍。④加入培养物体积0.003倍的10%甘油,分装。⑤电转化时取60 uL加小于2 uL的DNA质粒,进行电转。
2.1.5 RT-PCR体系
H2O:3.75 uL;10×Rtbuffer:1 uL;dNTPs:1 uL;Mg-Cl2:2uL;1﹟RNA反转录酶:0.5uL;2﹟RNAinhibitor:0.25uL;引物:0.5 uL;RNA:1 uL。
2.1.6 PCR体系
H2O:14uL;10×Buffer:2uL;Primer:1uL;Taq酶:1uL;dNTP:1 uL;模板:1 uL。
2.2 方法与步骤
2.2.1 质粒DNA的提取
①将含有2 mL含卡纳霉素的LB液体培养基加入到试管中,分别接入上述的含3种质粒的大肠杆菌,37℃振荡培养过夜。②将培养物导入1.5 mL的离心管中,12 000 r/min离心30 s。③吸取培养液,使细胞沉淀尽可能干燥。④浆细胞沉淀悬浮于200 μL溶液I中,用涡旋振荡器充分旋起沉淀,室温放置5 min。⑤加300 μL溶液I(I新鲜配制),盖紧管皿,轻轻滚动,上下颠倒,使溶液I与溶液II充分混匀,冰上放置5 min。⑥加入300 μL溶液III(冰上预冷),盖紧管口,轻轻颠倒数次,混匀,冰上放置10 min。⑦加入250 μL氯仿,轻轻颠倒数次,使盖上的蛋白质沉淀。⑧12 000 r/min离心10 min,转移上清(约600 μL)至新的离心管。⑨向上清中加入等体积的氯仿,反复混匀,12 000 r/min离心5 min,溶液分层,轻轻从离心机中取出。⑩小心吸取400 μL上清至新的离心管。向上清中加入2倍体积的无水乙醇,沉淀DNA后,进行混匀,室温放置5~10 min。12 000 r/min离心5 min,弃上清,用吸水纸吸干管口。1 mL70%乙醇洗质粒2次,轻轻弹起沉淀,离心,弃上清,空甩,风干5 min。
2.2.2 质粒转化土壤农杆菌感受态细胞
①取3个1 mL离心管,每管装入80 μL感受态细胞以及2 μL质粒。②将质粒和感受态细胞转移到电击杯中。将电击杯插入电转仪内,按下pulse键,几秒后电转仪指示灯发生变化时提出电击杯。③将900 μL培养基吸入电击杯内,移液枪打洗混匀。④将电击杯内液体吸净,转入原来的管内。
2.2.3 转化后菌体培养
①将转化完的菌液放入恒温箱中,28℃培养1 h。②配制培养基,倒平板(20 mL培养基中加入50 μL利福平和20 μL卡那霉素)。③涂平板,并将涂好的平板放入27℃培养48 h。④挑菌(每块板上挑取两个克隆)放入盛有3 mL培养液(每20 μL培养液含50 μL利福平和8~9 μL卡那霉素)的试管中。⑤摇菌:27℃震荡培养20~24 h。⑥再次扩大培养:取6支装有20 mL的三角瓶,并标名(每瓶加50μL利福平、20μL四环素、20μL卡那霉素)分别加入400~600 uL菌液。⑦对应每支试管取两支离心管。一支加入10%甘油150 μL加300 μL菌液,放入-80℃保菌;另一支加入菌液,4℃短期保菌。⑧试管中剩余的菌液,在三角瓶中扩大培养摇菌48h。⑨将菌液倒入大离心管中5 000 r/min,5 min弃去上清,加入10 mL小麦转化液悬浮。⑩用人工损伤小麦,接种农杆菌,对照组用小麦转化液处理,处理后将小麦放入室外。
2.2.4 RNA提取
①取黄花叶片4~5片,剪碎,立即液氮研磨成粉末状。②将粉末尽快转入细胞裂解液中并剧烈震荡至组织分散,室温下放置5 min。③加入0.2 mL氯仿充分震荡,室温下放置2~3 min。4℃,12 000 r/min,离心15 min。④冰浴上取上清液250 μL于离心管中,并加入250 μL异丙醇,静置10min,4℃,12000r/min,离心10min。⑤弃去上清,沉淀用DEPC水配制的70%~75%乙醇洗2次。⑥用30 uLDEPC灭菌水溶解,放在-80℃保存。
2.2.5 RNA电泳检测(琼脂糖凝胶电泳)
具体操作步骤略。
2.2.6 RT-PCR
用实验室已购买好的试剂盒加入模板进行反应。
2.2.7 cDNA进行PCR
CP5′+MPR1为引物,应该得到500 bp;CP5′+PAV3R为引物,应该得到603 bp;PAV3F+dMPR1为引物,应该得到100 bp;ORF6+PAV3R为引物,应该得到391 bp(阴性对照只加入水,阳性对照分别加入冰箱内保存的1304、1306、1304 rtd质粒)。
2.2.8 cDNA进行电泳检测(琼脂糖凝胶电泳)
3 结果与分析
3.1 试验结果
3.1.1 小麦出现的症状
西农749表现出病毒感染的症状,张氏和小偃6号这两个品种表现出被病毒侵染的症状。
3.1.2 RNA电泳结果
提取的RNA每一大管分为两小管,进行电泳,结果如表1所示。
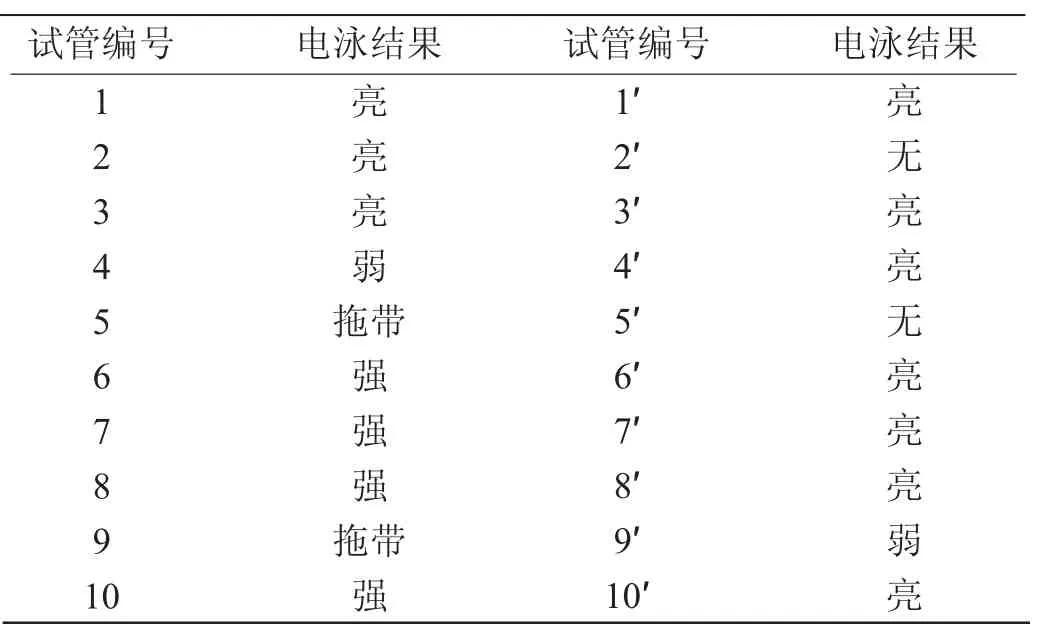
表1 RNA电泳结果表
3.1.3 反转录后进行电泳的结果
①以dMP1和PAV3R为引物进行反转录PCR,反转录成的cDNA经过PCR扩增,并将扩增产物进行电泳,没有出现条带。②以CP5′和PAV3R为引物进行反转录PCR,反转录成的cDNA经过PCR扩增,并将扩增产物进行电泳,3种质粒均出现大小稍微大于500 bp的条带。③以dMP1和PAV3F为引物进行反转录PCR,反转录成的cDNA经过PCR扩增,并将扩增产物进行电泳,3种质粒均出现大小为200 bp左右的条带。④以dMP1和PAV3R为引物进行反转录PCR,反转录成的cDNA经过PCR扩增,并将扩增产物进行电泳,3种质粒均出现大小600 bp左右的条带。
3.2 结果分析
由于试验具有随机性,又重复做了几次,反转录后进行PCR扩增后再电泳但都是出现类似结果,不能确定病毒的存在,无法对其进行分子生物学鉴定,所以试验得到的是负结果。
推测出现这种结果导致试验没有得出正结果的原因可能有以下几种:第一,试验过程中某些操作没严格执行,影响了结果;第二,反转录步骤出现了问题,只是转录了其中的一部分片段而且这一个片段的大小大于500 bp;第三,提取出的RNA为小麦RNA,并没有BYDV-PAV病毒的RNA,用农杆菌介导侵染小麦后病毒基因并没有得到复制和表达,而表现的症状是其他病毒引起的;第四,试验进行时外界环境不合适。
[1]晋治波.黄矮病毒GAV基因组全序列分析及运动蛋白介导的抗病毒小麦的研究[D].中国农业科学院植物保护研究所,2003.
[2]广和.世界大麦黄矮病研究概况[J].世界农业,1989,(7):38 241.
[3]吴云峰,李毅,魏宁生,等.大麦黄矮病毒的循回传播机理[J].西北农业大学学报,1997,25(6).
[4]常胜军,王锡锋,马占鸿,等.大麦黄矮病毒GAV株系外壳蛋白基因的克隆和序列分析[J].病毒学报,1999,15(4):1 000.
1005-2690(2016)08-0113-02
:S512.11;S435.12
:B
2016-07-12)

