人髓核细胞体外培养及冻存的实验研究*
薛鹏举,敖俊,赵利涛,郭明柯,吕海文,姬文慧,黄欢欢
(1.河南科技大学第二附属医院骨一科,河南 洛阳 471000;2.遵义医学院脊柱外科,贵州 遵义 563003;3.河南科技大学第二附属医院麻醉科,河南 洛阳 471000;4.河南科技大学第二附属医院病理科,河南 洛阳 471000)
临床论著
人髓核细胞体外培养及冻存的实验研究*
薛鹏举1,敖俊2,赵利涛1,郭明柯1,吕海文1,姬文慧3,黄欢欢4
(1.河南科技大学第二附属医院骨一科,河南 洛阳 471000;2.遵义医学院脊柱外科,贵州 遵义 563003;3.河南科技大学第二附属医院麻醉科,河南 洛阳 471000;4.河南科技大学第二附属医院病理科,河南 洛阳 471000)
目的研究颈椎手术所取髓核组织培养髓核细胞的可行性,适合作为种子的代次,冻存复苏是否影响其传代。方法测量传1~5代次髓核细胞免疫组织化学法照片光密度(OD)值,观察胞质内Ⅱ型胶原蛋白含量的差异。通过噻唑蓝(MTT)试验观察冻存(实验组)与未冻存(对照组)髓核细胞增殖活力的差异。通过免疫组织化学法观察冻存对髓核细胞胞质内Ⅱ型胶原蛋白含量的影响。结果①采用酶消化法可成功分离并培养出人髓核细胞,传1、2代细胞形态呈短梭型、三角形或多边形,传3代以后,细胞形态逐渐变为长梭型。②Ⅱ型胶原蛋白免疫组织化学法测OD值,传1与2代比较差异无统计学意义(P>0.05)。③实验组细胞胞质内Ⅱ型胶原蛋白免疫组织化学法测得OD值与对照组细胞比较,差异无统计学意义(P>0.05),实验组细胞与对照组细胞MTT比色法测OD值比较,差异无统计学意义(P>0.05)。结论①经颈椎手术取得的髓核组织,可体外培养出髓核细胞,并可获得传代细胞。②传1、2代髓核细胞胞质内Ⅱ型胶原蛋白含量差异较小,细胞形态分化不明显,适宜做髓核组织工程学种子细胞。③冻存复苏处理未能使髓核细胞胞质内Ⅱ型胶原蛋白含量减少,细胞增殖活力亦未降低。
髓核细胞;组织工程学;种子细胞;Ⅱ型胶原蛋白
腰腿痛的发病率正在不断增高,现阶段认为腰腿痛由椎间盘退行性变引起[1]。椎间盘退行性变存在高致残率[2-3]。髓核细胞数降低、胞质Ⅱ型胶原蛋白降低是椎间盘退行性变重要原因[4]。传统治疗方法可能造成椎间不稳、椎体间植骨不融合、医源性脊髓神经根损伤等后果[5],而且治疗费用对社会造成巨大的经济负担[6]。最新研究发现,组织工程学方法有望用于针对椎间盘退行性变的临床治疗[7],椎间盘组织工程学日益成为研究热点[8]。大量髓核细胞作为种子细胞是科研及临床的必要条件[9]。但现阶段多使用脊柱侧凸矫形术中切除的椎间盘,来源有限。腰椎间盘突出症患者虽较为常见,但患者年龄偏大,椎间盘内髓核组织存在老化及髓核细胞数量较少,体外培养困难。笔者发现临床因创伤引起的颈椎骨折患者较多,许多患者选择颈椎前路椎体次全切椎间植骨融合手术术式进行治疗。本实验采用酶消化法对所获椎间盘髓核组织进行研究。
1 资料与方法
1.1 人髓核细胞来源
选取2013年5月-2013年12月遵义医学院附属医院脊柱外科病区明确诊断为颈椎骨折,自愿选择颈椎前路椎体次全切椎间植骨融合手术术式并具备手术指证的患者,年龄≤45岁。排除标准:①血常规、肝肾功能、凝血功能异常者;②肝炎、梅毒、艾滋病患者;③因肿瘤、结核等原因引起的病理性骨折。受试者知情同意后,颈椎前路手术中,用生理盐水湿润纱布,包裹术中取出颈椎间盘髓核组织,放入无菌标本袋中,采集标本后30 min内进入实验程序。
1.2 主要实验试剂
F12-达尔伯克必需基本培养基(dulbecco's minimum essential medium,DMEM)(美国Hyclone公司),磷酸盐缓冲溶液(phosphate buffer saline,PBS)粉剂(北京中彬金桥公司),胰蛋白酶粉剂(北京索莱宝公司),Ⅱ型胶原蛋白酶粉剂(美国Sigma公司),4%多聚甲醛(北京博奥森生物工程有限公司),TritionⅩ-100(北京索莱宝公司),鼠抗人Ⅱ型胶原蛋白抗体浓缩液(北京中彬金桥公司),免疫组织化学法试剂盒(北京中彬金桥公司),双花扁豆凝集素显色试剂盒(dolichos bifows agglutinin,DBA)(北京中彬金桥公司);Clearmont封片剂(北京中彬金桥公司)。
1.3 实验方法
1.3.1 人颈椎间盘髓核细胞的取材与体外培养实验人员与纳入的患者沟通,签订同意书。全身麻醉下X线C臂定位伤椎平面。常规消毒铺巾,术者显露至病椎临近椎间盘,撑开钉固定椎间盘临近椎体并适当撑开,尖刃刀切开椎间盘,髓核钳夹出椎间盘纤维环及髓核组织,将组织用无菌生理盐水纱布包裹,放入无菌的标本袋内,交予实验人员。于30 min内运至细胞实验室,进入实验程序。用0.01 mol等渗PBS溶液反复冲洗术中所得组织表面血液,剪除纤维环,以及与髓核组织的交界组织,再用PBS反复冲洗髓核组织。将洗净的髓核组织置于无菌弯盘内,并剪成小块,体积约为1 mm3;用0.25%胰蛋白酶溶液3 ml,37℃消化20min。加入含胎牛血清(fetal bovine serum,FBS)的完全培养基3 ml,使胰蛋白酶的消化停止,5000r/min离心5min,倒除上清液。加入0.2%浓度的Ⅱ型胶原酶溶液3 ml,于37℃下消化4 h后终止消化,通过120目不锈钢网筛获得滤液,1 000 r/min离心5min,倒除上清液。PBS溶液悬浮细胞,1000 r/min离心5 min,倒除上清液,加入2 ml完全培养基悬浮细胞。取19μl悬浮细胞液,加入1μl 4%台盼兰染液,常规细胞计数板在倒置相差显微镜中计数。用完全培养基稀释细胞,调整密度为2×104个/ml时,将其移至25 cm2细胞培养瓶内。将培养瓶放置在孵箱中进行体外培养,培养条件为:37℃、5%二氧化碳CO2。5 d后为细胞第1次换液,此后每隔1 d换液1次,并在倒置相差显微镜镜下观察髓核细胞状况。用0.25%胰蛋白酶溶液消化贴壁率>80%的髓核细胞进行传代。将原代细胞、传2及传4代细胞以1× 104个/ml为密度移入24孔板中继续培养,获得传1代、传3代和传5代髓核细胞,于37℃、5%CO2孵箱中进行培养,每日消化3孔细胞。分别在第1~7天时,用血球计数板对髓核细胞计数,并据此绘制传代细胞的生长曲线。每日于倒置相差显微镜下观察传代细胞培养情况,对处于传代后生长对数期的髓核细胞进行于倒置相差显微镜拍照。
1.3.2 Ⅱ型胶原蛋白免疫组织化学法鉴定在6孔培养板的每个培养孔内放入盖玻片,将传1代细胞以2×104个/ml为密度培养,制备为传2代细胞爬片,隔1 d换液,每日观察培养的髓核细胞。细胞爬片以髓核细胞贴比率至30%为宜,用预弯的注射器针头挑出爬片。滴加4%多聚甲醛覆盖玻片,10 min后细胞爬片固定完毕。滴加2%TritionⅩ-100溶液,于37℃破膜10 min。应用免疫组织化学法染色试剂盒中山羊血清对髓核细胞爬片进行封闭,37℃条件下进行封闭10 min;加入经稀释后的一抗工作液,以使鼠抗人Ⅱ型胶原蛋白抗体与爬片上Ⅱ型胶原蛋白特异性结合,放置在4℃冰箱中,进行孵育过夜。加入免疫组织化学法染色试剂盒中辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠抗体工作液,37℃孵育15 min。使用DBA显色试剂盒中稀释后的DBA工作液,添加至液体覆盖细胞爬片静置15 min,滴加苏木素染液静置2 min,加入Clearmont进行封片处理。应用倒置相差显微镜观察染色情况,并每张爬片上随机选取10个视野进行拍照,胞质被染为黄棕色的细胞为髓核细胞。
1.3.3 细胞冻存与复苏将原代髓核细胞按是否做冻存复苏处理分为实验组和对照组。实验组细胞于-80℃冰箱中冻存2周后复苏,继续置于25 cm2培养瓶中培养,此时细胞为传1代髓核细胞。对照组细胞为未经冻存复苏的原代髓核细胞,继续置于CO2孵箱中继续培养2周后传代,此时细胞为传1代细胞。将两组细胞分别制备成传2代髓核细胞的细胞爬片,测量免疫组织化学法的平均光密度(optical density,OD)值;将两组细胞以1×104个/ml分别培养到96孔培养板中,应用噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]比色法在酶标仪中测OD值。消化离心原代髓核细胞,应用1ml细胞冻存液稀释髓核细胞,以1×106个/ml为密度移入冻存管内,在4℃、-20℃先后保存2 h后,置于-80℃冰箱冷冻保存。将实验组冻存的原代髓核细胞从-80℃冰箱迅速取出,并立即使用37℃水浴锅进行快速复苏。待完全解冻后,将细胞以1× 104个/ml培养在25 cm2培养瓶中,可得到传1代髓核。对照组细胞置于CO2孵箱中继续传代培养得到传1代髓核细胞。处理后,将两组分别制备传2代细胞爬片,应用Ⅱ型胶原蛋白为目的蛋白,行免疫组织化学法进行显色。将两组细胞以1×104个/ml分别培养在96孔培养板中,用MTT比色法测传2代细胞增殖活力。采用Image-Pro Plus 6.0软件测量平均每个髓核细胞OD值。在Image-Pro Plus 6.0软件中打开免疫组织化学法显色后的照片。在校准选项中选择强度选择标准OD曲线,在分割中吸取细胞内黄棕色区域,在测量指标选项中选择平均OD值,查看选项中点击统计得出的平均OD值。分别测量传1~5代的髓核细胞爬片免疫组织化学法照片中髓核细胞的OD值;分别测量两组传2代细胞爬片髓核细胞的OD值。
1.3.4 MTT比色法测OD值MTT比色法检测两组传2代细胞的增殖能力。两分别用细胞计数板计数,完全培养基稀释至1×104个/ml浓度的髓核细胞悬液。以每孔100μl细胞悬液用移液器培养在96孔的培养板中,置于CO2孵箱,以37℃、5%CO2为条件培养,每日换液,换液时每孔加完全培养基150μl。培养48 h后,单个培养孔内添加20μl MTT工作液。以37℃、5%CO2为条件孵箱内培养4 h。用移液器吸净各孔培养液,并避免将培养孔底部形成的结晶吸出,单个培养孔内打入150μl二甲基亚砜(dimethyl sulfoxide,DMSO)液。使用摇床调整为低速状态下,进行震荡大约10 min,溶解培养孔底部结晶物质。应用酶标仪在490 nm波长条件下,测各孔OD值,记录结果。
1.4 统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,不同代次的OD值比较,用单因素方差分析,两两比较用SNK法;两组标本密度值和OD值的比较,用两独立样本的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 髓核细胞鉴定
细胞形态呈短梭形或多边形,胞质内可见散在深色颗粒,细胞核较大形态明显(见图1A)。采用Ⅱ型胶原蛋白免疫组织化学法对传2代细胞进行鉴定,胞内显色为黄棕色为阳性,证实是髓核细胞(见图1B),设置同代次未添加一抗鼠抗人Ⅱ型胶原蛋白抗体的细胞爬片作阴性对照(见图1C)。
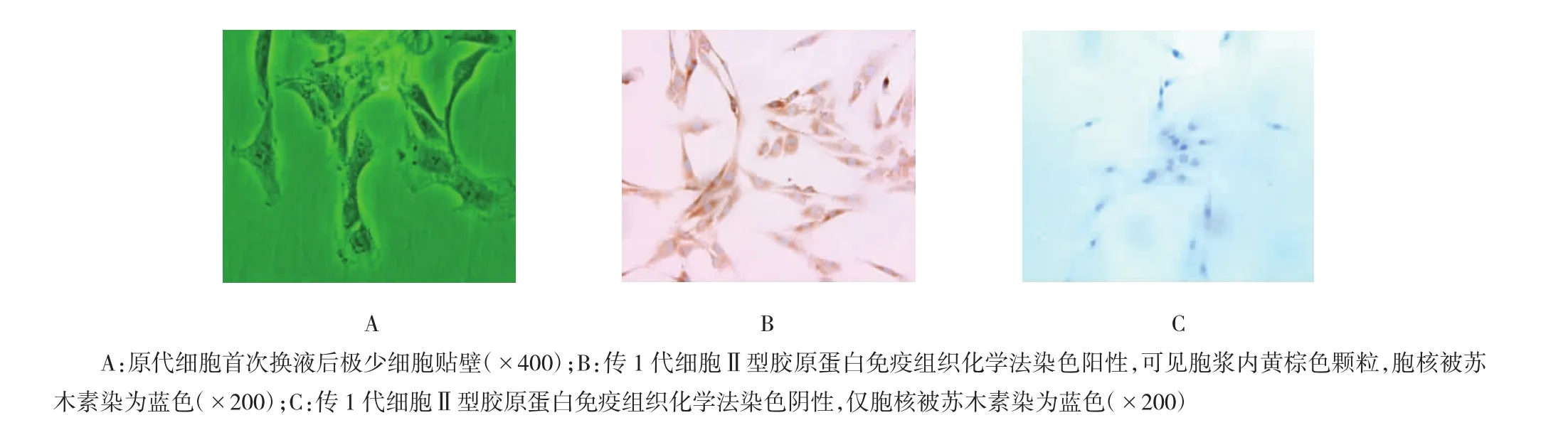
图1 髓核细胞形态学特征及免疫组织化学法鉴定(倒置相差显微镜及免疫组织化学法染色)
2.2 原代髓核细胞生长特点
酶消化法获得的原代细胞,需5 d才能观察到极少细胞的贴壁现象(见图2A)。但因为贴壁量少,使获得的传代和增殖的细胞种类纯净。第9天后细胞增殖迅速(见图2B),15 d细胞整体贴壁率>80%,局部细胞聚集(见图2C)。由传代髓核细胞生长曲线图可见,传代后第5天正处于细胞生长的对数期,故取第5天的髓核细胞拍照观察其形态学特征,且当髓核细胞持续传代使代次增加,其生长速度将变慢。传1、3和5代细胞较原代髓核细胞贴壁速度加快,1 d以内可以贴壁。形态学上传1代髓核细胞尚无形态变化,仍呈短梭形(见图2D)。部分传3代髓核细胞形态由短梭形变为长梭形(见图2E)。传5代髓核细胞长梭形细胞大量出现,胞质区域变小,增殖缓慢(见图2F)。

图2 原代与传代髓核细胞生长特点(倒置相差显微镜×100)
2.3 不同代次髓核细胞的OD值
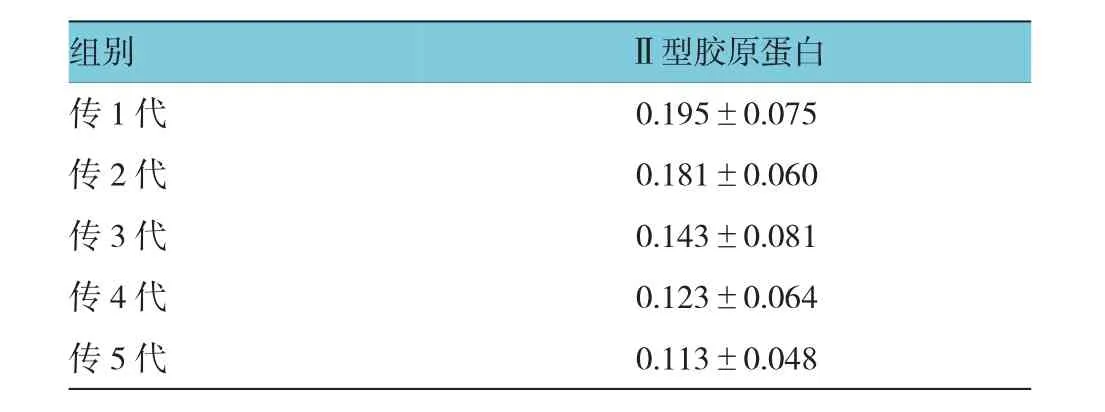
不同代次髓核细胞的OD值比较,经SNK法检验,差异有统计学意义(F=8.745,P=0.000)。传1与传2代之间髓核细胞OD值接近,差异无统计学意义(P=0.192),传3、4和5代之间髓核细胞OD值接近,差异无统计学意义(P=0.411)。见附表和图3。
附表不同代次髓核细胞Ⅱ型胶原蛋白含量比较(n=30±s)
附表不同代次髓核细胞Ⅱ型胶原蛋白含量比较(n=30±s)
组别Ⅱ型胶原蛋白传1代0.195±0.075传2代0.181±0.060传3代0.143±0.081传4代0.123±0.064传5代0.113±0.048
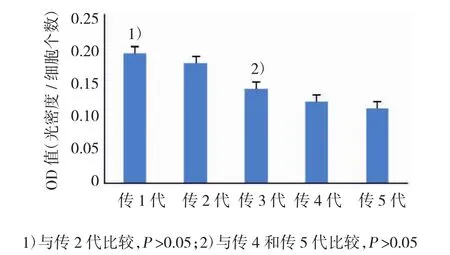
图3 不同代次髓核细胞Ⅱ型胶原蛋白含量OD值比较(±s)
2.4 冻存复苏处理对髓核细胞的影响
2.4.1 冻存复苏处理后细胞与未处理细胞的形态学比较未冻存复苏的传1代细胞生长呈短梭形或多边形(见图4A);用倒置相差显微镜下可见冻存复苏后的髓核细胞形态仍呈短梭形或多边形(见图4B)。复苏后的细胞与未冻存复苏的髓核细胞形态特点比较,无明显变化。

图4 冻存复苏处理后细胞较未处理的细胞的形态学比较(倒置相差显微镜×100)
2.4.2 MTT比色法检测的OD值冻存复苏处理的与未冻存复苏处理的髓核细胞OD值接近,实验组OD值为(0.180±0.045),对照组细胞OD值为(0.182±0.048),两组增殖能力比较,差异无统计学意义(t=0.133,P=0.895)。
2.4.3 免疫组织化学法显色的OD值冻存复苏处理与未冻存复苏处理的髓核细胞OD值接近,实验组OD值为(0.172±0.070),对照组细胞OD值为(0.183±0.071),两组胞质内Ⅱ型胶原蛋白含量比较,差异无统计学意义(t=0.499,P=0.620)。
3 讨论
本研究发现,经颈椎前路手术取得的髓核组织,可体外培养出的髓核细胞,并可获得传代细胞。传1、2代髓核细胞胞质内Ⅱ型胶原蛋白含量差异较小,细胞形态分化不明显,可能适宜做髓核组织工程学研究的种子细胞。冻存复苏处理未能使髓核细胞胞质内Ⅱ型胶原蛋白含量减少,细胞增殖活力亦未降低。
目前,治疗椎间盘退变方法包括牵引等非手术保守治疗,以及椎间盘摘除术、椎间融合术等手术治疗。近来来,国内外研究集中在采用组织工程学技术直接修复髓核,使椎间盘退行性变逆转。MEISEL等[10]成功延迟椎间盘退行性变进程。研究兔源性髓核细胞移植的WATANABE等[11]发现,髓核细胞移植可以使退变的椎间盘恢复同种异体椎间盘高度。髓核细胞合成Ⅱ型胶原蛋白能力下降,是椎间盘结构变化和功能减退的关键[12]。IWASHINA等[13]使用腺病毒SV40改善髓核组织内蛋白成分。然而,椎间盘种子细胞尤其是人髓核细胞培养较为困难[14]。髓核细胞本身在培养过程中,常常出现过早过多的老化现象[15]。髓核细胞从细胞分类上其实是一种类软骨细胞[16]。若持续传代则出现纤维样变,与原代细胞形态相差较大[17]。利用间充质干细胞分化诱导的特性,可能培养出大量的类似髓核细胞特征的细胞。韦葛堇等[18]发现骨髓间充质具备这一特性。而即使在非接触共培养的条件下,脐带间充质干细胞也有向髓核细胞分化的潜能[19]。方煌等[20]应用脂肪源性干细胞培养出椎间盘细胞。本研究成功从颈椎骨折且需颈椎前路手术患者的椎间盘组织提取分离出髓核细胞,一定程度上解决髓核组织来源匮乏的问题。该类组织来源的患者年龄不高,未发生椎间盘退行性变,髓核组织内髓核细胞量较多,且未发生髓核细胞的过度老化,仍有较强的增殖能力,具备合成和分泌Ⅱ型胶原蛋白等细胞外基质的能力。张荣峰等[21]用MTT比色法测不同代次髓核细胞增殖能力,发现传3代以后的髓核细胞的增殖能力明显下降。但未有文献对人各传代代次髓核细胞内Ⅱ型胶原蛋白水平进行检测。冻存是否影响髓核细胞增殖及Ⅱ型胶原蛋白表达亦未见文献报道。本研究通过比较不同代次体外培养的髓核细胞免疫组织化学法测得OD值的差异,可见传1、2代可用于做椎间盘组织工程学研究的种子细胞。冻存复苏处理并不能改变髓核细胞形态学特点、增殖活力及Ⅱ型胶原蛋白合成能力,可以正常传代,为椎间盘组织工程学优良种子细胞提供更广的来源,并为其存储方案提供实验依据。
关于髓核细胞的研究需要进一步完善的地方还有很多,如依据现有文献,涉及髓核细胞鉴定部分采用Ⅱ型胶原蛋白免疫组织化学法进行鉴定[22]。该方法虽然简便可靠,但是鉴定方法单一,有关髓核细胞的其他鉴定方法本身就是一个课题。除本文讨论部分提及的与干细胞共培养的基础研究方向,临床上还可以在伦理学许可基础上,使用干细胞经椎间孔镜入路植入椎间盘等方法,尝试治愈椎间盘突出等疾病。所以髓核细胞相关科学研究及临床试验有着广阔的空间。
[1]WOODS B L,VO N,SOWA G,et al.Gene therapy for intervertebral disk degeneration[J].Orthop Clin North Am,2011,42(4): 563-574.
[2]HOY D,MARCH L,BROOKS P,et al.Measuring the global burden of low back pain[J].Best Pract Res Clin Rheumatol, 2010,24(2):155-165.
[3]HOY D,BROOKS P,BLYTH F,et al.The Epidemiology of low back pain[J].Best Pract Res Clin Rheumatol,2010,24(6):769-781.
[4]BIBBY S R,JONES D A,LEE R B,et al.The pathophysiology of the intervertebral disc[J].Joint bone spine:revue du rhumatisme,2001,68(6):903-907.
[5]XIA X P,CHEN H L,CHENG H B.Prevalence of adjacent segment degeneration after spine surgery:a systematic review and Meta-analysis[J].Spine,2013,38(7):597-608.
[6]BECKER A,HELD H,REDAELLI M,et al.Implementation of a guideline for low back pain management in primary care:a cost-effectiveness analysis[J].Spine,2012,37(8):701-710.
[7]SMITH L J,CHIARO J A,NERURKAR N L,et al.Nucleus pulposus cells synthesize a functional extracellular matrix and respond to inflammatory cytokine challenge following long-term agarose culture[J].Eur Cell Mater,2011,22:291-301.
[8]O'HALLORAN D M,PANDIT A S.Tissue-engineering approach to regenerating the intervertebral disc[J].Tissue-engineering,2007, 13(8):1927-1954.
[9]李树文,武海军,银和平,等.Ⅱ型胶原酶消化结合组织块贴壁法分离培养兔髓核细胞[J].中国组织工程研究,2013,17(39):6861-6866.
[10]MEISEL H J,SIODLA V,GANEY T,et al.Clinical experience in cell-based therapeutics:disc chondrocyte transplantation A treatmentfordegeneratedordamagedintervertebraldisc[J]. Biomolecular Engineering,2007,24(1):5-21.
[11]WATANABE K,MOCHIDA J,NOMURA T,et al.Effect of reinsertion of activated nucleus pulposus on disc degeneration: an experimental study on various types of collagen in degenera tive discs[J].Connective Tissue Research,2003,44(44):104-108.
[12]FREEMONT A J.The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain[J].Rheumatology, 2009,48(1):5-10.
[13]IWASHINA T,MOCHIDA J,SAKAI D.Feasibility of using a human nucleus pulposus cell line as a cell source in cell transplantationtherapyforintervertebraldiscdegeneration[J]. Spine,2006,31(11):1177-1186.
[14]郭洪刚,马信龙.组织工程学策略再生椎间盘的研究进展[J].中国矫形外科杂志,2009,17(1):37-39.
[15]KIM K W,CHUNG H N,HA K Y,et al.Senescence mechanisms of nucleus pulposus chondrocytes in human intervertebral discs[J].Spine Journal Official Journal of the North American Spine Society,2009,9(8):658-666.
[16]GRUBER H E,STASKY A A,HANLEY E N.Characterization and phenotypic stability of human disc cells in vitro[J].Matrix Biology,1997,16(5):285-288.
[17]KLUBA T,NIEMEYER T,GAISSMAIER C,et al.Human anulus fibrosis and nucleus pulposus cells of the intervertebral disc:effect of degeneration and culture system on cell phenotype[J].Spine,2005,30(24):2743-2748.
[18]韦葛堇,黄育强,覃万安,等.髓核细胞共培养诱导骨髓间充质干细胞向类髓核细胞分化[J].中国组织工程研究,2013,17(45): 7834-7839.
[19]张燕,吴剑宏,王超锋,等.非接触式共培养体系对脐带间充质干细胞向类髓核细胞的诱导分化效应[J].脊柱外科杂志,2011,9(4): 249-252.
[20]方煌,解礼伟,陈安民,等.脂肪间充质干细胞向髓核样细胞诱导分化的初步研究[J].中国矫形外科杂志,2009,17(22):1729-1733.
[21]张荣峰,阮狄克,张超,等.不同代次成人正常髓核细胞的形态及生长动力学比较[J].脊柱外科杂志,2008,6(3):137-140.
[22]赵晨成,马迅,张明,等.人骨髓间充质干细胞与髓核细胞共培养后的类髓核分化效应及其对髓核细胞表型的调节作用[J].中国现代医生,2012,50(6):6-9.
(童颖丹 编辑)
Culture of human nucleus pulposus cellsin vitro and cryopreservation*
Peng-ju Xue1,Jun Ao2,Li-tao Zhao1,Ming-ke Guo1, Hai-wen Lyu1,Wen-hui Ji3,Huan-huan Huang4
(1.The First Department of Orthopedics,the Second Affiliated Hospital of Henan University of Science and Technology,Luoyang,Henan 471000,China;2.Department of Spine Surgery, the First Affiliated Hospital of Zunyi Medical College,Zunyi,Guizhou 563003,China;3. Department of Anesthesiology;4.Department of Pathology,the Second Affiliated Hospital of Henan University of Science and Technology,Luoyang,Henan 471000,China)
Objective To search for the best generation of the nucleus pulposus cells suitable as seed cells in tissue engineering,which come from the nucleus pulposus tissues of anterior cervical operation,and study the effects of cryopreservation and recovery process on typeⅡcollagen synthesis and proliferation of nucleus pulposus cells.Methods The mean optical density of the first,second,third,fourth and fifth generations of nucleus pulposus cells in immunohistochemical staining photographs was measured,so as to observe the difference between typeⅡcollagen content in cytoplasm.The primary nucleus pulposus cells were divided into groups A and B.The cells in the group A were frozen and the cells of the group B were not cryop-reserved.The proliferation activity of the nucleus pulposus cells in the group A and the group B was measured by MTT method and compared.The mean optical density values of immunohistochemical staining photos of the nucleus pulposus cells in the groups A and B were measured.Results Using enzyme digestion method, human nucleus pulposus cells were successfully extracted from the human nucleus pulposus tissues obtained from anterior cervical operation and cultured.The first and second generation cells were short fusiform,triangle or polygon.After the cells passaged to the third generation,they became spindle.The mean optical density of the first generation and the second generation of nucleus pulposus cells had no significant difference in the typeⅡcollagen immunohistochemical staining(P>0.05).There was no obvious statistical difference in the mean optical density of typeⅡcollagen between the two groups(P>0.05).There was no significant difference in optical density of MTT assay between the groups A and B(P>0.05).Conclusions The cells of the human nucleus pulposus tissues obtained from anterior cervical operation could be culturedin vitroand passaged cells could be obtained.The first and the second generations of nucleus pulposus cells have little difference in the content of intracellular typeⅡcollagen and unobvious cell morphological differentiation,and could act as seed cells of nucleus pulposus tissue engineering.The cryopreservation and recovery processing could not reduce the content of typeⅡcollagen in the cytoplasm or cell proliferation.
nucleus pulposus cell;tissue engineering;seed cell;typeⅡcollagen
R681.5
A
10.3969/j.issn.1005-8982.2016.23.011
1005-8982(2016)23-0053-06
2015-12-14
贵州省科技厅科学技术基金(No:黔科合J字20102179号)
敖俊,E-mail:ao00jun@163.com,Tel:13984989345

