MicroRNA-93在宫颈癌中的表达及其对细胞生物学行为的影响
林忠
(中南大学湘雅医院,湖南 长沙 410008)
临床论著
MicroRNA-93在宫颈癌中的表达及其对细胞生物学行为的影响
林忠
(中南大学湘雅医院,湖南 长沙 410008)
目的探讨microRNA-93(miR-93)在宫颈癌组织中的表达及其对宫颈癌细胞生物学行为的影响。方法收集2014年1月-2014年7月中南大学湘雅医院有完整病历资料的41例宫颈癌患者组织标本及对应癌旁组织,实时荧光定量-聚合酶链反应(qRT-PCR)检测宫颈癌组织中miR-93表达水平;采用脂质体转染法将miR-93模拟片段(mimic)转染入宫颈癌Hela细胞,恢复细胞内miR-93表达;活细胞计数试剂盒(CCK-8)和流式细胞术检测miR-93对宫颈癌Hela细胞增殖及凋亡的影响;Transwell小室法检测其对Hela细胞迁移及侵袭能力的影响;Western blot检测Hela细胞中上皮生长因子受体(EGFR)及其下游蛋白的表达量变化。结果41例宫颈癌患者肿瘤组织中miR-93表达量(0.048±0.013)低于癌旁组织(0.113±0.025),差异有统计学意义(P=0.026);转染miR-93模拟片段后,宫颈癌Hela细胞中miR-93表达恢复;与对照组和空白组比较,实验组宫颈癌细胞增殖能力下降(P=0.004),早期凋亡比例增加(P=0.032),侵袭(P=0.003)和迁移能力下降(P=0.003);过表达miR-93的Hela细胞EGFR及下游的p-AKT表达下降(P=0.005),而总AKT蛋白无明显变化(P=0.372)。结论miR-93在宫颈癌组织中的表达量下降,恢复其在宫颈癌细胞中的表达能够明显抑制其细胞增殖、迁移和侵袭,促进细胞凋亡,其机制部分与miR-93抑制宫颈癌细胞EGFR/AKT信号通路活性有关。
宫颈癌;microRNA-93;EGFR/AKT信号通路;生物学行为
宫颈癌是美国女性中第6位常见癌症,也是第2位常见的妇科肿瘤。美国平均每2 500例绝经妇女中就有1例宫颈癌,占因癌症死亡病例的5%~6%。为提高宫颈癌患者长期生存率,改善患者临床结局,降低宫颈癌发生风险,筛选和识别能够早期发现宫颈癌的生物标志物具有十分重要的意义[1]。
MicroRNA(miRNA)是一系列高度保守非编码RNA,其长度为18~25个核苷酸。近年来研究发现,癌组织中的miRNA表达异于正常组织,很多miRNA具有致肿瘤活性或肿瘤抑制活性[2-3],miRNA在致癌过程中起重要作用,可以作为宫颈癌诊断的生物标志物。
miR-93、miR-106b和miR-25属于同一个miRNA集群,即miR-106b-25[4],其参与多种细胞生物学过程[5-7]。此外,大量的实验表明miR-93在不同的人类恶性肿瘤中起重要作用。本研究通过检测miR-93在宫颈癌及其癌旁组织中的表达及对宫颈癌Hela细胞的主要生物学行为的影响,探讨miR-93在宫颈癌发生、发展中的作用及可能机制,为宫颈癌早期临床诊断和靶向治疗提供新的理论依据与方向。
1 资料与方法
1.1 研究对象
选取2014年1月-2014年7月中南大学湘雅医院经手术病理证实的原发性宫颈癌患者冻存的癌组织标本及相应的癌旁组织(距病灶2 cm的正常组织)标本共41例,均有完整病历资料。患者手术前均未行放射治疗、化学治疗、生物治疗等。釆用2009年国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)的临床分期标准,Ⅰ期10例,Ⅱ期8例,Ⅲ期23例;病理组织学分级中,高、中分化19例,低分化22例;患者年龄26~61岁,平均(46±12)岁。
1.2 细胞系
人宫颈癌细胞株Hela、siha、caski,c4-1和人正常宫颈上皮细胞株H8均购自中国典型培养物保藏中心(China Center For Type Culture Collection,CCTCC),细胞在37℃、含5%二氧化碳CO2的培养箱内,用含10%小牛血清的达尔伯克必需基本培养基(dulbecco's minimum essential medium,DMEM)高糖培基(美国Hyclone公司)培养,培养基中分别加入终浓度为100 mg/L的链霉素与青霉素,细胞贴壁生长24 h。细胞用0.05%胰蛋白酶-乙二胺四乙酸(ethylenedinitrilo tetraacetic acid,EDTA)消化传代,选取对数生长期细胞进行后续实验。
1.3 实时荧光定量聚合酶链反应检测miR-93表达水平
Trizol提取宫颈癌及宫颈癌细胞株总RNA,用miR-93检测试剂盒检测miR-93表达水平,取10 ng总RNA与3μl逆转录酶混合,在15μl反应体系中,16℃30 min,42℃30 min,85℃5 min,进行逆转录。而后将逆转录产物cDNA 150倍稀释,取2μl稀释的cDNA与2μl Taqman引物混合,在20μl反应体系中,95℃变性10 min,95℃变性15 s,60℃退火60 s,共40个循环。细胞中miRNA表达用U6sn RNA为内对照,相对miRNA表达水平用2-ΔΔCt计算改变倍数。
1.4 细胞培养及细胞增殖和周期分析
Hela宫颈癌细胞用含10%胎牛血清的DMEM培养基,在37℃、5%CO2条件下培养。传代培养至细胞对数生长期,随机将细胞分为对照组和实验组。采用脂质体转染法将miR-93 mimics和对照mimics分别转染实验组和对照组Hela细胞24 h后,细胞置无血清DMEM培养基中饥饿12 h后,换用DMEM完全培养基继续培养。12 h后离心收集细胞,弃上清,用预冷磷酸盐缓冲液(phosphate buffer solution,PBS)洗细胞2次,加入预冷70%乙醇,于4℃固定过夜。离心收集细胞,PBS洗细胞1次,加入PBS溴化乙啶染色液避光孵育30 min,流式细胞仪检测,活细胞计数试剂盒(cell counting kit-8,CCK-8)检测细胞增殖情况。
1.5 Transwell侵袭及迁移实验
Hela细胞转染后48 h,用无血清DMEM培养基饥饿16 h。调整细胞浓度为1×106个/ml,每个侵袭小室加100μl细胞悬液,每个侵袭小室下室加600μl含10%FBS的DMEM培养基。其中侵袭实验在小室接种细胞前一晚,Matrigen(基质胶)用无血清DMEM培养基稀释成浓度为1∶7,每个侵袭小室加60μl,而迁移实验不加基质胶。37℃、5%CO2培养箱中培养,侵袭实验28 h后再迁移实验20 h,取出小室用90%乙醇固定,0.1%结晶紫溶液染色,置于显微镜下观察并拍照,随机选取4个低倍视野(×100)进行细胞计数,并计算平均值。实验重复2次。
1.6 Western blot检测miR-93对ATK蛋白表达的影响
将两组细胞裂解后收集细胞,经超声机粉碎、离心,取上清液与上样缓冲液煮沸制成蛋白质样品。取等量样品依次经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electroph-oresis,SDS-PAGE),偏二氟乙烯膜(polyvinylidene fluoride,PVDF)(美国MilliPore公司)转膜,脱脂奶粉及Western blot封膜液封闭,然后分别加入AKT、p-AKT、表皮生长因子受体(epithelial growth factor receptor,EGFR)、磷酸化表皮生长因子受体(phospho-epithelial growth factor receptor,pEGFR)、兔抗大鼠多克隆抗体及大鼠抗β-actin单克隆抗体,再加入山羊抗兔及山羊抗鼠二抗,采用化学发光检测系统,将化学发光底物加于PVDF膜上,并在SYNGENE Chem Genius成像系统成像。
1.7 统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较用方差分析,若方差齐则组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-93在宫颈癌及宫颈癌细胞株中的表达
实时荧光定量聚合酶链反应(quantitative real time-polymerase chain reaction,qRT-PCR)检测41例宫颈癌及其相应癌旁组织中miR-93的表达,结果发现,miR-93在宫颈癌组织中的表达水平明显低于其相应癌旁组织(0.048±0.013vs0.113±0.025,P= 0.026)(见图1)。41例宫颈癌组织中,有29例miR-93表达水平低于其相应癌旁组织(70.73%,29/41)。qRT-PCR检测结果表明,宫颈癌细胞中miR-93的表达明显低于正常宫颈上皮细胞株H8,尤其是Hela细胞,后续功能实验均采用Hela细胞作为研究对象以分析miR-93对宫颈癌细胞生物学行为的影响(见表1和图2)。
表1 miR-93在宫颈癌细胞和正常宫颈上皮细胞中的表达±s)

表1 miR-93在宫颈癌细胞和正常宫颈上皮细胞中的表达±s)
组别Helasihacaskic4-1宫颈癌细胞0.017±0.0110.038±0.0120.042±0.0140.029±0.007正常宫颈上皮细胞株H80.072±0.0160.072±0.0160.072±0.0160.072±0.016 t值12.3749.4278.73510.162 P值0.0010.0100.0120.005
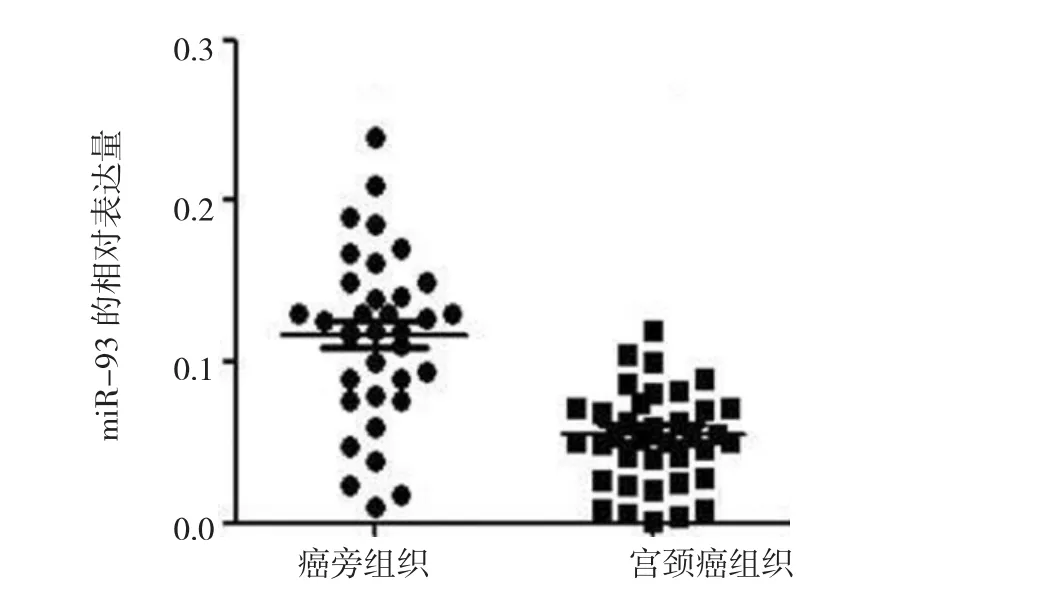
图1 miR-93在宫颈癌组织及其癌旁组织的表达(±s)
2.2 细胞转染
将miR-93 mimics转染Hela细胞,转染成功后,在荧光显微镜下可观察到绿色荧光。见图2。
2.3 miR-93对Hela细胞增殖的影响
Hela细胞转染miR-93 mimics 72 h后细胞增殖能力逐渐下降,实验组72、96和120 h的细胞增殖能力低于对照组和空白组(P=0.004)。见图3。
2.4 miR-93对Hela细胞凋亡的影响
空白组、对照组及实验组的凋亡率分别为(6.8± 0.8)%、(8.1±1.1)%和(15.3±1.5)%,对3组凋亡率进行随机方差分析后发现,3组间差异有统计学意义(t=7.246,P=0.027),空白组和对照组比较经单因素方差分析,差异无统计学意义(P=0.286);实验组和空白组比较,差异有统计学意义(P=0.032)。提示miR-93可促进Hela细胞凋亡。见图4。

图2 miR-93 mimics转染Hela细胞
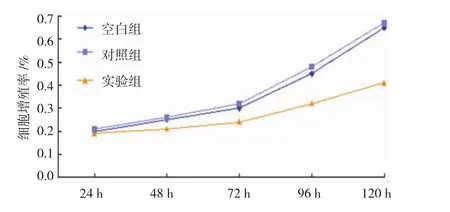
图3 转染miR-93 mimics后抑制Hela细胞生长(x±s)
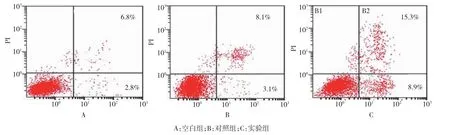
图4 miR-93过表达后对Hela细胞凋亡的影响
2.5miR-93对宫颈癌A2890细胞侵袭、迁移能力的影响
宫颈癌Hela细胞转染miR-93 mimics后,其迁移和侵袭功能受到明显影响。随机方差分析后发现3组细胞侵袭(t=6.472,P=0.031)和迁移(t=7.886,P=0.025)结果差异有统计学意义。实验结果表明,与对照组比较,实验组转染miR-93 mimics后,细胞的迁移(t=7.984,P=0.024)、侵袭(t=6.837,P=0.029)能力显著降低(见表2)。
表2 miR-93对Hela细胞迁移和侵袭的影响(±s)
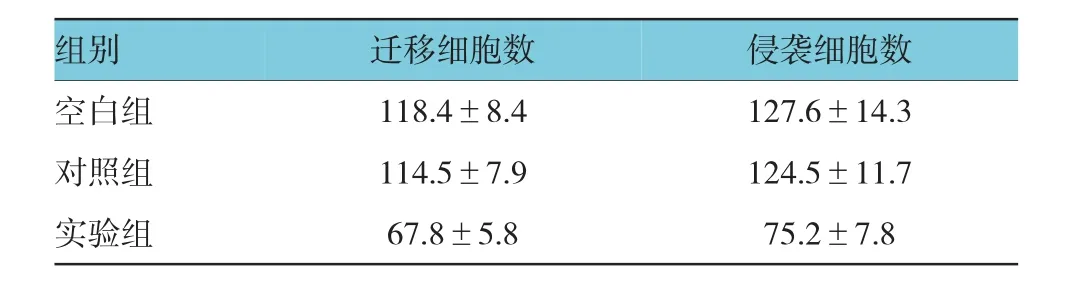
表2 miR-93对Hela细胞迁移和侵袭的影响(±s)
组别空白组对照组实验组迁移细胞数侵袭细胞数118.4±8.4127.6±14.3 114.5±7.9124.5±11.7 67.8±5.875.2±7.8
2.6miR-93表达对PTEN/PI3K/AKT信号通路的影响
本研究检测表达过miR-93后宫颈癌细胞中EGFR蛋白及其下游的AKT及p-AKT蛋白表达量的变化。Hela转染miR-93 mimics后细胞中p-EGFR及p-AKT蛋白表达下降(P=0.005),但是总的EGFR和AKT蛋白表达无明显变化(P=0.372),提示过表达miR-9后抑制宫颈癌细胞中EGFR/AKT信号通路的活性。见图5。

图5 Western blot检测miR-93对EGFR及AKT表达的影响(±s)
3 讨论
宫颈癌恶性程度高的主要原因是难以早期发现而且缺乏治疗晚期及复发患者的有效方法。因此,识别和发现能够早期诊断宫颈癌,并能协助优化和个体化治疗的预测性标志物对宫颈癌诊治具有十分重大的意义。目前已有大量研究证实,miRNAs发挥类似癌基因或抑癌基因作用。有学者建议将数种miRNAs作为宫颈癌的特异性标志,血液循环中miRNAs水平有望成为有价值的预后和诊断性生物标志物,如miR-200家族、miR-199/214簇或者let-7等。多种miRNAs都可能成为宫颈癌扩散或转移的治疗靶点,尽管还有很多困难尚未解决,但是miRNAs疗法可能是预防和治疗宫颈癌的有效手段。
miR-106b-25簇由高度保守的miRNA-106b(miR-106b)、miRNA-93(miR-93)和miRNA-25(miR-25)组成,以往研究表明在多种癌症中miR-106b-25簇过表达,如胃癌、前列腺癌、胰腺神经内分泌、成神经细胞瘤和多发性骨髓瘤等[8]。研究表明miR-106b-25 miRNA簇可作为原癌基因。许多研究还证实肿瘤形成的主要机制包括与MCM7协作进行靶向PTEN促使细胞增殖[9]。尽管证据表明miR-106b-25簇成员可作为原癌基因,但是在实际研究中发现miR-106b-25簇成员也能作为肿瘤抑制因子抑制肿瘤生长[10],这一矛盾的分子机制尚不清楚。
本研究结果显示,与癌旁正常宫颈组织比较,宫颈癌组织中miR-93表达显著降低。大量的研究表明miRNAs参与了各种类型人类肿瘤发生以及发展,与正常组织比较,肿瘤组织中miR-93是众多异常表达的miRNA之一。以往研究认为miR-93是致瘤miRNA,在小细胞肺癌[11]、骨肉瘤[12]、喉癌[13]和肝细胞癌等肿瘤中表达上调。然而TANG等[14]研究发现miR-93在结肠癌癌中的表达明显低于正常结肠黏膜组织,本研究中笔者也发现与癌旁正常宫颈组织比较,宫颈癌组织中miR-93表达水平显著降低,猜测miR-93在不同肿瘤中作用的差异可能是由不同的肿瘤异质性引起。
本实验转染miR-93 mimics至内源性低表达miR-93的宫颈癌Hela细胞,结果表明Hela细胞增殖、抗凋亡、侵袭和迁移能力下降,证实miR-93在宫颈癌中发挥抑癌作用。TANG等[14]研究也表明,miR-93过表达能抑制结肠癌细胞增殖、迁移和侵袭。此外,也有大量研究表明,抑制miR-93表达能够抑制宫颈癌、胃癌及神经胶质瘤等肿瘤细胞的增殖、抗凋亡、侵袭及迁移能力等。miR-93对不同肿瘤细胞的生物学影响不同,与不同肿瘤组织中miR-93表达也不同的研究结果相符合。提示考察miR-93的表达及临床意义应考虑肿瘤类型、肿瘤来源,等等,不能一概而论。
表皮生长因子受体位于细胞膜表面的糖蛋白,在宫颈癌细胞中异常活化,抑制EGFR活化可明显抑制宫颈癌细胞的增殖、侵袭,并促进宫颈癌细胞凋亡[15]。此外,大量研究表明miR-93的靶基因有EFGR、PTEN、RAD1、FGFR2S及酪氨酸蛋白激酶受体A4(ephrintype areceptor 4,EphA4)等。表皮生长因子受体信号通路在上皮恶性肿瘤包括宫颈癌中显得尤为重要。然而,EGFR信号通路是通过何种分子机制调节肿瘤进展的,仍然知之甚少。miR-93在多种肿瘤中呈低表达,能够激活EGFR信号通路,从而促使肿瘤的发生发展和侵袭转移。尽管基因芯片分析已经证实EGFR是miR-93的靶基因,但关于其在宫颈癌中的有关调控机制的报道仍少见。基于以上研究报道,本研究推测miR-93可能影响宫颈癌细胞EGFR/AKT信号通路活性。本实验研究分析miR-93过表达对宫颈癌细胞Hela、EGFR、p-EGFR、AKT及p-AKT表达的影响,结果表明过表达miR-93后细胞中p-EGFR、p-AKT表达量明显下降,但是总AKT和EGFR蛋白表达无明显变化。miR-93通过靶向抑制EGFR活性,阻断EGFR/AKT信号通路活,从而抑制宫颈癌细胞的生物学行为。
[1]特日格乐,苏尼尔,金焰.宫颈癌分子诊断标记物的研究进展[J].国际遗传学杂志,2014,37(3):12-16.
[2]NAHVI A,SHOEMAKER C J,GREEN R.An expanded seed sequencedefinitionaccountsforfullregulationofthehid 3'-UTR by bantam miRNA[J].Rna,2009,15(5):814-822.
[3]孙海婷.microRNA作用靶基因的预测[J].科技创新与应用,2013, 16(23):57-58.
[4]LIU X,SIU K,LIU S,et al.Epigenetic silencing of microRNA-199b-5p is associated with acquired chemoresistance via activation of JAG1-Notch1 signaling in cervical cancer[J].Oncotarget,2014,5(4):944-958.
[5]PARIKH A,LEE C,JOSEPH P,et al.MicroRNA-181a has a critical role in ovarian cancer progression through the regulationof the epithelial-mesenchymal transition[J].Nature Communications, 2014,3(5):2977.
[6]PETROCCA F,VECCHIONE A,CROCE C M.Emerging role of miR-106b-25/miR-17-92 clusters in the control of transforming growth factor β signaling[J].Cancer Research,2008,68(20):8191-8194.
[7]ZHAO Z,BAI J,ZHOU Q,et al.TSA suppresses miR-106b-93 -25 cluster expression through downregulation of MYC and inhibits proliferation and induces apoptosis in human EMC[J].PLoS One,2012,7(9):DOI:10.1371/journal.pone.0045133.
[8]XU D,HE X X,CHANG Y,et al.Downregulation of miR-93 expression reduces cell proliferation and clonogenicity of HepG2 cells[J].Hepato-gastroenterology,2011,59(120):2367-2373.
[9]CHEN L,JIANG M,YUAN W,etal.Prognostic value of miR-93 overexpression in resectable gastric adenocarcinomas[J]. Acta Gastroenterol Belg,2012,75(1):22-27.
[10]LI Y,TAN W,NEO T W L,et al.Role of the miR-106b-25 microRNA cluster in hepatocellular carcinoma[J].Cancer Science,2009,100(7):1234-1242.
[11]蔡静清,王宁,张敏.非小细胞肺癌血浆miR-223,miR-93和miR-218的表达及其临床意义[J].临床肿瘤学杂志,2014,19(12): 1075-1080.
[12]MONTANINI L,LASAGNA L,BARILI V,et al.MicroRNA cloning and sequencing in osteosarcoma cell lines:differential role of miR-93[J].Cellular oncology,2012,35(1):29-41.
[13]王培蓓,曹影,马荧雪,等.MiR-193a-3p对人Hep-2喉癌细胞增殖、凋亡及侵袭的影响[J].江苏医药,2014,11(8):875-878.
[14]TANG Q,ZOU Z,ZOU C,et al.MicroRNA-93 suppress colorectal cancer development via Wnt/β-catenin pathway downregulating[J].Tumour Biol,2015,36(3):1701-1710.
[15]张爱臣,张晓红,冷维春,等.EGFR在宫颈癌中的表达及其临床意义[J].中国实验诊断学,2007,11(2):166-169.
(申海菊 编辑)
Characterization of miR-93 expression and investigation of its biological function in cervical cancer
Zhong Lin
(Xiangya Hospital of Central South University,Changsha,Hunan 410008,China)
Objective To investigate the expression level of miR-93 in cervical cancer tissues and its effects on the biological functions of the cancer cells.Methods Forty-one paired cervical cancer tissues and adjacent normal tissues were collected from Xiangya Hospital of Central South University from Jan.2014 to Jul.2014,and all the collected tissues had complete medical records.Using qRT-PCR,the expression of miR-93 was explored in the 41 paired cervical cancer tissues and adjacent normal tissues.miR-93 mimic was transfected into cervical cancer Hela cells to restore the expression of miR-93.The proliferation and apoptosis effects of miR-93 on Hela cells were evaluated by cell counting kit-8(CCK-8)and flow cytometry, respectively.Moreover,the migration and invasion of transfected Hela cells were detected by Transwell chamber assay.Western blot was used to measure the expressions of EGFR and its downstream protein in the Hela cells.Results The expression of miR-93 was significantly decreased in the 41 cervical cancer tissues compared with the adjacent normal tissues[(0.048±0.013)vs(0.113±0.025),P=0.026].By transfection of miR-93 mimic fragment,miR-93 expression recovered in the cervical cancer Hela cells.Overexpression ofmiR-93 through exogenous transfection with miR-93 mimic significantly suppressed cell proliferation(P= 0.004),induced cell apoptosis(P=0.032),and inhibited cell migration and invasion(P=0.003).Moreover, miR-93 overexpression of Hela cells significantly suppressed the expressions of EGFR and its downstream p-AKT(P=0.005),while did not influence the expression of total AKT(P=0.372),which suggested that overexpression of miR-93 significantly suppressed the EGFR/AKT signaling pathway in cervical cancer cells. Conclusions The expression of miR-93 is significantly decreased in cervical cancer tissues.Restored expression of miR-93 could suppress cell proliferation,migration and invasion,and induce cell apoptosis through,at least partially,suppression of EGFR/AKT signaling pathway.
cervical cancer;miR-93;EGFR/AKT signaling pathway
R737.33
A
10.3969/j.issn.1005-8982.2016.23.010
1005-8982(2016)23-0047-06
2015-10-23

