番红花球茎组培中的消毒和褐化抑制方法
袁校文,项会敏,朱梦梦,苏永君,田长城 (蚌埠学院生物与食品工程系,安徽蚌埠 233000)
番红花球茎组培中的消毒和褐化抑制方法
袁校文,项会敏,朱梦梦,苏永君,田长城*(蚌埠学院生物与食品工程系,安徽蚌埠 233000)
[目的] 优化番红花球茎消毒和褐化抑制的方法。[方法] 以番红花球茎的染菌率、褐化率和愈伤组织诱导率为指标,分析了外植体大小、氯化汞浓度和消毒时间对番红花球茎染菌和诱导的影响,同时比较了抗坏血酸和活性炭对番红花球茎褐化的抑制效果。[结果] 当外植体大小5 mm3,氯化汞溶液浓度0.2%、消毒时间10 min时,染菌率和诱导率较为适宜;向培养基中加入0.5 g/L活性炭可以降低球茎的褐化。[结论]该研究建立了番红花球茎消毒和褐化抑制方法,为野外番红花球茎的初代组培提供了理论依据。
番红花;球茎;消毒;褐化
番红花(CrocussativuslL.)为鸢尾科番红花属多年生草本植物,又名藏红花、西红花,原产于西班牙、希腊、南欧以及伊朗等地,经印度传入我国,目前我国江浙和华北地区均有栽培[1]。番红花可作为调味剂、香料和染料,其花柱中富含藏红花酸(crocetin)和藏红花素(crocin)等活性成分,具有活血化瘀、舒经理络、消肿止痛等功效,在我国传统和现代医药中具有广泛的应用[2]。
番红花的种植主要依靠球茎进行无性繁殖,多次分球种植后,球茎中积累了大量的病毒和微生物,极大地影响作物的产量和质量[3]。为了解决此问题,研究者以番红花球茎为外植体进行组织培养,诱导愈伤组织和丛生芽[4-6]。在实际工作中,野外来源球茎外植体的高染菌率和褐化是妨碍球茎组培顺利进行的2个棘手问题。笔者以染菌率、褐化率和愈伤组织诱导率作为评价标准,分析了不同因素对番红花球茎组培中染菌及褐化的影响,以期寻求一种有效地抑制番红花球茎染菌和褐化的方法。
1 材料与方法
1.1 试剂和材料2,4-二氯苯氧乙酸(2,4-D)和6-苄胺基腺嘌呤(6-BA)购自国药集团;其他化学试剂均为化学纯。番红花球茎购自浙江省湖州市种植基地。
1.2 方法
1.2.1球茎的预处理。 去除番红花球茎外的皮膜,用自来水冲洗6 h,去除病斑后,无菌水浸泡10 min,滤纸滤干后置入2 %的次氯酸钠溶液中消毒10 min,无菌水洗涤4~6次,滤纸吸干表面水分,备用。
愈伤组织诱导培养基:MS+2.0 mg/L 2,4-D+0.5 mg/L 6-BA[7]。每瓶2个外植体,每个处理40瓶。培养温度为(23±2)℃,光照时间为12 h/d。计算外植体的染菌率、褐化率和愈伤组织诱导率,计算公式:
染菌率=(染菌个数/接种个数)×100%
褐化率=(褐化个数/接种个数)×100%
愈伤组织诱导率=(愈伤组织发生个数/接种个数)×100%
1.2.2染菌的抑制方法。
1.2.2.1外植体大小的影响。 将球茎切成2、5和10 mm3的块状体,置入70%乙醇溶液中10 s,分别用质量浓度0.2%的氯化汞溶液消毒10 min,无菌水洗涤5次,每次5 min,滤纸吸干后接入愈伤组织诱导培养基中,统计染菌率和愈伤组织诱导率。
1.2.2.2氯化汞浓度的影响。将球茎切成5 mm3的块状体,置入70%乙醇溶液中10 s,分别用质量浓度0.1%、0.2%和0.3%的氯化汞溶液消毒10 min,无菌水洗涤5次,每次5 min,滤纸吸干后接入愈伤组织诱导培养基中,统计染菌率和愈伤组织诱导率。
1.2.2.3消毒时间的影响。将球茎切成5 mm3的块状体,置入70%乙醇溶液中10 s,分别用质量浓度0.2%氯化汞溶液消毒5、10、15和20 min,无菌水洗涤5次,每次5 min,滤纸吸干后接入愈伤组织诱导培养基中,统计染菌率和愈伤组织诱导率。
1.2.3褐化的抑制方法。
1.2.3.1抗坏血酸的抑制作用。 将球茎切成5 mm3的块状体,置入70%乙醇溶液中10 s,用质量浓度0.2%氯化汞溶液消毒10 min,无菌水洗涤5次,吸干表面水分,分别用0.5、1.0和2.0 mg/ml的抗坏血酸溶液(无菌水配制)浸泡5、10和15 min,然后接入诱导培养基中。设置空白组,统计外植体的褐化率和愈伤组织诱导率。
1.2.3.2活性炭的抑制作用。将球茎切成5 mm3的块状体,置入70%乙醇溶液中10 s,用质量浓度0.2%氯化汞溶液消毒10 min,无菌水洗涤5次,吸干表面水分,接入分别加入0、0.5、1.0和2.0 g/L活性炭的诱导培养基中,统计外植体的褐化率和愈伤组织诱导率。
2 结果与分析
2.1 外植体大小的影响由图1可知,番红花球茎外植体具有较高的染菌率,且随着外植体体积的增大,球茎外植体染菌率逐渐升高。在第30天时,5 mm3外植体的染菌率为35%,愈伤组织诱导率为40%,优于其他试验组。

图1 外植体大小对染菌和愈伤组织诱导的影响
2.2 氯化汞浓度的影响由图2可知,氯化汞质量浓度与染菌率呈显著的负相关;当其浓度为0.2%时,球茎的诱导率最高,是较理想的消毒浓度。
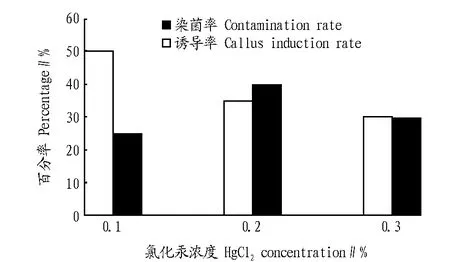
图2 氯化汞浓度对染菌和愈伤组织诱导的影响
2.3 消毒时间的影响由图3可知,利用氯化汞消毒时,消毒时间对染菌率的影响很大。当消毒时间为5 min时,染菌率达60%,进而造成了较低的诱导率。当消毒时间在10 min以上时,染菌率基本保持不变,但诱导率随消毒时间延长呈显著的负相关。因此,采用0.2%的氯化汞溶液对番红花外植体消毒10 min较为合适。

图3 消毒时间对染菌和愈伤组织诱导的影响
2.4 抗坏血酸对褐化的影响利用抗坏血酸溶液预处理番红花球茎,不同浓度和处理时间下球茎的褐化情况见表1。由表1可知,1.0 mg/mL抗坏血酸溶液浸泡球茎30 min,褐化率和诱导率分别为10.0%和45.0%,显著优于未处理组。

表1 抗坏血酸对番红花球茎褐化的影响
2.5 活性炭对褐化的影响由图4可知,培养基中加入一定量的活性炭可以显著降低褐化的发生,同时促进愈伤组织的发生。
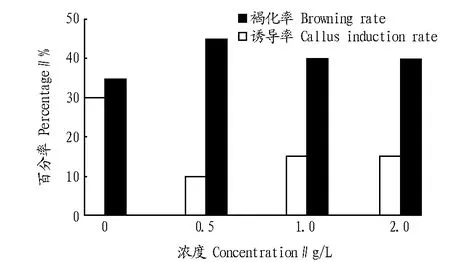
图4 活性炭对番红花球茎褐化的影响
3 结论与讨论
球茎是一种节间缩短膨大为球形的肉质地下变态茎,多为植物的无性繁殖器官。由于球茎深植于土壤中,含有大量的病毒和微生物。在利用野外球茎作为外植体进行组培时,有效的消毒方法成为试验成功的关键步骤。外植体消毒多利用一些化学试剂,如氯化汞、次氯酸钠、抗生素和乙醇等。在消除外植体表面微生物时,消毒剂对外植体细胞也具有破坏作用[8]。笔者前期研究发现,乙醇或氯化汞均会破坏原球茎的叶绿体,导致外植体黄化。因此,外植体消毒时要选择合适的消毒剂,同时要控制消毒剂浓度和消毒时间,兼顾染菌率和诱导率。
在植物组培过程中,消毒剂的使用、培养基的组分以及植物自身的特性均会诱导褐化的发生。褐化会降低植物细胞的活力,影响愈伤组织的形成。研究表明,在培养基中添加适量抗坏血酸(0.01~0.20 mg/L)可以降低褐化的发生率[9]。值得注意的是,加入抗坏血酸的培养基进行高压灭菌后,胶凝剂(琼脂)难以凝固。刘真华等[10]研究发现,蝴蝶兰组培过程中,活性炭的添加可以有效控制褐化发生,同时促进外植体的生长,与该研究结果一致。
[1] 刘辉辉,毛碧增.藏红花药理作用及组织培养研究进展[J].药物生物技术,2014,21(6):593-596.
[2] 邓颖,郭志刚,曾兆麟,等.藏红花的药理研究进展[J].中国中药杂志,2002,27(8):565-568.
[3] 李军,高广春,李白,等.植物组培脱毒技术及其在药用植物藏红花中的应用[J].生物技术通报,2014(7):44-48.
[4] 陈书安,王晓东,欧阳杰,等.藏红花球茎愈伤组织快速诱导的研究[J].中国药学杂志,2003,38(4):254-256.
[5] 陈明亮,张丽丽,秦路平,等.藏红花愈伤组织的诱导[J].安徽农业科学,2016,44(3):123-125.
[6] 汪洋,韩婷,朱昱,等.番红花组织培养及快速繁殖研究[J].中草药,2009,40(5):807-809.
[7] 袁丽红,陆玉婷,黄晶.藏红花愈伤组织诱导和褐化抑制[J].南京工业大学学报(自然科学版), 2009,31(6):22-26.
[8] 刘丽娟,李红梅,刘雪莲.不同处理方法对外植体消毒效果比较研究[J].北方园艺,2009(10):86-87.
[9] 李丽,张湮帆,何康,等.两种红豆杉植物的愈伤组织培养及褐化抑制[J].复旦学报(自然科学版),2006,45(6):702-707.
[10] 刘真华,葛红,郭绍霞,等.蝴蝶兰组织培养中的褐化控制研究[J].园艺学报,2005,32(4):732-734.
Methods for Disinfection and Browning Inhibition ofCrocussativusL. Corm in Tissue Culture
YUAN Xiao-wen, XIANG Hui-min, ZHU Meng-meng, TIAN Chang-cheng*et al (Department of Biology and Food, Bengbu College, Bengbu, Anhui 233000)
[Objective] To optimize the methods for disinfection and browning inhibition ofCrocussativusL. corm. [Method] With contamination rate, browning rate and callus induction rate ofC.sativuscorm as the indexes, we analyzed the effects of explant size, HgCl2concentration and disinfection time on the contamination and induction of corm. Meanwhile, the inhibition effects of ascorbic acid and active carbon on the browning of the corm were compared, respectively. [Result] The contamination rate and the callus induction rate were suitable under the conditions of 5 mm3explant size, 0.2% HgCl2concentration and 10 min disinfection time. The browning rate of the corm was lowered as the active carbon (0.5 g/L) was added into the culture medium. [Conclusion] The methods for disinfection and browning inhibition provide certain practical evidence for the original tissue culture of wildC.sativuscorm.
CrocussativusL.; Corm; Disinfection; Browning
安徽省大学生创新创业项目(AH201411305063)。
袁校文(1992- ),男,安徽安庆人,本科生,专业制药工程。*通讯作者,讲师,博士,从事农产品加工及贮藏研究。
2016-09-21
S 504.3
A
0517-6611(2016)30-0108-02

