抗氧化黑豆肽的分离纯化与结构鉴定
刘恩岐 巫永华 高兆建 张建萍
(徐州工程学院 江苏省食品资源开发与质量安全重点建设实验室,徐州 221008)
抗氧化黑豆肽的分离纯化与结构鉴定
刘恩岐 巫永华 高兆建 张建萍
(徐州工程学院 江苏省食品资源开发与质量安全重点建设实验室,徐州 221008)
以氧自由基清除能力(ORAC)为评价指标,通过超滤与大孔树脂吸附、乙醇分级洗脱对黑豆蛋白酶解产物进行初步分离,采用Sephadex G-25凝胶过滤色谱、反相高效液相色谱(RP-HPLC)与排阻色谱(SEC)逐级纯化,最终得到RP-HPLC P2组分SEC P2肽段和RP-HPLC P4组分SEC P3肽段2个纯化多肽,质量浓度为1 mg/mL的2个纯化多肽的ORAC 值(Trolox当量)分别为307.5和314.6 μmol/L,其氧自由基清除能力分别是超滤分离抗氧化最强黑豆肽组分(Mr<1 000)的2.68和2.74倍,经Edman降解、N-端测序进行结构鉴定,纯化后的2个抗氧化肽段的氨基酸组成序列结构分别为Tyr-Asn-Ile和Trp-Asn-Pro,N-端分别为具有酚羟基结构的酪氨酸Tyr和疏水性很强的色氨酸Trp。
黑豆肽 氧自由基清除能力 分离纯化 结构鉴定
按照自由基生物学理论,人体器官和细胞组织会不同程度地产生各种自由基,引起机体组织和细胞的氧化损伤和功能损害,适当补充具有自由基清除功能的抗氧化物质,能够抵御自由基造成的细胞氧化和机体损伤危害,提高人体组织器官的抗氧化水平[1-3]。食物蛋白和氨基酸普遍具有一定的抗氧化活性,且多肽的抗氧化能力优于蛋白质和氨基酸[4-6]。研究发现,大豆蛋白酶解物中由3~7个氨基酸组成的一些相对分子质量<700的小分子肽,抗氧化较强的疏水性氨基酸侧链基团暴露出来,可以更好地发挥抗氧化功能[7-11]。据报道,黑豆蛋白的氨基酸组成与普通大豆基本一致,且蛋白质和疏水性氨基酸含量均明显高于普通大豆蛋白,具有生物活性肽类产品开发优势[12-13]。
超滤和大孔吸附树脂吸附分离具有设备简单、操作方便等优点,已被广泛应用于生物活性肽的初级分离[14]。色谱分离具有分离效率高、不会造成被分离物质的变性等特点,是目标功能肽分离纯化的有效方法,既可以用于试验分析研究,也可用于少量样品的制备[15]。氧自由基清除能力(oxygen radical absorbance capacity,ORAC)是国际上应用范围较广的体外抗氧化活性检测方法之一,具有生物相关性强、灵敏度高、稳定性与重现性好等特点,2004年在第一届抗氧化方法国际会议上被推荐为抗氧化活性评价的标准方法之一[16-18]。本试验采用碱性蛋白酶(Alcalase)、中性蛋白酶(Neutrase)和风味蛋白酶(Flavourzyme)对黑豆蛋白进行组合水解,以ORAC值为抗氧化评价指标,通过超滤和大孔树脂分离获得抗氧化活性较强的黑豆蛋白肽粗品,采用凝胶过滤 (GFC)、反相高效液相 (RP-HPLC)与排阻色谱(SEC)等进一步逐级纯化,得到高纯度的抗氧化肽段,通过Edman降解与蛋白肽N-端测序对抗氧化肽一级结构进行鉴定,以期探讨肽链一级结构与抗氧化活性的构效关系。
1 材料与方法
1.1 材料与试剂
黑豆蛋白酶解物粗粉:将黑豆蛋白依次采用Alcalase酶水解30 min(60 ℃,pH 8.5),Neutrase酶水解60 min(50 ℃,pH 7.0),Flavourzyme酶水解30 min(50 ℃,pH 6.0),不同酶在底物上的作用位点不同,提高了酶解液的水解度和多肽含量[19]。于4 000r/min离心10min取上清液,冷冻干燥得到黑豆蛋白酶解物粗粉,相对分子质量≤5 000的多肽含量87.6%,具有较强的抗氧化活性。
Alcalase、Neutrase和Flavourzyme蛋白酶:丹麦诺维信(中国)生物技术有限公司;DA201-C大孔树脂:江苏苏青水处理工程集团有限公司;荧光素钠(FL)、自由基产生剂2,2’-偶氮二异丁基脒二盐酸盐(AAPH)、抗氧化标准物质Trolox:美国Sigma-Alorich公司;聚凝胺、PTH-氨基酸标品(PTH-AA)玻璃纤维膜、PTFE滤膜:日本岛津公司。
1.2 仪器与设备
Labscale TFF小型切向流超滤系统:美国Millipore公司; Synergy H1全功能酶标仪:美国BioTek公司;KTA蛋白纯化系统、Sephadex G-25凝胶过滤色谱柱。
1.3 氧自由基清除能力(ORAC)的测定
参考曹亚兰等[20]和Blanca H L等[21]的方法并修改,配制pH 7.4、75 mmol/L的磷酸氢二钾、磷酸二氢钾磷酸盐缓冲液,用磷酸盐缓冲液配制1 mg/mL的黑豆肽溶液、10 μmol/L的FL溶液和100 mmol/L的AAPH溶液。在96孔酶标板中,依次加入25 μL黑豆肽样品、25 μL FL溶液,空白以25 μL缓冲液磷酸代替样品,然后用多道移液器迅速加入150 μL AAPH溶液诱发荧光淬灭反应。将酶标板置于酶标仪振荡8 s,振荡幅度4 mm,以激发波长485 nm,发射波长535 nm于37 ℃条件下进行连续测定,每1 min测定1次各微孔的荧光强度,测定时间设定在荧光衰减呈基线后为止。应用BioTek全功能酶标仪Gen5数据分析软件得出荧光衰减曲线(荧光强度-时间)下面的面积(AUC),通过黑豆肽荧光衰减曲线的保护面积(netAUC)与标准抗氧化物质Trolox的netAUC值比较,以Trolox当量(μmol/L)表示黑豆肽的ORAC值。
netAUC=AUC抗氧化物质-AUC空白
1.4 抗氧化黑豆肽的分离纯化
1.4.1 超滤及大孔树脂分离
通过截留相对分子质量为1 000、3 000和5 000的超滤膜对黑豆蛋白酶解物粗粉水溶液进行分离,采用DA201-C树脂对抗氧化活性较强的黑豆蛋白肽超滤组分进行充分吸附,依次用体积分数为25%、50%、75%和100%乙醇洗脱3 h,按疏水性大小分离获得ORAC值相对最强的黑豆蛋白肽粗品[22]。
1.4.2 Sephadex G-25凝胶过滤分离纯化
1.4.3 反相高效液相色谱分离纯化
将Sephadex G-25分离所得ORAC值最强的组分用含0.06%TFA的超纯水溶解,12 000 r/min离心10 min,取上清;采用RP-HPLC法进一步纯化,收集各洗脱峰,冷冻干燥,测定筛选抗氧化活性高的黑豆肽组分。
色谱柱:Zorbax SB-C18;进样体积:500 μL;平衡缓冲液:0.06%TFA;洗脱缓冲液:含0.05%TFA的乙腈;梯度:0%~100% Bover 6 Column volumes;流速:0.8 mL/min;检测:214 nm。
1.4.4 排阻色谱分离纯化
将RP-HPLC分离所得ORAC值最强的组分用pH 8.6 Tris-HCl 溶液溶解,12 000 r/min离心10 min,取上清;采用SEC法分离和纯度检验。
色谱柱:Superdex Peptide 10/300 GL;进样体积:500 μL;平衡缓冲液:pH 8.6,50 mmol Tris-HCl,300 mmol NaCl;梯度:等梯度1.5个柱体积;流速:0.5 mL/min;检测:214 nm。
1.5 多肽氨基酸序列测定
参照刘晶等[23]的方法采用PPSQ-31A蛋白测序仪测定抗氧化黑豆肽的氨基酸序列结构。采用Edman降解法从多肽的N-端按顺序将氨基酸逐个切下,将切下的氨基酸与异硫氰酸苯(PITC)反应,生成易于检测的PTH氨基酸,采用柱前衍生的液相色谱分析,进行多肽的氨基酸序列分析。
样品处理:将纯样品12 000 r/min离心10 min,取上清;将聚凝胺15 μL加到玻璃纤维膜上,氮气吹干;将玻璃纤维膜上机预处理,即运行5个循环;将纯样品点加到预处理后的玻璃纤维膜上,N2吹干。
上机检测:将加好样品的玻璃纤维膜用PTFE滤膜封置于蛋白测序仪PPSQ-31A的反应器里,设定检测氨基酸数及其他参数,当样品序列色谱分析完成后,自动生成推断的序列。
2 结果与分析
2.1 氧自由基清除能力(ORAC)标准曲线的建立
在荧光素钠(FL)溶液中,加入过氧自由基启动剂AAPH,FL受到过氧自由基的氧化攻击,荧光强度衰减,当抗氧化剂Trolox存在时,以抑制自由基方式减缓FL荧光衰减速度,抑制程度反映了它对自由基的抗氧化能力。不同浓度的Trolox标准溶液的荧光淬灭动力学曲线见图1,随着Trolox浓度增加,到达荧光强度衰减基线的荧光淬灭时间逐渐延长,荧光动力学曲线下的面积逐渐增大,Trolox浓度与荧光动力学曲线下的保护面积netAUC 值之间的线性方程为y=55 385.8x+1 217 801.3 (R2=0.998 6)。将黑豆肽与Trolox的荧光衰减曲线保护面积netAUC相比较,从而得出黑豆肽的ORAC值,以Trolox当量(μmol/L)表示。
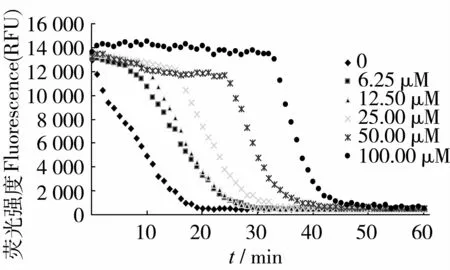
图1 不同浓度的Trolox荧光淬灭动力学曲线
2.2 抗氧化黑豆蛋白肽的超滤与大孔树脂吸附分离结果
2.2.1 超滤分离黑豆肽组分的抗氧化活性比较
由表1可知,通过超滤可以对黑豆蛋白酶解物进行有效地初步分离,黑豆蛋白肽的抗氧化活性与其相对分子质量分布范围有很大关系,相对分子质量<1 000的黑豆肽超滤组分占58.2%,具有相对最高的氧自由基清除能力,试验确定采用大孔树脂吸附法对该组分进一步分离纯化。
表1 黑豆肽超滤分离组分的氧自由基清除能力
2.2.2 大孔树脂吸附乙醇洗脱分离黑豆肽组分的抗氧化活性比较
由表2可知, DA201-C大孔树脂吸附,体积分数25%及50%乙醇洗脱分离的疏水性较低的黑豆肽组分约占69.1%,但氧自由基清除能力较低;体积分数75%乙醇洗脱分离的黑豆肽组分占25.2%,具有相对最高的ORAC值,该结果与苗欣等[24]的相关研究报道一致。而100%乙醇洗脱组分可能由于疏水性太高,在ORAC测定磷酸盐缓冲液体系中的溶解度降低,反而ORAC值有所下降,因此确定以75%乙醇洗脱黑豆肽组分进行进一步的色谱分离纯化。
表2 黑豆肽大孔树脂吸附分离组分的氧自由基清除能力
2.3 抗氧化黑豆肽的色谱分离纯化结果
2.3.1 Sephadex G-25凝胶过滤分离纯化结果
由图2和表3可知,经Sephadex G-25纯化后得到P1、P2、P3、P4、P5 5个峰组分,P1峰和P5峰的抗氧化活性很弱,P1组分可能是一些水解度较低的蛋白肽,P5组分可能是一些水解过度的游离氨基酸;P2、P3、P4组分的抗氧化活性较强,其中P4组分占37.2%,为主要组分,且ORAC值最强。但P4与P3组分的分离效果较差,试验确定采用反相高效液相色谱(RP-HPLC) 对P4组分进一步分离纯化。
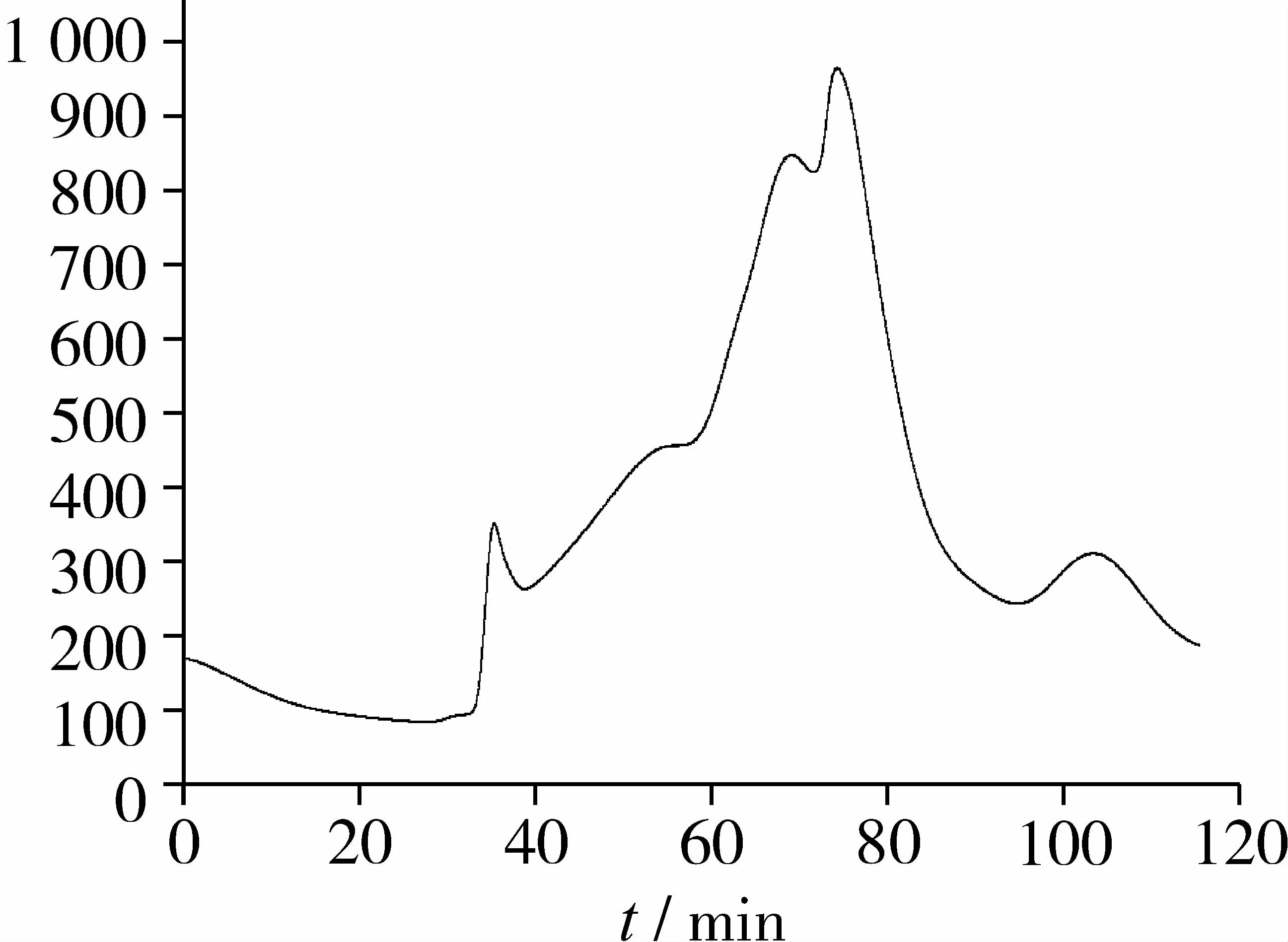
图2 抗氧化黑豆肽的Sephadex G-25分离图谱

峰号P1P2P3P4P5组分比例/%4.818.229.737.210.1Trolox当量/μmol/L58.2±0.4116.5±0.3187.2±0.7245.4±0.329.4±0.5
2.3.2 RP-HPLC分离纯化结果
由图3可知,将G-25 P4 峰组分通过RP-HPLC纯化后得到RP-HPLC P1、P2、P3、P4 4个黑豆肽组分,其中P2组分占41.4%、P4组分占36.4%,为主要组分。由表4可知,RP-HPLC P2、P4峰组分的ORAC值较为接近,且较G-25 P4 峰组分抗氧化活性进一步增强,试验确定采用排阻色谱(SEC)对RP-HPLC P2和P4 2个组分进行分离和纯度检验。
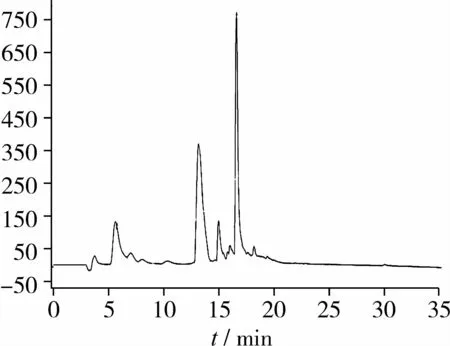
图3 抗氧化黑豆肽的RP-HPLC分离图谱
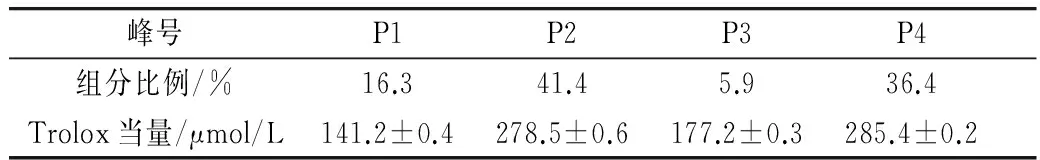
峰号P1P2P3P4组分比例/%16.341.45.936.4Trolox当量/μmol/L141.2±0.4278.5±0.6177.2±0.3285.4±0.2
2.3.3 SEC分离纯化结果
由图4可知,RP-HPLC纯化后P2组分的SEC分离色谱图显示为1个大的主峰P2和1个小峰P1,SEC P2组分占86.95%,ORAC值(Trolox当量)为307. 5 μmol/L,比纯化前RP-HPLC P2组分的抗氧化活性进一步增强,氧自由基清除能力是超滤分离抗氧化最强黑豆肽组分(Mr<1 000)的2.68倍。据此判断SEC P2主峰组分为1个纯度较高的肽段,试验确定对其进行氨基酸序列结构鉴定分析。
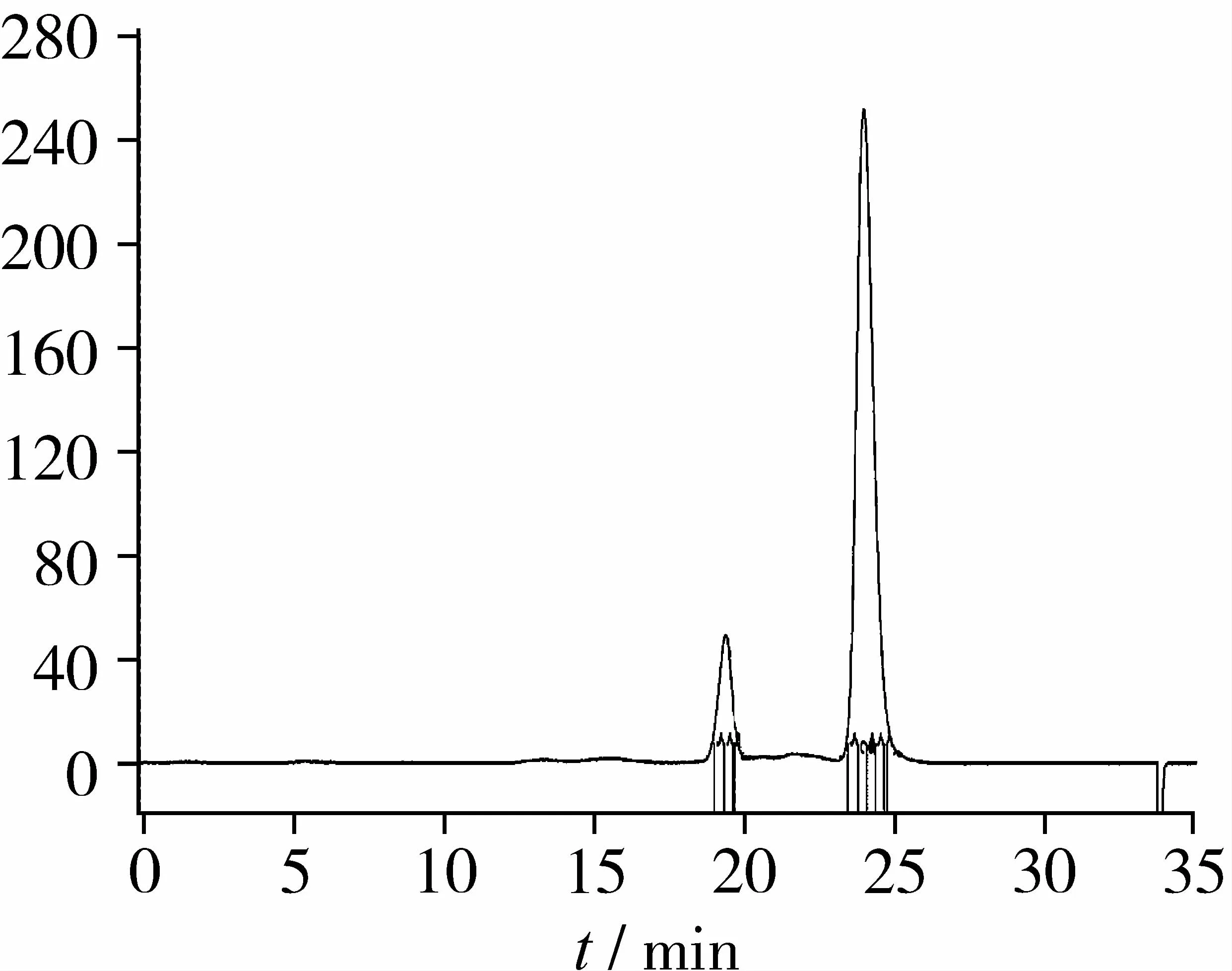
图4 抗氧化黑豆肽RP-HPLC-P2的SEC分离图谱
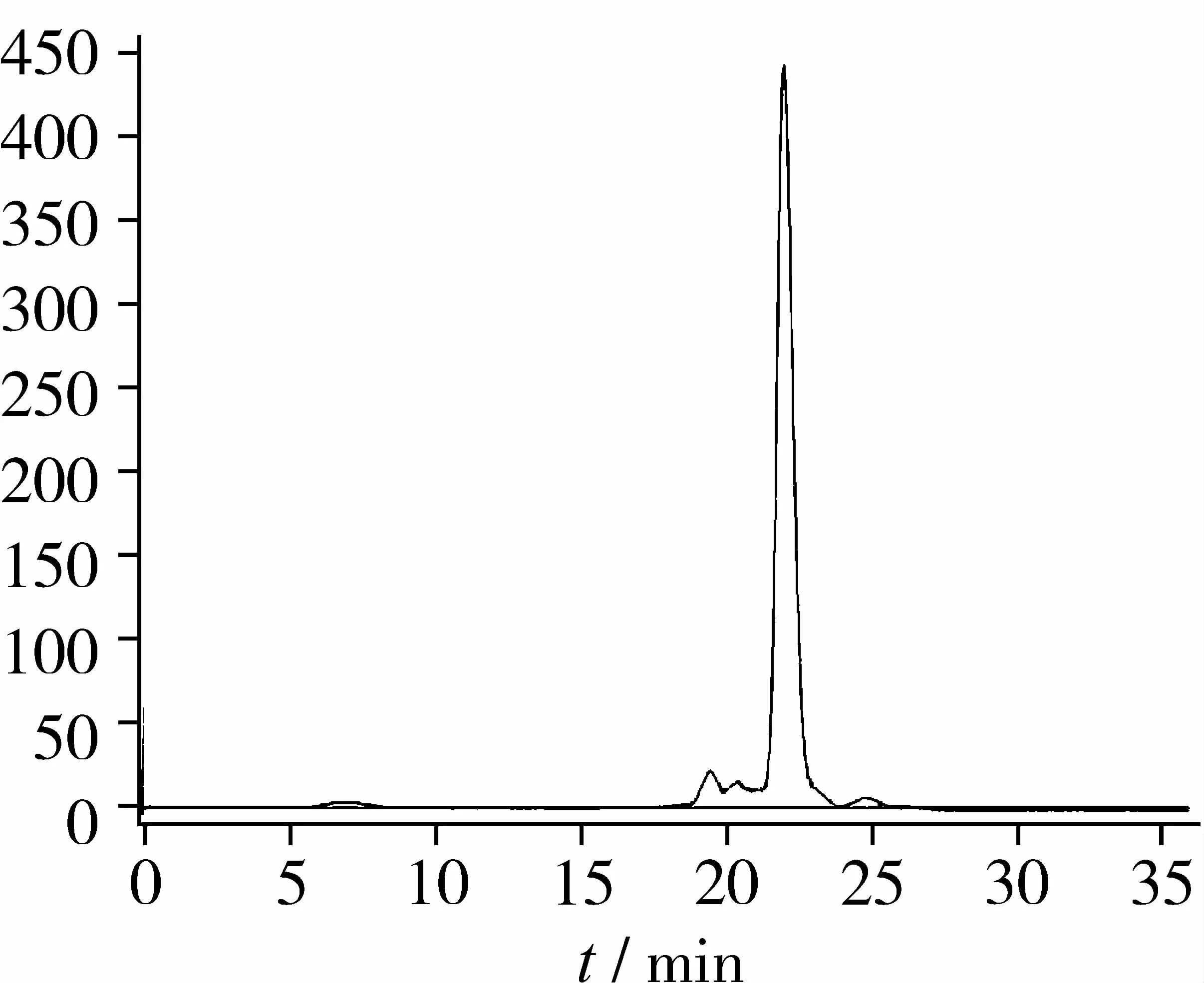
图5 抗氧化黑豆肽RP-HPLC-P4的SEC分离图谱
由图5可知,RP-HPLC纯化后P4组分的SEC分离色谱图显示为单一主峰P3和一些微小的杂峰,SEC P3组分占87.95%,ORAC值(Trolox当量)为314.6 μmol/L,比纯化前RP-HPLC P4组分的抗氧化活性进一步增强,氧自由基清除能力是超滤分离抗氧化最强黑豆肽组分(Mr<1 000)的2.74倍。据此判断SEC P3主峰组分为1个纯度较高的抗氧化肽段,试验确定对其进行氨基酸序列结构鉴定分析。
2.4 抗氧化黑豆肽的氨基酸序列结构鉴定
Edman降解后通过蛋白测序仪测定,RP-HPLC纯化后P2组分SEC P2黑豆肽的氨基酸组成如图6所示,RP-HPLC P2组分SEC P2肽段共有3个氨基酸组成,其氨基酸组成序列结构为Tyr-Asn-Ile,相对分子质量为444。
RP-HPLC纯化后P4组分SEC P3黑豆肽的氨基酸组成如图7所示,RP-HPLC P4组分SEC P3肽段共有3个氨基酸组成,其氨基酸组成序列结构为Trp-Asn-Pro,相对分子质量为451。
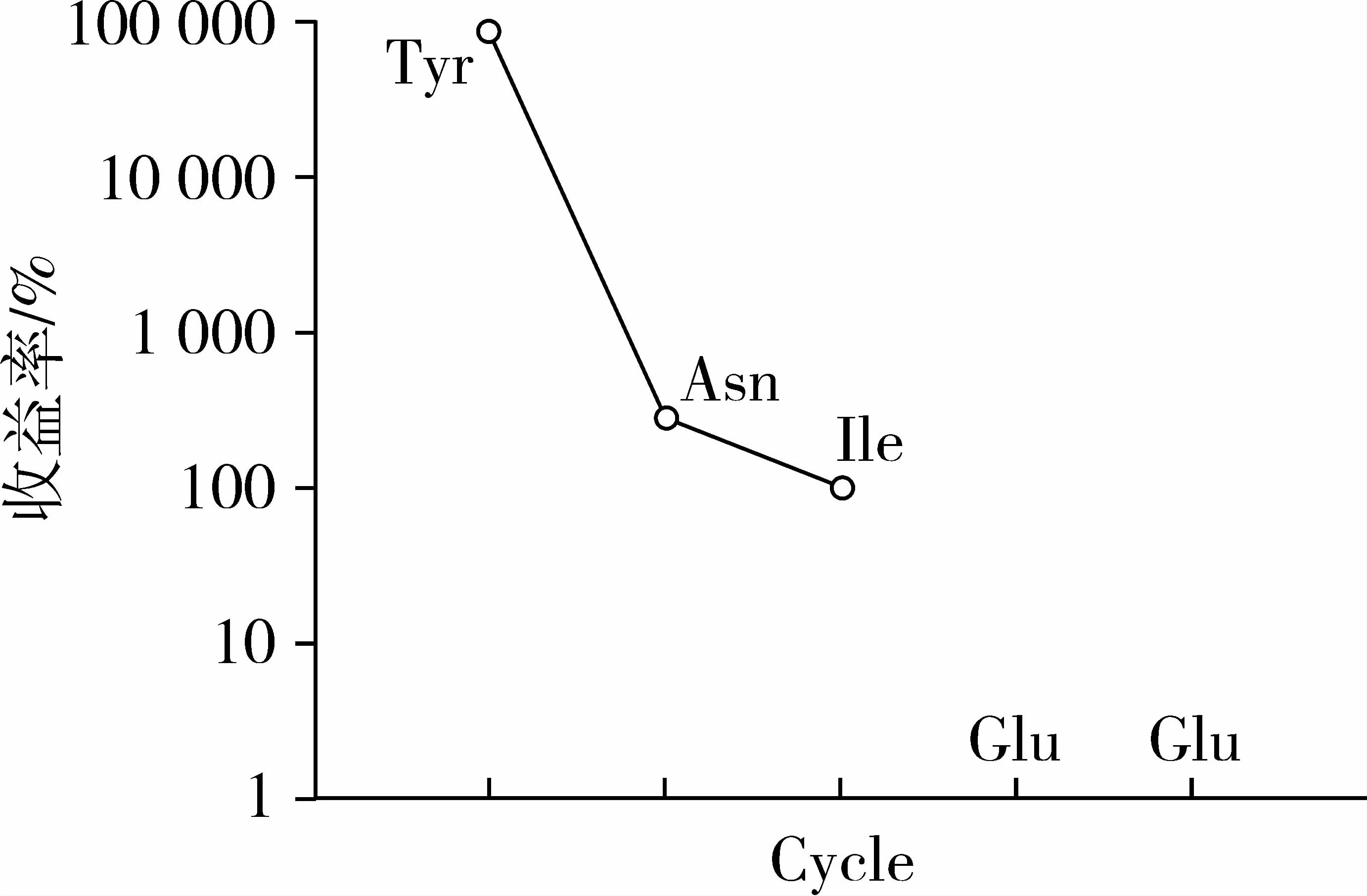
图6 抗氧化肽RP-HPLC-P2组分SEC-P2氨基酸序列图
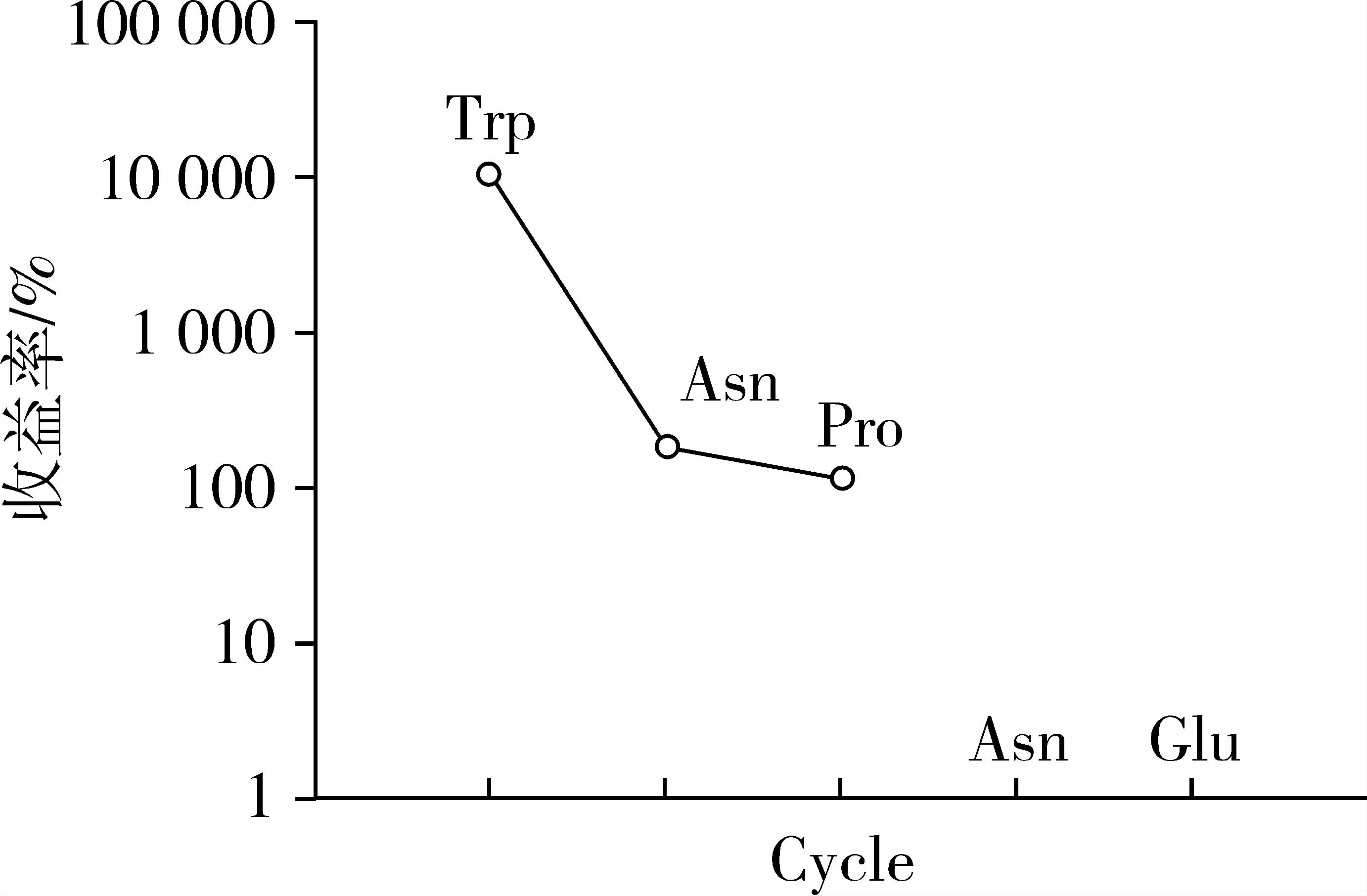
图7 抗氧化肽RP-HPLC-P4组分SEC-P3氨基酸序列图
据相关研究报道[25-26],抗氧化肽多数是一些由3~7个氨基酸所组成的小分子肽, N-端为捕捉自由基的能力较强的疏水性氨基酸如Ala、Ile、Pro、Trp等,具有较强的抗氧化活性,或N-末端是酪氨酸,它具有酚羟基结构,能提供质子从而猝灭自由基[9,27],可以提高肽的抗氧化能力。本试验经多级色谱分离纯化获得的抗氧化黑豆肽是2个由3个氨基酸所组成的小肽,N-端为具有酚羟基结构的酪氨酸Tyr或疏水性很强的色氨酸Trp,与上述研究报道的抗氧化肽的氨基酸组成序列结构基本一致,为抗氧化目标功能肽的开发研究提供了理论参考。
3 结论
通过超滤和DA201-C大孔树脂对黑豆蛋白酶法水解产物进行初步分离,相对分子质量<1 000,以体积分数75%乙醇洗脱的黑豆蛋白肽具有相对最强的抗氧化活性。采用色谱分离技术进一步逐级纯化,经Sephadex G-25凝胶色谱分离,得到P1、P2、P3、P4和P5共5个峰组分,抗氧化活性相对最强的P4组分占37.2%。将Sephadex G-25 P4 峰组分通过RP-HPLC按疏水性差异分离纯化后得到P1、P2、P3、P4共4个峰组分,其中P2组分占41.4%、P4组分占36.4%,RP-HPLC P2和P4峰组分的氧自由基清除能力较为接近,且较Sephadex G-25 P4峰组分的抗氧化活性进一步增强。
采用排阻色谱(SEC)法对RP-HPLC P2和P4峰组分进行分离和纯度检验,最终获得RP-HPLC P2组分SEC P2肽段和RP-HPLC P4组分SEC P3肽段2个纯化的抗氧化黑豆肽。通过Edman 降解、蛋白测序仪测定,RP-HPLC P2组分SEC P2肽段的氨基酸组成序列结构为Tyr-Asn-Ile,N-端是具有酚羟基结构的酪氨酸Tyr;RP-HPLC P4组分SEC P3肽段的氨基酸组成序列结构为Trp-Asn-Pro,N-端是疏水性很强的色氨酸Trp。
[1]赵保路. 氧自由基和天然抗氧化剂[M]. 北京: 科学出版社, 1999
[2]Harman D. Aging: a theory based on free radical and radiation chemistry[J]. Journal of Gerontology, 1956(11): 298-300
[3]赵保路. 自由基、营养、天然抗氧化剂与衰老[J]. 生物物理学报, 2010, 26(1): 26-36
[4]陈园园. 大豆肽的酶解制备与抗疲劳、抗氧化功能研究[D]. 无锡: 江南大学, 2008
[5]王章存, 徐贤, 魏翠平. 大豆蛋白的酶解及其抗氧化活性研究[J]. 中国粮油学报, 2009, 24(5): 21-24
[6]张英, 董绍华. 氨基酸清除活性氧自由基作用的研究[J]. 科技通报, 1997,(5): 312-315
[7]张连慧, 贺寅, 刘新. 大豆肽的研究进展及其发展前景[J]. 食品工业科技, 2012,33(22): 406-408
[8]黎观红, 晏向华. 食物蛋白源生物活性肽: 基础与应用[M]. 北京: 化学工业出版社, 2010
[9]Chen Hua-Ming, Muramoto K, Yamauchi F. Structural analysis of antioxidative peptides from soybean beta-Conglycinin[J]. Journal of Agriculture and Food Chemistry, 1995, 43(3): 574-578
[10]Chen H M, Muramoto K, Yamauchi F. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J]. Journal of Agriculture and Food Chemistry, 1998, 46(1):49-53
[11]Yamamoto N, Ejiri M, Mizuno S. Biogenic peptides and their potential use[J]. Current Pharmaceutical Design, 2003, 9(16): 1345-1355
[12]丛建民. 黑豆的营养成分分析研究[J]. 食品工业科技, 2008, 29(4): 262-264
[13]张瑞芬, 池建伟, 丘银清, 等. 黑大豆的营养及保健功能研究进展[J]. 广东农业科学, 2006(11): 13-16
[14]赵利, 钱芳, 许建军, 等. 大孔吸附树脂及其在蛋白质、多肽和氨基酸分离纯化中的应用[J]. 四川食品与发酵, 2003(2): 39-41
[15]任娇艳, 赵谋明, 崔春, 等. 草鱼蛋白源抗氧化肽的分离及鉴定[J]. 食品科学, 2009, 30(13): 13-17
[16]宋立霞, 王向社, 吴紫云, 等. 氧自由基吸收能力测定方法的研究进展[J]. 食品研究与开发, 2008, 29(12): 166-170
[17]Prior R L, Wu X, Schaich K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J]. Journal of Agriculture and Food Chemistry, 2005, 53: 4290-4302
[18]Prior R L, Hoang H, Gu L, et al. Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity(ORAC) of plasma and other biological and food samples[J]. Journal of Agriculture and Food Chemistry, 2003, 51: 3273-3279
[19]李华, 刘恩岐, 唐仕荣, 等. 酶法制备黑豆抗氧化肽及其分离纯化与氨基酸组成分析[J]. 食品科学, 2013, 34(9): 271-276
[20]曹亚兰, 赵谋明, 郑赛晶, 等. 以ORAC 法为评价指标优化制备大豆抗氧化肽[J]. 食品与发酵工业, 2011, 37(10): 73-77
[21]Blanca H L,Lourdes A, Isidra R, et al. ACE-inhibitory and radical-scavenging activity of peptides derived from β-lactoglobulin[J]. Journal of Agriculture and Food Chemistry, 2007, 55: 3392-3397
[22]钟芳, 张晓梅, 麻建国. 大豆肽的大孔吸附树脂以及凝胶过滤色谱分离[J]. 食品与机械, 2006, 22(4):25-28
[23]刘晶, 温志英, 韩清波. 米渣肽抗疲劳作用及抗疲劳肽的分离鉴定[J]. 中国粮油学报, 2013, 28(1): 1-4
[24]苗欣, 张晖, 柳杰. 大孔树脂对花生抗氧化肽的吸附研究[J]. 中国油脂, 2011, 36(5): 21-25
[25]Chen G T, Zhao L, Zhao L Y, et al. In vitro study on antioxidant activities of peanut protein hydrolysate[J]. Journal of the Science of Food and Agriculture, 2007, 87(2):357-362
[26]Pouliot Y, Wijers M C, Gauthier S F, et al. Fractionation of whey protein hydrolysates using charged UF/NF membranes[J]. Journal of Membrane Science, 1999, 158 (1):105-114
[27]Rajapakse N, Mendis E, Jung W, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38(2): 175-182.
Isolation and Identification of Antioxidant Peptides Derived from Black Soybean Protein
Liu Enqi Wu Yonghua Gao Zhaojian Zhang Jianping
(Jiangsu Key Laboratory of Food Resource Development and Quality Safety,Xuzhou Institute of Technology, Xuzhou 221008)
The oxygen radical absorbance capacity(ORAC) has been applied as an index to isolate the antioxidant peptides from black soybean protein hydrolysates by ultrafiltration (UF) and Macroporous Adsorption Resin (MAR); the fraction performed the highest antioxidant activity was further purified with consecutive methods on Sephadex G-25 column, reversed phase high-performance liquid chromatography (RH-HPLC) and Size Exclusion Chromatography (SEC); two highly purified antioxidant peptides named SEC P2 and SEC P3 produced from RP-HPLC P2 and RP-HPLC P4 have been obtained with ORAC values of 307.5 and 314.6 μmol/L, respectively. The antioxidant capacities were 2.68 and 2.74 times than that of the fraction purified by UF (Mr<1 000), respectively. Moreover, the amino acid sequences of the peptides with strong antioxidant activity were confirmed as Trp-Asn-Pro and Tyr-Asn-Ile by automated Edman degradation with protein sequencer. Additionally, Tyr with aromatic residue and Trp with high hydrophobicity could be located at N-terminus.
black soybean peptides, ORAC, isolation, structural analysis
TS201.2.1
A
1003-0174(2016)02-0033-06
2014-07-15
刘恩岐,男,1964年出生,博士,教授,粮油植物蛋白与食品生物技术

