BTI保护法测定小麦水解蛋白中谷氨酰胺含量
王章存 王许东 张子峰 安广杰 曹 芹
(郑州轻工业学院 食品与生物工程学院1,郑州 450002)(郑州新威营养技术有限公司2,郑州 450002)
BTI保护法测定小麦水解蛋白中谷氨酰胺含量
王章存1王许东2张子峰2安广杰1曹 芹1
(郑州轻工业学院 食品与生物工程学院1,郑州 450002)(郑州新威营养技术有限公司2,郑州 450002)
根据蛋白中谷氨酰胺与BTI试剂反应后不再被酸解转化为谷氨酸的原理,介绍了测定蛋白质和肽中谷氨酰胺方法,主要包括样品的BTI处理、酸解、PITC衍生和HPLC色谱分析等。以小麦水解蛋白为例,测定结果为:结合态谷氨酰胺质量分数为(26.178±0.061)%,游离谷氨酰胺质量分数为(0.121±0.008)%,其他17种游离氨基酸质量分数为(2.053±0.034)%。丙氨酰-谷氨酰胺二肽标准品和游离氨基酸含量测定结果印证了该方法是可靠的,可测定蛋白质和肽分子中的谷氨酰胺含量。
小麦水解蛋白 结合态谷氨酰胺 BTI试剂 PITC衍生
谷氨酰胺是组成蛋白质的重要氨基酸之一,也是动物体的一种条件性必需氨基酸。它可以促进动物小肠绒毛膜的生长发育,促进皮肤的快速愈合,提高机体的运动耐力等,在动物机体代谢中具有十分重要的功能[1-2],而且大量研究表明,结合态比游离态谷氨酰胺具有更好的营养效果[3-5],因此,近年来人们十分重视结合态谷氨酰胺的开发利用。
小麦蛋白具有丰富的谷氨酰胺,以小麦蛋白为原料通过酶解制备含有结合态Gln活性肽的研究受到国内外高度关注[6-8],但如何有效评价蛋白质酶解产物中结合态谷氨酰胺的含量是困扰人们的主要难题。因为目前测定蛋白质及肽中氨基酸含量时首先用盐酸水解样品,此时蛋白质及肽中的谷氨酰胺(Gln)转化为相应的谷氨酸(Glu),后者也是蛋白质中的固有氨基酸。因此,分析报告中Glu的含量实际是Gln转化所得Glu与蛋白质中固有Glu含量之和。
目前结合态Gln的测定方法主要有基因或序列分析法、酶法[9]和BTI试剂保护法[10]。基因序列法因操作周期长、难度大、费用高等原因而无法普及;酶解法因无法确保结合态Gln的完全释放,也不能有效利用。BTI保护法是基于蛋白质中Gln(也称作结合态Gln)与试剂 [二(三氟乙酰氧基)碘]苯, 缩写为BTI)反应转化为对酸稳定的L-2,4-二氨基丁酸(DABA),因此可以通过测定BTI保护后样品中DABA含量来计算Gln含量[10-13]。但该法需要DABA作为标准品且价格较高,而且结合态Gln与BTI的反应产物未必全部是DABA,这是影响该方法广泛应用的制约因素。因此有必要探讨新的分析方法。
本研究根据BTI衍生化反应原理,通过BTI保护和未经保护蛋白质样品经酸水解后的Glu含量差值来计算蛋白质中的Gln含量,可省去以DABA标准品的测定。同时通过测定小麦水解蛋白中游离Gln含量,进一步确认样品中Gln的存在状态。
1 材料与方法
1.1 材料和试剂
小麦水解蛋白(粗蛋白80.93%):郑州新威公司;Gln标准品(纯度99.9%):日本协和KYOWA KIRIN公司;Ala-Gln二肽标准品(纯度为99. 34%):上海旭新科技公司;双-(三氟乙酰氧基)-碘苯(BTI,分析纯):阿拉丁试剂(上海)公司;Venusil AA分析方法包(包括17种标准Aa,内标物正亮氨酸,异硫氰酸苯酯,三乙胺):天津Agela科技公司。其他试剂为分析纯或色谱纯。
1.2 主要仪器
高效液相色谱仪(HPLC):Lab-Tech莱博泰科公司;Venusil AA 分析专用柱(4.6×250 mm,5 μm):天津博纳Agela公司;干式氮吹仪(DN-12A):无锡沃信公司。
1.3 分析方法
1.3.1 样品的BTI保护处理
[11-12]的方法并做适当改进。取1.0 mL小麦水解蛋白样品液(1%),加1.5 mL BTI溶液(乙腈溶解)和0.25 mL吡啶水溶液,于50 ℃水浴保温5 h以上。然后,再用氮吹仪吹干。另取1份样品液,加入同样的乙腈和吡啶水溶液,保温和干燥方法不变,作为对照样品。
1.3.2 样品的酸水解
在BTI保护和对照样品中分别加入10 mL 含0.1%苯酚的6 mol/L盐酸,振摇使样品溶解或使样品均匀分散于溶液中,将安瓿瓶置-20 ℃冰箱中冷冻3~5 min,充氮后用喷灯熔封,然后置(110±1)℃烘箱中水解24 h,取出冷却,取水解液1mL,置浓缩管中浓缩仪浓缩至干(或用氮气吹干去除盐酸),加入1.0 mL浓度为0.1 mol/L 稀HCl溶解,用0.45 μm滤膜过滤后,供衍生使用。
1.3.3 Aa标准溶液和样品溶液的衍生
准确量取Aa标准溶液及样品液200 μL ,分别置入1 mL 离心管中,往每个离心管中准确加入正亮氨酸内标溶液20 μL ,然后加入三乙胺乙腈溶液 100 μL ,异硫氰酸苯酯乙腈溶液100 μL,混匀,室温放置 1 h,然后加入正己烷 400 μL ,振摇后放置10 min,取下层溶液(PTC-AA),用0.45 μm 微滤器过滤上色谱柱。
1.3.4 Ala-Gln二肽标准品的处理
取适量Ala-Gln二肽标准品按前述BTI保护、酸解和衍生等方法处理后上柱分析。
1.3.5 HPLC色谱条件:
色谱柱:Venusil AA分析柱 4.6 mm×250 mm, 5 μm;柱温:40 ℃;进样量:10 μL;流速:1.0 mL/min,测定波长:254 nm;流动相A:为0.1 mol/L醋酸钠溶液(pH 6.5)∶乙腈=93∶7;流动相B为乙腈∶水=80∶20(V/V);线性梯度洗脱程序为:0~4 min,0~3% B;4~16 min,3%~11% B;16~17 min,11%~21% B;17~32 min,21%~34% B;32~34 min,34%~100% B;38.01 min,0% B;38.01~45 min,0% B。
1.3.6 游离氨基酸总量和游离态Gln含量的测定
将一定量小麦水解蛋白样品加入稀酸溶液充分溶胀后离心,取上清液即游离氨基酸(包括Gln)样品溶液。另取Gln标准品,按相同方法用PITC衍生后上柱分析。
1.3.7 试验结果的处理
按Aa常规分析方法,分别计算BTI保护和未保护样品中的Glu含量、游离氨基酸总含量。试验数据用SPSS 11.0 软件统计,结果以平均数±标准差表示。Glu和Gln的分子质量分别为147.1和146.2,所以Gln对Glu的质量换算系数为0.994。
2 结果与讨论
2.1 样品氨基酸图谱
小麦水解蛋白样品按常规氨基酸分析方法测定(即未经BTI保护)结果如图1所示。其中正亮氨酸是内标物。Venusil AA 色谱柱和选择的洗脱条件可以很好地分离各种氨基酸。以标准氨基酸测定结果进行校正和计算该样品中各种氨基酸含量,3次重复试验氨基酸质量分数为 (79.587±0.119) % 。其中3次试验Glu质量分数分析值分别为28.952%、29.016%、28.779%,统计结果为(28.916±0.123) %。可见,该分析结果重复性很好。

图1 样品Aa图谱
2.2 BTI保护样品氨基酸图谱
图2是小麦水解蛋白经BTI保护后酸水解产物的氨基酸图谱。与未经保护的蛋白质样品(图1)相比,该图谱中Glu峰很小,氨基(NH3)峰也很小,表明BTI对Gln有很好的保护效果,可以抵抗酸水解而不再生成Glu,在Phe和Lys峰之间新增加一个高峰,经以BTI保护的Ala-Gln二肽标准品的图谱(图3)指认,该峰即是DABA峰。
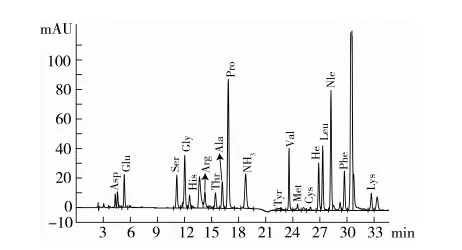
图2 BTI保护样品Aa图谱
经BTI保护样品Glu质量分数3次测定值分别为2.581%、2.643%和2.513%,统计结果为平均值(2.579±0.062)%,重复性较好。
根据测定原理,BTI保护和未保护样品中的Glu含量差值为(26.336±0.061)%,即为样品中结合态Gln水解所得。根据1.3.7,可计算出小麦水解蛋白中结合态Gln质量分数为(26.178±0.061) %。说明在该小麦水解蛋白样品中,结合态Gln占Glu和Gln总和的91.03% ,这意味在常规方法测定的Glu结果中,绝大部分是由Gln贡献的。
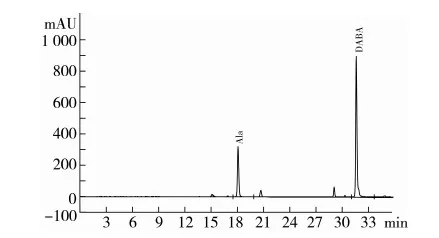
图3 Ala-Gln二肽标准品经BTI保护分析图谱
2.3 游离Aa(Aa)总量和游离Gln含量
对小麦水解蛋白中游离氨基酸的分离结果如图4所示。各种氨基酸含量与原料蛋白中相应氨基酸有差异,并不是等比例释放氨基酸(这与酶的水解位点有很大关系)。通过标准氨基酸峰面积校正计算,17种游离氨基酸含量只有(2.053±0.034)%,另外,根据标准品Gln峰面积(图5)校正计算,样品中游离Gln含量为(0.121±0.008) %,说明该样品中绝大部分氨基酸(97.3%)以肽的形式存在。
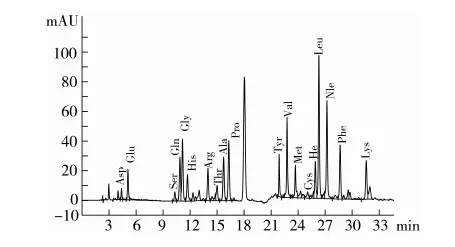
图4 小麦水解蛋白样品游离氨基酸分离图谱
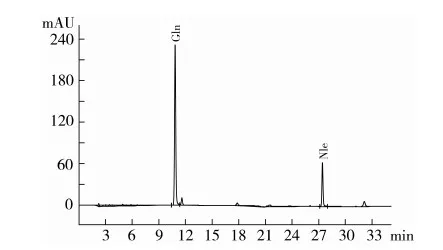
图5 标准Gln分离图谱
3 结论
小肽分子中结合态Gln在动物营养代谢和应激反应中具有特殊生理功能。因此,蛋白质酶解产物中结合态Gln的含量测定对于评价蛋白质的酶解效果十分重要。但目前氨基酸分析方法均采用酸水解法,无法测定结合态Gln和Asn。本研究以小麦水解蛋白为例,根据蛋白质中的Gln与BTI试剂反应转化为其他化合物后不再受酸水解影响的原理,通过常规氨基酸分析中谷氨酸含量与样品经BTI反应后谷氨酸含量的差值计算结合态Gln含量,并以Ala-Gln二肽标准品和游离氨基酸测定对结果进行了印证,证明该方法是可靠的。与目前所用DABA标准品法相比,本方法具有明显的优势和更广泛的实用价值。
参考文献
[1]刘涛. 谷氨酰胺对早期断奶仔猪肠道营养与免疫功能影响机理的研究[D].武汉:华中农业大学,2002
[2]Julia B E, Gordon K M, Johnson I R, et al. Glutamine supplementation improves intestinal barrier function in a weaned piglet model of Escherichia coli infection[J]. British Journal of Nutrition, 2011, 106, 870-877
[3]桑剑锋,吴文溪. 丙氨酰谷氨酰胺二肽的代谢及在肠外营养中的应用[J]. 肠外与肠内营养, 2001,8(1): 46-50
[4]任国谱,李玉英,谷文英. Gln活性肽营养液的稳定性及其营养作用的研究[J].中国粮油学报, 2003,18(3):35-39
[5]Luo M, Bazargan N, Griffith D P, et al. Metabolic effects of enteral versus parenteral alanyl-glutamine dipeptide administration in critically ill patients receiving enteral feeding: a pilot study[J]. Clinical Nutrition, 2008, 27(2): 297-306
[6]Swails W S, Bell S J, Borlase B C, et al. Glutamine Content of Whole Proteins: Implications for Enteral Formulas[J]. Nutrition in Clinical Practice,1992, 7:77-80
[7]Merrill D A,Hunter E A. Method for producing a gluten-free peptide preparation and preparation thus obtained[P]. US Patent 6692933-2004
[8]刘文豪. 麦谷蛋白源谷氨酰胺肽的制备和肠道营养效果研究[D]. 武汉:华中农业大学,2008
[9]Tsao M,Otter D E. Quantification of glutamine in proteins and peptides using enzymatic hydrolysis and reverse-phase high-performance liquid chromatography[J]. Analytical Biochemistry, 1999, 269(1):143-148
[10]Kuhn K S, Peter S,Peter F. Quantitative analyses of glutamine in peptides and proteins[J]. Journal of Agricultural and Food Chemistry, 1996, 44(7):1808-1811
[11]陶冠军,任国谱,谷文英. 蛋白质和肽中谷氨酰胺的HPLC定量分析[J]. 郑州粮食学院学报,1999,20(4): 65-67
[12]张海华,陶冠军,周惠明. UPLC快速测定可溶性肽或蛋白中谷氨酰胺含量[J]. 食品工业科技, 2012,33(1): 338-339.
Determination of Bound-Glutamine in Hydrolyzed Wheat Protein with BTI Reagent
Wang Zhangcun1Wang Xudong2Zhang Zifeng2An Guangjie1Cao Qin1
(School of Food & Bioengineering, Zhengzhou University of Light Industry1, Zhengzhou 450000)Zhengzhou Newwill Nutritional Technology Co., Ltd2.,Zhengzhou 450000)
A simple yet accurate method for the analysis of glutamine content in polypeptides was described, which includes reaction between BTI reagent and peptide bound glutamine, acid hydrolysis, PITC derivation and HPLC analysis. The results of wheat protein hydrolyzed showed that bound glutamine was (26.178±0.061)%, free glutamine was (0.121±0.008)%, the total of other 17 free amino acid was (2.053±0.034)%. The results of standard alanyl-glutamine dipeptide and free amino acids measurement manifested the reliability and accuracy of the method.
hydrolyzed wheat protein, bound glutamine, BTI reagent, PITC derivation
TS207.3
A
1003-0174(2016)06-0150-04
国家自然科学基金(31071517)
2014-10-10
王章存,男,1963年出生,教授,粮油蛋白质深加工

