麦麸发酵前后不同存在形态酚类物质中酚酸含量的变化及其抗氧化活性分析
杜小燕 吴 晖 唐语谦 雷灼贵 陈彦君 陈彩薇 赖富饶 闵 甜
(华南理工大学轻工与食品学院,广州 510642)
麦麸发酵前后不同存在形态酚类物质中酚酸含量的变化及其抗氧化活性分析
杜小燕 吴 晖 唐语谦 雷灼贵 陈彦君 陈彩薇 赖富饶 闵 甜
(华南理工大学轻工与食品学院,广州 510642)
以小麦麦麸为培养基,采用三株泡盛曲霉进行固态发酵,分别提取并采用高效液相色谱法测定麦麸发酵前后不同存在形态(游离型、酯苷结合型、糖苷结合型、碱解束缚型和酸解束缚型)的酚类物质中酚酸的含量,并通过DPPH自由基清除试验、还原力试验以及抗脂质过氧化试验,研究这些酚类物质的抗氧化活性。结果表明:未经过发酵的麦麸,束缚型酚酸在总酚酸含量中约占总量的80%,其酚酸类成分主要包括对香豆酸、阿魏酸、丁香酸、对羟基苯甲酸、咖啡酸、绿原酸、没食子酸、香草酸和肉桂酸等。发酵后的麦麸,游离型酚类物质的含量显著提高。抗氧化试验的结果显示,麦麸中碱解束缚型的酚类物质和发酵后麦麸的游离型酚类物质的抗氧化性较强。试验结果说明泡盛曲霉能促使被束缚的阿魏酸游离出来,使游离型酚类物质的含量及抗氧化性显著提高;而且抗氧化活性与酚酸的种类及含量有关,咖啡酸、丁香酸和阿魏酸含量高的酚类物质,其抗氧化性也较强。
小麦麦麸 泡盛曲霉 酚类物质 抗氧化性
小麦麸皮中含有两大类生理活性物质,即活性多糖和酚类化合物。酚类化合物是一类具有广泛生物活性的植物次生代谢物,相对于小麦植物细胞壁的碳水化合物成分而言含量较少,但对人体的生理机能有不可忽视的重要作用。麦麸中的酚类物质主要有酚酸、类黄酮、木酚素[1]。
酚酸主要存在于麦麸皮层中,是细胞壁组分之一。酚酸中以阿魏酸含量较高,约为麸皮质量的0.4%~7%[2-4]。酚酸具有抗氧化性和抗癌作用,并对环境中的有毒物质如多环芳香烃和亚硝胺以及真菌毒素有抗诱变作用,而阿魏酸是一种优良的羟自由基清除剂,在癌症的预防中有重要作用[5]。
研究表明,酚类物质主要以游离型,结合型和束缚型等几种形式存在于植物机体内[6-8]。Wang等[8]发现枣子中的酚酸主要以糖苷结合型和不溶性的形式存在,且这2种酚酸具有最强的抗氧化活性,其中果皮总酚含量最高,果核和果皮的酚酸为不溶性酚酸,果肉的酚酸为糖苷结合型酚酸。
从麸皮中提取酚类物质逐渐成为了研究热点,但采用微生物发酵法提取麦麸酚类物质的研究报道较少。本课题组前期研究发现,采用泡盛曲霉对麦麸进行固态发酵,可把束缚在麦麸中的酚类物质游离出来,从而大大地提高酚类物质的释放量。在此基础上,采用HPLC进一步研究不同存在形态的酚类物质中酚酸的种类和含量,并采用DPPH自由基清除试验、还原力试验以及抗脂质过氧化试验研究不同形态酚类物质的抗氧化性差异,进一步探讨发酵对麦麸中酚类物质的种类和抗氧化性的影响。
1 材料与设备
1.1 材料与试剂
小麦麦麸:南方面粉厂;3株泡盛曲霉(分别为GIM3.266,GIM3.4,GIM3.5):广东省微生物菌种保藏中心;PDA培养基:青岛高科园海博生物技术有限公司;DPPH( 2.2-Diphenyl-l-picrylhydrazyl)、BHT(2,6-二叔丁基对甲酚)、没食子酸、对羟基苯甲酸、龙胆酸、绿原酸、香草酸、咖啡酸、丁香酸、对香豆酸、阿魏酸(后9种酚酸标准品均为色谱纯):阿拉丁公司。
1.2 仪器与设备
超声细胞破碎机:宁波生物科技有限公司;立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;LRH-150-S恒温恒湿培养箱:广东省医疗器械厂; RE-52 型旋转蒸发器:上海亚荣系列化仪器厂;Spectrμmlab 752S 型紫外可见分光光度计:上海棱光技术有限公司;6CE-60F-717P型高效液相色谱仪:美国Waters公司。
2 试验方法
2.1 泡盛曲霉固体发酵[9-10]
2.1.1 发酵培养基配方
斜面培养基为PDA培养基;固态培养基的组成为5 g麸皮、0. 02 g (NH4)2SO4、0.0115 g CuSO4、15 mL水,混匀后121 ℃灭菌 20 min,冷却。每株泡盛曲霉各需制备6瓶固态培养基。
2.1.2 接种和培养
无菌条件下,向斜面培养基加入无菌生理盐水,用接种环轻刮斜面,制成孢子悬液,分别向6瓶固态培养基中各加入2 mL孢子悬液,于28 ℃静置培养连续6 d后,提取麦麸中5种不同形态的酚类物质(游离型、酯苷结合型、糖苷结合型、碱解束缚型和酸解束缚型),并分别采用Foiln-Ciocalteu 法和HPLC法测定其含量。
2.2 5种存在形态酚类物质的提取及测定[11-13]
2.2.1 游离型酚酸的提取
取发酵好的固态培养基,加入50 mL甲醇/丙酮/水混合溶液(7∶7∶6含0.1 g无水亚硫酸钠),室温下超声辅助提取30 min,4 ℃ 5 000 g离心15 min,重复1次,合并离心后的上清,35 ℃真空浓缩至25 mL,用6 mol/L盐酸调pH至2,再用等体积乙酸乙酯/乙醚(1∶1,V∶V)重复萃取3次,合并有机相,在30 ℃下真空浓缩至干,用纯甲醇复溶,定容至30 mL,得到游离型酚酸,于4 ℃棕色瓶保存。
2.2.2 酯苷结合型酚酸的提取
取2.2.1萃取后的水相,加入40 mL 4 mol/L的氢氧化钠和乙醇混合溶液(2∶1,含0.1 g无水亚硫酸钠),于室温下避光密封碱解4 h,用6 mol/L盐酸调pH至2,再用等体积乙酸乙酯/乙醚(1∶1)重复萃取3次,合并有机相,在30 ℃下真空浓缩至干,用纯甲醇复溶,定容至30 mL,得到酯苷结合型酚酸,于4 ℃棕色瓶保存。
2.2.3 糖苷结合型酚酸的提取
取2.2.2萃取后的水相,加入40 mL6 mol/L的盐酸溶液,于85 ℃水浴水解30 min后冷却,用等体积乙酸乙酯/乙醚(1∶1)重复萃取3次,合并有机相,于30 ℃下真空浓缩至干,用纯甲醇复溶,定容至30 mL,得到糖苷结合型酚酸,于4 ℃棕色瓶保存。
2.2.4 碱解束缚型酚酸的提取
取2.2.1离心后的沉淀,加入40 mL 4 mol/L的氢氧化钠和乙醇混合溶液(2∶1,含0.1 g无水亚硫酸钠),于室温下避光密封碱解4 h后4 ℃ 5 000 g离心15 min,上清液用6 mol/L盐酸调pH至2,用等体积乙酸乙酯/乙醚(1∶1)重复萃取3次,合并有机相,于30 ℃下真空浓缩至干,用纯甲醇复溶,定容至30 mL,得到碱解束缚型酚酸,4 ℃棕色瓶保存。
2.2.5 酸解束缚型酚酸的提取
取2.2.4离心后的沉淀,加入40 mL6 mol/L的盐酸溶液,于85 ℃水浴水解30 min后冷却,于4 ℃ 5 000 g离心15 min,上清液用等体积乙酸乙酯/乙醚(1∶1)重复萃取3次,合并有机相,于30 ℃下真空浓缩至干,用纯甲醇复溶,定容至30 mL,得到酸解束缚型酚酸,于4 ℃棕色瓶保存。
2.2.6 酚酸含量的测定
各酚酸含量采用Foiln-Ciocalteu 法(用没食子酸作标准物)来测定。
2.2.6.1 总酚标准曲线的制作
用甲醇配制一系列浓度梯度的没食子酸溶液,分别取 100 μL 上述标准液,各加入 300 μL 水、150 μL 的福林试剂、450 μL 质量分数 20% Na2CO3溶液,充分振荡,于室温下避光静置30 min,在760 nm处测量吸光度。以没食子酸浓度为横坐标(μg/mL),以吸光度(A)为纵坐标,绘制标准曲线,建立回归方程:y=0.013x+0.020,R2=0.998。
2.2.6.2 样品的测定
分别取100 μL经过适当稀释的酚酸,按上述方法测定各酚酸含量,每组平行测量3次。
2.3 HPLC测定各酚酸含量
色谱条件:参考文献[14]的方法,并作相应修改。色谱柱为Venusil XBP C18(L) (4.6 mm×250 mm),流动相:A为乙腈,B为2%冰乙酸水溶液,洗脱程序:0~30 min,100%B~85%B,30~50 min,85%B~50%B,50~55 min,50%B~0%B,55~60 min,0%B~100%B,流速为1 mL/min,进样量为10 μL,柱温为室温,检测波长280 nm,进样前样品均用0.45 μm微孔滤膜过滤。
用甲醇把9种酚酸的标准样品配制一系列浓度梯度,经0.45 μm微孔滤膜过滤,进样10 μL,按色谱条件进行测定,标准混合样品色谱图如图1所示。以测得的峰面积为纵坐标、标准样品的浓度为横坐标,分别绘制9种酚酸样品的标准曲线。
分别测定各种存在形态的酚类物质样品,根据各种酚酸的标准曲线,计算其含量,每个样品平行测定3次,取平均值。

注:1 没食子酸(6.146 min);2 对羟基苯甲酸(17.250 min);3 绿原酸(20.129 min);4 香草酸(21.917 min);5 咖啡酸(22.517 min);6 丁香酸(24.342 min);7 对香豆酸(30.362 min);8 阿魏酸(34.254 min);9 肉桂酸(45.558 min)。
图1 标准混合样品液相色谱图
2.4 DPPH 自由基清除率测定
[15]的方法,以BHT(2,6-二叔丁基对甲酚)为阳性对照,分别测定各种形态酚类物质和BHT的DPPH自由基清除能力。
式中:A0为1 mL 蒸馏水与5 mL DPPH 甲醇溶液的吸光度;A1为1 mL 样品稀释液与5 mL DPPH 甲醇溶液的吸光度;A2为 1 mL 样品稀释液与5 mL 甲醇的吸光度。
2.5 还原力试验
把各酚类物质统一稀释为50 μg/mL,参考文献[16]的方法,以BHT(2,6-二叔丁基对甲酚)为阳性对照,分别测定各酚类物质和BHT的还原力,在700 nm所测得的吸光值越大,说明样品的还原力越强,其抗氧化性越强。
2.6 抗脂质过氧化能力的测定
参考文献[17]的方法,以BHT(2,6-二叔丁基对甲酚)为阳性对照,分别测定各酚类物质和BHT的抗脂质过氧化能力的大小。

式中:A0为空白对照液的吸光值;A1为加入酚类物质后的吸光值。
2.7 数据统计分析
所有样品做3组平行试验,结果以均值(±S.D.)表示,采用SPSS 19.0统计软件的单因素方差分析和Duncan多重比较法进行数据统计(α<0.05),差异显著水平为P<0.05。
3 结果与分析
3.1 酚类物质的含量(Foiln-Ciocalteu法)
一般而言,游离型和结合型酚类物质为可溶性酚类,束缚型酚类物质则为不溶性酚类,以酯键、糖苷键和醚苷键等形式与其他物质相结合。超声波可促使麦麸中游离型酚类物质向有机溶剂中迁移,由于强酸水解主要打开糖苷键,强碱水解主要打开酯苷键[9],所以麦麸萃取液经强碱水解后可得到酯苷结合型酚类物质,麦麸残渣经强碱水解后可得到碱解束缚型酚类物质,麦麸萃取液经强酸水解后可得到糖苷结合型酚类物质,麦麸残渣经强酸水解后可得到酸解束缚型酚类物质。
各种存在形态的酚类物质的含量如表1所示。发酵前的麦麸酚酸以束缚型酚类物质为主,束缚型酚类物质占了总酚的82.67%,游离型的酚类物质仅占总酚的7.19%。随着发酵时间的增加,泡盛曲霉分泌的酶系会分解麦麸细胞壁与酚类物质相连的酯苷键、糖苷键、醚键,使被束缚的酚类物质逐渐被释放出来,所以游离型酚类物质含量不断增加。其中经泡盛曲霉GIM3.4发酵的麦麸,游离型酚类物质含量比发酵前提高了6 784.80 μg/g麸皮,其次是GIM3.5,游离型酚类物质提高了2 961.94 μg/g麸皮,而GIM3.266发酵后游离型酚类物质提高了559.80 μg/g麸皮,说明泡盛曲霉的发酵有助于麦麸酚类物质的释放,进而提高总酚的提取率。

表1 各种存在形态酚类物质的含量(Foiln-Ciocalteu法)
注:采用Duncan多重比较法进行数据统计,同列相同小写字母表示差异不显著(P>0.05),同列不同小写字母表示差异显著(P<0.05),“—”表示未检出,余同。
3.2 不同存在形态酚类物质中酚酸的含量
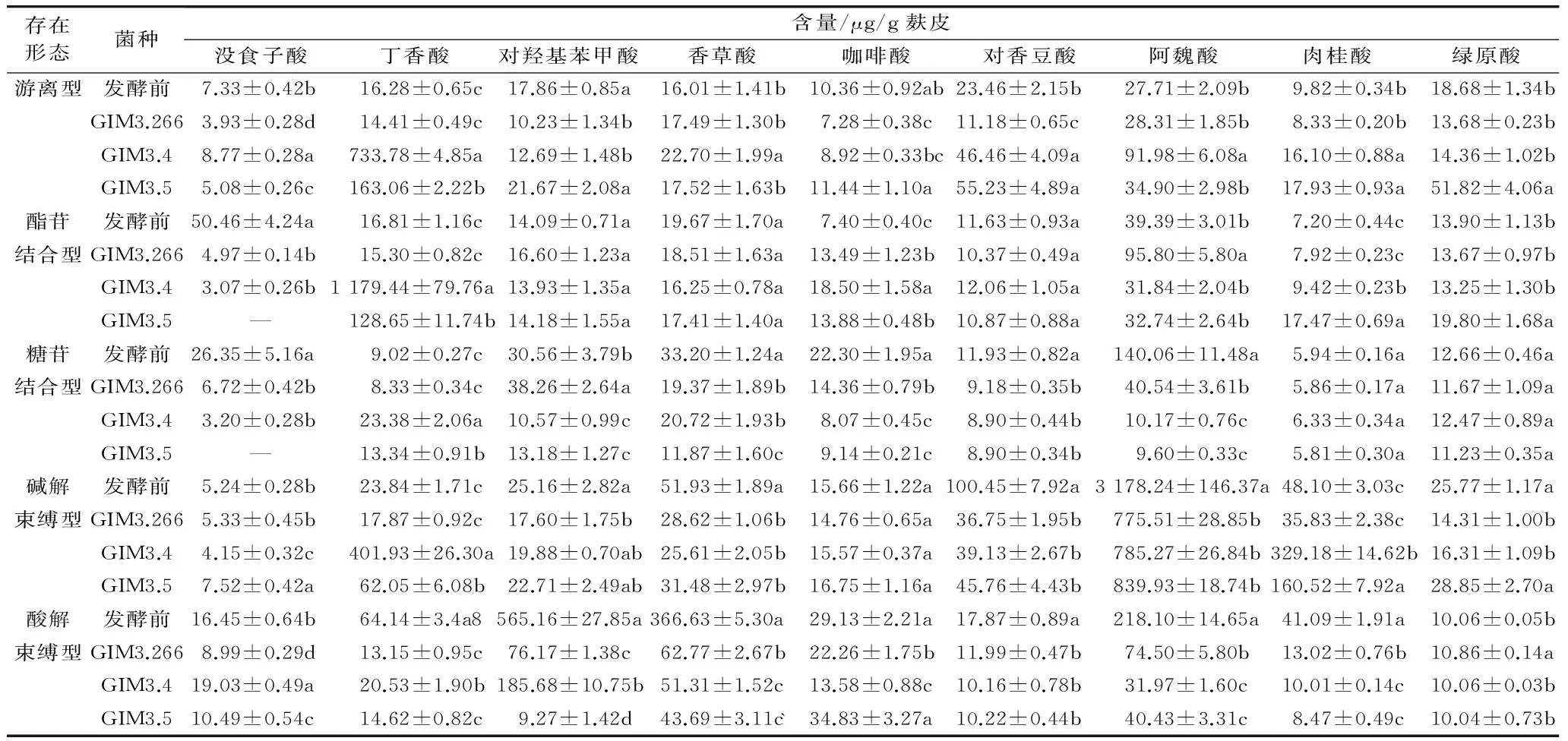
表2 各种存在形态酚类物质中的酚酸含量
各酚类物质中酚酸的含量如表2和表3所示,发酵后的麦麸酚类样品色谱图中出现了许多未知的峰,说明泡盛曲霉不仅会分解麦麸,把束缚的酚类物质释放出来,同时也会分解转化麦麸本身的酚酸,引起酚类物质含量的变化:经泡盛曲霉发酵后的麦麸,丁香酸的含量都大大增加。其中,游离型酚类物质中阿魏酸的含量显著提高,说明泡盛曲霉的发酵有利于把束缚在麦麸中的阿魏酸游离出来。此外,发酵后的麦麸肉桂酸的含量也有所增加。然而,其他酚酸含量与发酵前相差不大,甚至有所下降。例如,发酵后的麦麸中酸解束缚型酚类物质中的对香豆酸、肉桂酸、咖啡酸和阿魏酸的含量都比发酵前的麦麸降低了。
采用HPLC测得各酚酸含量的总和与Foiln-Ciocalteu 法的总酚含量不一致,一方面是因为本研究只采用了相关报道的酚酸标准品,且发酵后的酚酸样品的色谱图出现了较多未知的色谱峰,所以不能计算其含量。另一方面,由于Foiln-Ciocalteu 法的专一性不强,一些糖类、蛋白质、环状化合物和螯合剂都会消耗福林酚试剂,导致结果偏大[19]。这表明小麦麦麸的提取液很复杂,除了可辨别的酚酸组分外,还可能含有氨基酸和脂肪酸。因此推测泡盛曲霉发酵麦麸后,会分解麦麸原有的酚酸,转化成其他酚类物质。
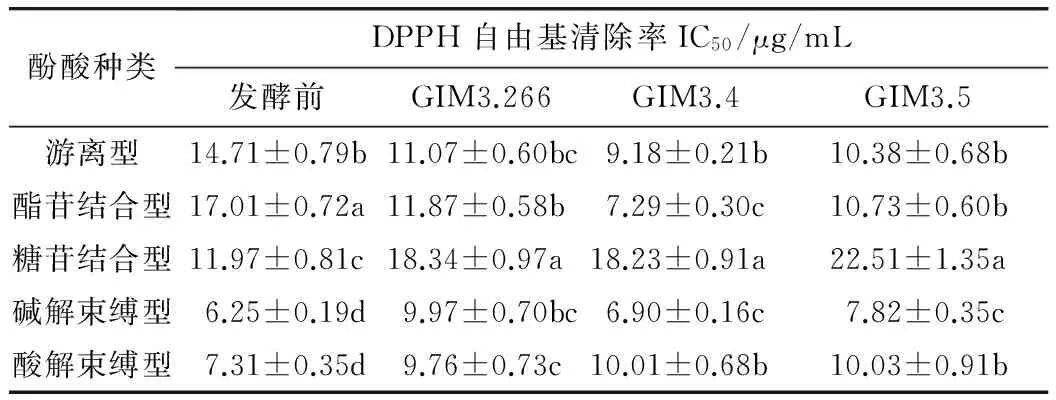
表3 各酚类物质DPPH自由基清除率(IC50)
3.3 DPPH自由基清除率
DPPH是一种稳定的有机自由基,被广泛应用于体外评价天然产物的抗氧化性,尤其是酚类物质,通过测定酚酸对 DPPH 自由基的清除能力可以评估其抗氧化性的强弱[20]。5种存在形态的酚类物质对 DPPH 自由基率的IC50值如表3所示,同时以BHT为阳性对照,其对 DPPH 自由基率的 IC50值为11.76 μg/mL。IC50值越低,酚类物质对 DPPH自由基的清除能力越强,抗氧化性越强。总体而言,碱解束缚型酚类物质对 DPPH自由基的清除能力最强,比BHT的抗氧化性强,经过发酵后的麦麸,游离型酚类物质的抗氧化性有所提高,因为阿魏酸和丁香酸具有较强的抗氧化性[21],而发酵后的麦麸,游离型酚类物质中阿魏酸和丁香酸的浓度都大大提高,所以含高浓度的阿魏酸和丁香酸的酚类物质提取物的抗氧化性更强。
3.4 还原力试验
检验样品的还原力可以得知其是否为良好的电子供应者,还原力强的样品应为良好的电子供应者,因为其供应的电子除了可使 Fe3+还原为 Fe2+外,也可与自由基反应,使自由基成为更稳定的物质。一般情况下,样品还原能力的高低可以间接地反映抗氧化能力的强弱。样品的还原力越强,其抗氧化性则越强[22]。根据反应后所测吸光值可知其还原能力的大小,吸光值越大,表明其对三价铁离子的还原力越强。试验对5种酚类物质对铁离子的还原力进行了比较,并以BHT为阳性对照,其吸光值为0.24,其余酚类物质所测得的吸光值如表4所示。碱解型酚类物质具有较强的铁离子还原力,发酵后麦麸的游离型酚类物质与发酵前相比,阿魏酸和丁香酸浓度增大,所以其酚类物质的铁离子还原力明显增强,碱解型酚类物质和发酵后麦麸的游离型酚类物质的抗氧化作用都比BHT强,与DPPH自由基清除试验结果相似。

表4 各酚类物质的还原力试验吸光值
3.5 抗脂质过氧化能力
脂质极易被氧化,通过测定酚类物质抗脂质过氧化能力可以评估其抗氧化性的强弱,IC50值越低,其抗氧化性越强。5种存在形态的酚类物质抗脂质过氧化能力的IC50值如表5所示,同时以BHT为阳性对照,其抗脂质过氧化能力的IC50值为184.73μg/mL。由表5可知,碱解型酚酸的抗氧化性较强,且发酵后的麦麸的游离型酚类物质抗脂质氧化的能力增强。
在3个抗氧化试验中,麦麸经发酵后,糖苷结合型和酸解束缚型酚类物质的抗氧化性都降低,结合酚类物质的HPLC数据可发现,酚类物质的抗氧化性与其酚酸的组成和含量有一定的相关性,发酵后的麦麸糖苷结合型和酸解束缚型酚类物质的各种酚酸含量都显著降低,尤其是阿魏酸、对羟基苯甲酸、香草酸,咖啡酸的含量显著降低,其色谱图上出现了一些峰面积较大,但未被识别的峰。由于小麦麸皮中存在的酚酸类成分,如羟基苯甲酸、龙胆酸、咖啡酸、香草酸、绿原酸、丁香酸、香豆酸和阿魏酸,是其抗氧化活性的关键[11],且咖啡酸、阿魏酸具有较强的抗氧化性[14],故这些酚酸浓度的降低,导致了其酚类物质抗氧化性的下降。抗氧化性强的酚类提取物,一般咖啡酸、丁香酸和阿魏酸的含量较高,这与Kim等[14]的研究结果一致。
然而,由于样品的酚类物质成分复杂,清除自由基活性是这些酚类化合物协同或拮抗的综合体现[23],一般很难衡量每种酚酸对总酚抗氧化性的贡献,特别是如果已知的酚酸仅占总酚的一小部分的情况。另外各种酚酸不一定具有协同增效的作用,所以多种酚酸的混合物,不一定能使抗氧化性增强。这些单个化合物的含量与抗氧化活性之间的相关性,以及它们的抗氧化作用机制是相互协同或是拮抗,将有待研究。

表5 各酚类物质的抗脂质过氧化能力比较
4 结论
未经过发酵的麦麸,束缚型酚类物质在总酚含量中约占总量的80%,阿魏酸主要存在于束缚型的酚类物质中。麦麸在发酵的过程中,泡盛曲霉不仅会分解麦麸,把束缚的酚类物质释放出来,同时也会分解转化麦麸本身的酚酸,导致引起酚类物质的含量和抗氧化性变化。
发酵后的麦麸,其游离型酚类物质中阿魏酸的含量显著提高,肉桂酸的含量也有所增加。然而,其他酚酸含量与发酵前相差不大,甚至有所下降。
酚类物质的抗氧化性与其酚酸的组成和含量有一定的相关性。发酵后的麦麸,游离型酚类物质的含量及其抗氧化性都显著增强,主要是因为泡盛曲霉能把本来束缚在麦麸中的阿魏酸和丁香酸释放出来,使游离型酚酸的阿魏酸含量显著提高,而阿魏酸、丁香酸具有较强的抗氧化性,所以游离型酚酸的抗氧化性也显著增强。
参考文献
[1]朱小乔,刘通迅. 小麦麸皮的功能组分及其在食品中的开发应用[J]. 粮油食品科技,2000,8(6):18-21
[2]Andreasen M F, Kroon P A, Williamson G, et al. Esterase activity able to hydrolyze dietary antioxidant hydroxycinnamates is distributed along the intestine of mammals [J]. Journal of Agricultural and Food Chemistry, 2001, 49(11): 5679-5684
[3]Mathew S, Abraham T E. Ferulic acid: an antioxidant found naturally in plant cell walls and feruloyl esterases involved in its release and their applications [J]. Critical Reviews in Biotechnology, 2004, 24(2-3): 59-83
[4]Adom K K, Sorrells M E, Liu R H. Phytochemicals and antioxidant activity of milled fractions of different wheat varieties[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 2297-2306
[5]Zhuang M, Hiroshi K, Koji T. Synthesis and biological activities of ferulic acid-amino acid derivatives [J]. Bioscience, Biotechnology and Biochemistry, 1997, 61(3): 527-529
[6]Liu R H. Whole grain phytochemicals and health [J]. Journal of Cereal Science, 2007, 46(3): 207-219
[7]Krygier K, Sosulski F, Hogge L. Free, esterified and insoluble-bound phenolic acids. 2. composition of phenolic acids in rapeseed flour and hulls [J]. Journal of Agricultural and Food Chemistry, 1982, 30(2): 334-336
[8]Wang B N, Liu H F, Zheng J B, et al. Distribution of phenolic acids in different tissues of jujube and their antioxidant activity [J]. Journal of Agricultural and Food Chemistry, 2011, 59(4): 1288-1292
[9]刘子立,欧仕益,蒋笃孝,等. 麦麸发酵产酶制备并提纯阿魏酸[J]. 暨南大学学报:自然科学版,2006,27(1):117-122
[10]方园,张宁,欧仕益. 利用泡盛曲霉产阿魏酸酯酶的研究[J]. 暨南大学学报:自然科学版,2011,(9):103-106
[11]郝杰,张长虹,曹学丽. 七种谷物麸皮中的酚酸类成分分析[J]. 食品科学,2010,31(10):263-267
[12]丁岩,唐世云,侯汉学. 小麦麸皮中酚酸提取方法的研究[J]. 中国食物与营养,2012,18(6):52-58
[13]姚艳艳. 小麦麸皮中阿魏酸提取与纯化工艺研究[D]. 雅安:四川农业大学,2011
[14]Kim K H, Tsao R, Yang R, et.al. Phenolic acid proles and antioxidant activities of wheat bran extracts and the effect of hydrolysis conditions[J]. Food Chemistry, 2006, 95(3): 466-473
[15]何秋彤,余以刚,李聪聪. 20种市售凉茶类植物饮料抗氧化性的比较研究[J]. 食品科学,2011,32(7):47-51
[16]Viswanath V, Urooj A, Malleshi N G. Evaluation of antioxidant and antimicrobial properties of finger millet polyphenols (Eleusinecoracana)[J]. Food Chemistry, 2009, 114(1): 340-46
[17]Chen N F. Study on the extraction of flavonoid compound in pteridium aquilinum (L.) and its antioxidant property [J]. Food and Fermentation Industries, 2003, 29(11): 63-67
[18]Karl H, Charles W N. Occurrence and content of hydroxycinnamic and hydroxybenzoic acid compounds in foods [J]. Critical Reviews in Food Science and Nutrition, 1989, 28(4): 315-347
[19]Verma B, Hucl P, Chibbar R N. Phenolic acid composition and antioxidant capacity of acid and alkali hydrolysed wheat bran fractions [J]. Food Chemistry, 2009, 116(4): 947-954
[20]王会,郭立,谢文磊. 抗氧化剂抗氧化活性的测定方法(一)[J]. 食品与发酵工业,2006,32(3):92-97
[21]彭长连,陈少薇,林植芳,等. 用清除有机自由基 DPPH 法评价植物抗氧化能力[J]. 生物化学与生物物理进展,2000,27(6):658-661
[22]徐亚民,赵晓燕,马越,等. 紫甘蓝色素抗氧化能力的研究[J]. 食品研究与开发,2006,27(11):59-62
[23]杨占南,林丽娇,何磊磊. 黄褐毛忍冬中酚酸类化合物含量及其抗氧化活性相关性[J]. 现代食品科技,2012,28(9):1228-1265.
Analysis of Phenolic Compounds Contents and Antioxidant Activities in Unfermented and Fermented Wheat Bran
Du Xiaoyan Wu Hui Tang Yuqian Lei Zhuogui Chen Yanjun Chen Caiwei Lai Furao Min Tian
(South China University of Technology College of Light Industry and Food Sciences, Guangzhou 510642)
Solid state fermentation of wheat bran was performed by three aspergillus awamori strains (GIM3.266, GIM3.4, GIM3.5, respectively). Different forms of phenolic components in wheat bran were extracted and analyzed using HPLC method. Furthermore, DPPH radical scavenging assay, reducing power assay and anti-lipid per oxidation assay were conducted to analyze the antioxidant activities of phenolic components. It was showed that 80% of the phenolic components existed in an insoluble-bound form in wheat bran and it mainly included p-coumaric acid, ferulic acid, syringic acid, p-hydroxybenzoic acid, caffeic acid, chlorogenic acid, gallic acid, vanillic acid and cinnamic acid, et al. The content of free phenolic components increased sharply after fermentation. It was indicated that alkaline-hydrolysable phenolic components of wheat bran and free phenolic components of fermented wheat bran exhibited higher antioxidant activities in this study. Conclusion: aspergillus awamori could release the bound form of ferulic acid from wheat bran after fermentation which resulted in a sharp increase of the content of free phenolic components and its antioxidant activities. Moreover, correlations were found between the composition of phenolic components and its antioxidant activities. Therefore, phenolic components with high concentrations of caffeic acid, syringic acid and ferulic acid exhibited higher antioxidant activities in this study.
wheat bran, aspergillus awamori, phenolic compounds, antioxidant activities
TS210.9
A
1003-0174(2016)06-0017-07
国家自然科学基金(31201330),中央高校基本科研业务费专项(2013ZM0 065),广东省天然产物绿色加工与产品安全重点实验室开放基金(201304),广东省高等学校科技创新重点项目(2012CXZD0009),广州市科技攻关(201300000202)
2014-10-01
杜小燕,女,1990年出生,硕士,食品安全与天然产物化学
赖富饶,男,1981年出生,讲师,天然产物化学

