荠蓝胶多糖的分离纯化和理化性质研究
李泽珍 狄建兵 陈 敏
(山西农业大学食品科学与工程学院1,太谷 030801)(中国农业大学食品科学与营养工程学院2,北京 100083)
荠蓝胶多糖的分离纯化和理化性质研究
李泽珍1狄建兵1陈 敏2
(山西农业大学食品科学与工程学院1,太谷 030801)(中国农业大学食品科学与营养工程学院2,北京 100083)
研究荠蓝胶脱除蛋白的方法,荠蓝胶多糖的分离纯化,以及部分理化性质的测定。采用水提醇沉法从荠蓝籽中提取荠蓝胶,比较了Sevag法、碱性蛋白酶+Sevag法、胰蛋白酶+Sevag法3种脱除蛋白方法,此后经DE-52离子交换柱进行纯化得到精制多糖。采用凝胶电泳、紫外扫描等进行纯度鉴定,红外扫描、液相色谱分析其结构和单糖组成,并进行部分理化性质的测定。结果表明,碱性蛋白酶+sevag法是脱除荠蓝胶中蛋白的有效方法,分离纯化的荠蓝胶多糖CSP(camelina sativa polysaccharide)为单一级分,含有糖醛酸结构,吡喃糖环和β-糖苷键,其单糖组成包括鼠李糖、木糖、阿拉伯糖和葡萄糖4种,摩尔比为11.95∶13.95∶0.79∶0.27。荠蓝胶多糖CSP是一种水溶性,有较高黏度的酸性多糖类物质。
荠蓝胶多糖 分离纯化 理化性质
荠蓝可抵抗冬季-16 ℃左右的低温,对土壤条件要求低,如干旱、瘠薄、半沙质的地区都可种植,适应性强。与亚麻荠相比,荠蓝农艺性状好,抗病虫、抗倒伏、高产质优,具有许多优点[1]。
近年来,荠蓝作为一种新的高产油料作物越来越受到人们的重视[ 1-3],如其栽培特性、食用价值等。相关研究表明,荠蓝籽含油率为36%~42%,可作为食用植物油源;荠蓝油中富含α-亚麻酸、亚油酸,其含量分别为33%~36%,18%~25%,并且VE含量高达36~44 mg/100 g,因而,荠蓝油也被认为是具有特殊功能营养保健油源[4]。荠蓝籽榨取油脂后的荠蓝籽饼(粕)仍具有很高的应用价值,它含有高达42%~45%的蛋白质,可在家禽饲料中添加应用[5],也可对其蛋白分离纯化或酶解获得多肽,作为生物活性物质在食品中添加[6]。荠蓝籽表皮附着植物多糖胶质,采用水提醇沉法可获得荠蓝胶,其中含有70%以上的多糖和少量蛋白质[7]。荠蓝胶中含有大量的植物多糖,已有研究表明,植物多糖具有多种生物活性,如抗肿瘤、抗衰老、降血糖和免疫调节等,并且具有毒副作用小,不易造成残留等优点[8]。近年来,多糖的研究被重视,研究方面包括分离纯化、理化性质测定,以及生物活性的探讨。目前,严奉伟等[9]、税丹等[10]研究表明菜籽多糖具有清除自由基的能力,有明显的抗氧化作用;毛丰玮等[11]研究了亚麻籽壳多糖,对其提取工艺,分离纯化,多糖结构进行了研究。而荠蓝籽壳提取到的荠蓝胶中的多糖,其分离纯化及理化性质研究至今鲜见报导。
本研究对荠蓝胶脱除蛋白方法进行了比较,对多糖成分进行了分离纯化,并探讨了纯化后多糖的理化性质,旨在为荠蓝胶多糖进一步的结构或构效关系研究、保健品的开发应用,提供一定的理论基础,同时,进一步提高油料作物荠蓝的经济效益。
1 材料与仪器
荠蓝胶:自制;单糖标品-葡萄糖、鼠李糖、木糖、阿拉伯糖、α-葡萄糖苷酶、β-葡萄糖苷酶:Sigma公司;8~14 ku透析袋:美国联合碳化公司;DE-52:Whatman Intermational Ltd;三氟乙酸、茚三酮-乙醇溶液、费林试剂、双缩脲试剂、三氯化铁、碘-碘酸钾溶液、CTAB:分析纯级。
752型紫外光栅分光光度计:上海精密科学仪器有限公司; HL-2S 恒流泵、SBS-100 电脑全自动部分收集器、层析柱(1.6 cm×40 cm)、HD-5 电脑紫外检测仪:上海青浦沪西仪器厂;DYCZ-24D双垂直电泳槽电泳仪、DYY-6C电泳仪:北京市六一仪器厂;UV-VIS紫外-可见光光谱分析仪:澳大利亚瓦里安有限公司;SY-4000K高效液相色谱设备:北京北分瑞利分析仪器有限责任公司;sugar pakⅠ色谱柱:沃特世公司;RI-K-2301示差折光检测器:北京北分瑞利分析仪器有限责任公司;5DX红外光谱仪:美国尼高力公司。
2 试验方法
2.1 荠蓝胶脱除蛋白
荠蓝胶的制备:按比例称取荠蓝籽壳与蒸馏水,重量比为1∶33,在61 ℃下浸提3.5 h,匀浆后离心处理,获得上层胶液,多次加入无水乙醇沉淀,脱水浓缩,纱布过滤,得到的胶质在60 ℃下鼓风干燥。干燥后制品为纤维状,粉碎后过筛(80目),制得荠蓝胶粉。
配制50 mL 0.4%荠蓝胶溶液,分别使用Sevag法、碱性蛋白酶+Sevag法、胰蛋白酶+Sevag法对其进行脱蛋白处理[12-13],用考马斯亮蓝染色法与苯酚-硫酸法分别测定3 种方法处理后的蛋白质含量以及多糖含量。脱除蛋白后的粗多糖液透析,冷冻干燥,制得荠蓝胶粗多糖。
2.2 DEAE-52离子层析
称取荠蓝胶粗多糖,配制浓度为1.0 mg/mL的溶液,经微孔滤膜过滤后上样,上样量为10 mL。DE-52(Cl-型) (1.6 cm×40 cm) 蒸馏水洗脱4 h后,经0~1.5 mol/L NaCl溶液洗脱,流速0.6 mL/min,以5 mL/管分部收集。收集得到的洗脱液采用苯酚-硫酸法检测糖峰部分,合并单一含糖峰位,蒸馏水中透析48 h后冷冻干燥,精制得到多糖组分。
2. 3 聚丙烯酰胺凝胶电泳
聚丙烯酰胺凝胶电泳,采用pH8.3的Tris-甘氨酸为缓冲液,电泳条件为电压400 V,电泳时间8 h。0.5%甲苯胺蓝染色后,再用乙醇∶水∶乙酸(5∶5∶0.1)脱色处理。
2. 4 紫外光谱
称取荠蓝胶精制多糖,配制0.1 mg/mL的水溶液,紫外分析仪UV1800进行扫描,范围为190~400 nm。
2.5 红外光谱分析
KBr压片法。红外扫描范围在4 000~400 cm-1。
2.6 单糖组成分析[14]
单糖标准液配置浓度为2.0 mg/mL。多糖的酸水解:称取10 mg多糖CSP加入螺口试管中,加入4 mL 2 mol/L三氟乙酸(TFA),充氮气封管;100 ℃水浴6 h后取出;旋转蒸发仪中真空浓缩至干(温度低于40 ℃),加入甲醇再由氮气吹干,重复4~5次,直到完全除去TFA,最后配成溶液。
高效液相(HPLC)法分析CSP多糖的单糖组成成分,以warers sugar pakⅠ为色谱柱, 0.05 g /L EDTA钙钠溶液为流动相,流速0.5 mL/min,进样量20 μL,柱温为90 ℃,RI-K-2301示差折光检测器。
2.7 CSP多糖的理化性质[12]
对多糖CSP的多种理化性质进行检测观察,包括颜色、状态、溶解性、CTAB络合反应、碘-碘酸钾反应、费林试剂反应、茚三酮反应、三氯化铁反应、双缩脲反应。
3 结果与分析
3.1 荠蓝胶脱除蛋白
荠蓝胶中蛋白质含量较高,sevag法需反复处理7次以上,才能使游离蛋白质除尽,最终蛋白质含量5.01 mg/mL,脱去58.5%的蛋白质,多糖损失率23.46%。酶解后,使用sevag法处理,可以减少后续有机溶剂脱除蛋白的次数,降低了多糖随凝胶物沉淀而损失的可能。碱性蛋白酶处理后,sevag法仅处理2次,蛋白质脱除率为59.90%,胰蛋白酶处理后,仍需sevag法处理5次,其优点是蛋白质脱除率最高(63.60%),但多糖损失率很大。综上所述,碱性蛋白酶+sevag法可以有效提高蛋白脱除效率,减少多糖损失,酶法与sevag法结合是脱除荠蓝胶中蛋白的有效方法。

表1 不同脱蛋白方法处理的试验结果
注:蛋白含量测定:考马斯亮蓝法。荠蓝胶蛋白含量12.06 mg/mL。
3.2 荠蓝胶多糖的分离纯化
采用 DE-52(C1-型)柱层析,蒸馏水洗脱4 h后,用0~1.5 mol/L NaCl梯度洗脱。NaCl溶液梯度洗脱可获得一种主要的分离组分,命名为CSP(camelina sativa polysaccharide),分离效果见图1。柱层析时,蒸馏水洗脱后检验无组分,NaCl溶液梯度洗脱后有组分,该组分是被DE-52吸附的酸性多糖峰,这说明荠蓝胶多糖中的组分是酸性多糖,而不是中性多糖。

图1 荠蓝胶多糖的柱层析图谱
3.3 凝胶电泳
荠蓝胶多糖CSP组分达到了电泳纯,凝胶电泳获得到单一区带(图2),这表明CSP为单一组分多糖。
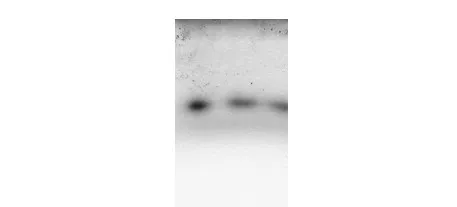
图2 CSP的聚丙烯酰胺凝胶电泳谱图
3.4 紫外扫描光谱
紫外扫描图谱(图2)表明,多糖CSP中不含蛋白质、多肽及核酸的成分,其扫描范围内260、280 nm处均无吸收。
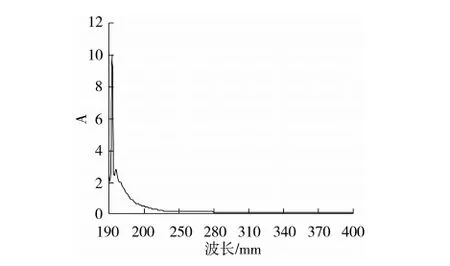
图3 CSP的紫外扫描图谱
3.5 多糖红外扫描分析

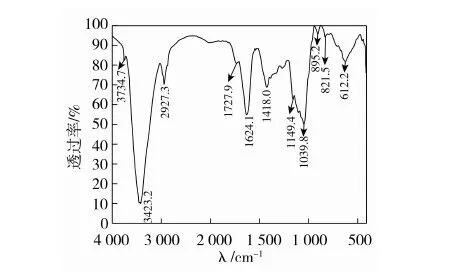
图4 CSP红外光谱图
3.6 单糖组成分析
如图5、图6所示,CSP是一种杂多糖。其单糖组成包括鼠李糖、木糖、阿拉伯糖、葡萄糖,相对摩尔比为:11.95∶13.95∶0.79∶0.27。结合多糖的红外扫描,可知荠蓝胶多糖CSP是由β-糖苷键连接的4种单糖组成的杂多糖。
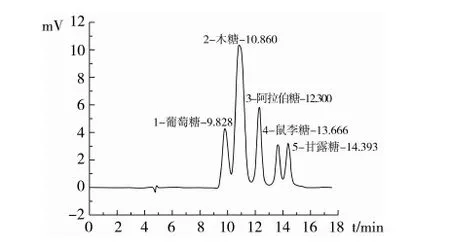
图5 单糖标样HPLC检测图谱
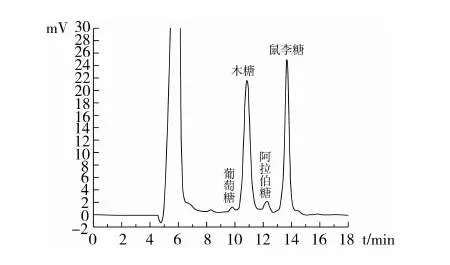
图6 CSP的单糖HPLC检测图谱

表2 单糖的HPLC洗脱信息
3.7 多糖CSP的理化性质
多糖CSP的CTAB络合反应为阳性外,其他反应均为阴性,表明CSP组分具有水溶性,有较高黏度,是非淀粉类酸性多糖。同时,CSP组分不含淀粉、还原糖、酚类物质、蛋白、多肽物质。

表3 CSP的理化性质
注:“+”表示阳性反应,“-”表示阴性反应。
4 结论
荠蓝胶脱除蛋白方法的研究,结果表明碱性蛋白酶+sevag法是有效的脱除荠蓝胶蛋白质的方法,可以显著减少sevag法处理的次数,并降低多糖的损失。
荠蓝胶粗多糖经离子交换柱层析,进行分离纯化,得到一个主要组分CSP。该组分聚丙烯酰胺凝胶电泳只有一条带,紫外扫描260、280 nm处无吸收,纯度鉴定表明CSP为单一组分。高效液相色谱分析表明,CSP多糖含有4种单糖,分别为鼠李糖、木糖、阿拉伯糖和葡萄糖,摩尔比为11.95∶13.95∶0.79∶0.27。糖苷键分析结果表明,荠蓝胶多糖CSP是由β-糖苷键连接的4种单糖组成的杂多糖。红外扫描表明CSP是多糖类化合物,具有吡喃糖的β-糖苷键结构,并含有糖醛酸。其理化性质试验表明,CSP是非淀粉类多糖,具有水溶性、较高黏度,是不含淀粉、还原糖、酚类物质、蛋白、多肽的酸性多糖类物质。
[1]黄凤洪,谢笔钧,刘昌盛.新型油料作物——荠蓝[J].中国油脂,2005,30(10):76-77
[2]Zubr J. Dietary fatty acids and amino acids of [ J].Journal of food quality,2003, 26( 6): 451-462
[3]Zubr J,Matthaus B. Effects of growth conditions on fatty acids and to copherols in Camelina sativa oil[J]. Industrial crops and products,2002,15(2):155-162
[4]Djoussé L,Hunt S C,Arnett D K,et al. Dietary linolenic acid is inversely associated with plasma triacylglycerol the National Hear,t Lung, and Blood Institute Family Heart Study [J]. The American Journal of Clinical Nutrition,2003,78(12): 1098-1102
[5]邓乾春,黄凤洪,黄庆德等.荠蓝籽饼粕在家禽饲料中的应用效果研究[J].中国饲料,2009,17:3-7
[6]戴昱旻,朱晓聪,云田田等.荠蓝籽蛋白酶解制备抗氧化肽工艺的研究[J].中国粮油学报,2008,23(5):149-153
[7]李泽珍,陈敏,戴蕴青等.荠蓝胶提取工艺的优化[J].中国食品学报,2010,10(2):142-148
[8]Ge Y, Duan Y F,Fang G Z,et al.Study on biological activities of Physalis alkekengivar francheti polysaccharide[J]. The Science of Food and Agriculture,2009,89(9):1593-1598
[9]严奉伟,罗祖友,吴季勤.菜籽多糖的抗氧化作用与机理研究[J].中国农业科学,2005,38(1):157-162
[10]税丹,王立峰,袁建,等.酸法提取菜籽多糖的抗氧化活性研究[J].食品科学,2011,32(21):98-101
[11]毛丰玮.亚麻籽壳多糖的提取﹑分离纯化与结构研究[D]:浙江工商大学,2012
[12]张维杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999
[13]尹艳,高文宏,于淑娟.多糖提取技术的研究进展[J].食品工业科技,2007(2): 248-250
[14]郭振楚.糖类化学[M].北京:化学工业出版社,2005,106-180
[15]Xu W T, Zhang F F, Luo Y B, et al. Antioxidant activity of a water-soluble polysaccharide purified from Pteridium aquilinum [J]. Carbohydrate Research,2009,344 (2): 217-222
[16]Cai W R,Gu X H, Tang J. Extraction, purification, and characterization of the polysaccharides from Opuntia milpaalta [J]. Carbohydrate Polymers, 2008, 71(3): 403-410.
Isolation, Purification and Physicochemical Properties of the Polysaccharides from Camelina Sativa Gum
Li Zezhen1Di Jianbing1Chen Min2
(College of Food Science & Engineering,Shanxi Agricultural University1,Taigu 030801)(College of Food Science & Nutritional Engineering,China Agricultural University2,Beijing 100083)
The methods of deprotein from Camelina Sativa gum,isolating and purifying the polysaccharides, and determining the partial physicochemical characters of polysaccharides were investigated. Water extraction and alcohol precipitation are employed to isolate Camelina Sativa gum from seed shell. Comparison was carried out between three different methods, Sevag, combination of Sevag with trypsase, combination of Sevag with alkaline protease for deproteinization. After the removal of protein, the Camelina Sativa polysaccharides were purified by DEAE-cellulose chromatography. The purity is identified by polyacrylamide gel electrophoresis and UV scanning, while its structure and monosaccharides composition were analyzed by IR scanning and HPLC, and particial physicochemical properties are measured. The results showed that Sevag method combined with alkaline protease could greatly increases removal rate of protein;separated and purified Camelina sativa polysaccharide was an homogeneous component which contains uronic acids, pyranoid ring and β-glycosidic bond. And physichemical characters of CSP showed that it mainly contains rhamnose, xylose, arabinose and glucose in the molar ratio of 11.95∶13.95∶0.79∶0.27. CSP was an acidic polysaccharides with water-soluble, high viscosity.
camelina sativa polysaccharide, ioslation and puirifcation, physichemical characters
TS201.1
A
1003-0174(2016)06-0052-05
2015-04-29
李泽珍,女,1980年出生,讲师,果蔬贮藏与加工,天然产物开发
陈敏,女, 1956年出生,教授,天然产物开发

