EMS对工业大麻种子萌发的影响
姜颖
(黑龙江省科学院大庆分院,黑龙江大庆163319)
EMS对工业大麻种子萌发的影响
姜颖
(黑龙江省科学院大庆分院,黑龙江大庆163319)
研究不同浓度的化学诱变剂甲基磺酸乙酯(Ethylmethylsulfone,简称EMS)处理对工业大麻种子萌发的影响,测定工业大麻种子的发芽势、发芽率、胚根长、胚轴长,计算种子的发芽指数和活力指数,筛选各材料适宜的诱变浓度和诱变时间。结果显示:EMS处理“火麻一号”、“格里昂”和“金刀15”种子时适宜浓度均为1.5%,处理时间分别为8 h、6 h和8 h。
工业大麻;甲基磺酸乙酯;化学诱变;发芽率;活力指数
工业大麻(Cannabis sativa L.)浑身是宝,可从农业种植延伸到纺织、服装、造纸、军需、化工、新型建材、生物能源、食品保健、医药、饲料等十几个产业链[1-7],是重要的经济作物。但是,黑龙江省工业大麻生产种植过程中存在的主要问题是种质贫乏,品种混杂退化,遗传基础日趋狭窄,缺乏品质、产量优异的品种[8,9]。因此,开拓一种快速、简捷的方法进行种质资源改良、创新,在工业大麻育种上有着十分重要的意义。采用化学诱变产生突变体是创造新种质的有效途径之一,而EMS是一种良好的化学诱变剂,目前已成为在作物诱变育种中应用最广泛、应用效果最好的一种化学诱变剂[10,11]。
EMS诱导的突变主要是点突变,而且点突变的频率相对较高,染色体畸变相对较少,生理损伤小;诱变范围广,出现的突变体类型较多;Bird报道用EMS处理玉米花粉,突变频率可高达78%[12]。近年来甲基磺酸乙酯(EMS)诱变技术在作物育种中得到了广泛的应用,温岚等利用EMS和60Co-γ相结合的方法诱变黄麻,观察记录诱变黄麻苗期的形态学变化,分析诱变黄麻的代谢特性和抗性指标[13]。马海新等研究不同浓度的化学诱变剂EMS处理对加工番茄种子萌发的影响,筛选适宜的诱变浓度和诱变时间[14]。原小燕等用EMS处理不同品种的油菜种子,研究其萌发和生长情况[15]。本实验以“火麻一号”、“格里昂”和“金刀15”三个品种为试验材料,研究了EMS对工业大麻种子萌发及幼苗胚根、胚轴生长的影响,计算种子的发芽指数和活力指数,以筛选适宜的诱变浓度和诱变时间,为今后的化学诱变育种及定向诱导基因组局部突变技术(TILLING)材料创建提供依据。
1 材料与方法
1.1 试验地点
试验于2015年在黑龙江省科学院大庆分院麻类作物育种与良种繁育实验室进行。
1.2 试验材料
供试材料“火麻一号”是由黑龙江省科学院大庆分院选育出的新品种;“格里昂”和“金刀15”是在乌克兰引进来的,并且在试验区种植性状表现良好的品种。化学诱变剂甲基磺酸乙酯(EMS)为无色油状透明液体,Sigma M-0880。
1.3 试验方法
1.3.1 种子处理与发芽试验
工业大麻种子用EMS(用pH=7.5,0.1 mol/L磷酸钾缓冲液和二甲基亚砜(DMSO)配制),设0%、0.4%、0.8%、1.25%、1.5%、2.0%6个处理浓度)分别浸种处理4 h、6 h、8 h,处理过的种子用0.1mol/L硫代硫酸钠溶液冲洗5次,每次静置5 min以终止反应。然后将处理好的工业大麻种子整齐排列在铺有滤纸的培养皿中,每皿100粒,重复3次,置于人工气候培养箱内,24℃恒温下避光进行发芽试验。(0%是指用不含EMS的pH=7.5,0.1 mol/L磷酸钾缓冲液和二甲基亚砜(DMSO)浸种)。
1.3.2 发芽指标测定与数据处理
处理后第3 d测定发芽势,第5 d统计发芽率,工业大麻种子的发芽标准以幼根达种子直径长为标准。第5 d计算发芽率的同时测量工业大麻的胚轴长和胚根长,均以每一处理的随机10株的平均值表示。
发芽势(%)=3 d内发芽种子数/供试验种子数×100%
发芽率(%)=5 d内正常发芽种子数/供试种子总数×100%
发芽指数(GI)=∑(Gt/Dt)(Gt为t时间内的发芽数,Dt为相应的发芽天数)
活力指数(VI)=GI×S(GI为发芽指数,S为胚轴长+胚根长)
相对发芽指数(%)=各处理的发芽指数/对照的发芽指数×100%
相对活力指数(%)=各处理的活力指数/对照的活力指数×100%
采用SPSS 17.0处理软件和Excel2007进行方差分析,用新复极差法进行差异显著性检验。
2 结果与分析
2.1 EMS对工业大麻种子发芽势和发芽率的影响
从表可知,EMS抑制工业大麻种子的萌发,且总体上随着诱变剂浓度的增高和处理时间的延长,种子的发芽势和发芽率呈下降趋势。
对于“火麻一号”,当EMS处理浓度为2.0%,处理时间为6 h,发芽率接近50%,与对照间的差异极显著。当处理浓度为1.5%,处理时间为8 h时,发芽率接近50%,与对照间的差异极显著。
对于“格里昂”,当EMS处理浓度为2.0%,处理时间为4 h,以及当处理浓度为1.5%,处理时间为6 h时,发芽率接近半致死率,与对照间的差异极显著。
对于“金刀15”,当EMS处理浓度为1.5%,处理时间为8 h,发芽率接近50%,与对照间的差异显著。当处理浓度为2.0%,处理时间为8 h时,发芽率接近50%,与对照间的差异极显著。
可见,不同品种的工业大麻种子对EMS的敏感性不同,“格里昂”对EMS的敏感性要高于另外两个品种。
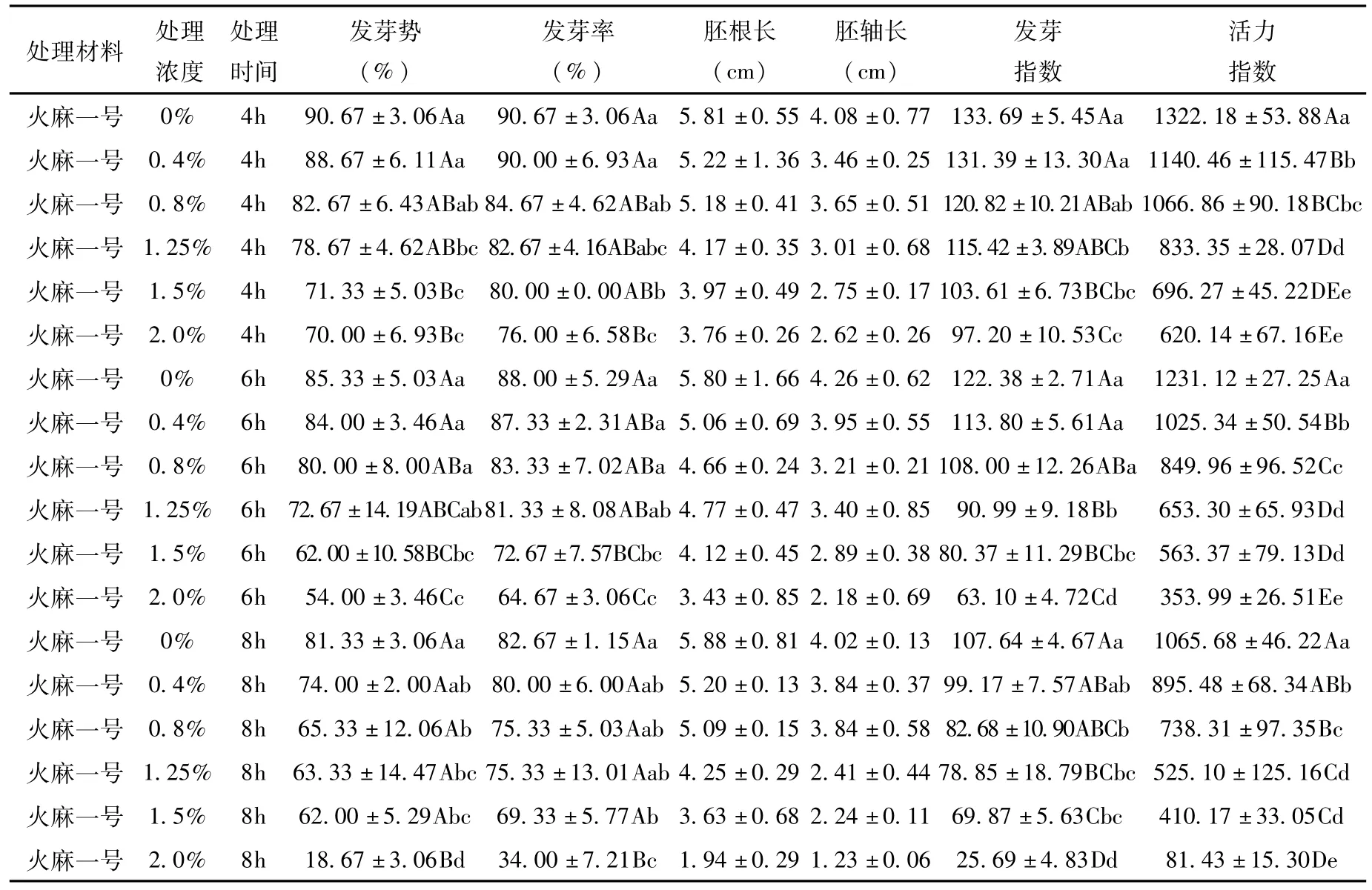
表1 EMS对“火麻一号”种子萌发的影响Tab.1 Effect of EMS mutagenesis on seed germination of“Huo Ma No.1”
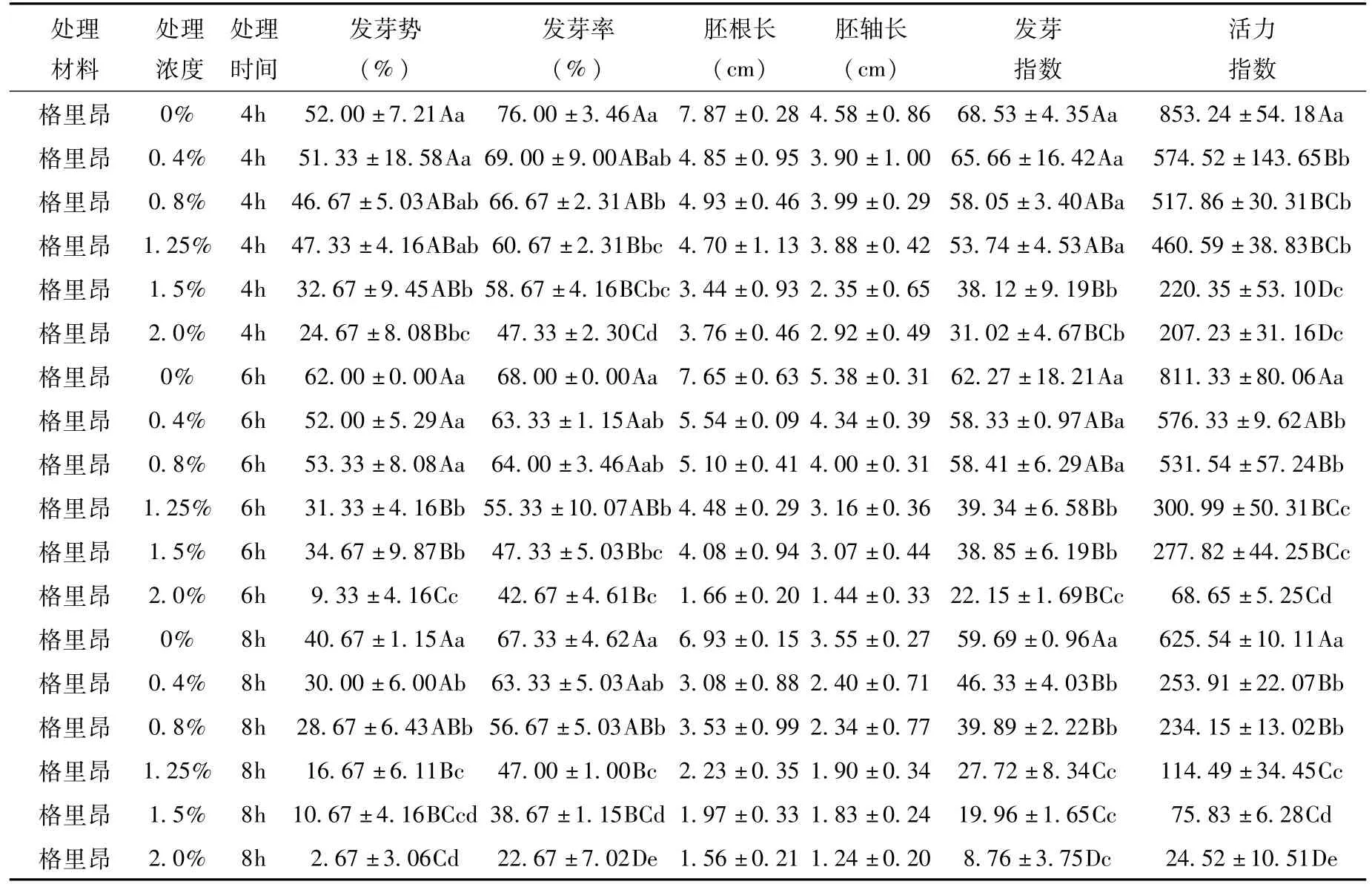
表2 EMS对“格里昂”种子萌发的影响Tab.2 Effect of EMS mutagenesis on seed germination of“Ge Liang”
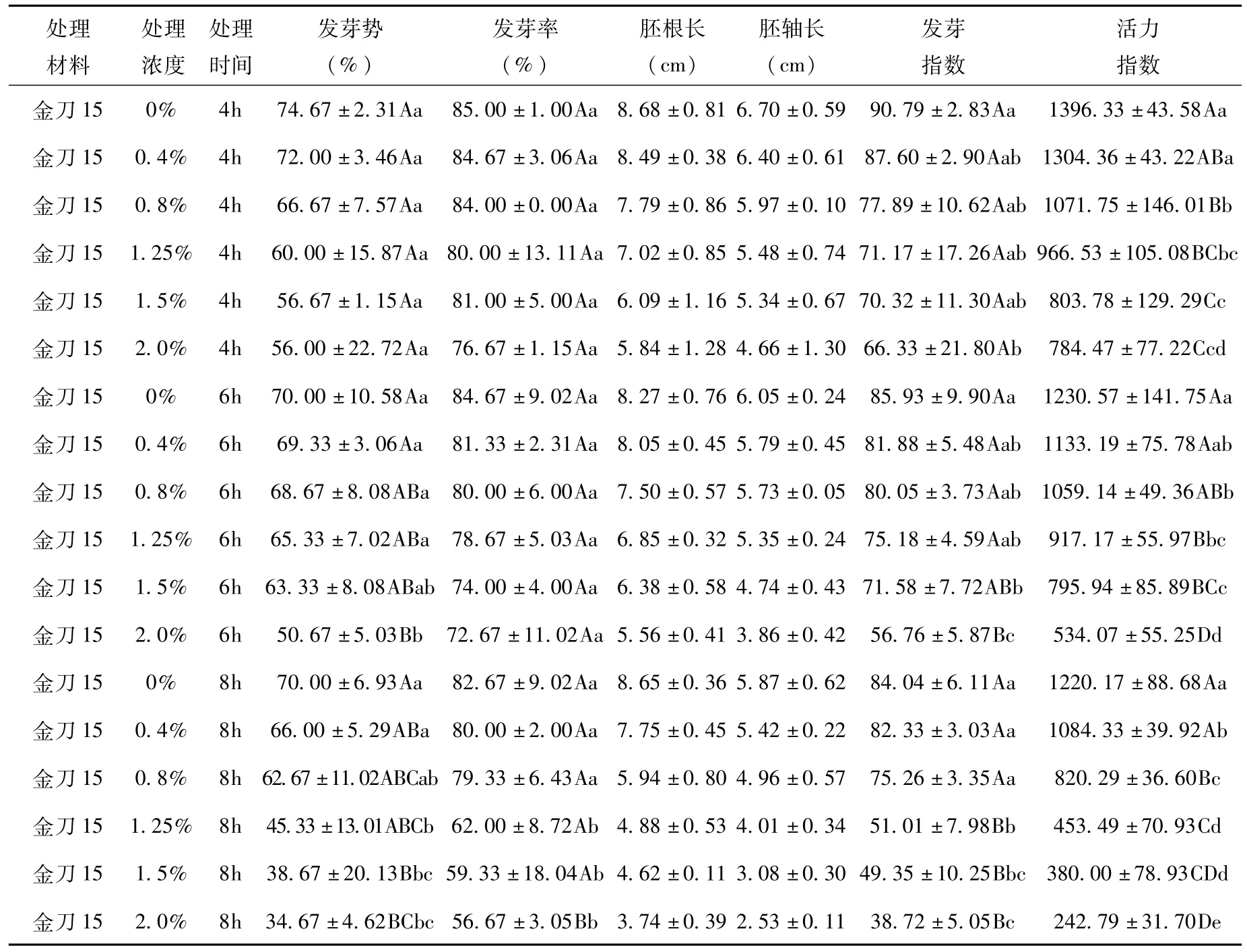
表3 EMS对“金刀15”种子萌发的影响Tab.3 Effect of EMS mutagenesis on seed germination of“Jin Dao No.15”
2.2 EMS对工业大麻种子发芽指数和活力指数的影响
从表可知,随着EMS浓度的增加和处理时间的延长,工业大麻种子的发芽指数和活力指数均降低,对于“火麻一号”,当EMS处理浓度为2.0%,处理时间为6 h,其相对活力指数达到28.75%;当处理浓度为1.5%,处理时间为8 h时,其相对活力指数达到38.49%。
对于“格里昂”,当EMS处理浓度为2.0%,处理时间为4 h,其相对活力指数达到24.28%;当处理浓度为1.5%,处理时间为6 h时,其相对活力指数达到34.24%。
对于“金刀15”,当EMS处理浓度为1.5%,处理时间为8 h,其相对活力指数达到31.14%;当处理浓度为2.0%,处理时间为8 h时,其相对活力指数达到19.90%。
由表可知,“火麻一号”的相对发芽指数要高于“金刀15”的相对发芽指数,“金刀15”的相对发芽指数要高于“格里昂”的相对发芽指数,可见“格里昂”对EMS更为敏感。
2.3 EMS对工业大麻幼苗胚根长和胚轴长的影响
从表可知,整体看来随着EMS浓度的增大和处理时间的延长,对胚根长和胚轴长的抑制作用逐渐增大。
由表可知,对于“火麻一号”,当EMS处理浓度为2.0%,处理时间为6 h,其对苗高的抑制达到48.82%;当处理浓度为1.5%,处理时间为8 h时,其对苗高的抑制达到44.28%。
对于“格里昂”,当EMS处理浓度为2.0%,处理时间为4 h,其对苗高的抑制达到36.24%;当处理浓度为1.5%,处理时间为6 h时,其对苗高的抑制达到42.94%。
对于“金刀15”,当EMS处理浓度为1.5%,处理时间为8 h,其对苗高的抑制达到47.53%;当处理浓度为2.0%,处理时间为8 h时,其对苗高的抑制达到56.90%。
3 结论与讨论
实验结果表明,EMS对工业大麻种子萌发随着浓度的增大以及处理时间的延长,抑制效应越明显,EMS浓度和时间的变化会导致发芽势、发芽率、发芽指数、活力指数、胚轴长、胚根长下降。同时3个品种对EMS的敏感性差别很大,“格里昂”对EMS的敏感性要高于另外两个品种,其原因可能是由于“格里昂”种皮存在裂缝的特点。因此,针对不同品种确定其适宜处理浓度是工业大麻化学诱变工作中的关键。可根据种子萌发率的高低来确定适宜处理浓度,一般认为,取种子萌发的半致死剂量作为大田处理的浓度[16]。发芽指数和活力指数是良好的种子活力指标,特别是活力指数,既包括了发芽总数和发芽速率的信息,又反映了幼苗的生长势,因此可以很好地反映EMS对种子的影响[17]。胡延吉认为,化学诱变剂的适宜剂量是以降低10%~30%的苗高为适宜剂量[18]。原小燕认为,活力指数和苗高可以作为EMS浓度的选择指标,相对活力指数为50%和苗高抑制率为10%~30%时,可作为EMS浓度筛选的依据[15]。所以,综合分析,EMS处理“火麻一号”、“格里昂”和“金刀15”种子时适宜浓度均为1.5%,处理时间分别为8 h、6 h和8 h。通过浓度梯度和时间梯度筛选出用于EMS处理不同工业大麻种子的最佳浓度和时间,为后续工业大麻诱变群体的构建奠定基础。
[1]杨阳,张云云,苏文君等.工业大麻纤维特性与开发利用[J].中国麻业科学,2012,34(5):237-240.
[2]刘大勇.六安大麻纤维纺织开发利用的探讨[C].全国纺纱新技术、新纤维应用研讨会,2011:242-248.
[3]S.Radu,T.Robu.Effects and efficiency of dietary hemp seed and flaxseed oils on the human metabolic function[J].Journal of environmental protection and ecology,2014,15(1).
[4]Delfin Rodriguez-Leyva,Grant N Pierce.The cardiac and haemostatic effects of dietary hempseed[J].Nutrition&Metabolism,2010,7:32.
[5]Min Jung Lee,Min Soo Park,Soojin Hwang,et al.Dietary hempseed meal intake increases body growth and shortens the larval stage via the upregulation of cell growth and sterol levels in Drosophila melanogaster[J].Molecules and Cells,2010,30(1):29-36.
[6]孙川棋,周涛.汉麻——柔软健康的“盔甲”[J].中国科技奖励.2012(4):71-73.
[7]胡尊红,郭鸿彦,胡学礼,等.大麻品种遗传多样性的AFLP分析[J].植物遗传资源学报.2012,13(4):555-561.
[8]关凤芝.大麻遗传育种与栽培技术[M].黑龙江人民出版社,2011,25-52.
[9]熊和平.麻类作物育种学[M].中国农业科学技术出版社,2008,297-317.
[10]Wang N,Wang Y J,Tian F,et al.A functional genomics resource for Brassica napus:development of an EMS mutagenized population and discovery of FAE1 point mutations by TILLING[J].New Phytologist,2008,180(4):751-765.
[11]Stephenson P,Baker D,Girin T,et al.A rich TILLING resource for studying gene function in Brassica rapa[J].BMC Plant Biology,2012,10:62.
[12]Bird,R.Mck.,and M.G.Neuffer.Induced mutations in maize.In:J.Janick(ed.).Plant Breeding Reviews(5)[J].New York:Van Nostrand Reinhold,1987,139-180.
[13]温岚,龚友才,陈基权等.EMS和60Co-γ射线辐照复合诱变黄麻突变体苗期生理生化特性研究[J].中国麻业科学. 2014,36(5):226-231.
[14]马海新,庞胜群,杨邦杰等.EMS诱变对加工番茄种子萌发的影响[J].种子.2015,34(5):28-33.
[15]原小燕,李加纳,刘列钊.EMS对油菜种子萌发的影响[J].西南师范大学学报.2010,35(3):217-221.
[16]祝丽英.利用EMS花粉诱变创造玉米新种质及其突变体鉴定方法的研究[D].青岛:青岛建筑工程学院,2000.
[17]高捍东.种子活力测定方法及其评价[J].种子.1990,(6):33-35.
[18]胡延吉.植物育种学[M].北京:高等教育出版社,2003:193-194.
Effect of EMS Mutagenesis on Seed Germination of Industrial hemp(Cannabis sativa L.)
JIANG Ying
(Daqing Branch of Heilongjiang Academy of Sciences,Daqing 163319,Heilongjiang,China)
This project aimed to study the effect of different concentrations of chemical mutagen EMS on seed germination of industrial hemp.The seeds germination potential,germination rate and hypocotyl length,radicle length were measured to calculate the seed germination index and vigor index through seeds germination test.Then appropriate mutagenesis concentration and mutagenesis time of different varieties were confirmed.The result showed that the appropriate concentration of EMS treatment processing industrial hemp seed“Huo Ma No.1”,“Ge Liang”,“Jin Dao No.15”all were 1.5%,and the appropriate time were 8h,6h,8h respectively.
industrial hemp;EMS;chemical mutagenesis;germination rate;vigor index
S563.3
A
1671-3532(2016)06-0258-05
2016-06-20
黑龙江省青年科学基金(QC2016037)
姜颖(1986-),女,助理研究员,研究方向作物遗传育种。E-mail:bazhujiangying@126.com

