原发性阑尾黏液性肿瘤的临床特点和生存分析
马 越 涂水平
上海交通大学医学院附属仁济医院肿瘤科(200127)
原发性阑尾黏液性肿瘤的临床特点和生存分析
马 越*涂水平#
上海交通大学医学院附属仁济医院肿瘤科(200127)
背景:原发性阑尾黏液性肿瘤(AMN)临床少见,病理上分为黏液性腺瘤/囊腺瘤(MA)、低级别阑尾黏液性肿瘤(LAMN)、低级别腹膜假黏液瘤(PMP-L)、阑尾黏液腺癌(MAC)、高级别腹膜假黏液瘤(PMP-H)5种类型,后三者在临床上被认定为恶性肿瘤。目的:探讨原发性AMN的临床特点和预后因素。方法:回顾性分析2004年1月—2015年12月上海交通大学医学院附属仁济医院收治的23例原发性AMN患者的临床病理资料,采用Kaplan-Meier法行生存分析,分别采用单因素和多因素分析评估影响患者预后的因素。结果:23例AMN患者的中位生存率(OS)为56.13个月,中位无进展生存率(PFS)为53.79个月。单因素分析显示,病理分类、局部淋巴结转移、疾病进展是影响患者OS的因素(P<0.05);病理分类、局部淋巴结和远处转移、实质脏器累及、腹膜假黏液瘤(PMP)形成是影响患者PFS的因素(P<0.05)。多因素分析显示,局部淋巴结转移是影响患者PFS的独立因素(P=0.042)。在15例恶性AMN患者中,单因素分析显示局部淋巴结转移是影响患者OS的因素(P=0.014)。多因素分析显示,局部淋巴结转移(P=0.010)、实质脏器累及(P=0.012)、PMP形成(P=0.042)、术后腹腔化疗(P=0.037)是影响患者PFS的独立因素。结论:AMN患者伴有局部淋巴结转移易发生疾病进展;病理为恶性肿瘤且伴有局部淋巴结转移或疾病进展者的预后差。局部淋巴结转移、实质脏器累及、PMP形成、术后未行腹腔化疗的恶性AMN患者易发生疾病进展,局部淋巴结转移的恶性AMN患者预后可能较差。
阑尾肿瘤; 无病生存; 危险因素; 治疗
Background: Primary appendiceal mucinous neoplasm (AMN) is rare in clinic and is classified into 5 groups including mucinous adenoma (MA), low grade appendiceal mucinous neoplasm (LAMN), low grade pseudomyxoma peritoneum (PMP-L), mucinous adenocarcinoma (MAC) and high grade pseudomyxoma peritoneum (PMP-H) based on pathology. PMP-L, MAC and PMP-H are identified as malignant tumors in clinic. Aims: To investigate the clinical characteristics and prognostic factors of primary AMN. Methods: The clinical data of 23 patients with primary AMN treated at Ren Ji Hospital of Shanghai Jiao Tong University School of Medicine from January 2004 to December 2015 were retrospectively analyzed. The survival was analyzed by Kaplan-Meier method. The influencing factors were analyzed by univariate and multivariate models. Results: The median overall survival (OS) and median progression-free survival (PFS) of 23 patients were 56.13 months and 53.79 months, respectively. Univariate analysis revealed that pathological categorization, regional lymph node metastasis and disease progression were the influencing factors of OS (P<0.05). Pathological categorization, regional lymph node and distant metastasis, organ involvement, pseudomyxoma peritoneum (PMP) formation were the influencing factors of PFS (P<0.05). Multivariate analysis showed that regional lymph node metastasis was the independent influencing factor of PFS (P=0.042). In 15 patients with malignant AMN, univariate analysis revealed that regional lymph node metastasis was the influencing factor of OS (P=0.014). Multivariate analysis showed that regional lymph node metastasis (P=0.010), organ involvement (P=0.012), PMP formation (P=0.042) and intraperitoneal chemotherapy (P=0.037) were independent influencing factors of PFS. Conclusions: AMN patients with regional lymph node metastasis are easily to have disease progression. The prognosis of pathologically malignant tumor patient with regional lymph node metastasis or progression of disease is poor. Malignant AMN patients with regional lymph node metastasis, organ involvement, PMP formation, not receiving intraperitoneal chemotherapy postoperatively are likely to have disease progression, and malignant AMN patients with regional lymph node metastasis have poor prognosis.
原发性阑尾肿瘤可分为上皮性肿瘤和非上皮性肿瘤两大类,前者依据是否分泌黏液分为阑尾黏液性肿瘤和阑尾非黏液性肿瘤。阑尾黏液性肿瘤(appendiceal mucinous neoplasm, AMN)是阑尾肿瘤的主要病理类型之一,临床相对少见,仅占结直肠癌的1%[1-3]。根据2010年消化系统肿瘤WHO分类和AJCC癌症分期手册中的标准,将AMN分为黏液性腺瘤/囊腺瘤(mucinous adenoma, MA)、低级别阑尾黏液性肿瘤(low grade appendiceal mucinous neoplasm, LAMN)、起源于阑尾的低级别腹膜假黏液瘤(low grade pseudomyxoma peritoneum, PMP-L)、阑尾黏液腺癌(mucinous adenocarcinoma, MAC)以及起源于阑尾的高级别腹膜假黏液瘤(high grade pseudomyxoma peritoneum, PMP-H)5种病理类型。前3者为非浸润性病变,病理学上属良性病变,后2者为浸润性病变,属恶性病变[4-5]。但阑尾腔内的黏液可播散至腹腔形成腹膜假黏液瘤(PMP),具有侵袭性的临床行为,故被认定为恶性肿瘤[6]。
目前对AMN的认识尚不充分,本研究通过回顾性分析23例原发性AMN的临床病理资料,分析其临床特点和预后,旨在为原发性AMN的诊治提供参考。
对象与方法
一、研究对象
选取2004年1月—2015年12月上海交通大学医学院附属仁济医院肿瘤科收治的原发性AMN患者,根据2010年消化系统肿瘤WHO分类和AJCC癌症分期手册中的标准[4-5],所有患者术后病理诊断均符合AMN,排除仅出现阑尾杯状细胞类癌、管状类癌和其他非肿瘤性黏液性病变。
二、研究方法
回顾性分析AMN患者的临床病理资料,并对患者随访至2016年2月29日,随访2~134个月,中位36个月。
三、统计学分析
采用SPSS 18.0统计软件,以Kaplan-Meier法行生存分析,采用Log rank检验行影响因素的单因素分析,Cox回归模型行多因素分析。检验水准α=0.05。
结 果
一、一般资料
共纳入23例原发性AMN患者,其中男7例,女16例,发病年龄42~79岁,中位年龄66岁。5例因急性腹痛行急性阑尾炎手术发现,13例因腹部包块就诊,2例因慢性腹痛就诊,2例因腹胀就诊,1例因腹痛伴腹胀就诊。术前11例癌胚抗原(CEA)升高,7例CA19-9升高,8例CA125升高,6例CA50升高。病理为良性肿瘤者11例,其中MA 1例,LAMN 7例,PMP-L 3例;恶性肿瘤12例,其中MAC 5例,PMP-H 7例。从临床行为上分类,良性肿瘤8例,恶性肿瘤15例。肠梗阻6例。
二、治疗方法
23例患者均行手术治疗,其中行右半结肠切除术6例,阑尾切除术4例,回盲部部分切除术4例,5例行阑尾、大网膜和附件切除术,4例行探查活检术。2例局部淋巴结转移,11例远处转移,其中4例为腹膜外远隔转移,7例仅腹腔转移。将肿瘤性黏液和上皮成分浸润至脏器实质判定为实质脏器累及,6例患者累及实质脏器,包括卵巢和输卵管。术后12例患者接受静脉化疗,其中3例为5-氟尿嘧啶(5-fluorouracil, 5-Fu)单药,2例为FP方案(顺铂+5-Fu),4例为FOLFOX方案(奥沙利铂+亚叶酸钙+5-Fu),1例为FOLFOX联合贝伐单抗,2例为FOLFIRI方案(伊立替康+亚叶酸钙+5-Fu)。4例患者行术后腹腔化疗,分别为顺铂联合5-Fu、奈达铂、伊立替康、5-Fu。11例患者术后出现疾病进展,其中2例再次接受化疗和减瘤术,3例再次接受化疗,1例行减瘤术。
三、生存和疾病进展情况
Kaplan-Meier法显示,23例患者累计1、3、5、10年生存率(overall survival, OS)分别为95%、82%、43%、43%,中位OS为56.13个月。累计1、3、5、10年无进展生存率(progression-free survival, PFS)分别为73%、67%、30%、30%,中位PFS为53.79个月。15例恶性AMN患者中(包括病理的PMP-L、MAC和PMP-H),累计1、3、5年OS分别为93%、74%、27%,中位OS为51.54个月;累计1、3、5年PFS分别为60%、53%、11%,中位PFS为48.92个月。因该亚组的最长随访时间为97个月,未能得出10年的OS和PFS。
四、生存和疾病进展影响因素分析
单因素分析显示,病理分类、局部淋巴结转移、疾病进展是影响患者OS的因素(P<0.05),病理分类、局部淋巴结和远处转移、实质脏器累及、PMP形成均是影响患者PFS的因素(P<0.05)(表1)。多因素分析显示,病理分类、局部淋巴结转移、疾病进展不是影响患者OS的独立因素(P>0.05),局部淋巴结转移是影响患者PFS的独立因素(P=0.042)(表2)。
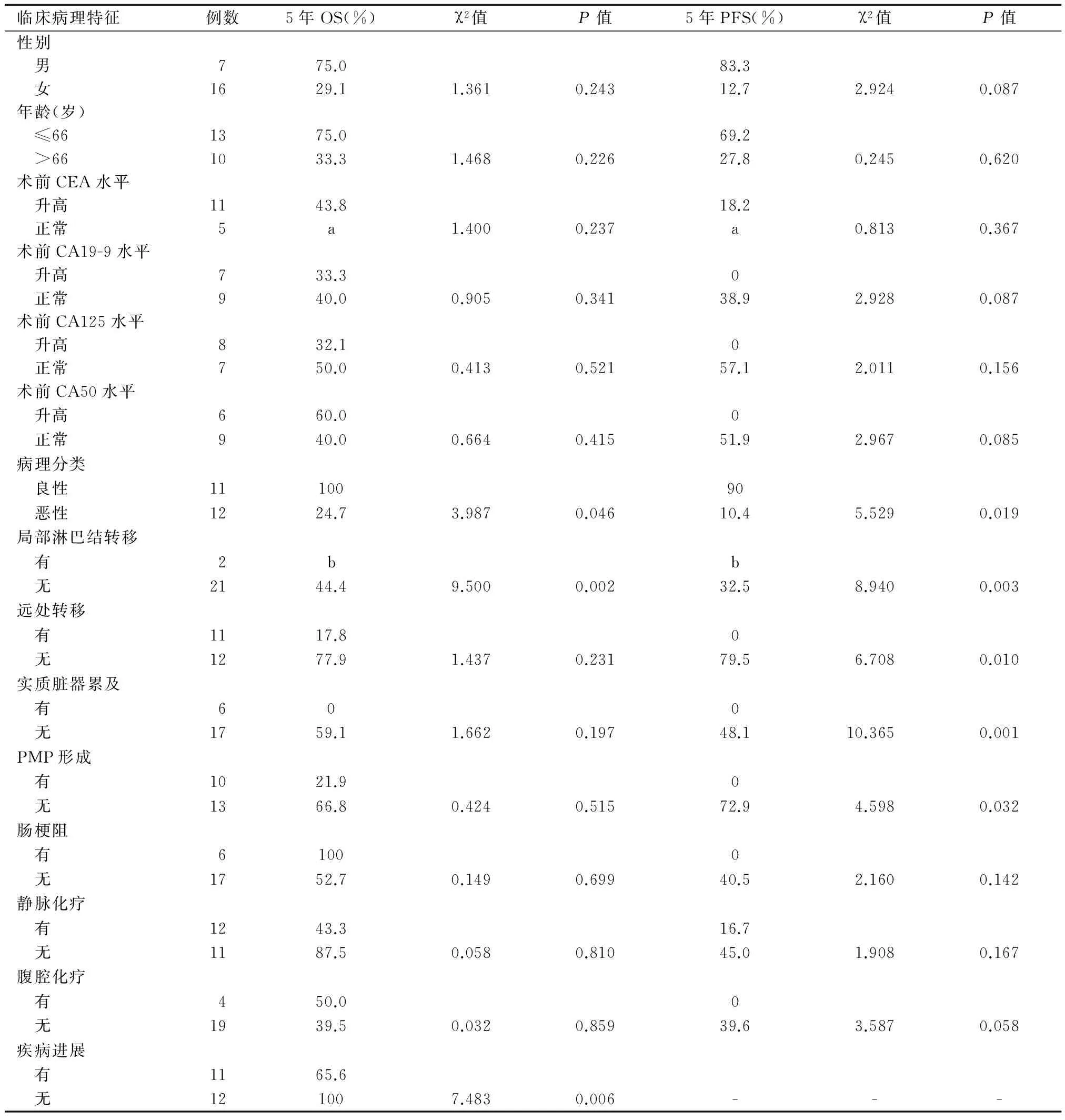
表1 23例AMN患者OS、PFS的单因素分析
a表示最长随访时间48个月,b表示最长随访时间为14个月,未能得到5年OS和PFS
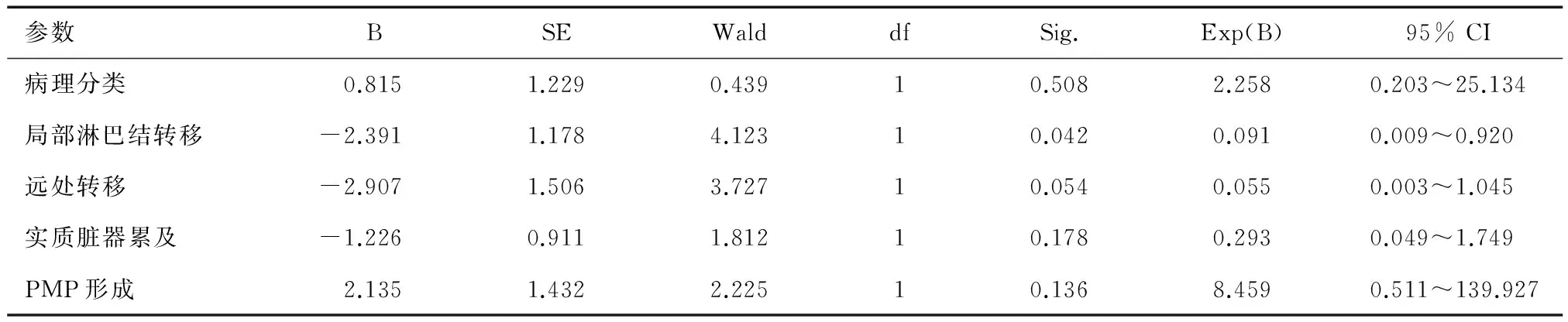
表2 影响AMN患者PFS的Cox回归模型多因素分析
对15例恶性AMN患者行单因素分析发现,局部淋巴结转移是影响OS的因素(P=0.014)。局部淋巴结转移、实质脏器累及是影响PFS的因素(P=0.026;P=0.039)。多因素分析显示,局部淋巴结转移(P=0.010)、实质脏器累及(P=0.012)、PMP形成(P=0.042)、术后腹腔化疗(P=0.037)是影响患者PFS的独立因素(表3)。在12例术后接受静脉化疗的患者中,铂类联合5-Fu的化疗方案的OS和PFS与伊立替康联合5-Fu的化疗方案无明显差异(OS:P=0.976;PFS:P=0.508)。
讨 论
AMN好发于中老年,国外报道其发病年龄集中在40岁以上,平均年龄45~70岁,男女均可发病,女性略高于男性[7]。本研究23例患者发病年龄最小42岁,女性占69.6%,男性5年OS和PFS高于女性,但差异无统计学意义(P>0.05)。AMN临床表现无特异性,起病以右下腹痛和腹部包块最为常见,亦可出现腹胀、肠梗阻、尿路梗阻等症状。影像学表现可见右下腹占位、网膜增厚或钙化、腹水等,但容易误诊为附件来源的肿瘤。腹水穿刺可见黏冻状液体,但涂片中细胞成分少,形态学往往无法鉴别[8]。因此,AMN术前易误诊为急慢性阑尾炎、阑尾脓肿、结肠恶性肿瘤或卵巢恶性肿瘤等。
血清肿瘤标记物CEA、CA19-9对MAC和PMP的诊断有价值。有文献报道,AMN患者中,术前CEA升高占58%,CA19-9升高占67%;在术后复发病例中,CEA升高的比例高达91%,患者预后较差,而CEA和CA19-9正常者的预后较好[7,9]。本研究检测肿瘤标记物(MA患者未检测)发现,CEA升高占68.8%,CA19-9升高占43.8%,CA125升高占53.3%,CA50升高占40.0%。术后出现复发或转移患者中,CEA和CA19-9升高比例为66.7%;CA125升高占75%,CA50升高占62.5%。PMP患者术前血清CEA、CA19-9、CA125、CA50水平较高。但其是否升高与患者的OS和PFS无明显相关性(P>0.05)。
WHO分类提示LAMN患者需定期随访监测有无复发或进展的可能;PMP等同于MAC,发生PMP的患者,不论是高级别还是低级别,均会出现复发和死亡[10]。但有研究[11]认为,PMP-L多源自于LAMN,PMP-H多源自于MAC,两者预后有明显差异。张梅等[12]对70例AMN患者进行分析发现,MA组发生复发或进展的比例为0,LAMN组为7.3%,PMP-L组为28.6%,MAC组为42.9%,PMP-H组为50.0%;MA和LAMN组死亡比例为0,PMP-L和MAC组为14.3%,PMP-H组为50.0%;5组的OS和PFS差异均有统计学意义(P<0.05,P<0.01)。本研究中,MA组和LAMN组无复发和死亡患者;PMP-L组复发比例为33.3%,死亡比例为0;MA组复发和死亡比例均为60.0%;PMP-H组患者均发生复发或进展,死亡比例为57.1%。因例数较少,5组的OS和PFS未行统计学分析,但病理恶性肿瘤者的OS和PFS明显低于病理良性者(P<0.05)。多因素分析显示,PMP形成患者易发生疾病进展。AMN转移多为盆腔广泛种植性转移,较少发生淋巴结途径转移,几乎不会通过血液途径转移至肝脏、肺脏等远处脏器[13-14]。局部淋巴结是否受累是胃肠道恶性肿瘤的重要预后因素之一,本研究多因素分析发现,局部淋巴结转移的恶性AMN患者易发生疾病进展(P=0.010)。

表3 影响恶性AMN患者PFS的Cox回归模型多因素分析
手术是确诊和治疗AMN的主要方法,不同手术方法对预后的影响尚无定论。MA行局部阑尾切除即可。LAMN患者存在复发或转移风险,需定期随访。MAC患者首选右半结肠切除术,但病变局限期的手术方案存在争议。有研究报道,与右半结肠切除术相比,Ⅰ期和Ⅱ期患者单纯阑尾切除术的5年OS无明显差异。但对于Ⅲ期和Ⅳ期患者,右半结肠切除术可提高OS[15-16]。PMP目前主张采用肿瘤细胞减灭术联合围手术期的术中腹腔内热灌注化疗(intraoperative hyperthermic intraperitoneal chemotherapy, HIPEC)[17]。但有研究发现,HIPEC治疗后部分患者肿瘤发展迅速,因而对其可靠性提出质疑[18]。但多数研究证实,HIPEC能显著提高PMP患者的无瘤生存时间和总生存时间,减少病死率[19-20]。术后早期腹腔内灌注化疗(early postoperative intraperitoneal chemotherapy, EPIC)亦有一定的治疗效果,有研究表明手术联合HIPEC对PMP的疗效明显优于联合EPIC;手术联合HIPEC和EPIC对PMP-L的疗效明显优于单独应用HIPEC或EPIC[21-22]。本研究中,无患者接受HIPEC,但接受EPIC的恶性肿瘤患者PFS长于未接受治疗者。
虽然PMP对全身化疗并不敏感,但对于无法行完整肿瘤减灭术者、PMP-H患者、AMN复发或进展患者,仍推荐全身化疗[23]。常用的化疗药物包括丝裂霉素、5-Fu和铂类。有研究表明,血管内皮生长因子在肿瘤组织的表达与MAC腹膜转移的总生存数相关;西妥西单抗在治疗MAC腹膜转移中有良好的临床效果[24-25]。Sun等[26]报道,对耐药或复发的PMP患者采用贝伐单抗联合卡培他滨方案化疗,有利于病情的稳定,减少药物不良反应,提高疗效。本研究中,全身化疗并未提高恶性AMN患者OS和PFS,但在血清肿瘤标记物升高的患者中,5-Fu为基础的全身化疗可显著降低肿瘤标记物水平。仅1例患者使用贝伐单抗,无患者使用西妥西单抗。随着更多新药的研发,全身化疗在PMP治疗中的地位可能会有所提高。
原发性AMN少见,近年随着检查方法的改进和手术率的提高,才逐渐被国内外医师们所重视。2010年前AMN及其亚型的病理学分类命名有较大争议,增加了诊断难度。AMN患者总体生存率较高,存活时间长,但失访率相对高。本研究仅纳入了23例资料相对完全且能完成随访的患者。证实AMN患者伴有局部淋巴结转移易发生疾病进展;病理为恶性肿瘤且伴有局部淋巴结转移和疾病进展者的预后差。局部淋巴结转移、实质脏器累及、PMP形成、术后未行腹腔化疗的恶性AMN患者易发生疾病进展,局部淋巴结转移的恶性AMN患者预后可能较差。应根据不同的病理类型和临床情况采用不同的手术和化疗方案,减少复发,提高患者的生存期。但本研究例数较少,需行多中心研究收集更多的患者,进行临床分型分类治疗,为下一步大样本、多中心的研究打下基础。
1 Shankar S, Ledakis P, El Halabi H, et al. Neoplasms of the appendix: current treatment guidelines[J]. Hematol Oncol Clin North Am, 2012, 26 (6): 1261-1290.
2 Benedix F, Reimer A, Gastinger I, et al; Study Group Colon/Rectum Carcinoma Primary Tumor. Primary appendiceal carcinoma -- epidemiology, surgery and survival: results of a German multi-center study[J]. Eur J Surg Oncol, 2010, 36 (8): 763-771.
3 武忠弼, 杨光华. 中华外科病理学[M]. 北京: 人民卫生出版社, 2002: 718-723.
4 Bosman FT; World Health Organization, International Agency for Research on Cancer. WHO classification of tumours of the digestive system[M]. Lyon: International Agency for Research on Cancer, 2010: 417.
5 Edge SB; American Joint Committee on Cancer, American Cancer Society. AJCC cancer staging handbook: from the AJC cancer staging manual[M]. New York: Springer, 2010: 718.
6 Reu S, Neumann J, Kirchner T. Mucinous neoplasms of the vermiform appendix, pseudomyxoma peritonei, and the new WHO classification [Article in German] [J]. Pathologe, 2012, 33 (1): 24-30.
7 Carmignani CP, Hampton R, Sugarbaker CE, et al. Utility of CEA and CA 19-9 tumor markers in diagnosis and prognostic assessment of mucinous epithelial cancers of the appendix[J]. J Surg Oncol, 2004, 87 (4): 162-166.
8 O’Donnell ME, Carson J, Garstin WI. Surgical treatment of malignant carcinoid tumours of the appendix[J]. Int J Clin Pract, 2007, 61 (3): 431-437.
9 魏振军, 梁浩. 阑尾黏液腺癌临床资料回顾性调查分析[J]. 人民军医, 2007, 50 (10): 604-605.
10 Yantiss RK, Shia J, Klimstra DS, et al. Prognostic significance of localized extra-appendiceal mucin deposition in appendiceal mucinous neoplasms[J]. Am J Surg Pathol, 2009, 33 (2): 248-255.
11 Carr NJ, Finch J, Ilesley IC, et al. Pathology and prognosis in pseudomyxoma peritonei: a review of 274 cases[J]. J Clin Pathol, 2012, 65 (10): 919-923.
12 张梅, 高凤娟, 孟凡青, 等 阑尾黏液性肿瘤病理学特征及预后分析[J]. 中华胃肠外科杂志, 2014, 17 (1): 65-70.
13 Young RH. Pseudomyxoma peritonei and selected other aspects of the spread of appendiceal neoplasms[J]. Semin Diagn Pathol, 2004, 21 (2): 134-150.
14 González-Moreno S, Sugarbaker PH. Right hemicolectomy does not confer a survival advantage in patients with mucinous carcinoma of the appendix and peritoneal seeding[J]. Br J Surg, 2004, 91 (3): 304-311.
15 McGory ML, Maggrd MA, Kang H, et al. Malignancies of the appendix: beyond case series reports[J]. Dis Colon Rectum, 2005, 48 (12): 2264-2271.
16 Walters KC, Paton BL, Schmelzer TS, et al. Treatment of appendiceal adenocarcinoma in the United States: penetration and outcomes of current guidelines[J]. Am Surg, 2008, 74 (11): 1066-1068.
17 Sugarbaker PH. Are there curative options to peritoneal carcinomatosis? [J]. Ann Surg, 2005, 242 (5): 748-750.
18 Smeenk RM, Verwaal VJ, Antonini N, et al. Progression of pseudomyxoma peritonei after combined modality treatment: management and outcome[J]. Ann Surg Oncol, 2007, 14 (2): 493-499.
19 Spiliotis JD, Halkia EA, Efstathiou E. Peritoneal carcinomatosis 2011; it’s about time for chemosurgery[J]. J BUON, 2011, 16 (3): 400-408.
20 Dubé P, Sideris L, Law C, et al. Guidelines on the use of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in patients with peritoneal surface malignancy arising from colorectal or appendiceal neoplasms[J]. Curr Oncol, 2015, 22 (2): e100-e112.
21 Chua TC, Liauw W, Zhao J, et al. Comparative analysis of perioperative intraperitoneal chemotherapy regimen in appendiceal and colorectal peritoneal carcinomatosis[J]. Int J Clin Oncol, 2013, 18 (3): 439-446.
22 Elias D, Gilly F, Quenet F, et al; Association Française de Chirurgie. Pseudomyxoma peritonei: a French multicentric study of 301 patients treated with cytoreductive surgery and intraperitoneal chemotherapy[J]. Eur J Surg Oncol, 2010, 36 (5): 456-462.
23 Kelly KJ. Management of appendix cancer[J]. Clin Colon Rectal Surg, 2015, 28 (4): 247-255.
24 Andreopoulou E, Safa M, Escalon J, et al. Phase Ⅱ study of cetuximab in mucinous peritoneal carcinomatiosis[J]. J Clin Oncol ASCO Annual Meeting Proceedings Part I. No.18S, 2006, 24: 14020.
25 Logan-Collins JM, Lowy AM, Robinson-Smith TM, et al. VEGF expression predicts survival in patients with peritoneal surface metastases from mucinous adeno-carcinoma of the appendix and colon[J]. Ann Surg Oncol, 2008, 15 (3): 738-744.
26 Sun WL, Hutarew G, Gradl J, et al. Successful antiangiogenic combination therapy for pseudomyxoma peritonei with bevacizumab and capecitabine[J]. Cancer Biol Ther, 2009, 8 (15): 1459-1462.
(2016-03-30收稿;2016-05-03修回)
Clinical Features and Survival Analysis of Primary Appendiceal Mucinous Neoplasm
MAYue,TUShuiping.
DepartmentofOncology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity,Shanghai(200127)
Correspondence to: TU Shuiping, Email: tushuiping@yahoo.com
Appendiceal Neoplasms; Disease Progression; Risk Factors; Therapy
10.3969/j.issn.1008-7125.2016.11.005
*Email:aoyungogo84@126.com
#本文通信作者,Email:tushuiping@yahoo.com

