桑白皮黄酮提取物对2型糖尿病大鼠胰岛素抵抗的影响
高颖,高英,李艳,李卫民,袁捷
(广州中医药大学中药学院,广东广州510006)
·中药药理·
桑白皮黄酮提取物对2型糖尿病大鼠胰岛素抵抗的影响
高颖,高英,李艳,李卫民,袁捷
(广州中医药大学中药学院,广东广州510006)
【目的】观察桑白皮黄酮提取物对2型糖尿病大鼠(T2DM)胰岛素抵抗的作用。【方法】采用高脂饲料喂养联合糖皮质激素灌胃法复制2型糖尿病大鼠模型。将40只SD大鼠分成4组:正常对照组、模型组、罗格列酮组和桑白皮黄酮提取物组(以下简称中药组),每组10只。灌胃给药10周。于给药6、10周末,测量大鼠空腹血糖(FBG)、总胆固醇(TC)和甘油三酯(TG)水平,空腹胰岛素(INS)含量,并计算胰岛素抵抗指数(HOMA-IR);于第10周末,做口服葡萄糖耐量试验(OGTT)。【结果】中药组可显著降低模型大鼠体质量(P<0.05或P<0.01),并低于正常对照组;模型组FBG、TC、TG、INS、HOMA-IR水平较正常对照组均显著升高(P<0.05或P<0.01);除给药6周的中药组FBG含量无显著变化外,其他中药组和罗格列酮组均可显著降低FBG、TC、TG、INS、HOMA-IR水平(P<0.05或P<0.01)。OGTT结果显示:模型组大鼠血糖在0 min以及口服葡萄糖后20、60、90、120 min时均显著高于正常对照组,且各时间点血糖值比较,差异均具有统计学意义(P<0.01或P<0.001);中药组在各个时间点的血糖值均低于模型组(P<0.01或P<0.001)。【结论】桑白皮黄酮提取物具有改善糖尿病大鼠糖耐量及胰岛素抵抗的作用。
桑白皮黄酮提取物/药理学;2型糖尿病/中药疗法;胰岛素抵抗;OGTT;HOMA-IR;疾病模型,动物;大鼠
我国糖尿病(diabetes mellitus,DM)以2型糖尿病(type 2 diabetes mellitus,T2DM)为主,胰岛素抵抗(insulin resistance,IR)是T2DM的主要病理特征之一[1],开发能够改善胰岛素抵抗的药物对防治T2DM具有重要的意义。桑白皮(Cortex Mori)为桑科桑属植物桑Morus alba L.的干燥根皮,始载于《神农本草经》,列为中品,味甘性寒,归肺经,是临床上常用的止咳平喘类中药,有泻肺平喘、利水消肿的功效[2],临床研究表明桑白皮用于治疗糖尿病是有效的[3-4]。本课题组前期研究[5-6]表明桑白皮提取物具有显著的降糖降脂作用。为进一步明确桑白皮有效部位对糖尿病的药效作用,本研究拟采用高脂饲料喂养结合糖皮质激素(glucocorticoid,GC)灌胃法诱导胰岛素抵抗T2DM大鼠模型,观察桑白皮黄酮提取物对糖尿病大鼠胰岛素抵抗的影响,现报道如下。
1 材料与方法
1.1 动物SPF级健康雄性SD大鼠40只,体质量180~220 g,由广东省医学实验动物中心提供,合格证号:SCXK(粤)2013-0002。
1.2 饲料配比高脂血症动物模型饲料(质量分数配比:庶糖20%、猪油15%、胆固醇1.2%、胆酸钠0.2%、酪蛋白10%、磷酸氢钙0.6%、石粉0.4%、预混料0.4%、基础饲料52.2%)由广东省医学实验动物中心加工,许可证号:SCXK(粤)2013-0002。其中,基础饲料由广东药科大学实验动物中心提供。
1.3 药物与试剂桑白皮黄酮提取物,棕褐色粉末,由导师李卫民教授委托河北省邯郸市晨光生物科技集团股份有限公司按本课题组提供的提取工艺程序制备;罗格列酮(东京化成工业株式会社,批号:5MM4N-0B)。醋酸泼尼松(大连美仑生物技术有限公司,批号:D0719A);阿拉伯树胶粉(天津市大茂化学试剂厂,批号:20150421);肝素钠(江苏万邦生化医药股份有限公司,批号:1408102);葡萄糖(Glu)试剂盒、甘油三酯(TG)试剂盒、总胆固醇(TC)试剂盒(上海荣盛生物药业有限公司,批号分别为:20150804147、20151003121、20151003146);罗康全活力型血糖试纸(德国罗氏诊断有限公司,批号:24635333);胰岛素(INS)ELISA试剂盒(武汉华美生物工程有限公司,批号:T02019065)。
1.4 主要仪器AUY120型万分之一电子分析天平(日本岛津公司);BINDER烘箱(德国德祥科技有限公司);1-15k型冷冻离心机(美国Sigma公司);RT-2100C型自动酶标仪(德国上海创奕科教设备有限公司);RODI-50(H)-RE实验室纯水系统(厦门锐思捷科学仪器有限公司);SIM-F14O型碎冰/制冰机(日本SANYO公司)。
1.5 桑白皮黄酮提取物的制备取桑白皮药材粉碎,用体积分数为60%的乙醇加热回流提取2次,每次2 h,合并提取液并浓缩至适量,加在处理好的大孔吸附树脂柱上,依次用水和不同纯度的乙醇洗脱,收集相应的洗脱液,回收乙醇,喷雾干燥即得。
1.6 动物模型复制、分组与给药采用高脂饲料和糖皮质激素诱导法复制实验性2型糖尿病大鼠模型[7]。40只SD大鼠随机分为4组:正常对照组、模型组、罗格列酮组和桑白皮黄酮提取物组(以下简称中药组),每组10只。正常对照组给予基础饲料;其他组大鼠给予高脂饲料,并给予醋酸泼尼松3.5 mg·kg-1·d-1灌胃,复制模型。各组均灌胃给药,每天1次,正常对照组给予等体积的5 g/L阿拉伯树胶溶液,中药组给予1 g/kg桑白皮黄酮提取物,罗格列酮组给予3 mg/kg罗格列酮。造模和治疗同时进行,连续给药10周。根据2015版《中华人民共和国药典》,按临床生药量计,以人体质量(60 kg)折算大鼠的临床等效剂量。桑白皮临床常用剂量为6~12 g,本实验按12 g计算。桑白皮黄酮提取物提取率为75.6%,大鼠等效剂量系数为6.343,经换算大鼠一般给药量为12 g×75.6%/ 60 kg×6.343=0.959 g/kg,故本实验将桑白皮黄酮提取物给药量设为1 g/kg。罗格列酮给药量按临床常用剂量换算后为3 mg/kg。醋酸泼尼松给药量按预实验结果确定为3.5 mg/kg。
1.7 检测指标①体质量检测:每周称体质量2~3次。②生化指标:分别于第6、10周末,对大鼠禁食不禁水12~14 h,眼底静脉丛取血,4℃以3 000 r/min离心10 min,取上清用于空腹血糖(FBG)、TC、TG、INS测定,并计算胰岛素抵抗指数(IHOMA-IR),计算公式:IHOMA-IR=cINS×cFBG/22.5;于第10周末,做口服葡萄糖耐量试验(OGTT)测试。
1.8 统计方法采用Stat View 5.0软件进行统计处理,所有数据用均数±标准差表示,若各组资料符合正态分布和方差齐性,不同时间点之间数据采用重复测量方差分析,两两组间比较用方差分析(ANOVA)中的最小显著性差异法(LSD);若资料不符合正态分布或方差齐性,则采用含重复测量因素的秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠体质量变化表1结果显示:与正常对照组比较,从第5周开始,模型组大鼠体质量显著增加,差异有统计学意义(P<0.05);第5周开始,中药组大鼠体质量显著降低,与模型组比较,差异有统计学意义(P<0.05或P<0.01),且低于正常对照组,提示桑白皮黄酮提取物有减轻大鼠体质量的作用。
表1 各组大鼠每周体质量变化Table 1Comparison of body mass of rats in various groups at every weekm/g)
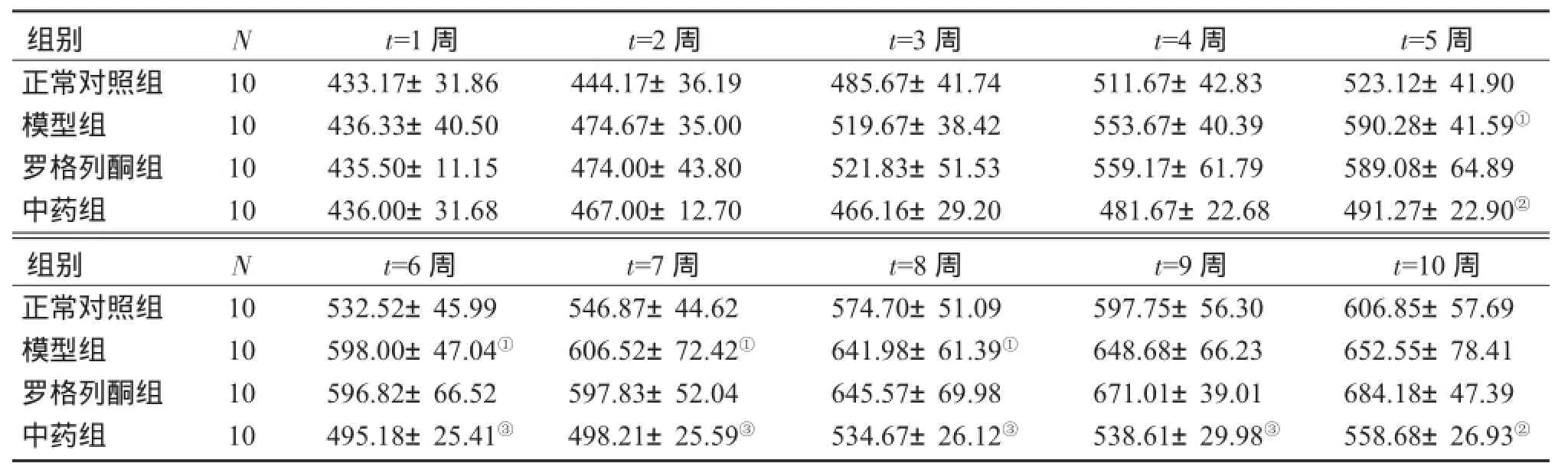
表1 各组大鼠每周体质量变化Table 1Comparison of body mass of rats in various groups at every weekm/g)
①P<0.05,与正常对照组比较;②P<0.05,③P<0.01,与模型组比较
组别正常对照组模型组罗格列酮组中药组组别正常对照组模型组罗格列酮组中药组N 10 10 10 10 N 10 10 10 10 t=1周433.17±31.86 436.33±40.50 435.50±11.15 436.00±31.68 t=6周532.52±45.99 598.00±47.04①596.82±66.52 495.18±25.41③t=2周444.17±36.19 474.67±35.00 474.00±43.80 467.00±12.70 t=7周546.87±44.62 606.52±72.42①597.83±52.04 498.21±25.59③t=3周485.67±41.74 519.67±38.42 521.83±51.53 466.16±29.20 t=8周574.70±51.09 641.98±61.39①645.57±69.98 534.67±26.12③t=4周511.67±42.83 553.67±40.39 559.17±61.79 481.67±22.68 t=9周597.75±56.30 648.68±66.23 671.01±39.01 538.61±29.98③t=5周523.12±41.90 590.28±41.59①589.08±64.89 491.27±22.90②t=10周606.85±57.69 652.55±78.41 684.18±47.39 558.68±26.93②
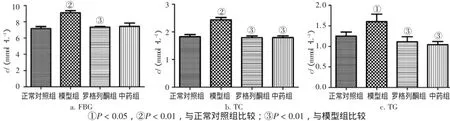
图1 给药6周后各组大鼠FBG、TC、TG含量比较Figure 1Comparison of FBG,TC,TG contents in various groups after 6-week medication(x±s,N=10)
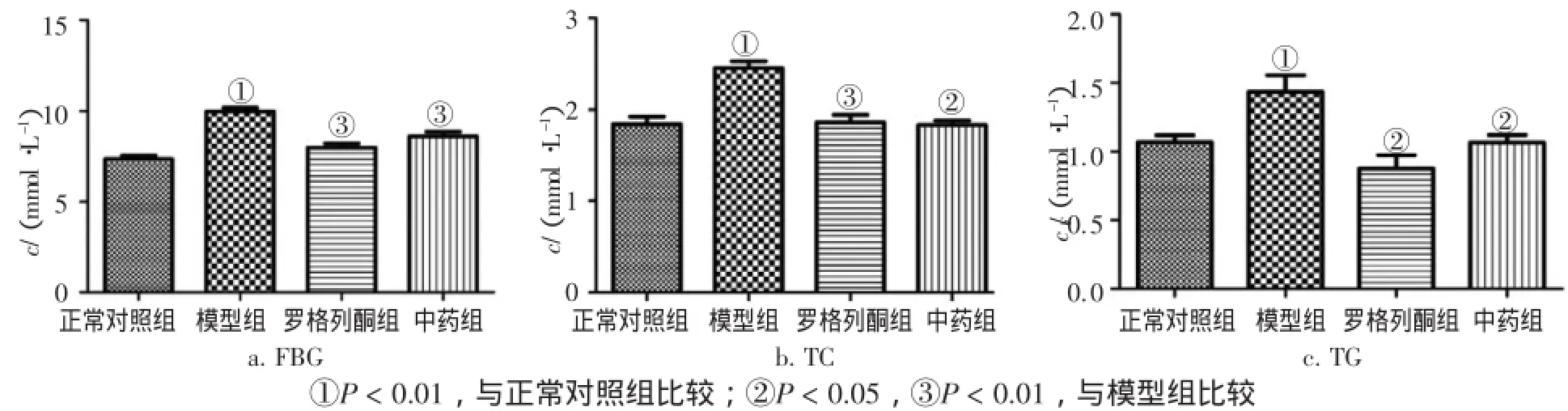
图2 给药10周后各组大鼠FBG、TC、TG含量比较Figure 2Comparison of FBG,TC,TG contents in various groups after 10-week medication(x±s,N=10)
2.2 各组大鼠给药6周、10周后FBG、TC、TG含量的变化图1、图2结果显示:给药6周、10周后,模型组FBG、TC、TG含量均显著上升,与正常对照组比较,差异均有统计学意义(P<0.05或P<0.01);除给药6周中药组FBG含量无显著变化外,给药6、10周后中药组和罗格列酮组均可显著降低FBG、TC、TG含量,与模型组比较,差异均有统计学意义(P<0.05或P<0.01)。
2.3 各组大鼠INS含量及HOMA-IR变化图3结果显示:模型组INS、HOMA-IR水平显著升高,与正常对照组比较,差异均有统计学意义(P<0.01或P<0.001);中药和罗格列酮均可显著降低INS、HOMA-IR水平,与模型组比较,差异均有统计学意义(P<0.05或P<0.001)。
2.4 各组大鼠OGTT结果表2结果显示:模型组大鼠的血糖在0 min以及口服葡萄糖后20、60、90、120 min时均显著高于正常对照组,且在各时间点差异均有统计学意义(P<0.01或P<0.001)。与模型组比较,中药组和罗格列酮组在90、120 min时降糖作用显著(P<0.01或P<0.001),提示桑白皮黄酮提取物对T2DM大鼠葡萄糖耐受有较好的调节作用。
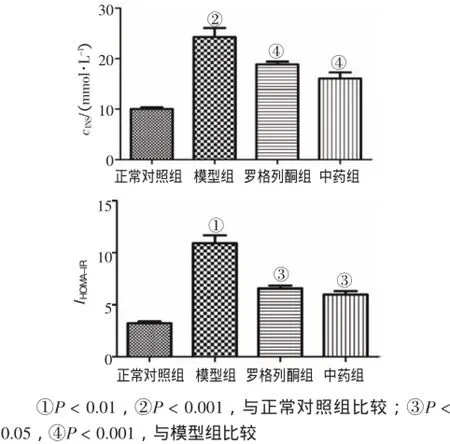
图3 各组大鼠INS含量及HOMA-IR结果Figure 3Comparison of rat INS contents and HOMA-IR in various groups(,N=10)
表2 各组大鼠OGTT结果Table 2Comparison of OGTT in rats of various groups[,c血糖/(mmol·L-1)]

表2 各组大鼠OGTT结果Table 2Comparison of OGTT in rats of various groups[,c血糖/(mmol·L-1)]
①P<0.01,②P<0.001,与正常对照组比较;③P<0.05,④P<0.01,⑤P<0.001,与模型组比较
组别正常对照组模型组罗格列酮组中药组N 10 10 10 10 t=0 min 4.9±0.27 6.1±0.45②5.1±0.39⑤5.3±0.51⑤t=20 min 8.5±0.75 10.4±1.30①8.7±0.51④8.2±1.01④t=60 min 7.3±0.82 9.7±1.09②8.5±0.93③8.1±1.18④t=90 min 5.9±0.57 8.3±0.25②6.7±0.69⑤6.9±0.57⑤t=120 min 5.3±0.38 7.2±0.48①6.0±0.58⑤6.2±0.31④
3 讨论
胰岛素抵抗是指正常浓度的胰岛素生理效应低于正常的一种病理状态,主要表现为胰岛素作用的靶组织对其敏感性和反应性降低[8-9]。研究[10]证实,胰岛素抵抗为T2DM的基本发病机制,“胰岛素抵抗—糖耐量降低—临床糖尿病”发展模式代表了T2DM整个发病过程。所以,针对胰岛素抵抗的治疗是防治T2DM的关键环节。
糖皮质激素是由肾上腺皮质分泌的一类甾体激素,在生理上具有拮抗胰岛素调节糖脂代谢方面的作用。高浓度糖皮质激素能引起机体胰岛素抵抗,最终导致T2DM。文献[11-12]报道,地塞米松能引起大鼠胰岛素抵抗;氢化可的松琥珀酸钠(HCSS)可成功制备胰岛素抵抗小鼠模型[13]。基于以上研究报道,本实验进行了预实验,最终确定采用高脂饲料联合糖皮质激素法来诱导建立T2DM胰岛素抵抗大鼠模型。
本研究结果显示:桑白皮黄酮提取物给药6周后并没有明显的降血糖作用,但表现出较好的降低TC和TG作用;给药10周后,桑白皮黄酮提取物降血糖、降血脂的功效均明显表现出来。OGTT、INS和HOMA-IR的检测结果表明,桑白皮黄酮提取物和阳性药罗格列酮不仅对T2DM大鼠葡萄糖耐受有较好的调节作用,对糖尿病大鼠胰岛素抵抗还有改善作用,2药作用效果差异无统计学意义,可见,桑白皮黄酮提取物亦可有效治疗T2DM。对于FBG和TG指标,罗格列酮的降低功效优于桑白皮黄酮提取物;但从各组大鼠体质量的数据结果可知,给予罗格列酮治疗的大鼠体质量明显高于正常对照组和中药组,甚至略高于模型组,表明阳性药罗格列酮虽然对糖尿病大鼠具有较好的降糖降脂作用,但它存在增肥的副作用。综合上述因素来看,糖尿病常用治疗药物罗格列酮在治疗时会出现肥胖副作用,而桑白皮黄酮提取物反而会降低大鼠体质量,故认为桑白皮黄酮提取物对T2DM大鼠的治疗作用是有一定优势的。
本实验在课题组前期研究的基础上进一步细化了药物对象,使对中药桑白皮提取物的研究深入到研究其有效部位,既优化了中药桑白皮的药理研究方法,也为下一步研究与开发2型糖尿病中药防治药物提供了一定的实验基础。
[1]黄鸣清.丹酚酸B改善2型糖尿病大鼠IR作用及其机制研究[D].广州:广州中医药大学,2010.
[2]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:280.
[3]杨燕彬,张骤珠,杨丽.从肺、脾(胃)、肾论治消渴病[J].长春中医学院学报,2002,18(1):12.
[4]陈继新,王建华.从肺脾肾气虚论治糖尿病[J].陕西中医,2003,24(1):339.
[5]段志涛.桑白皮有效部位工艺、质控及药效学研究[D].广州:广州中医药大学,2013.
[6]齐翠翠.桑白皮异戊烯基黄酮工艺、质控及药效初探[D].广州:广州中医药大学,2014.
[7]张世卿,佟丽.胰岛素抵抗作用发生机制及实验模型的研究进展[J].中药新药与临床药理,2012,23(3):364.
[8]Sookoian S,Rosselli M S,Gemma C,et al.Epigenetic regulation of insulin resistance in nonalcoholic fatty liver disease:impact of liver methylation of the peroxisome proliferator-activated receptor gamma coactivator 1 alpha promoter[J].Hepatology,2010,52(6):1992.
[9]Gallagher E J,Leroith D,Karnieli E.Insulin resistance in obesity as the underlying cause for the metabolic syndrome[J].Mt Sinai J Med,2010,77(5):511.
[10]李光伟.胰岛素抵抗和β细胞功能不良在2型糖尿病发病上的作用[J].中华内分泌代谢杂志,2002,18(3):250.
[11]白红艳,邹文俊,高小平.葛根对地塞米松诱导的胰岛素抵抗的影响[J].中国中药杂志,2004,29(4):356.
[12]潘竞锵,韩超,谭海荣,等.葛根芩连汤对抗地塞米松诱导大鼠胰岛素抵抗作用[J].广东药学,2003,13(6):27.
[13]王春怡.黄芪散干预2型糖尿病胰岛素抵抗机制及制剂基础研究[D].广州:广州中医药大学,2009.
【责任编辑:黄玲,侯丽颖】
Effect of Cortex Mori Flavone Extracts on Insulin Resistance in Rats with Type 2 Diabetes Mellitus
GAO Ying,GAO Ying,LI Yan,LI Weimin,YUAN Jie
(School ofChinese Herbal Medicine,Guangzhou UniversityofChinese Medicine,Guangzhou 510006 Guangdong,China)
ObjectiveTo investigate the effect of Cortex Mori flavone extracts on insulin resistance in rat model with type 2 diabetes mellitus(T2DM).MethodsWe established the rat T2DM model by feeding with high-fat diet plus gastric administration of glucocorticoid.Forty SD rats were randomized into 4 groups,namely normal control group,model group,Rosiglitazone group and Cortex Mori flavone extracts group(below briefly named Chinese medicine group),10 rats in each group.Treatment lasted for 10 weeks.At the end of administration week 6 and 10,fasting blood glucose(FBG),total cholesterol(TC),triglyceride(TG)levels and insulin(INS)content were detected,and the homeostasis model assessment-estimated insulin resistance(HOMA-IR)index was calculated.At the end of adiministration week 10,the oral glucose tolerance test(OGTT)was carried out.ResultsChinese medicine group could decrease body mass of the rat model significantly(P<0.05 or P<0.01),and the body mass was lower than the normal control group.FBG,TC,TG,INS and HOMA-IR levels in the model group were significantly elevated compared with those of normal control group(P<0.05 or P<0.01). Except that FBG level of Chinese medicine group showed no obvious changes after 6-week treatment,the other observation parameters were significantly decreased in Chinese medicine group and Rosiglitazone group(P<0.05 or P<0.01).OGTT results showed that blood glucose levels of the model group at 0,20,60,90,120 min were respectively higher than those of the normal control group(P<0.01 or P<0.001),but blood glucose levels at various time points in Chinese medicine group were significantly lower than those of the model group(P<0.01 or P<0.001).ConclusionCortex Mori flavone extracts can improve glucose tolerance and insulin resistance of T2DM rats.
Cortex Mori flavone extracts/pharmachology;type 2 diabetes mellitus/TCD therapy;insulin resistance;OGTT;HOMA-IR;disease models,animal;rats
285.5
A
1007-3213(2016)06-0831-05
10.13359/j.cnki.gzxbtcm.2016.06.018
2016-05-22
高颖(1990-),女,在读硕士研究生;E-mail:13631455175@139.com。
李卫民(1954-),男,博士研究生,教授;E-mail:liweimin@gzucm.edu.cn。
国家自然科学基金资助项目(编号:81373775)

