三唑磷作用下翡翠贻贝抑制性消减杂交文库构建与分析
孙 伟,张林宝,胡 莹,蔡文贵,贾晓平 (中国水产科学研究院南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东省渔业生态环境重点实验室,广东 广州 510300)
三唑磷作用下翡翠贻贝抑制性消减杂交文库构建与分析
孙 伟,张林宝*,胡 莹,蔡文贵,贾晓平 (中国水产科学研究院南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东省渔业生态环境重点实验室,广东 广州 510300)
采用抑制性差减杂交技术,构建了三唑磷农药急性胁迫下翡翠贻贝雌贝性腺正反向消减杂交cDNA文库.正反向文库共有117个表达序列标签(expressed sequence tags, ESTs)与NCBI 数据库中已知功能蛋白具较高同源性,假定蛋白12种,另有195个ESTs未检索到同源序列.正向文库中含有细胞周期蛋白、性激素合成蛋白、DNA修复蛋白、能量代谢相关蛋白等一系列与生殖、应激适应和代谢相关的转录本信息,而反向文库中的差异ESTs主要涉及DNA复制、转录和翻译调控基因以及骨架蛋白.结果表明三唑磷对翡翠贻贝的毒性涉及到生殖调控、能量代谢、应激适应、转录翻译调控等生理代谢的多个方面,正向文库中发现的几种生殖调控基因(细胞周期蛋白、周期蛋白依赖性蛋白激酶、合子DNA复制许可因子、精子特异性蛋白、雌激素硫酸转移酶和卵黄膜卵透明带域蛋白)可能是三唑磷生殖干扰毒性作用过程中的关键基因,这为有机磷农药的生殖毒性探索提供了基础数据.
翡翠贻贝;性腺;三唑磷;抑制性消减杂交文库;表达序列标签
三唑磷(O,O-二乙基-O-1-苯基-1,2,4-三唑基-3-硫代磷酸酯, triazophos)做为高毒高残留有机磷农药的理想替代品种,其需求量呈不断上升趋势,2012年我国三唑磷农药原药和制剂年产量达万 t以上[1].三唑磷半衰期较长,农药残留问题严重[2]. 20世纪80年代后期以来,浙江和福建沿海地区广泛使用三唑磷作为清涂、清塘药剂,大大提高了贝类养殖产量.然而,由于三唑磷农药在水产养殖业中使用范围和强度不断增大,再加上农药施用不规范,对海洋生物资源和养殖生物所造成的损害已不容忽视[3].国内关于三唑磷农药对河口、海湾以及水产养殖品种的污染日益引起关注[4-5].然而,目前国际上和我国水质标准中并未有各类水体中三唑磷的浓度限值.因此,开展三唑磷农药生态风险评估迫在眉睫.
三唑磷农药毒理效应和生物体对三唑磷的响应研究是进行生态风险评估的重要前提和科学依据.目前对三唑磷农药毒性研究主要集中在急性毒性、积累与消除规律、神经毒性、组织损伤和氧化损伤等方面[5-12].有机磷农药作为环境激素严重影响人类健康和水生生物的胚胎发育和繁殖等生命活动[13],有研究报道三唑磷对稻褐飞虱(Nilaparvata lugens)和灰飞虱(Laodelphax striatellus)的产卵具有明显的刺激作用[14-15],成虫体内保幼激素滴度以及卵黄蛋白基因的表达随着三唑磷暴露浓度的增加而增加[16],表明三唑磷农药具有一定的环境雌激素效应.目前,有关三唑磷对海洋贝类的生殖毒性研究尚未见报道.
翡翠贻贝(Perna viridis)广泛分布于我国东海南部和南海沿岸,对多种污染物均具有较高的蓄积能力,是我国近岸海洋环境污染定点监测的良好指示生物[17].翡翠贻贝多为雌雄异体,在繁殖季节其性腺肥硕丰满颜色明显可见,雄性多呈乳白色,雌性则为橙黄色或橘红色[18],因此是研究三唑磷生殖毒性的理想实验材料.最近研究表明,苯并芘(BaP)作用会影响翡翠贻贝精巢的精子发生过程,干扰贻贝生殖相关基因表达[19-20].本研究采用抑制性消减杂交技术(suppressive subtractive hybridization, SSH)构建三唑磷农药胁迫下翡翠贻贝性腺消减cDNA文库,旨在获取三唑磷作用下翡翠贻贝性腺组织中差异表达的ESTs,从而为分离和克隆三唑磷作用下翡翠贻贝生殖相关基因提供重要的转录本信息,并为阐明三唑磷农药作用下翡翠贻贝生殖毒性效应和分子机制提供科学依据和理论基础.
1 材料和方法
1.1 三唑磷农药对翡翠贻贝的急性毒性实验
实验于2015年6~7月在中国水产科学研究院南海水产研究所深圳试验基地进行.实验所用翡翠贻贝购自深圳东山码头,壳长7~8cm.实验开始前贻贝驯养于 28~30℃的充气过滤海水中(海水盐度 32‰,pH 8.1),每日换水,并投喂螺旋藻粉(贻贝组织干重的 2%),驯养一周以适应实验条件.20%三唑磷乳油农药购自浙江新农化工有限公司,三唑磷浓度按乳油中三唑磷的实际含量计算.采用半静态急性毒性实验法,根据预实验结果设置三唑磷浓度分别为 0,0.2,0.6,1.8,5.4和16.2mg/L 6个实验组,每组设3个平行,每个平行各放入10只翡翠贻贝.实验持续96h,暴露期间每24h定时更换含有相应浓度三唑磷的新鲜海水.以闭壳肌无力、 张口、用玻璃棒轻敲其外壳许久不作出反应者定为死亡.用 Bliss 法计算获得三唑磷对翡翠贻贝的96h LC50数值.
1.2 三唑磷农药作用下翡翠贻贝性腺消减cDNA文库构建
1.2.1 实验设计 根据急性毒性实验计算出三唑磷农药对翡翠贻贝的96h LC5数值.实验共两个处理组,以正常海水组为驱动子组,以三唑磷胁迫组(96h LC5)为检测子组,每个处理3个重复,每个重复20只贻贝,置于含有20L海水的玻璃钢中.实验期间不投喂螺旋藻粉,保持充气,水温28~30℃,每24h定时更换含有相应浓度三唑磷的新鲜海水.曝毒实验过程中各组翡翠贻贝无死亡现象,48h后取各处理组雌性贻贝,解剖分离获得卵巢组织迅速置于液氮中冷冻.
1.2.2 抑制性消减杂交cDNA文库的构建 按照 Trizol操作手册(Invitrogen公司)提取翡翠贻贝雌贝性腺总 RNA,1.5%琼脂糖凝胶电泳检测总RNA的完整性并利用NanoDrop2000超微量紫外分光光度计检测总 RNA浓度.按照 PCRSelectTMcDNA Subtraction kit操作手册(Clontech公司)构建三唑磷胁迫下翡翠贻贝雌贝性腺正反向SSH cDNA文库,主要步骤如下:(1)cDNA反转录,分别将处理组和对照组的总RNA合成cDNA第一链,进而摸索最佳循环数合成 cDNA第二链.(2)cDNA文库差减杂交,以三唑磷处理组cDNA为Tester组,对照组cDNA为Driver组,将Rsa I酶切后并接上接头的Tester cDNA与Driver cDNA进行两次差减杂交.(3)二轮差减套式PCR鉴定,以杂交后的cDNA为模板,未进行差减杂交的Tester cDNA为对照模板,分别进行两次抑制性 PCR,产物用 1.5%琼脂糖凝胶电泳进行分析.(4)PCR产物载体连接转化和克隆,将差减组的PCR产物纯化后与pMD19-T克隆载体连接,转化至大肠杆菌DH5感受态细胞中,涂布于氨苄青霉素抗性的LB平板,37℃培养过夜.
1.2.3 SSH文库的初步鉴定和分析 随机挑取200个阳性菌落,接种于含有氨苄青霉素的LB培养基中,37 ℃ 培养过 8h,对挑取的菌落进行重组PCR鉴定,产物用 1.5%琼脂糖凝胶电泳检测,计算文库中插入片段大小分布及重组率.将重组质粒送上海生工生物工程有限公司测序.测序结果使用 DNAstar 5.0除去载体和接头序列.预测开放阅读框、翻译编码的氨基酸序列.利用 NCBI (http://blast.ncbi.nlm.nih.gov/Blast.cgi?CMD=We b&PAGE_TYPE=BlastHome)网站上同源序列相似性搜索比对工具 BLASTn、BLASTx和BLASTp在GenBank数据库中进行序列相似性搜索比对分析.用 Blast2GO 程序对 EST 序列进行基因注释和功能分类,分析基因在细胞中的代谢途径(https://www.blast2go.com/).
2 结果
2.1 三唑磷农药对翡翠贻贝的急性毒性
采用半静态急性毒性实验法,设置5个三唑磷浓度组和丙酮阴性对照组,每组设2个平行,每个平行各放入10只贻贝,每24h观察和记录贻贝的存活状态及死亡个数,实验持续96h后,翡翠贻贝在0.2, 0.6, 1.8, 5.4, 16.2mg/L的三唑磷浓度组中的死亡率分别为0、0、0、20%、70%、和100%,用 Bliss 法计算得出三唑磷对翡翠贻贝的 96h LC50为3.5mg/L, 96h LC5为1mg/L.
2.2 翡翠贻贝性腺 RNA提取质量和抑制性差减杂交产物检测
对照组和 1mg/L三唑磷处理组翡翠贻贝性腺组织总RNA浓度分别为0.8154和0.9339μg/ μL, 260/A280值分别为2.07和2.09,表明总RNA质量达到构建消减文库的要求.试验确定了18个循环为第2链cDNA合成的最佳PCR循环数.差减后的cDNA和未差减的cDNA分别进行两次抑制性PCR扩增后,产物电泳结果如图1所示.电泳显示片段大小主要集中在500~1000bp之间,差减和未差减cDNA两者条带分布明显不同,正向文库中较大的片段得到了明显的消减.
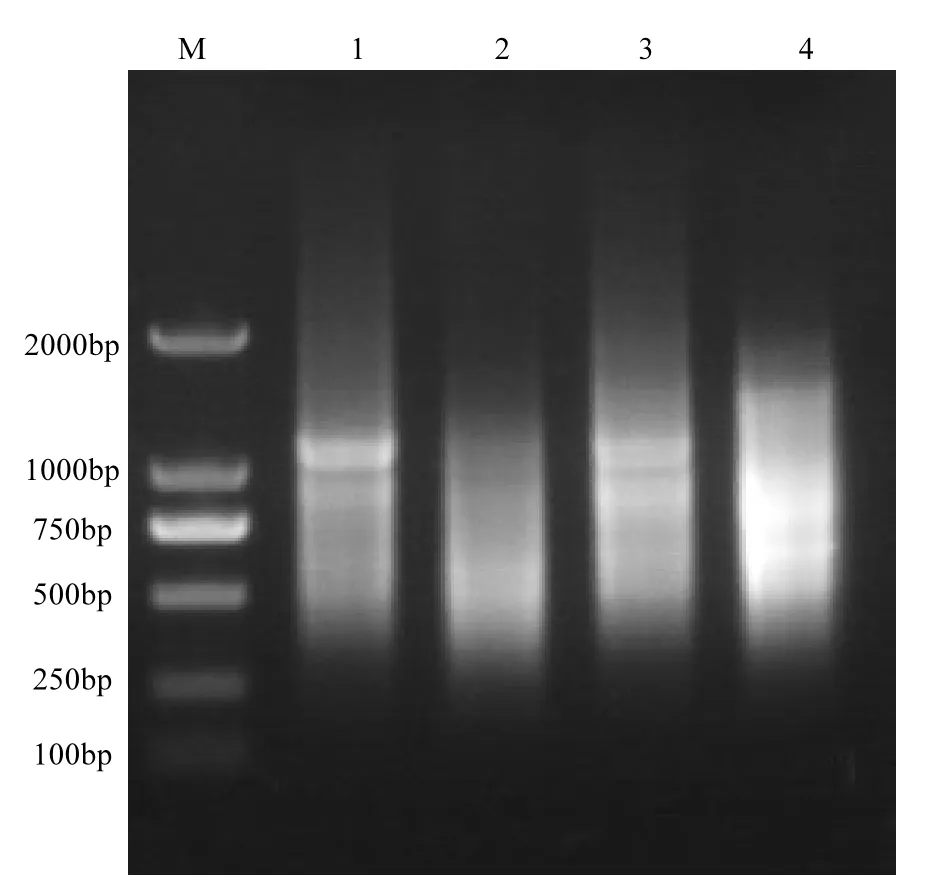
图1 正反向SSH文库差减杂交产物第二轮PCR扩增结果Fig.1 Electrophoresis of SSH products of the forward and reverse subtracted libraries amplified after two rounds of PCR
2.3 差减文库的构建及分析
差减后的第二次PCR扩增产物经纯化、连接、转化、平板培养后,从正、反向cDNA消减文库分别挑取200个菌落克隆进行PCR检测,结果显示插入片段长度不一,主要分布在 200~1000bp之间(图2).菌液PCR扩增产物显示正向cDNA消减文库有193个为重组克隆,反向文库186个为重组克隆,重组效率分别为96.5%和93%.菌液 PCR 检测结果显示,除去插入片段<200bp的菌液样品外,正、反向cDNA消减文库分别有180个和176个菌液样品可进行测序.
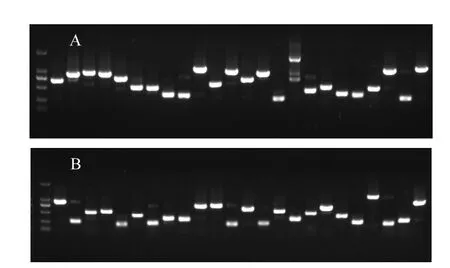
图2 三唑磷胁迫下翡翠贻贝正(A)反(B)向抑制性消减杂交cDNA文库插入片段PCR鉴定电泳图(部分)Fig.2 Identification of the inserted cDNA fragments in the forward (A) and reverse (B) SSH cDNA library of Perna viridis under triazophos stress by PCR (partial)
测序结果如表1所示,除去测序效果不好或序列测序片段小于 150bp等,实际上正、反向cDNA消减文库共获得166个和158个EST序列.利用NCBI网站上BLAST工具进行同源序列相似性搜索比对,结果表明正向文库中含有72个ESTs与己知功能序列具有较高的同源性,4个假定蛋白,另外有97个序列未检索到同源性相似的序列.反向cDNA文库与Genbank中已知功能基因同源性较高的ESTs有57种,假定蛋白9种,未检索到同源性相似的序列有101种.正向文库已知功能的差异基因部分结果如表2所示,包括细胞周期蛋白、雌激素硫酸转移酶、卵黄膜卵透明带蛋白、DNA修复相关蛋白、细胞色素和细胞色素氧化酶、NADH脱氢酶、NAD依赖性蛋白去乙酰化酶、核糖体蛋白等,主要涉及生殖调控、电子传递、活性氧清除、DNA修复等功能.反向文库基因主要包括转录和翻译调控基因、细胞骨架蛋白、催化酶类以及钙调蛋白等.经 BLASTP同源比对发现,正反向文库中 117种已知功能EST序列编码的蛋白主要与太平洋牡蛎(Crassostrea gigas)等贝类和部分鱼类相应蛋白的同源性最高(表 1和表 2).另外,几乎很少相同ESTs同时出现在正反向文库中,这表明该研究所构建文库的消减效率是比较高的.

表1 三唑磷作用下翡翠贻贝正、反向cDNA消减文库ESTs序列统计分析Table 1 General characteristic of ESTs obtained from the forward (A) and reverse (B) SSH cDNA library of Perna viridis under triazophos stress
利用Blast2GO工具进行基因注释和功能分类表明,从细胞组成(Cellular component)看,翡翠贻贝性腺组织正向 cDNA消减文库ESTs 序列(图3a)中基因产物主要定位于细胞(cell)、细胞器(organelle)和生物大分子复合物中(macromolecular complex);从分子功能(Molecular function)上分析差异基因划分为 9 类:主要为结合类(binding)和催化类(catalytic),另外还有抗氧化活性类(antioxidant)、电子载体类(electron carrier)、酶调节因子类(enzyme regulator)、分子转导类(molecular transducer)、结构分子类(structural molecular)、转录调控因子类(transcription regulator)和运输活性类(molecular transducer).这些 ESTs 序列共参与 22类生物学过程(Biological proeess),分别是:结构形成(anatomical structure formation)、 生 物 黏 附 (biological adhesion)、生物调节(biological regulator)、细胞组分生物合成(cellular component biogenesis)、细胞组分组装(cellular component organization)、细胞过程(cellular process)、凋亡(death)、发育进程(developmental process)、建立定位(establishment of localization)、生长(growth)、免疫系统过程(immune system process)、定位(localization)、运动(locomotion)、代谢过程(metabolic process)、多生物过程(multi/-organism process)多细胞生物过程(multicellular organismal process)、色素沉着(pigmentation)、生殖(reproduction)、生殖过程(reproduction process)、压力应激(response to stimulus)、细胞周期过程(rhythmic process)和病毒增殖(viral reproduction).其中参与细胞进程和代谢进程的基因种类最多.另外,翡翠贻贝雌贝性腺组织反向cDNA消减文库ESTs 序列在细胞定位、分子功能和生物过程三个层次的分布与正向文库的 ESTs序列分布较为接近(图3b).
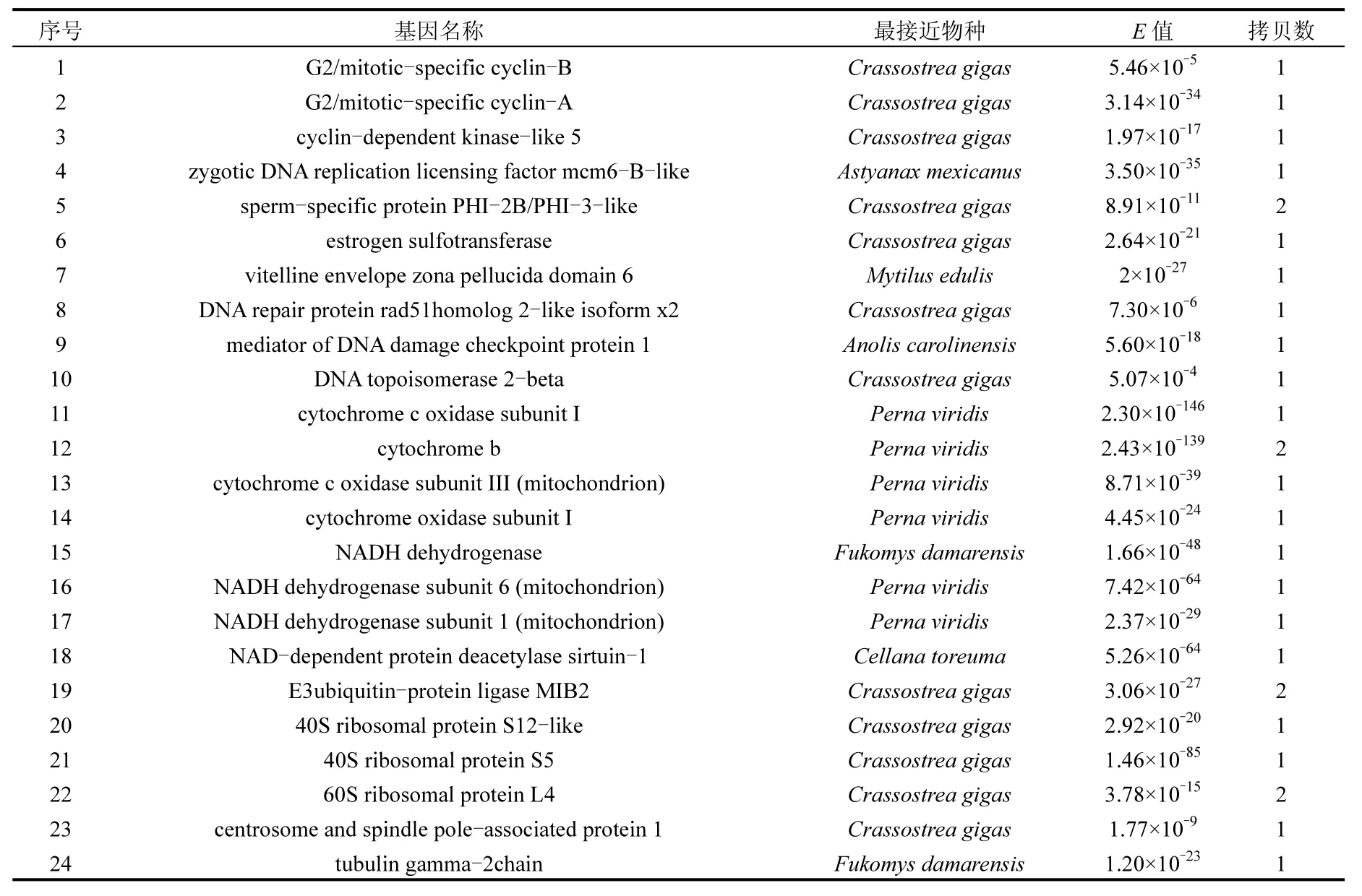
表2 三唑磷作用下翡翠贻贝性腺正向消减文库ESTs比对结果(部分)Table 2 BLAST results of forward subtracted cDNA library (partial)
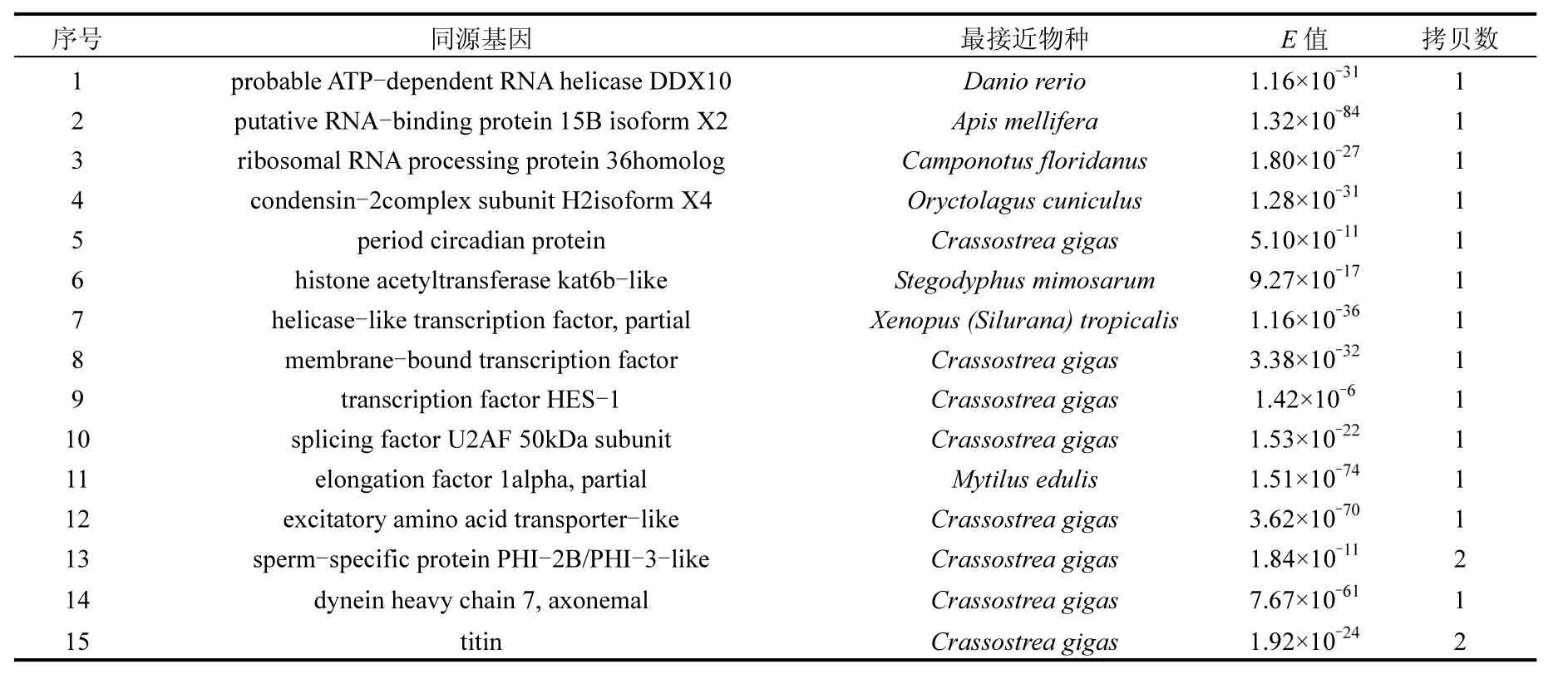
表3 三唑磷作用下翡翠贻贝性腺反向消减文库ESTs比对结果(部分)Table 3 BLAST results of reverse subtracted cDNA library (partial)
续表3
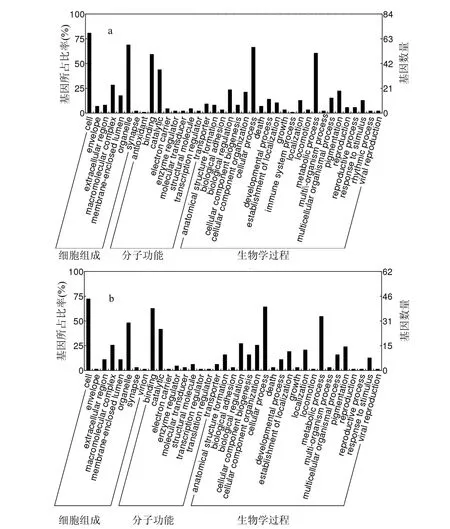
图3 正向和反向cDNA消减文库ESTs功能注释分类Fig.3 Gene ontology classification of forward and reverse subtracted cDNA library
3 讨论
三唑磷农药对水生生物的毒性试验数据是危害影响评价的基础.本研究采用半静态急性毒性实验法获得了三唑磷农药对翡翠贻贝的 96h LC50为 3.5mg/L,与其他海洋贝类的急性毒性数据相比(表 4),翡翠贻贝对三唑磷的耐受性更强.查阅近年来的相关研究表明,浮游动物桡足类和轮虫对三唑磷农药最为敏感,然后依次为虾类、鱼类、蟹类,而藻类和贝类对三唑磷表现出较强的耐受性[3].贝类由于其独特的滤食方式,对三唑磷具有较强的富集作用,比甲壳类和鱼类高 1~3个数量级[3].

表4 三唑磷对海洋贝类的急性毒性数据Table 4 Acute toxic data of triazophos to marine shellfish
贝类性腺在成熟季节脂肪含量较高.亲脂性的三唑磷农药更容易在性腺内积累.性腺是贝类激素合成及卵黄蛋白原合成的部位[21],三唑磷在性腺中的积累及代谢必定会对贝类的生殖机能造成负面影响.然而有关三唑磷农药对海洋贝类的生殖毒性研究尚未见报道.因此本研究以翡翠贻贝雌贝性腺为材料,采用SSH技术构建了三唑磷农药急性胁迫下贻贝正、反向消减杂交cDNA文库,以筛选三唑磷作用下贻贝性腺中的差异表达基因.应用 SSH 技术分离鉴定贝类差异表达基因也逐渐成为贝类毒理学和免疫学研究热点之一. 如 Lüchmann等[22]、Tanguy等[23]、Miao等[24]、Araya等[25]和Prado-Alvarez等[26]分别构建了柴油、农药、溴代阻燃剂以及病原生物作用下牡蛎(Crassostrea brasiliana和C. gigas)、菲律宾蛤仔(Ruditapes philippinarum)、砂海螂(Mya arenaria)以及沟纹蛤仔(Ruditapes decussatus)的SSH差减文库,并分离和鉴定了多种差异表达基因.本研究中正、反向 cDNA 消减文库测序后共获得 324个 ESTs序列,其中117个EST序列与NCBI 数据库中已知功能蛋白质具较高同源性,假定蛋白12种,另有195个EST(60.19%)在数据库中未发现同源序列.同样的问题也存在于对其它贝类EST文库的研究中,如病原微生物作用下沟纹蛤仔血淋巴细胞中有高达60%以上的 ESTs序列在GenBank中找不到同源序列[26-27].造成这一问题的原因是由于对海洋生物尤其是贝类的大规模 ESTs分析还比较少,它们可能是目前还未知的 EST序列,又或者是因为另外一大部分ESTs是 5’或 3’-UTR 序列.
本研究中正、反向 cDNA消减文库一共获得 117个差异基因,极大的丰富了翡翠贻贝的ESTs数据资源.通过进一步的生物信息学分析,初步将它们分成了以下几个类型:(1)生殖调控相关蛋白(2)DNA复制/修复/转录/翻译蛋白(3)能量代谢/呼吸链相关蛋白;(4)核糖体蛋白(5)细胞纤维及骨架蛋白;(6)细胞信号转导相关蛋白;(7)钙调蛋白等.利用 Blast2GO 工具进行基因注释和功能分类发现,这些 ESTs 参与机体细胞周期调控、催化代谢、信号转导、生殖调控等多种生物代谢过程.正向文库中筛选得到了两种细胞周期蛋白(cyclin A与cyclinB)和周期蛋白依赖性蛋白激酶(cyclin-dependent kinase, CDK)、合子DNA复制许可因子(zygotic DNA replication licensing factor)、精子特异性蛋白(sperm-specific protein)、雌激素硫酸转移酶(estrogen sulfotransferase)、卵黄膜卵透明带域蛋白(vitelline envelope zona pellucida)等7种生殖功能相关蛋白.周期蛋白通过与细胞周期蛋白依赖性激酶结合,并调节它们的酶活性,从而对细胞增殖分裂起了重要的监控作用[28].周期蛋白 A与 B属于 M 期周期蛋白
[29-30],主要负责细胞由G2期进入M期的准确性.有研究表明青蟹(Scylla paramamosain)中的周期蛋白A和B在卵巢中的表达量最高,参与了卵原细胞增殖、卵母细胞的减数分裂等卵子发生和精子发生过程[31-32].同样在虹鳟(Oncorhynchus mykiss)和斑节对虾(Penaeus monodon)中也发现周期蛋白A和B在卵母细胞和精母细胞减数分裂调控以及卵巢成熟过程中发挥了主导性的作用[33-35].受精卵 DNA复制许可因子是一种存在于细胞核中的 DNA复制所必需蛋白因子,控制受精卵 DNA的复制.另外,雌激素硫酸转移酶是硫酸化代谢雌激素(使雌激素活性降低)的主要酶,在机体雌激素合成与代谢中发挥着重要作用,如 17β-雌二醇作用下,紫贻贝(Mytilusgalloprovincialis)体内该酶活性显著升高[36].卵黄膜卵透明带域是卵外的一道天然的物理屏障,在精卵识别和结合、诱发精子顶体反应和穿透卵黄膜等一系列生殖事件中起着重要的作用[37].由以上讨论可知,三唑磷农药对翡翠贻贝雌贝性腺的几种生殖相关基因具有诱导作用,存在一定的生殖干扰毒性.相似的研究在昆虫体内也有发现,如Bao等通过抑制性消减杂交技术研究表明三唑磷可显著诱导褐飞虱雌成虫体内卵黄蛋白原等生殖相关基因的转录水平[38].蛋白质组学研究表明三唑磷显著诱导雌性褐飞虱体内卵巢丝氨酸蛋白酶和卵黄蛋白原表达水平,雄性褐飞虱体内精子发生相关蛋白以及睾丸发育蛋白的含量也显著升高,且三唑磷处理的雄性褐飞虱对雌性褐飞虱的生殖具有一定的刺激作用[39].
另外,正向文库中还发现几种与 DNA凋亡和修复相关的基因(DNA repair protein, mediator of DNA damage checkpoint protein和 DNA topoisomerase),表明三唑磷胁迫启动了贻贝性腺中 DNA凋亡和修复基因的表达.正向文库中筛选到的细胞色素、细胞素色氧化酶和NADH脱氢酶等能量代谢相关基因一般参与机体呼吸链电子传递、糖酵解和柠檬酸循环,这表明三唑磷胁迫下贻贝性腺内伴随着紧密的能量分配和产生,指示机体代谢失衡的出现.反向文库中 DNA合成及蛋白转录、翻译调控因子的响应较明显,如RNA解旋酶(ATP-dependent RNA helicase)、凝缩蛋白(condensin)、各类转录因子(helicaselike transcription factor、 membrane-bound transcription factor和transcription factor HES-1)、剪接因子(splicing factor)、延生因子(elongation factor),这表明三唑磷胁迫抑制了贻贝性腺中某些基因的转录和翻译表达.另外,正、反向文库中还发些一些细胞骨架及纤维蛋白相关基因(tubulin, actin, titin和collagen alpha等),这表明三唑磷胁迫后膜蛋白和细胞骨架蛋白的转录表达被激活或抑制以适应外界环境的变化.另外,基因注释和功能分类分析还发现有些 ESTs 可以同时存在于不同的细胞组分、生物学过程.如正向文库中的 NAD依赖的蛋白去乙酰化酶(naddependent protein deacetylase sirtuin-1isoform x2)通过基因功能注释发现其可以定位于细胞质、细胞核、线粒体等多个细胞组分,并参与葡萄糖代谢调节、氧化应激、DNA修复、免疫调节等多种生物学过程.
4 结论
4.1 三唑磷农药对翡翠贻贝的 96h LC50为3.5mg/L, 与其他海洋贝类的急性毒性数据相比,翡翠贻贝对三唑磷的耐受性更强.
4.2 抑制性差减杂交技术研究表明,三唑磷农药作用下翡翠贻贝卵巢中细胞周期蛋白、性激素合成蛋白、DNA修复蛋白、能量代谢相关蛋白、转录和翻译调控因子以及细胞骨架蛋白等一系列与生殖、能量代谢和应激适应等相关基因表达收到影响,三唑磷对翡翠贻贝的毒性涉及到生理代谢的多个方面.
4.3 正向文库中发现的几种生殖调控相关基因(细胞周期蛋白、周期蛋白依赖性蛋白激酶、合子DNA复制许可因子、精子特异性蛋白、雌激素硫酸转移酶和卵黄膜卵透明带域蛋白)可能是三唑磷生殖干扰毒性作用过程中的关键基因.
[1] 汤鸣强.三唑磷降解菌的分离鉴定及其降解酶特性的研究 [D].福州:福建农林大学, 2012:14.
[2] 戴青华,张瑞福,蒋建东,等.三唑磷水解酶基因的克隆及水解产物的确定 [J]. 中国环境科学, 2007,27(6):777-780.
[3] 钟 志,刘 琴,刘士忠,等.三唑磷对浙江沿岸海域水生生物的影响 [J]. 广州化工, 2010,38(5):215-216.
[4] 徐继林,严小军,王国良,等.滩涂及贝类中残留三唑磷的 GC/MS分析 [J]. 海洋环境科学, 2004,23(4):53-56.
[5] 王 扬,王国良,於 宏,等.三唑磷在养殖泥螺中的残留及消解动态 [J]. 东海海洋, 2004,22(2):35-39.
[6] 丁跃平,金彩杏,郭远明,等.三唑磷对海水虾类、蟹类的急性毒试验 [J]. 浙江海洋学院学报(自然科学版), 2002,2:116-118.
[7] 陈波宇,郑斯瑞,牛希成,等.水生生物对三唑磷的物种敏感度分布研究 [J]. 环境科学, 2011,32(4):1101-1107.
[8] 周常义,严重玲,黄 成,等.三唑磷对泥蚶急性毒性及血清SOD,CAT酶活性的影响 [J]. 海洋科学, 2004,28(12):43-48.
[9] 薛秀玲,袁东星,樊国峰,等.有机磷农药对缢蛏(Sinonovacula constricta)消化腺超微结构的影响 [J]. 环境科学学报, 2007, 27(5):790-795.
[10] Li S N, Tan Y J. Hormetic response of cholinesterase from Daphnia magna in chronic exposure to triazophos andchlorpyrifos [J]. Journal of Environmental Sciences, 2011,23(5): 852-859.
[11] 李红艳,张 喆,陈海刚,等.三唑磷短期暴露对翡翠贻贝的毒性效应 [J]. 南方水产科学, 2013,9(5):71-79.
[12] 李红艳,张 喆,陈海刚,等.斑节对虾不同组织乙酰胆碱酯酶对三唑磷的响应 [J]. 海洋环境科学, 2013,4:547-550.
[13] 周 慜,石 雷,李取生,等.珠江河口水体有机磷农药的含量与季节变化 [J]. 中国环境科学, 2013,33(2):312-318.
[14] 庄永林,沈晋良,陈 峥,等.三唑磷对不同翅型稻褐飞虱繁殖力的影响 [J]. 南京农业大学学报, 1999,22(3):21-24.
[15] 徐广春,顾中言,徐德进,等.五种常用杀虫剂对灰飞虱繁殖力的影响 [J]. 植物保护学报, 2008,35(4):361-366.
[16] 戈林泉,程 耀,徐 婕,等.三唑磷诱导褐飞虱雌虫卵黄蛋白基因表达及保幼激素滴度动态的变化 [J]. 公共植保与绿色防控2010:224-230.
[17] Liu J H, Kueh C S. Biomonitoring of heavy metals and trace organics using the intertidal mussel Perna viridis in Hong Kong coastal waters [J]. Marine Pollution Bulletin, 2005,51(51):857-875.
[18] Al-Barwani S M, Arshad A, Amin S M N, et al. Incidence of hermaphrodite in green mussel Perna viridis along the west coast of Peninsular Malaysia [J]. Asian Journal of Animal and Veterinary Advances, 2013,8(2):376-382.
[19] Song Q, Zheng P, Qiu L, et al. Toxic effects of male Perna viridis, gonad exposed to BaP, DDT and their mixture: A metabolomic and proteomic study of the underlying mechanism [J]. Toxicology Letters, 2015,240(1):185-195.
[20] Jiang X, Qiu L, Zhao H, et al. Transcriptomic responses of Perna viridis, embryo to Benzo(a)pyrene exposure elucidated by RNA sequencing [J]. Chemosphere, 2016,163:125-132.
[21] Scott A P. Do mollusks use vertebrate sex steroids as reproductive hormones? Part I: Critical appraisal of the evidence for the presence, biosynthesis and uptake of steroids [J]. Steroids, 2012, 77(13):1450-1468.
[22] Lüchmann K H, Mattos J J, Siebert M N, et al. Suppressive subtractive hybridization libraries prepared from the digestive gland of the oyster Crassostrea brasiliana exposed to a diesel fuel water-accommodated fraction [J]. Environmental Toxicology Chemistry, 2012,31(6):1249-1253.
[23] Tanguy A, Boutet I, Laroche J, et al. Molecular identification and expression study of differentially regulated genes in the Pacific oyster Crassostrea gigas in response to pesticide exposure [J]. Febs Journal, 2005,272(2):390-403.
[24] Miao J, Pan L, Zhang W, et al. Identification of differentially expressed genes in the digestive gland of manila clam Ruditapes philippinarum exposed to BDE-47 [J]. Comparative Biochemistry Physiology C, 2014,161(5):15-20.
[25] Araya M T, Markham F, Mateo D R, et al. Identification and expression of immune-related genes in hemocytes of soft-shell clams, Mya arenaria, challenged with Vibrio splendidus [J]. Fish Shellfish Immunology, 2010,29(4):557-564.
[26] Prado-Alvarez M, Gestal C B, Figueras A. Differentially expressed genes of the carpet shell clam Ruditapes decussatus against Perkinsus olseni [J]. Fish Shellfish Immunology, 2009, 26(1):72-83.
[27] Gestal C, Costa M, Figueras A, et al. Analysis of differentially expressed genes in response to bacterial stimulation in hemocytes of the carpet-shell clam Ruditapes decussatus: Identification of new antimicrobial peptides [J]. Gene, 2007,406(1/2):134-143.
[28] 蔡家新,童坦君.细胞周期蛋白 [J]. 生理科学进展, 1994,25(4): 351-353.
[29] Schulze A, Zerfass K, Spitkovsky D, et al. Cell cycle regulation of the cyclin A gene promoter is mediated by a variant E2F site. Proceedings of the National Academy of Sciences, 1995,92(24): 11264-11268.
[30] Draetta G, Luca F, Westendorf J, et al. Cdc2protein kinase is complexed with both cyclin A and B: evidence for proteolytic inactivation of MPF [J]. Cell, 1989,56(5):829-838.
[31] Huang H, Li, W, Huang J, et al. Two transcripts and the expression profiles of cyclin A in ovary of the mud crab, scylla paramamosain. Marine Behaviour Physiology, 2013,46(1):45-58. [32] Han K, Dai Y, Zou Z, et al. Molecular characterization and expression profiles of cdc2and cyclin B during oogenesis and spermatogenesis in green mud crab (Scylla paramamosain) [J]. Comparative Biochemistry Physiology B, 2012,163(3/4):292-302.
[33] Qiu G F, Ramachandra R K. Molecular characterization and expression profiles of cyclin B1, B2and Cdc2kinase during oogenesis and spermatogenesis in rainbow trout (Oncorhynchus mykiss) [J]. Animal Reproduction Science, 2008,105(3/4):209-225.
[34] Zhao C, Fu M J, Zhou F L, et al. Characterization and expression analysis of a cyclin B gene from black tiger shrimp (Penaeus monodon) [J]. Genetics Molecular Research Gmr, 2015,14(4): 13380-13390.
[35] Visudtiphole V, Klinbunga S, Kirtikara K. Molecular characterization and expression profiles of cyclin A and cyclin B during ovarian development of the giant tiger shrimp Penaeus monodon [J]. Comparative Biochemistry Physiology A, 2009, 152(4):535-543.
[36] Janer G, Lavado R, Thibaut R, et al. Effects of 17β-estradiol exposure in the mussel Mytilus galloprovincialis [J]. Marine Environmental Research, 2004,58(2-5):443-446.
[37] Aagaard J E, Xianhua Y, Maccoss M J, et al. Rapidly evolving zona pellucida domain proteins are a major component of the vitelline envelope of abalone eggs [J]. Proceedings of the National Academy of Sciences, 2006,103(46):17302-17307.
[38] Bao YY, Li BL, Liu ZB, et al. Triazophos up-regulated gene expression in the female brown planthopper, Nilaparvata lugens [J]. Journal of Insect physiology, 2010,56(9):1087-1094.
[39] Ge L, Cheng Y, Wu J, et al. Proteomic analysis of insecticide triazophos-induced mating-responsive proteins of Nilaparvata lugens Stal (Hemiptera: Delphacidae) [J]. Journal of proteome research, 2011,10(10):4597-4612.
Construction and analysis of suppressive subtractive hybridization library from Perna viridis induced by triazophos.
SUN Wei,
ZHANG Lin-bao*, HU Ying, CAI Wei-gui, JIA Xiao-ping (Key Laboratory of Fishery Ecology Environment , Guangdong Province, Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China). China Environmental Science, 2016,36(12):3807~3815
To study the reproductive toxicity and molecular mechanism of triazophos to marine shellfishes, a suppressive subtractive hybridization (SSH) cDNA library of gonads from female Perna viridis by actue triazophos (1mg/L) stress was constructed for the first time. A total of 117expressed sequence tags (ESTs) from the forward and reverse subtraction library exhibited homology with genes of know functions, 12ESTs related to hypothetical protein, and the remaining 195 ESTs had no significant matches in the GenBank database. Among the 117 annotated sequences,the most abundant upregulated transcripts identified in the forward SSH libraries were associated with cell cycle regulation, sex steroid biosynthesis, DNA repairing and respiratory processes, while genes encoding proteins of DNA replication, transcription and translation regulation, cytoskeleton were found in reverse SSH libraries. Altogether, the results showed that different pathways (reproduction control, respiratory processes and stress adaptation) of mussel metabolism were changed in both forward and reverse directions after exposed to triazophos. Several reproduction-related transcripts (cyclin, cyclin-dependent kinase, zygotic DNA replication licensing factor, sperm-specific protein, estrogen sulfotransferase and vitelline envelope zona pellucida domain) identified in forward library might be the key genes involved in reproductive disturbance of triazophos, and provided the basis for the study of reproductive toxicity of organophosphorus pesticide.
Perna viridis;gonads;triazophos;suppression subtractive hybridization library;ESTs
X55,S949
A
1000-6923(2016)12-3807-09
孙 伟(1981-),男,安徽巢湖人,硕士,助理研究员,主要从事海洋环境毒理学研究.发表论文5篇.
2016-04-02
中央级公益性科研院所基本科研业务费专项资金资助项目(中国水产科学研究院,2014A02XK02);国家自然科学基金资助项目(41306113);广东省科技计划项目(2013B021100014)
* 责任作者, 副研究员, zhanglinbao1984@163.com

