碳酸盐矿化菌的筛选与其吸附和矿化Cd2+的特性
赵 越,姚 俊,*,王天齐,原志敏,姜新舒,王 飞,代云容(.北京科技大学能源与环境工程学院,
北京 100083;2.中国地质大学水资源与环境学院,北京 100083)
碳酸盐矿化菌的筛选与其吸附和矿化Cd2+的特性
赵 越1,姚 俊1,2*,王天齐1,原志敏1,姜新舒1,王 飞1,代云容2(1.北京科技大学能源与环境工程学院,
北京 100083;2.中国地质大学水资源与环境学院,北京 100083)
从贵州省毕节市妈姑镇矿区重金属污染的土壤中筛选出5株碳酸盐矿化菌,探究其吸附和矿化Cd2+的特性.从代谢热角度阐明Cd2+与基质(尿素)胁迫下菌活性会降低.实验结果表明,2#菌株对Cd2+耐受能力可达250mg/L.菌株吸附和矿化效率随Cd2+浓度增大而降低.Cd2+初始浓度为10mg/L时,菌龄为4h的菌株对Cd2+矿化效果最佳(45.14%),且矿化效果稳定.该研究表明碳酸盐矿化菌通过诱导沉淀矿化去除Cd2+的效果优于菌体吸附,为碳酸盐矿化菌修复重金属污染提供理论参考和实践指导.
碳酸盐矿化菌;筛选;Cd2+;矿化;吸附
镉(Cd)是典型的重金属元素,其毒性是铅的5倍以上.Cd可通过食物链进入人体,蓄积在肝肾之中,造成慢性不可逆的肝脏损伤,严重的将导致骨质疏松和软化[1-2].Cd不能被彻底清除,在环境中滞留时间久,随食物链在植物,动物和人体中不断积累,这种永久性和积累性造成的潜在危害比表观影响严重得多.近十年我国发生 Cd污染事件 60多起,市场上常见的市售大米约 10%存在Cd超标[3],已对我们的生存环境和身体健康产生了极大的威胁.因此从源头控制 Cd污染,发展高效低廉的修复技术已经势在必行.
众多修复手段中生物修复以其成本低、无二次污染、高效等受到广泛的关注.有研究表明,从Cd污染土壤中可以筛选出对 Cd具有高耐性的菌株,通过胞外沉淀和基团吸附固定 Pb,Cd可以取得良好的修复效果[4].向土壤中添加微生物,有机物料等,通过调节和改变土壤理化性质,在微生物作用下,可以改变重金属离子的赋存状态,抑制其生物有效性,减少毒害达到修复重金属污染土壤的目的[5-6].Cd不是植物生长发育的必需元素,会对植物造成不良影响,如植株矮小,叶片退绿,生长迟缓,产量下降甚至死亡等[7],因而植物修复Cd污染受到环境的诸多限制.而微生物适应性较强,耐受Cd能力高,适用于大面积,低浓度的污染区域修复[8].目前微生物修复重金属污染的机理主要包括对重金属的吸附,沉淀,氧化-还原等作用[9],对微生物修复重金属的研究热点主要集中在微生物对重金属的吸附作用,特性和机理方面,微生物作为吸附剂对重金属的吸附作用机制有很多,其中包括离子交换,络合作用,胞内富存,氧化还原等,探究手段也日趋成熟.
然而,针对微生物诱导矿化技术修复 Cd污染的研究相对匮乏.诱导矿化是生物地球化学循环的一个基础部分,是指生物体通过生物大分子的调控生成无机矿物的过程.其中碳酸盐矿化是生物矿化的一个重要方面,它是指菌株可以产生脲酶,分解环境中的基质(尿素)生成 CO32-,在微生物的控制或影响下,将溶液中的重金属离子转变为碳酸盐固相矿物的过程.国外有研究已经证实利用微生物诱导碳酸盐沉淀(MICP)技术可以有效地对放射性元素,微量元素 Sr,As()Ⅲ等污染进行矿化修复[10-11],形成的金属矿物耐酸性强,重金属离子得到有效的固定[12].而国内针对微生物诱导碳酸盐成矿修复重金属污染的研究还较少.矿山的开采,冶炼是我国 Cd污染的主要人为原因之一,矿区周边土壤重金属污染严重,但也是巨大的Cd耐受微生物资源库.
本研究从贵州矿区重金属污染农田土壤中筛选出碳酸盐矿化菌,分别进行 Cd的菌体吸附及生物矿化实验.研究菌株在基质和 Cd的胁迫下的微生物活性变化,探讨不同因素(Cd浓度,基质,菌龄)对Cd去除效果的影响,为碳酸盐矿化菌修复矿区Cd污染的工业化应用提供参考.
1 材料与方法
1.1 实验材料
1.1.1 样品来源 供试土壤采集于贵州省毕节市妈姑镇农田(104.5618°E, 26.9744oN,海拔1965m),该地区铅锌冶炼历史悠久,土法冶金产生的废气,废水,废渣的肆意排放与堆存导致该地区土壤重金属污染严重.土壤pH值为6.32,全Cd含量 4.36mg/kg,是《土壤环境质量标准》(GB 15618—2008)[13]中二级标准限值(0.3mg/kg)的14倍多.
1.1.2 主要试剂 使用 CdCl2·5/2H2O(分析纯,天津市光复科技发展有限公司)配制浓度为20g/L的 Cd2+储备溶液,其他浓度 Cd2+溶液使用蒸馏水稀释得到.尿素为分析纯试剂,购自汕头西陇化工有限公司.
1.1.3 培养基 1) 选择培养基(g/L):酵母提取物10,氯化铵20,无水乙酸钠8.2,尿素40.4,去离子水.尿素,氯化铵采用过滤灭菌,其余成分 121 ,℃高压灭菌20min.
2) 鉴别培养基(g/L):蛋白胨 10,牛肉膏 3,尿素40.4,氯化钠5,琼脂粉15,1.6%溴甲酚紫2,去离子水.尿素与溴甲酚紫溶液采用过滤灭菌,其余成分 121 ,℃ 高压灭菌 20min.最终使用 2mol/L NaOH溶液调节培养基pH值为5.75.
3) LB培养基(g/L):蛋白胨10,NaCl 10,酵母提取物5.121℃高压灭菌20min.
所有培养基在使用前均做灭菌处理.
1.2 实验方法
1.2.1 碳酸盐矿化菌的筛选和分离纯化 将1g土壤样品接种到灭菌的选择培养基中,在 35 ,℃150r/min条件下振荡培养 24h,用无菌水梯度稀释至合适菌液浓度,涂布至鉴别培养基,35℃静置培养 48h.挑取菌落特征明显不同的且培养基周围变紫色的菌株进行划线分离,此步骤反复3次,进行纯化,直至获得纯净单菌.
1.2.2 菌株Cd2+抗性实验 使用 LB液体培养基法分别考察菌株在存在和不存在基质(尿素)条件下对 Cd2+的耐受能力.将上步分离纯化后的菌株接种至LB培养基中活化,在35℃,150r/min条件下振荡培养24h后,按照1%接种量接种于含Cd2+浓度分别为 0,5,50,100,150,200,250,300, 400mg/L(不含或含 40.4g/L 基质)的 LB培养基中,在35℃,150r/min条件下振荡培养48h,观测菌株生长状况.采用不添加Cd2+的培养基作为对照实验,每个浓度设置3组平行实验.
1.2.3 基质和 Cd2+对菌株代谢活性的影响 使用十二通道微量热仪(TAMIII Multi-channel Thermal Activity Monitor, 美国TA仪器)通过测定热功率-时间曲线来研究基质和Cd2+对菌株活性的影响.将纯化后的菌株接种至 LB培养基活化 12h,用移液枪将 1mL 含有适宜浓度基质和Cd2+的 LB培养基加入到安瓿瓶中,取活化后的菌液按 1%的量接种到安瓿瓶中,用布擦拭干净后放入微量热仪通道中,在28℃下测定.
分别考察不同浓度 Cd2+和基质对菌株活性的影响.Cd2+对菌株活性影响的浓度选择分别为10,20,30,40,50mg/L.基质对菌株活性影响的浓度选择分别为 10.1,20.2,40.4,80.8,121.2g/L.Cd2+和基质联合作用对菌株活性影响的浓度选择为Cd2+10mg/L,基质浓度与上述浓度相同.
热力学参数包括最大热功率 Pmax;Tmax表示从微生物开始生长到最大功率时所用的时间;k表示微生物生长速率常数,k通过以下公式计算:

式中:t为时间;Pt为t时刻的功率,μW;P0为对数生长期开始时的功率,μW.
1.2.4 菌株吸附和矿化 Cd2+实验 菌株在 LB培养基35℃,150r/min振荡条件下培养24h后,使用离心机在4℃,3000r/min下离心10min,将收集到的菌体用蒸馏水洗涤三次,以排除培养基中有机物成分的影响,制成均匀的菌悬液后备用.菌株吸附Cd2+实验中,将菌悬液加入到不同浓度Cd2+初始溶液中,使菌悬液最终浓度为 2g/L(以湿菌计).在 35℃,150r/min振荡反应 3h后,立即在4℃,8000r/min下离心 10min,使用原子吸收光谱仪(SHIMAZU AAS6300, Japan)测定上清液中剩余 Cd2+浓度.菌株矿化实验需在吸附试验所有Cd2+溶液中添加适宜浓度的基质,其余操作条件与上述一致,所有实验重复三次,两组实验中未添加菌体的溶液作为空白对照实验.
Cd2+的去除效率计算公式如下:
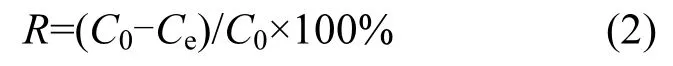
式中:R为 Cd2+的去除效率;C0表示溶液的初始Cd2+浓度mg/L;Ce表示上清液中残余的Cd2+浓度mg/L.
1.2.5 各因素(菌龄,基质浓度,Cd2+浓度)对菌株吸附,矿化 Cd2+效果的影响 1) 菌龄:将活化好菌株以 1%接种于 LB培养基中,分别在培养4,8,16,24,48h时,于4℃,3000r/min下离心10min,收集菌体,制备菌悬液,进行吸附和矿化实验,Cd2+的初始浓度分别设置为 10,50mg/L,基质初始浓度为40.4g/L.
2) 基质浓度:本实验拟考察基质浓度对菌株矿化 Cd2+能力的影响,设置初始溶液中基质浓度分别 10.1,20.2,40.4,80.8,121.2g/L,Cd2+浓度为10mg/L,进行菌株矿化实验.
3) 初始 Cd2+浓度:探究初始 Cd2+浓度对菌株去除Cd2+的影响,初始Cd2+浓度设置为10,20, 30,40,50mg/L,矿化实验中基质浓度为40.4g/L.
三组实验中,除特殊提到的实验操作,其余条件步骤同2.2.4.
2 结果与分析
2.1 碳酸盐矿化菌的筛选与抗Cd2+能力
溴甲酚紫是一种酸碱指示剂,在酸性环境中呈黄色,碱性环境中呈紫色,含有溴甲酚紫的选择培养基(pH=5.75)呈现青色.当碳酸盐矿化菌成活,会因分泌脲酶将尿素分解为(NH4)2CO3,使菌落周围选择培养基 pH值升高,而呈现紫色.根据选择培养基颜色变化(青色变为紫色)和多次分离筛选,得到5株菌落形态明显不同的碳酸盐矿化菌,分别编号为2#,7#,8#,9#,15#.
5株碳酸盐矿化菌筛选自 Cd2+含量超标的矿区农田土壤中,该地区菌株经过长时间 Cd2+驯化作用,对Cd2+有一定耐受能力.抗Cd2+能力实验结果见表 1,实验结果证明 5株碳酸盐矿化菌对Cd2+均有耐受能力,其中2#菌株对Cd2+耐受能力最强,在LB液体培养基中耐受能力为250mg/L,在含有基质的 LB液体培养基中耐受能力达到200mg/L.培养基中的尿素与 Cd2+的联合作用对菌株的生长代谢产生一定的毒害作用,且分解尿素后培养基pH值由7.1升高至9,形成了不利于菌株新陈代谢的生长环境,导致含有基质的培养基中2#菌对Cd2+耐受能力减小[14].
根据前期实验研究,2#菌株生长迅速,生物量大,经过 16S rDNA鉴定为某种芽孢杆菌(GenBank登录号:KU870701).其对Cd2+耐受能力强,更容易适应恶劣的Cd2+污染环境,在Cd2+污染的修复中有很大实用意义,因此对2#碳酸盐矿化菌吸附,矿化Cd2+的能力做了进一步分析.
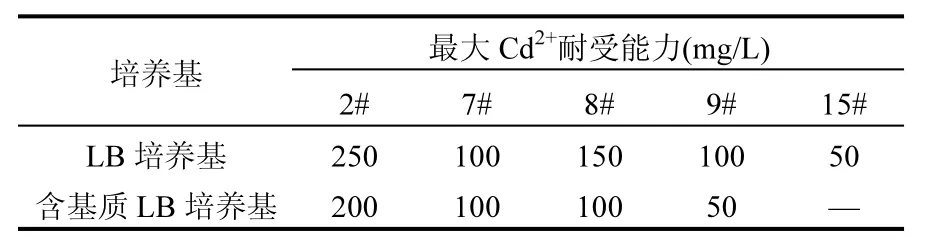
表1 5株碳酸盐矿化菌对镉耐受情况Table 1 Carbonate-biomineralization microbial tolerance to cadmium
2.2 微量热技术分析 Cd2+,尿素胁迫下 2#菌株代谢活性
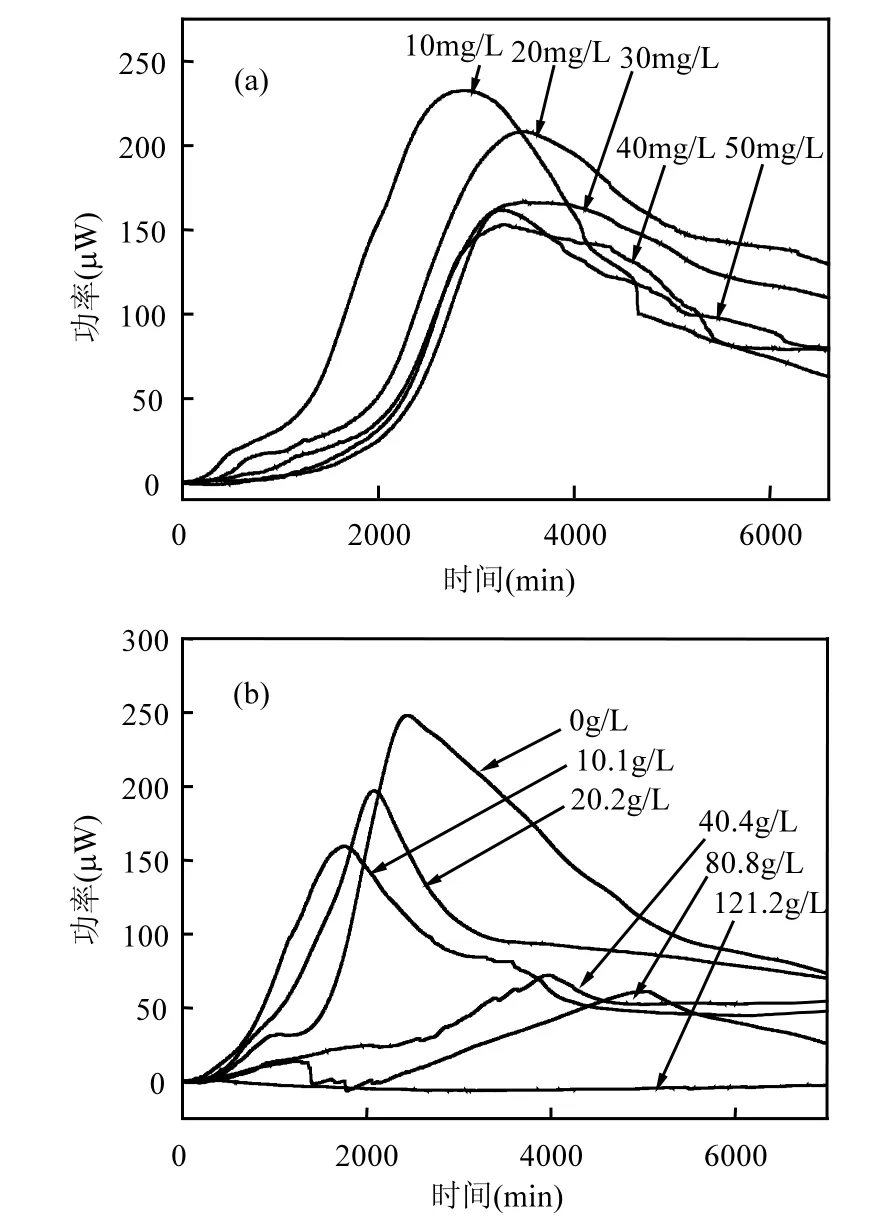
图1 Cd2+和基质胁迫下2#菌株的代谢功率—时间曲线Fig.1 Power-time curves of 2# bacterial strain afteradding Cd2+and urea
微量热技术是近年来兴起的一种实时、原位、无破坏的研究生物代谢热的方法,其可以连续准确地监测和记录微生物生长过程的反应热且与微生物种类和代谢类型无关,能够在相对真实的情况下反应微生物的活性.本实验中不同浓度 Cd2+胁迫下,2#菌株代谢热曲线如图 1a所示.结果表明,随着Cd2+浓度增大,菌株代谢活性降低,菌株生长速率常数k(表2)呈缓慢下降的趋势.这说明在10~50mg/L范围内,Cd2+浓度增大对菌株新陈代谢产生了轻微抑制作用.代谢热的峰值降低是由于菌株利用其抵抗 Cd2+毒性的能力取代了传统的生理功能[15],从而适应环境得以生存.
碳酸盐矿化菌用于修复 Cd2+污染时,受到Cd2+与基质的共同作用,因此研究 Cd2+与基质共同胁迫下菌株的生长活性具有重要意义.根据菌株代谢的功率-时间曲线特征参数(表 2),Cd2+浓度保持在 10mg/L,基质浓度逐渐增大时,生长速率常数k出现明显下降趋势.基质存在时,出现最大功率峰值的时间逐步推迟,且基质浓度逐渐增大,曲线变得平缓(图1b),菌株停滞期时间明显增长,最大功率显著降低,说明在复合体系下,基质浓度增大反而会抑制2#菌株的代谢活性.
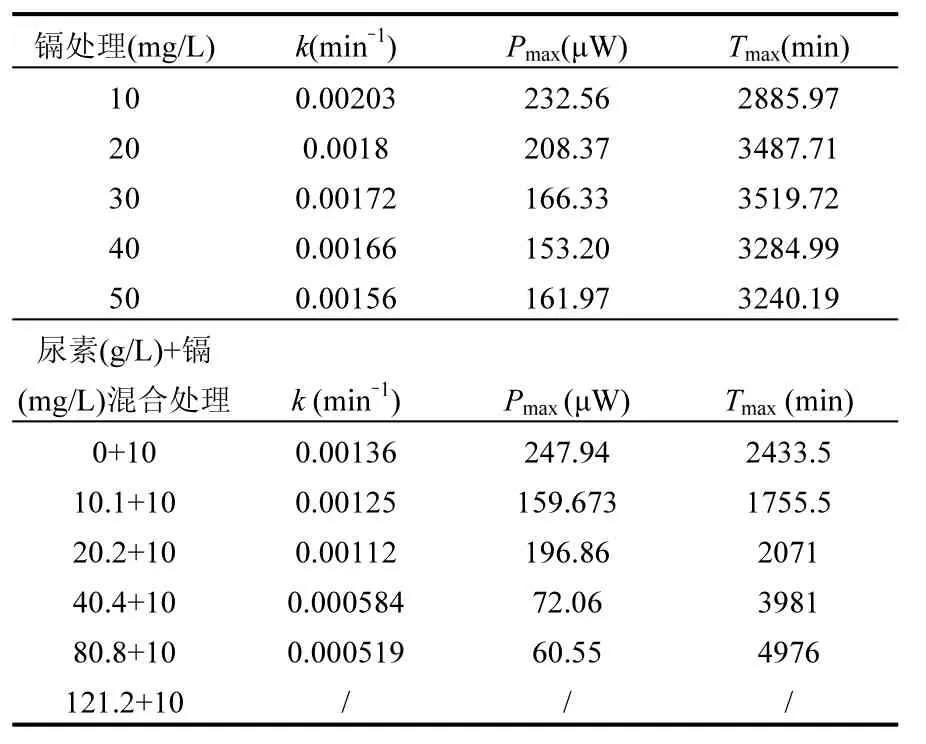
表2 2#菌株代谢功率-时间曲线特征参数Table 2 Calorimetric parameters of 2# bacterial strain in the period of logarithmic phase at 28℃
2.3 不同因素对菌株吸附,矿化Cd2+的影响
2.3.1 菌龄的影响 如图2所示,在Cd2+浓度为10mg/L时,随培养时间的增长,2#菌株对 Cd2+吸附效率有明显下降趋势,最高去除效率发生在培养 4h的菌体上,该阶段的菌体处于对数生长期,新陈代谢旺盛,脲酶活性高,吸附重金属的活性基团基本形成.随着菌龄增大,菌体新晨代谢减慢,吸附 Cd2+活力下降,使得吸附效率降低.菌株对Cd2+的矿化效率随菌龄增大趋于稳定,菌体对Cd2+进行吸附的同时进行矿化作用,增强了 Cd2+的去除效率.
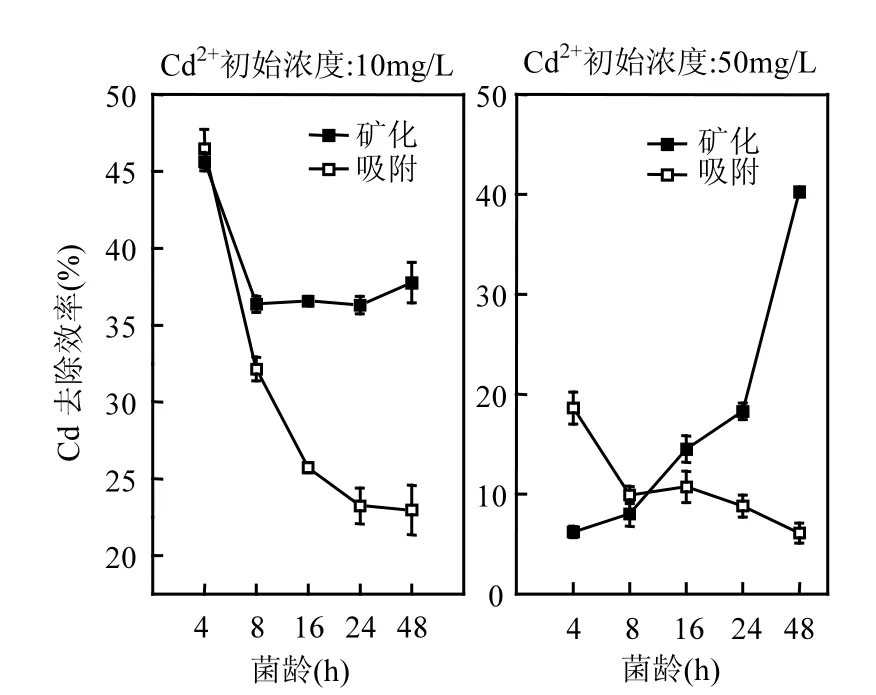
图2 菌龄对菌株吸附、矿化去除镉效率的影响Fig.2 Effects of cell age on the Cd2+removal efficiencyby biosorption and biomineralization
在 50mg/L Cd2+环境中,菌体吸附表现出相同的规律,但是菌体矿化 Cd2+效率曲线的趋势与在低浓度Cd2+中明显不同.菌龄较小时,矿化效率很低,菌体矿化Cd2+效率随菌龄增大显著提高.这是因为菌龄较小的菌体受50mg/L Cd2+与尿素影响大,菌体活性大幅度降低;而菌龄较大的菌体发育完整,在 50mg/L Cd2+与基质共同胁迫下耐受能力更强,脲酶活性稳定,使矿化效果受环境影响较小.但是菌龄为48h的菌株已达到衰亡期,培养48h后培养基中的生物量明显降低,为了得到相同的生物量需耗费更多时间及成本,从实际应用角度考虑成本过高,所以没有验证菌龄超过 48h的菌株对Cd的去除率.
2.3.2 Cd2+浓度的影响 由图3可以看出,随着Cd2+浓度增高,菌株对 Cd2+的去除效率呈下降趋势,该趋势与许多研究结果均一致[16].Cd2+浓度为10mg/L时,菌株对其的吸附,矿化效率均达到最高,分别为 42.08%,53.06%.这是由两方面原因造成的:一是菌体在低浓度的 Cd2+溶液中,大部分Cd2+有机会与菌体上吸附点位结合,而 Cd2+浓度增大导致菌体上吸附点位达到饱和,吸附率因此降低.另一方面,由于高浓度Cd2+影响微生物的吸附结构[17-18],降低菌体活性,使得活细胞数量减少. Cd2+可与菌体细胞表面的酶结合,通过菌体的主动运输转移到菌体内部,这一过程需要细胞代谢提供能量[19-20].从 3.2中不同 Cd2+浓度下菌株的时间-功率曲线可知,高浓度 Cd2+抑制菌体正常新陈代谢,使能量提供受到阻碍,去除效率因而降低.而菌体矿化过程,需要活菌体产生脲酶,Cd2+胁迫下脲酶活性降低[21],且活菌体的减少直接对成矿过程产生不利影响,导致矿化效率的降低.
菌体通过静电吸引,螯合作用等吸附溶液中Cd2+,碳酸盐矿化菌水解基质产生的 CO32-会在菌体表面与Cd2+结合形成CdCO3,菌体表面的功能基团可以有效地调节矿物与菌体表面的粘附力[22],微生物分泌物的刺激促进了CdCO3晶体的沉降[23].从图 3可以看出,无论哪种初始浓度下,菌株通过诱导沉淀矿化去除 Cd2+效果均优于菌体吸附.与由此可见,碳酸盐矿化菌用于Cd2+污染的修复蕴藏着巨大的潜力.
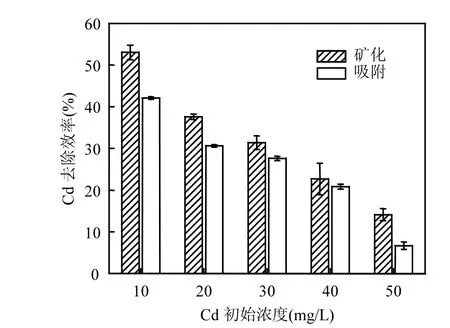
图3 Cd2+初始浓度对2#菌株吸附、矿化效率的影响Fig.3 Effects of initial Cd2+concentration on the removal rate by biosorption and biomineralization
2.3.3 基质浓度的影响 由图4可以看出:随基质浓度增大,Cd2+去除效率出现先升高后降低的趋势,在浓度为 40.4g/L时达到最大去除效率45.14%.基质浓度较低时,菌株矿化效率与吸附效率相差不多,这是由于低浓度基质对于菌株活性影响不大,但是低浓度的尿素经过微生物酶解作用产生的 CO32-浓度小,不利于 Cd2+矿物的结晶过程.基质浓度超过最适宜矿化浓度时,Cd2+去除效率明显下降,甚至低于吸附效率.这是因为高浓度基质与 Cd2+的共同作用抑制菌株正常生长代谢,脲酶活性变低,严重降低矿化能力,能量代谢受到阻碍,主动运输 Cd2+能力减弱.而且,溶液中尿素分解产生的铵根浓度增大,会与 Cd2+竞争吸附菌体上的吸附点位[24].
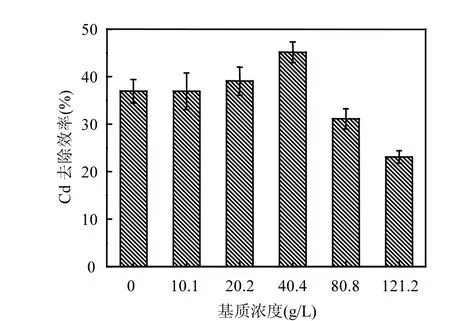
图4 基质浓度对2#菌株吸附、矿化Cd2+效率的影响Fig.4 Effects of urea concentration on the Cd2+removal efficiency by biosorption and biomineralization
3 结论
3.1 在贵州矿区农田土壤中筛选出5株碳酸盐矿化菌,其中 2#菌株对 Cd2+耐受能力最强.且Cd2+和基质浓度越大,对该菌株活性的抑制作用越强.
3.2 各因素对 Cd2+去除率的影响实验结果表明:Cd2+浓度为10mg/L时,对数期的菌体对Cd2+去除效率达到最高;基质浓度为 40.4g/L时,2#菌株对Cd2+矿化效率最佳.
3.3 该实验研究结果证明,2#菌株矿化去除Cd2+效率普遍高于菌体吸附作用.说明利用碳酸盐矿化菌诱导碳酸盐沉淀去除 Cd2+污染是一种很有前景的修复技术.
[1] Tang Y, Hu J, Yang X, et al. Biotoxicity of cadmium-based quantum dots and the mechanisms [J]. Progress in Chemistry, 2014,26(10):1731-1740.
[2] Angeletti R, Binato G, Guidotti M, et al. Cadmium bioaccumulation in mediterranean spider crab (Maya squinado): Human consumption and health implications for exposure in Italian population [J]. Chemosphere, 2014,100:83-88.
[3] 易泽夫,余 杏,吴 景.镉污染土壤修复技术研究进展 [J]. 现代农业科技, 2014,(9):251-253.
[4] 林晓燕,牟仁祥,曹赵云,等.耐镉细菌菌株的分离及其吸附镉机理研究 [J]. 农业环境科学学报, 2015,(9):1700-1706.
[5] 孙约冰,徐应明,史 新,等.污灌区镉污染土壤钝化修复及其生态效应研究 [J]. 中国环境科学, 2012,32(8):1467-1473.
[6] 蔡 楠,肖青青,许振成,等.基于土壤—农作物迁移途径重金属镉化学形态研究 [J]. 中国环境科学, 2013,33(S1):13-18.
[7] Liu J, Zho Q, Sun T, et al. Growth responses of three ornamental plants to Cd and Cd-Pb stress and their metal accumulation characteristics [J]. Journal of Hazardous Materials, 2008,151(1): 261-267.
[8] 陈美标,郭建华,姚 青,等.大宝山矿区耐 Cd2+细菌的分离鉴定及其生物学特性 [J]. 微生物学通报, 2012,(12):1720-1733.
[9] 钱春香,王明明,许燕波.土壤重金属污染现状及微生物修复技术研究进展 [J]. 东南大学学报(自然科学版), 2013,(3):669-674.
[10] Achal V, Pan X, Fu Q, et al. Biomineralization based remediation of As (III) contaminated soil by Sporosarcina ginsengisoli [J]. Journal of Hazardous Materials, 2012,201:178-184.
[11] Achal V, Pan X, Zhang D. Bioremediation of strontium (Sr) contaminated aquifer quartz sand based on carbonate precipitation induced by Sr resistant Halomonas sp. [J]. Chemosphere, 2012, 89(6):764-768.
[12] Li M, Cheng X, Guo H. Heavy metal removal by biomineralization of urease producing bacteria isolated from soil [J]. International Biodeterioration & Biodegradation, 2013,76:81-85.
[13] GB 15618—2008 土壤环境质量标准 [S].
[14] Karthikeyan S, Balasubramanian R, Iyer C S P. Evaluation of the marine algae Ulva fasciata and Sargassum sp for the biosorption of Cu (II) from aqueous solutions [J]. Bioresource Technology, 2007,98(2):452-455.
[15] 宋长顺,姚 俊.赤铁矿—微生物联合去除六价铬及相关微生物活性 [J]. 农业工程, 2012,(10):16-18.
[16] 潘 蓉,曹理想,张仁铎.青霉菌和镰刀菌对重金属 Cd2+,Cu2+, Zn2+和Pb2+的吸附特性 [J]. 环境科学学报, 2010,(3):477-484.
[17] Bishak Y K, Payahoo L, Osatdrahimi A, et al. Mechanisms of cadmium carcinogenicity in the gastrointestinal tract. [J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2015,16(1):9-21.
[18] Yu Q, Fein J B. The effect of metal loading on Cd adsorption onto shewanella oneidensis bacterial cell envelopes: The role of sulfhydryl sites [J]. Geochimica et Cosmochimeca Acta, 2015,167: 1-10.
[19] 董 博,袁国强,欧 杰,等.微生物对实验室废水中重金属吸附作用的辅助因子 [J]. 广东农业科学, 2013,(20):182-184.
[20] 陈佩林.微生物吸附重金属离子研究进展 [J]. 生物学教学, 2003,(12):1-3.
[21] 陆兆文,钱春香,许燕波,等.不同污染条件下微生物矿化固结Zn2+的作用及机理 [J]. 东南大学学报(自然科学版), 2013,(2): 365-370.
[22] Burns J L, Ginn B R, Bates D J, et al. Outer membraneassociated serine protease involved in adhesion of shewanella oneidensis to Fe (III) Oxides [J]. Environmental Science & Technology, 2010,44(1):68-73.
[23] Huang J, Elzinga E J, Brechbuchl Y, et al. Impacts of shewanella putrefaciens strain CN-32cells and Extracellular Polymeric Substances on the Sorption of As (V) and As (III) on Fe (III)-(Hydr) oxides [J]. Environmental Science & Technology, 2011,45(7):2804-2810.
[24] 周广麒,任铮宇,杨洪泽,等.微生物菌体对 Cd2+等重金属离子的吸附研究 [J]. 生物技术通报, 2013,(6):155-159.
Screening of carbonate-biomineralization microbe and its cadmium removal characteristics based on adsorption and biomineralization.
ZHAO Yue1, YAO Jun1,2*, WANG Tian-qi1, YUAN Zhi-min1, JIANG Xin-shu1, WANG Fei1, DAI Yun-rong2, (1.School of Energy and Environmental Engineering, University of Science and Technology Beijing, Beijing 100083, China;2.School of Water Resouces and Environment, China University of Geosciences (Beijing), Beijing 100083, China). China Environmental Science, 2016,36(12):3800~3806
Five carbonate-biomineralization microbes were isolated from a mine soil, which was from Magu town of Bijie city, Guizhou province, China. The removal ability of 2# bacterial strain for Cd2+was evaluated on the basis of biosorption and biomineralization. Experimental results showed that 2# strain had the strongest cadmium (Cd) tolerance in LB medium (250mg/L) among the five strains. The power-time growth curves indicated that the urea and Cd2+inhibited the growth of 2# strain. Both the biosorption and biomineralization efficiencies declined with the increasing concentration of Cd2+. The strain had the best Cd2+removal efficiency (45.14%) at its cell age of 4h. These results illustrated that the carbonate-biomineralization bacteria had a higher Cd2+removal efficiency by biomineralization than that by biosorption. This study will offer a theoretical reference and practical guidance for remediating the heavy metal-polluted environments.
carbonate-biomineralization microbe;screening;Cd2+;biomineralization;adsorption
X172
A
1000-6923(2016)12-3800-07
赵 越(1992-),女,河北衡水人,北京科技大学硕士研究生,主要研究内容:碳酸盐矿化菌的筛选及矿化重金属的研究.
2016-04-15
国家自然科学基金重点项目(41430106);国家自然科学基金(41273092,U1402234);环境保护部公益项目(201509049)
* 责任作者, 教授, yaojun@ustb.edu.cn

