高脂诱导肥胖大鼠血清游离脂肪酸与血糖代谢的相关性
陈兴国 李庆新 李东阳 杨 静 李 英 康之裔
(天津市泰达医院检验科,天津 300457)
高脂诱导肥胖大鼠血清游离脂肪酸与血糖代谢的相关性
陈兴国 李庆新 李东阳 杨 静 李 英 康之裔1
(天津市泰达医院检验科,天津 300457)
目的 研究高脂诱导肥胖大鼠血清游离脂肪酸与血糖代谢的相关性。方法 选择SD大鼠36只作为研究动物并随机分为高脂饮食组和普通饮食组,高脂饮食组给予高脂饲料喂养,正常饮食组给予普通饲料喂养,4 w、8 w、12 w后采集血清并测定游离脂肪酸(FFA)、空腹血糖(FPG)、空腹胰岛素(FINS),计算胰岛素抵抗指数(HOMA-IR)、胰岛素分泌指数(HOMA-β)。结果 喂养8 w、12 w时,高脂饮食组大鼠体重明显高于普通饮食组(t=3.120,4.528,均P<0.05);喂养4 w、8 w、12 w时,高脂饮食组大鼠血清中FFA均明显高于普通饮食组(t=5.995,8.175,13.942,均P<0.05);两组FPG比较无统计学意义(t=0.869,0.496,0.827,均P>0.05),高脂饮食组血清FINS、HOMA-IR、HOMA-β均明显高于普通饮食组(t=5.152,7.411,6.638;5.868,9.770,8.858;2.517,2.890,4.390,均P<0.05);血清FFA含量与FINS、HOMA-IR、HOMA-β呈正相关(r=0.724,0.668,0.637,均P<0.05)。结论 高脂诱导肥胖大鼠的血清FFA含量显著升高且存在胰岛素抵抗和高胰岛素血症,FFA含量与胰岛素抵抗程度具有良好的相关性。
肥胖;高脂饮食;游离脂肪酸;胰岛素抵抗
近年来,随着我国居民生活水平的提高以及饮食结构的改变,肥胖的发病率逐年升高,相应的心血管疾病、糖尿病的发病率也不断升高,对居民的生命健康造成重大影响〔1〕。肥胖人群体内胰岛素抵抗、内皮损伤、微炎症状态等病理现象是连接肥胖与心血管疾病、糖尿病的重要环节,但是引起上述病理现象的分子机制尚未阐明〔2〕。游离脂肪酸(FFA)是血清中未与胆固醇、甘油等成分酯化的脂肪酸,肥胖人群体内FFA的含量显著升高〔3〕。有关FFA与血糖代谢相关性研究的文献报道较少,且各家观点并不尽相同〔4,5〕。本文以长期高脂饲养大鼠为研究对象,探讨高脂诱导肥胖大鼠血清FFA与血糖代谢的相关性。
1 材料与方法
1.1 仪器与试剂 高脂饲料参照邱烈峰〔6〕文献资料配置,以100 g计,普通饲料60 g、奶粉10 g、猪油10 g、全白糖7 g、蛋奶粉13 g以及浓缩鱼肝油10滴。全自动生化分析仪(日本日立7600型);美国雅培I2000化学发光仪;离心机(上海医用分析仪器厂LXJ-Ⅱ型);血糖、FFA试剂盒(北京九强生物科技公司);胰岛素检测试剂(雅培I2000配套试剂)。
1.2 实验方法
1.2.1 实验动物 选择36只雄性SD大鼠作为研究动物,购自天津南开大学泰达学院动物中心(许可证号20151201),10~12周龄,体重200~240 g,置于清洁、恒温环境饲养。
1.2.2 模型建立方法 所有大鼠均分笼喂养(6只/每笼),正常喂养1 w后,随机分为高脂饮食组和普通饮食组各18只,普通饮食组给予普通饲料喂养,高脂饮食组给予高脂饲料喂养。喂养8 w称量大鼠体重,高于普通饲料组10%即为造模成功〔7〕。从中挑选12只肥胖大鼠继续高脂饲料喂养4 w。
1.2.3 指标检测方法 饮食干预后4 w、8 w、12 w时,各组大鼠禁食12 h,采集腹主动脉血2 ml,3 000 r/min离心10 min(离心半径3 cm),采用全自动生化分析仪测定空腹血糖(FPG)和FFA、化学发光仪测定空腹胰岛素(FINS)含量,计算胰岛素抵抗指数(HOMR-IR)=FINS×FPG/22.5、胰岛素分泌指数(HOMA-β)=20×FINS/(FPG-3.5)。检测方法:FFA:酶法(ACS-ACOD法);INS:磁颗粒化学发光法。
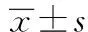
2 结 果
2.1 各组大鼠体重比较 喂养4 w时,两组大鼠体重差异无统计学意义(P>0.05);喂养8 w、12 w时,高脂饮食组大鼠体重明显高于普通饮食组(P<0.05)。见表1。
2.2 各组血清FFA含量比较 喂养4 w、8 w、12 w时,高脂饮食组大鼠血清中FFA均明显高于普通饮食组(P<0.05);且喂养8 w、12 w时,高脂饮食组血清FFA含量均明显高于喂养4 w时(P<0.05)。见表2。
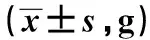
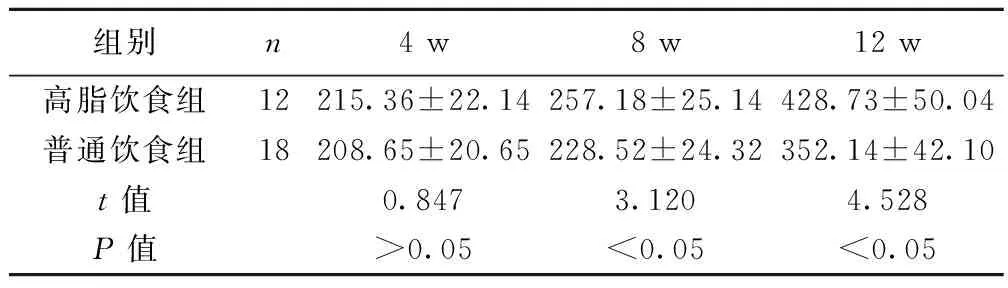
组别n4w8w12w高脂饮食组12215.36±22.14257.18±25.14428.73±50.04普通饮食组18208.65±20.65228.52±24.32352.14±42.10t值0.8473.1204.528P值>0.05<0.05<0.05
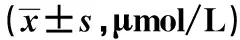
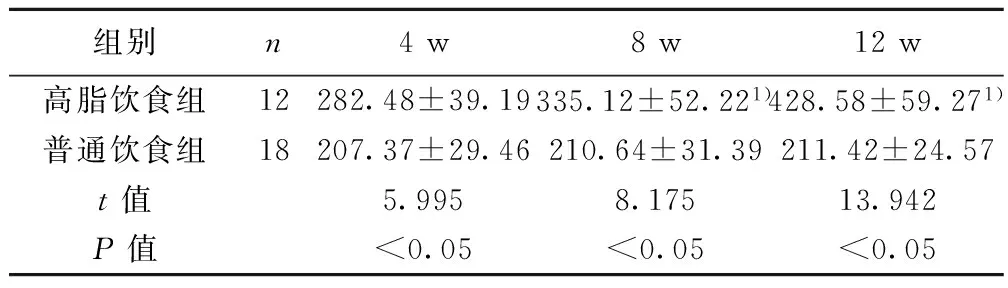
组别n4w8w12w高脂饮食组12282.48±39.19335.12±52.221)428.58±59.271)普通饮食组18207.37±29.46210.64±31.39211.42±24.57t值5.9958.17513.942P值<0.05<0.05<0.05
与喂养4 w比较:1)P<0.05
2.3 各组糖代谢指标比较 喂养4 w、8 w、12 w时,两组FPG比较无统计学意义(t=0.869,0.496,0.827;均P>0.05),高脂饮食组血清FINS、HOMA-IR、HOMA-β均明显高于普通饮食组(P<0.05)。见表3。

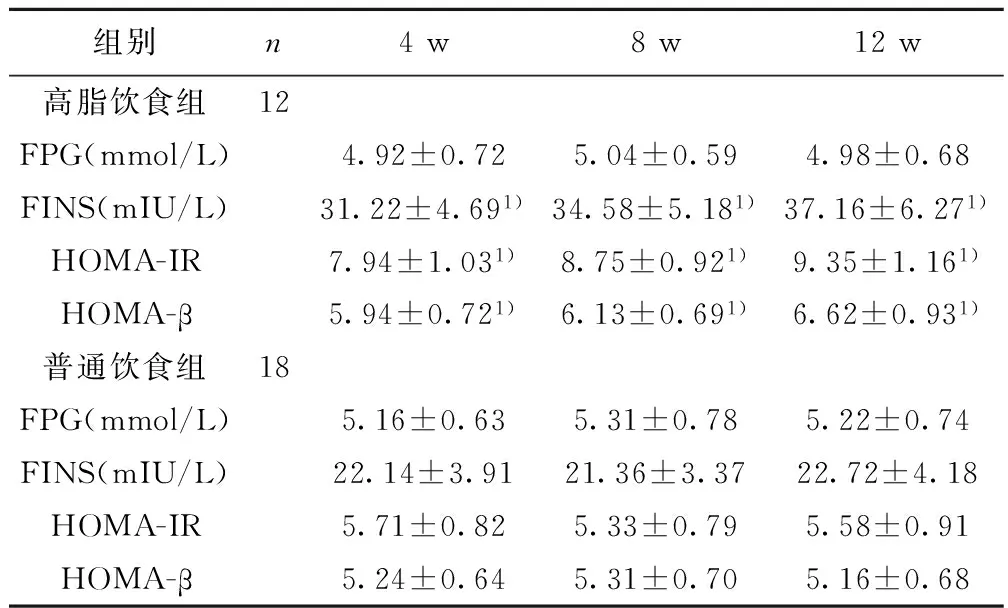
组别n4w8w12w高脂饮食组12FPG(mmol/L)4.92±0.725.04±0.594.98±0.68FINS(mIU/L)31.22±4.691)34.58±5.181)37.16±6.271)HOMA-IR7.94±1.031)8.75±0.921)9.35±1.161)HOMA-β5.94±0.721)6.13±0.691)6.62±0.931)普通饮食组18FPG(mmol/L)5.16±0.635.31±0.785.22±0.74FINS(mIU/L)22.14±3.9121.36±3.3722.72±4.18HOMA-IR5.71±0.825.33±0.795.58±0.91HOMA-β5.24±0.645.31±0.705.16±0.68
与普通饮食组比较:1)P<0.05
2.4 FFA含量与胰岛素抵抗的相关性 Pearson相关性分析显示,血清FFA含量与FINS、HOMA-IR、HOMA-β呈正相关(r=0.724、0.668、0.637,均P<0.05)。
3 讨 论
FFA是血清中未与胆固醇、甘油等成分酯化的脂肪酸,血清中FFA的含量较低。在高脂诱导肥胖的过程中,脂肪细胞的增殖以及脂肪组织的增多会增加FFA的产生,同时也会抑制机体对脂肪酸的清除和代谢,进而造成血清中FFA含量升高〔8,9〕。本研究通过高脂饮食诱导肥胖大鼠的动物模型,高质饮食后8 w、12 w时,高脂饮食组大鼠体重明显重于正常饮食组,提示大鼠肥胖模型诱导成功。喂养4 w、8 w、12 w时,高脂饮食组大鼠血清FFA含量明显高于普通饮食组,说明高脂饮食诱导的肥胖会增加血清中FFA的含量。
FFA的生物学功能在近年来受到了越来越多的重视,FFA在体内代谢活跃且比高密度脂蛋白、低密度脂蛋白、甘油三酯等指标更早反机体血脂代谢紊乱的状况,血清中FFA含量升高是血脂代谢异常的结果〔10〕。肥胖患者是发生心血管事件的高危人群,大量分泌的FFA是增加肥胖患者心血管事件发生风险的主要途径〔11〕。目前关于FFA增加心血管事件发生风险的具体机制尚未明确,相关研究认为FFA增加心血管事件风险的可能途径如下〔12,13〕:(1)促进INS分泌,加重周围组织的胰岛素抵抗;(2)造成内皮损伤;(3)激活肾素-血管紧张素-醛固酮系统的活性;(4)增加eNOS的表达。
近年来关于肥胖的研究认为,多数肥胖患者存在不同程度的胰岛素抵抗并且具有发展为糖尿病的高度风险,同时胰岛素抵抗也是造成内皮损伤、增加心血管事件发生率的中心环节〔14〕。本研究对高脂饮食诱导肥胖大鼠的血糖代谢情况进行了分析,高脂饮食后4 w、8 w、12 w时,高脂饮食组大鼠的FPG含量与普通饮食组无显著性差异。说明高脂饮食12 w造成的肥胖尚不足以造成FPG损伤。进一步分析表明,高脂饮食后4 w、8 w、12 w时,高脂饮食组大鼠的INS含量、HOMA-IR及HOMA-β显著高于普通饮食组。FINS含量升高表明机体存在INS抵抗,也是机体对外周组织胰岛素不敏感的自身代偿机制,通过增加FINS的合成和分泌控制FPG水平在正常范围。HOMA-IR及HOMA-β能够分别反映胰岛素抵抗的程度和胰岛的分泌功能,高脂饮食能够造成胰岛素抵抗并促进胰岛β细胞分泌FINS〔15〕。相关性分析表明,血清FFA含量与FINS、HOMA-IR、HOMA-β呈正相关。国内外学者也有类似的文献报道〔16,17〕,提示高脂诱导的肥胖大鼠体内FFA含量升高能够造成胰岛素抵抗、增高FINS的含量。
本文研究结果表明,高脂诱导肥胖大鼠的血清FFA含量显著升高且存在胰岛素抵抗和高INS血症,FFA含量与胰岛素抵抗程度具有良好的相关性。需要指出的是,本文研究中,高脂诱导大鼠与常规饮食大鼠FPG并无统计学意义,其中原因尚待继续研究。
1 王 媛,郭 剑,芦文丽,等.肥胖人群生活行为方式对高血压患病风险影响〔J〕.中国公共卫生,2012;28(4):462-3.
2 Shiomi Y,Yamauchi T,Iwabu M,etal.A novel peroxisome proliferator-activated receptor(PPAR)α agonist and PPARγ antagonist,Z-551,ameliorates high-fat diet-induced obesity and metabolic disorders in mice〔J〕.J Biol Chem,2015;290(23):14567-8.
3 胡志坚,江永青,谷 翔,等.中心肥胖型高血压患者血清游离脂肪酸与载脂蛋白的变化〔J〕.实验与检验医学,2016;34(1):15-7.
4 孙红爽,乜春城,朱小丽,等.11β-HSD1在糖皮质激素联合高脂喂养大鼠胰岛素抵抗中的作用〔J〕.国际内分泌代谢杂志,2016;36(1):14-9.
5 Khare P,Jagtap S,Jain Y,etal.Cinnamaldehyde supplementation prevents fasting-induced hyperphagia,lipid accumulation,and inflammation in high-fat diet-fed mice〔J〕.Biofactors,2016;42(2):201-11
6 邱烈峰.高脂饮食诱导肥胖大鼠脂代谢相关指标的变化〔J〕.中国老年学杂志,2014;34(10):2815-8.
7 Woods SG,Seeley KJ,Rushing PA,etal.A controlled high fat induces an obese syndrome in rats〔J〕.J Nutr,2003;(4):1081-7
8 于海涛,马洪波,富校轶,等.高脂饮食诱导肥胖大鼠血清游离脂肪酸水平分析〔J〕.吉林医药学院学报,2015;36(6):415-7.
9 高芳芳,刘戈力,郑荣秀,等.肥胖幼鼠脂肪组织vaspin与胰岛素敏感性的关系〔J〕.中国当代儿科杂志,2013;15(1):71-4.
10 李彩凤.2型糖尿病患者游离脂肪酸水平变化与胰岛素抵抗的关系分析〔J〕.基层医学论坛,2016;20(5):641-2.
11 Lin SY,Huang GC,Hsieh YY,etal.Vitis thunbergii var.taiwaniana extracts and purified compounds ameliorate obesity in high-fat diet-induced obese mice〔J〕.J Agirc Food Chem,2015;63(42):9286-94.
12 Jung CH,Lee WJ,Hwang JY,etal.The preventive effect of uncarboxylated osteocalcin against free fatty acid-induced endothe-lial apoptosis through the activation of phosphatidylinositol 3-kinase/Akt signaling pathway〔J〕.Metabolism,2013;62(9):1250-7.
13 Sun X,Pan H,Tan H,etal.High free fatty acids level related with cardiac dysfunction in obese rats〔J〕.Diabetes Res Clin Pract,2012;95(2):251-9.
14 Sartorius T,Drescher A,Panse M,etal.Mice lacking free fatty acid receptor 1(GPR40/FFAR1)are protected against conjugated linoleic acid-induced fatty liver but develop inflammation and insulin resistance in the brain〔J〕.Cell Physiol Biochem,2015;35(6):2272-84.
15 李阳雪,郑 爽,韩亭亭,等.脂蛋白脂酶基因敲除小鼠糖脂代谢研究及其胰岛素抵抗的机制探索〔J〕.中华内分泌代谢杂志,2015;31(2):143-7.
16 邢冬杰,宿世震.三白草总黄酮对Ⅱ型糖尿病胰岛素抵抗大鼠糖、代谢的影响〔J〕.中成药,2015;37(8):1840-2.
17 Cordoba-Chacon J,Majumdar N,Polala NK,etal.Islet insulin content and release are increased in male mice with elevated endogenous GH and IGF-I,without evidence of systemic insulin resistance or alterations in β-cell mass〔J〕.Growth Horm IGF Res,2015;25(4):189-95.
〔2016-02-19修回〕
(编辑 徐 杰)
国家高技术研究发展计划(863计划)课题(2011AA02A111)
1 天津南开大学泰达学院
陈兴国(1965-),男,副主任技师,主要从事免疫研究。
R151.2
A
1005-9202(2016)23-5810-03;
10.3969/j.issn.1005-9202.2016.23.016

