硒的生理功能、摄入现状与对策研究进展
袁丽君, 袁林喜*, 尹雪斌*, 秦立强
1.中国科学技术大学地球和空间科学学院, 合肥 230026;2.中国科学技术大学先进技术研究院, 功能农业工程中心联合实验室, 合肥 230088;3.江苏省硒生物工程研究中心, 江苏 苏州 215123;4.苏州大学公共卫生学院, 江苏 苏州 215123
硒的生理功能、摄入现状与对策研究进展
袁丽君1,2,3, 袁林喜1,2,3*, 尹雪斌1,2,3*, 秦立强3,4
1.中国科学技术大学地球和空间科学学院, 合肥 230026;2.中国科学技术大学先进技术研究院, 功能农业工程中心联合实验室, 合肥 230088;3.江苏省硒生物工程研究中心, 江苏 苏州 215123;4.苏州大学公共卫生学院, 江苏 苏州 215123
硒是谷胱甘肽过氧化物酶、甲状腺素脱碘酶、硒蛋白K、硒蛋白W等多达25种硒蛋白的重要组分,与抗氧化、激素调节、矿质元素代谢等功能密切相关。综述了近10年来国内外对微量元素硒在人体中的生理功能、参考摄入量标准、硒摄入不足所导致的“硒隐性饥饿”问题的现状及其相应的对策等方面的研究进展,以期为硒的营养强化研究提供参考。
硒;生理功能;摄入量;隐性饥饿;生物营养强化;应对策略
1817年,瑞典化学家Berzelius从硫酸厂铅室底部的红色粉状物质中首次发现硒(selena)。1934年,美国怀俄明州和南达柯他州农业站发布了一份关于动物因食用高硒植物而患碱毒症和蹒跚盲的报告引起学界的重视,随后,科学家们开始了硒元素生理作用的研究。1957年,德国科学家Schwarz等[1]证实硒对肝脏有很强的保护作用;与此同时,大量研究表明硒的缺乏将直接导致多种疾病的发生。1973年,美国科学家Rotruck等[2]在分子水平上揭示了硒的生物活性形态——谷胱甘肽过氧化物酶(GPx),指出人体缺硒将导致谷胱甘肽过氧化物酶活性降低,这一发现首次确认硒的生理作用;同年,中国科学家杨光圻等[3]发现克山病区居民血硒和发硒浓度均低于非病区,首次提出克山病可能是由于硒的摄入量过低导致的。1981年,杨光圻等[4]在调查湖北恩施高硒区的人群脱发脱甲病过程中,发现其与过高的硒摄入密切相关。因此,尽管微量元素硒在人体中发挥着重要的生理功能,但是摄入量过高或过低都会导致健康风险。随着科学研究的不断深入,硒的生理功能不断被发掘,各国的硒推荐摄入量也在变化,硒摄入量缺乏问题也开始得到关注和重视,应对方法和手段也丰富起来。基于此,本文总结了近10年来最新的研究成果,综合论述了硒的生理功能研究进展,调研了各国权威公布的硒推荐摄入量,总结了应对硒摄入缺乏的策略,以期为科学认识硒的生理功能、合理指导硒营养摄入与补充提供科学参考。
1 硒的生理功能研究进展
目前,在人体和动物体中已发现了25种硒蛋白,其种类与功能如表1[5,6]所示。由于这些硒蛋白参与特定酶的代谢活动,因此硒缺乏将会阻碍酶的合成、降低酶的活性,从而影响人体正常的生理活动,尤其是在甲状腺激素代谢、氧化还原反应、生殖功能和免疫功能等方面[6]。另一方面,硒蛋白在机体中的抗氧化作用对人体的健康具有重要意义,可以清除身体正常代谢和呼吸过程中不断生成的活性氧(ROS)、活性氮(RNS),抑制DNA、RNA、蛋白质、脂类等生物分子的烷基化。充足的硒有助于保持适当的硒蛋白水平,进一步保持特定酶的活性,降低血浆中ROS和RNS的水平,预防许多疾病的发生与发展。鉴于硒对人体健康的重要作用,硒与人体疾病的关系也逐渐为科学家所确认,目前已发现了几种与硒摄入相关的疾病。
1.1 硒缺乏地方病
1.1.1 克山病 克山病是最早发现的与缺硒相关的地方病,最早发现于20世纪70年代中国黑龙江省克山县,随后西藏和西伯利亚的某些低硒地区也发现了类似症状。杨光圻等[7]在1973年最先关注并研究了克山病与硒之间的联系。研究表明克山病是一种慢性病程的心肌病,而硒代谢失衡会使谷胱甘肽过氧化物酶(GPx)与超氧化物歧化酶(SOD)活性降低、清除自由基功能降低,从而导致自由基堆积,生物膜氧化,进一步造成心肌细胞损伤[8]。
1.1.2 大骨节病 自1849年俄罗斯科学家Yurenski首次报道该病以来,目前世界范围内仅有俄罗斯、朝鲜以及我国部分地区仍然存在大骨节病患者。大骨节病是一种以关节软骨变性、坏死为主的慢性地方性疾病。研究表明,大骨节病与硒元素的缺乏密切相关[9]。大骨节病区基本都处于低硒的地球化学环境中,体内的低硒营养水平是大骨节病患者的共同特征,对大骨节病患者进行补硒后能有效缓解病症[10]。

表1 硒蛋白的种类与功能Table 1 Type and function of selenoproteins.
1.2 与抗氧化功能相关的疾病
1.2.1 癌症 研究显示硒具有抑制和预防癌症的作用。无机形式硒(如亚硒酸钠)和有机形式硒(如硒代半胱氨酸或硒代蛋氨酸)的化学性质都表明硒具有很强抗氧化能力[11];还原型谷胱甘肽可以催化还原过氧化氢,消除自由基,防止脂质过氧化,保护细胞免受活性氧氧化;硒水平可明显地影响癌基因表达,人体血硒含量与恶性肿瘤发病率间存在显著的负相关关系[12]。
目前,临床上开发了与其他抗癌物质协同作用的无机硒化合物(如硒酸钠、亚硒酸钠[13]、二氧化硒),还开发了可以高效防止癌症扩散和转移的有机硒化合物,包括硒氰(如苄基硒氰化物、对苯二亚甲基硒氰化物)、硒醚[如二(喹唑啉-4-基)二硒醚]、硒醇[14]以及含硒杂环(如三苯基氯化硒、硒唑呋喃)等。临床研究表明,这些硒化合物对癌症治疗具有明显效果,尤其是肺癌、膀胱癌、大肠癌、肝肿瘤、食道癌、贲门部胃癌、甲状腺癌和前列腺癌等。
1.2.2 心血管疾病 许多研究清晰表明硒与心血管的结构、功能及有关疾病的发生密切相关。血硒水平可作为心血管疾病的风险因素,高血硒水平可以大大降低心血管风险,尤其能够提高谷胱甘肽过氧化物酶的水平,有助于保持心脏健康[15]。
在美国,Bleys等[16]调查得出成年人血清硒水平与心血管疾病的死亡率相关,高硒区心血管发病率明显低于低硒区;芬兰学者Salonen等[17 ]进行了7年心血管病死亡率与血清硒含量之间关联研究,发现心血管疾病患者死亡与其血清硒含量低有关;荷兰学者Kok等[17 ]进行的9年病理研究中也得出类似结论。这主要由于硒可以提高谷胱甘肽过氧化物酶(GPx)与超氧化物歧化酶(SOD)活性,直接限制了ROS、脂质过氧化物和氧自由基的水平,从而进一步降低心血管疾病的风险[17]。
1.2.3 艾滋病 艾滋病毒感染者硒水平往往较低,可能因为硒摄入量不足,也可能是过度腹泻和吸收不良导致的。研究发现,血液中硒浓度的降低将会使艾滋病患者心肌病和死亡风险增加;对于孕妇,低硒可能增加艾滋病毒传染给后代和后代早夭的风险[18]。一些临床实验发现,增加成年艾滋病患者的硒摄入,能够抑制HIV-1病毒载量的增加从而降低住院频率[19]。
大量人和动物模型实验发现,艾滋病毒具有强力诱导氧化应激活化和损伤细胞DNA的特点,而硒蛋白的抗氧化性能在免疫反应中发挥重要的调节作用[20],可以减缓艾滋病发病。硒修饰的核苷作为抗病毒药物,与一些不含硒化合物的抗氧化补充剂相比具有更明显的优势[21]。
1.2.4 热带疾病 大量的哺乳动物实验结果指出,硒作为一种天然抗氧化剂,对热带疾病的预防和治疗有一定作用,特别是热带疾病中的肺结核(TB)和利什曼病。最近,微量元素硒已被确认为一种热带疾病保护剂,可以有效地抑制利什曼原虫引起的氧化损伤和肺结核病(TB)[22]。
1.2.5 病毒感染 2001年,美国科学家Beck等[23]的研究发现充足的硒含量可以保护机体免受病毒感染,相对正常人群而言缺硒人群更易于被流感病毒传染。由于硒的抗氧化功能,人体在处于最优血浆硒浓度时对病毒的免疫力也相应提高。
1.3 与激素调节功能相关的疾病
1.3.1 甲状腺疾病 人体所有器官中单位硒含量最高的为甲状腺[24],硒和碘一样对甲状腺素(三碘甲状腺素T3)的分泌和代谢具有重要作用,存在于甲状腺中的硒蛋白对维持其氧化还原反应(如硫氧蛋白还原酶)和甲状腺激素合成两个代谢活动至关重要。
由于硒蛋白对甲状腺代谢活动的调控作用,开发硒蛋白类似物的抗甲状腺药物研究曾掀起一阵热潮。近年来,已陆续研发出MMI(MSeI)、PTU和MTU(MSeU)等,其中MMI在临床研究中效果最为显著;相关的研究还发现,甲状腺疾病——粘液水肿型克汀病与硒缺乏存在关联:对患者同时补充硒和碘,可以有效改善粘液水肿型克汀病症状,而单独补充碘没有作用[25]。
1.3.2 糖尿病 在以往的研究中,硒曾因是人体内谷胱甘肽过氧化物酶(GPx)、硫氧还原酶的活性成分,而被认为可以缓解糖尿病患者胰岛的氧化应激。但美国科学家Laclaustra等[26]对9 000多名美国成年糖尿病患者进行横断面研究指出,高硒水平会导致Ⅱ型糖尿病的发生;同时Wiernsperger等[27]对意大利北部的7 182名女性受试者进行类似的研究后也发现提高膳食硒摄入量会导致女性Ⅱ型糖尿病发病风险增加;硒可以通过反向调节ROS削弱肝胰岛素敏感性,从而增加Ⅱ型糖尿病风险。最新的研究揭示血清硒水平与Ⅱ型糖尿病风险之间呈现U型非线性关系:血清中的硒水平处于52.5~97.5 μg/L的范围内,Ⅱ型糖尿病风险与血清硒水平呈正相关关系;在血清硒水平处于97.5~132.5 μg/L的范围内时,Ⅱ型糖尿病风险随血清硒水平增加呈平缓下降的趋势;在血清硒水平大于132.5 μg/L时,Ⅱ型糖尿病风险与血清硒水平呈极显著正相关关系[28]。
1.3.3 神经退行性疾病 硒蛋白P在脑部主要分布于小脑、嗅球、海马区和额叶皮质,在神经元和星形胶质细胞中均有表达,对神经细胞具有保护作用,在维持正常的脑功能中发挥着重要作用[29]。脑部硒含量随着年龄增长而逐渐下降,这可能是老年人更易患神经退行性疾病的原因之一[30]。研究显示硒缺乏引起的氧化应激会诱导阿尔茨海默症(简称AD)早期形成,且硒与AD的氧化应激、胞内钙、磷酸激酶/磷酸酯酶等相关信号转导通路密切相关[31]。
1.4 炎症性疾病
横断面研究显示,患有囊性纤维化、痤疮、炎症性肠病等慢性炎症性疾病病人的硒水平会降低,而硒的补充有助于缓解这些症状。类风湿性关节炎(RA)患者的临床数据显示,RA患者的血清硒水平都明显低于健康人群[32]。其可能的机制是硒可以通过抑制诱导白细胞介素和肿瘤坏死因子α产生的NF-κB级联反应影响炎症反应,此外,硒蛋白S(SelS)在炎症反应中扮演了重要的角色[33]。
1.5 硒过量导致的疾病
硒摄入过量会导致中毒症状或疾病,包括恶心、呕吐、指甲变色或变脆甚至脱落、脱发、疲劳、烦躁、皮肤或呼吸有大蒜气味[34]。慢性硒中毒多发生在高硒地区,如:发生在1961-1964年间的湖北恩施高硒区的人群脱毛、脱甲、神经系统感觉迟钝、四肢麻木甚至瘫痪、腱反射亢进等症状与其过高的硒摄入(日硒摄入量达到4 990 μg)密切相关[4];在印度天然高硒区的旁遮普州,当地男性的日硒摄入量达到632 μg,女性达到475 μg,出现了脱发的硒中毒症状[35]。急性硒中毒曾在2008年的美国发生,当时201个人服用硒含量标注错误的硒补充剂,导致日硒摄入量高达41 749 μg,随后78%的人出现腹泻、75%的人出现疲劳、72%的人出现脱发、70%的人出现关节疼痛、61%的人出现指甲变色或变脆、58%的人出现恶心等症状[34]。
2 硒的参考摄入量研究进展
2.1 中国
最早关于人体硒需求量和推荐摄入量的研究来自杨光圻研究团队,其于1982-1992年对低硒的四川克山病区和高硒的湖北恩施地区进行了硒的需求量和安全量研究,得到避免发生克山病的膳食硒最低需要量为17 μg/d,而使血浆谷胱甘肽过氧化物酶(GPx)达到饱和的膳食硒生理需要量为41 μg/d,膳食硒最高安全摄入量为400 μg/d。随着研究的不断深入,有数据表明,当血硒浓度达到1.27 μmol/L (100 μg/L)时,GPx活性达到饱和而不再升高,无法评价硒的营养状态,故以GPx活性作为评价指标时,仅适用于较低硒水平人群[36]。同时发现血浆硒蛋白P也可以作为评估硒营养状态的有效指标。2007年,夏弈明[37]在四川克山病区进行硒需求量研究,得出使血浆硒蛋白P达到饱和的硒需求量为49 μg/d,认为其更适合作为今后评价人体硒营养状态、测定人体硒需求量及修订DRIs的最佳指标。经体重和个体差异等因素适当校正,即加上两个标准差(一般设为10%)后计算出推荐摄入量为60 μg/d,即49 μg/d×1.2=58.8 μg/d,然后修正为60 μg/d。目前最新的2013年中国膳食硒营养素参考摄入量标准见表2[38]。
2.2 国际
基于杨光圻1987年的调研数据[39],美国选取40 μg/d为基数值,同时考虑到中美体重的差异,因此以美国居民的体重为调整因子对40 μg/d的基数进行调整,得到美国的硒膳食营养素参考摄入量为53 μg/d[40];然而1999年,新西兰进行的类似实验结果则表明,使血浆谷胱甘肽过氧化紧随中国、美国对硒摄入量标准化后,世界各国政府也开始积极响应。首先,欧盟给出的膳食硒营养素参考摄入量为55 μg/d;随后,澳大利亚和新西兰一起进行了全民硒摄入量的调查[49],同时基于中国实验数据制定了本国的硒营养素参考值:平均需要量(EAR)为52 μg/d和推荐摄入量(RNI)为60 μg/d(男性)、55 μg/d(女性)[47];加拿大、英国也开始对成年健康人群的膳食硒营养素参考摄入量进行标准化:英国推荐摄入量(RNI)为75μg/d(男性)和60 μg/d(女性);加拿大则认为膳食硒营养素参考摄入量无性别差异均为55 μg/d;德国、奥地利、瑞士也开始重视硒的研究,由德国营养协会进行调查分析,最终一起制定了3个国家的膳食硒营养素参考摄入量的标准(表3)。
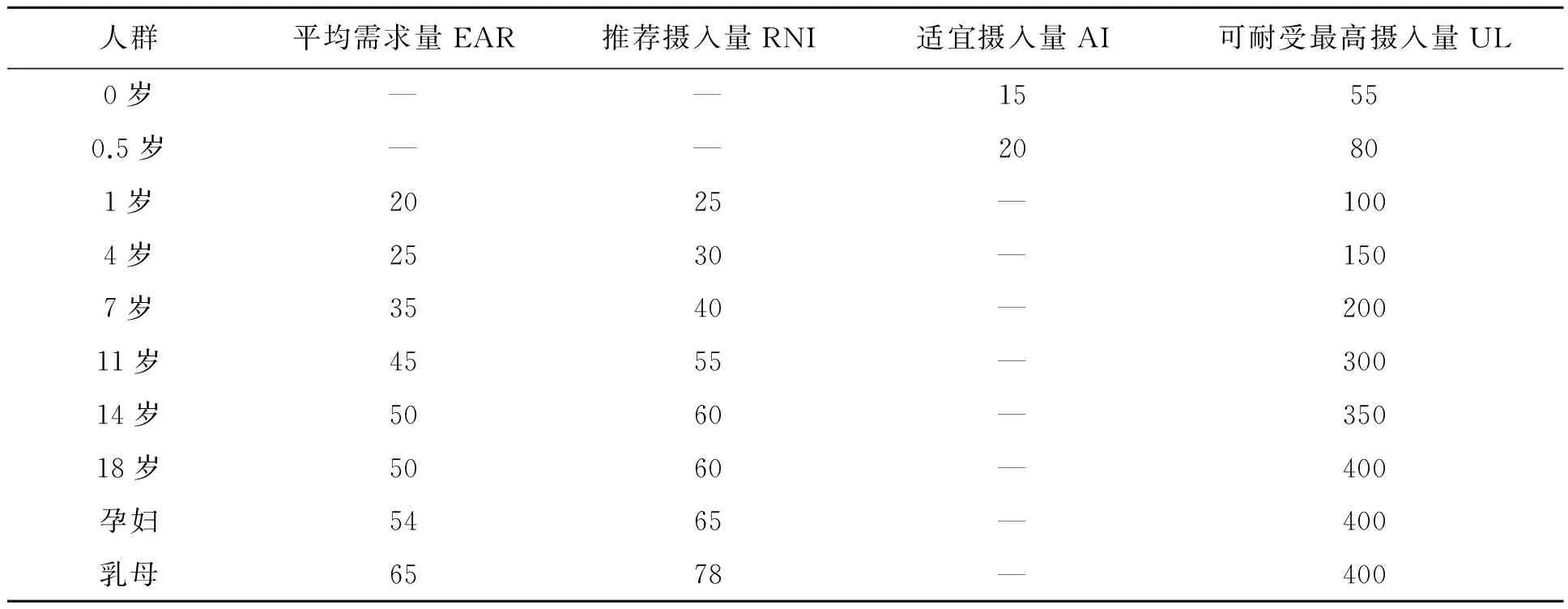
表2 中国居民硒营养素参考摄入量(μg/d)Table 2 Dietary reference intakes (DRIs) of selenium for Chinese residents(μg/d).
物酶(GPx)达到饱和的膳食硒生理需求量为68 μg/d[41],同年,美国和加拿大的DRI委员会也进行了类似研究,分析得出人体补充硒可以提高血浆中的GPx活性,且在10~40 μg/d范围内,补充越多,效果越明显。目前美国膳食硒摄入量的基数是45 μg/d,根据中国平均需求量(52 μg/d[39])和新西兰的平均需求量(38 μg/d[40])的平均值,加上两个标准差(一般设为10%)后计算出推荐摄入量为55 μg/d,即(52 μg/d+38 μg/d)/2×1.2=54 μg/d,然后修正为55 μg/d。目前美国膳食硒营养素参考摄入量标准(2005年)见表3。

表3 其他国家、WHO居民硒营养素推荐摄入量(μg/d)Table 3 Recommended nutrient intakes (RNIs) of selenium in other contries and WHO (μg/d).
世界卫生组织(WHO)也迅速关注了硒摄入量的问题,于1990年召开的“微量元素在人体营养中的作用”会议上专家委员建议采用适宜膳食硒需求量的实验值作为膳食推荐摄入量的基数值。世界卫生组织(WHO)计算出了硒的最低需求量(所需摄入量可以满足预防克山病和临床相关的饮食不足),得出19 μg/d的日硒摄入量可以防止克山病的发生,与体重校正后,得出男性摄入量为34 μg/d,女性为26 μg/d(表3)。
3 硒摄入现状与对策
3.1 硒摄入现状
根据不同国家和地区的成年人硒摄入量统计数据[50],中国除硒中毒区以外的大部分地区、沙特阿拉伯、捷克共和国、布隆迪(非洲)、新几内亚(岛)、尼泊尔、克罗地亚、埃及、巴西、印度、比利时、法国、塞尔维亚、斯洛维尼亚、土耳其、波兰、瑞典、德国、西班牙、葡萄牙、丹麦、斯洛伐克共和国、希腊、荷兰、意大利、奥地利、爱尔兰、韩国等29个国家或地区的成人日硒摄入量都显著低于中国居民硒推荐摄入量(RNI)60 μg/d,出现显著的硒“隐性饥饿”问题;仅有澳大利亚、新西兰、瑞士、芬兰、日本、美国、加拿大、委内瑞拉等8个国家的成人日硒摄入量在60~400 μg/d范围内,为硒摄入充足国家;但在中国恩施等高硒地区,成人日硒摄入量却高达4 990 μg/d,为硒摄入过量地区。可见,硒的摄入量在全球的分布是极不均匀的,大多数国家都处于硒摄入量不足的“隐性饥饿”状态。
根据WHO的调查数据显示目前大约10亿人面临着硒营养不良的问题[51],缺硒引起的“隐性饥饿”正威胁着人类健康。值得指出的是,尽管中国的硒储备资源(26 000 t,约为世界硒资源的五分之一)在全球排名第四(仅在加拿大、美国和比利时之后),但是从东北的黑龙江省到西南的云南省都处于低硒带,土壤硒含量低于0.4 μg/g,土地缺硒面积达到71.2%[52],约占世界缺硒土地的70%[53]。因此,2014年《营养问题罗马宣言》和“2015年后可持续发展议程”的主题为:“让饥饿与营养不良成为历史”,期望让“隐性饥饿”问题得到更多的国家和人们的认识和重视,并采取积极的应对措施。
3.2 应对硒摄入缺乏的对策
3.2.1 增加食物多样性 中国居民主要食物中的硒含量为水果(0.53±0.30 μg/100g)<蔬菜(4.23±17.05 μg/100g) <畜禽肉类(6.62±2.28 μg/100g) <谷物(9.41±9.98 μg/100g)<蛋乳类(10.13±8.98 μg/100g) <水产类(39.84±38.15 μg/100g)[54],但中国居民膳食摄入以谷物为主、蔬菜和肉类为辅,导致硒摄入量偏低,因此为提高硒摄入,建议中国人群增加水产类、蛋乳类食物的摄入。美国当地食物硒含量特点为蔬菜(1 μg/100g)<水果(2 μg/100g)<蛋乳类(8~15 μg/100g)<谷物(19 μg/100g)<畜禽肉类(18~33 μg/100g)<水产类(40 μg/100g)[55],而美国居民饮食特点以谷物、畜禽肉类、水产类为主,从而导致美国居民的日硒摄入量显著高于中国居民,达到106 μg/d[56]。欧洲当地常见食物平均硒含量为水果(1 μg/100g)<蔬菜(2 μg/100g)<谷物(11 μg/100g)<畜禽肉类(牛肉:7.6 μg/100g、猪肉:14 μg/100g、羊肉:3.8 μg/100g)<鱼(16 μg/100g)<内脏(猪肝:42 μg/100g、猪腰:145 μg/100g)[57],同时发现欧洲沿海地区居民由于食用较多海产品导致硒摄入量明显高于内陆地区,因此欧洲内陆居民可以通过增加海产品的摄入来提高其日硒摄入量。
尽管通过增加食物多样性可提高膳食硒的摄入,但食物中硒的含量普遍较低,需要摄入足够量的食物才能达到明显提高硒摄入的效果,对于老人、小孩及其他食物摄入量较少的人群及素食主义者,则很难实现,同时食物摄入量过多可能会引起正常人出现肥胖等副作用,且饮食习惯的改变通常也比较有挑战性。
3.2.2 工业硒营养强化 工业硒营养强化是通过向一般食品中适量添加硒的营养强化剂,从而使食品具有特定营养价值。目前中国境内允许添加的硒营养强化剂只有以下7种:亚硒酸钠、硒酸钠、硒蛋白、富硒食用菌粉、L-硒-甲基硒代半胱氨酸、硒化卡拉胶(仅限用于含乳饮料)、富硒酵母(仅限用于含乳饮料)[58]。
工业硒营养强化剂可以分为2类:一类为以亚硒酸钠、硒酸钠为代表的无机硒营养强化剂,人体对无机硒的吸收利用率较低,且无机硒营养强化剂稳定性差,生物利用率较低,同时无机硒毒性大,摄入过量会对人体造成伤害,甚至在生产加工中过多地接触也会对人体产生毒害。另一类为以硒蛋白、硒酵母为代表的有机硒营养强化剂,是经生物转化而得,毒性低,且生物利用性和生理作用更好,吸收利用率高[59]。
工业硒营养强化由于技术成熟、产品价格适宜,且对人群的年龄和食量没有限制,因此对提高人群的硒摄入量具有明显效果。但无机硒营养强化剂对人体存在一定的毒害作用,且超标添加硒营养强化剂是目前仍不能杜绝的现象。
3.2.3 硒膳食补充剂摄入 膳食补充剂在中国又称为营养素补充剂,是指以补充维生素、矿物质等营养物质的手段达到保健功能,而不以提供能量为目的的产品。其作用是补充膳食营养供给的不足,预防营养缺乏和降低某些慢性退行性疾病的发生风险。
据2009-2010年美国国家健康与营养(NHANES)调查数据分析:大多数美国人之所以每日能够摄取足够的硒,是由于18%~19%的成人和儿童使用膳食硒补充剂来补充硒[60](常见为硒迷你片、硒酵母复合水果酵素),其中2岁以上美国人平均每日从食物中摄入硒量为108.5 μg,从膳食硒补充剂中摄入硒量为12.3 μg;其中成年男性有较高的日摄入量:从食物中获得硒量为134 μg,从膳食硒补充剂中获得硒量为17 μg;成年女性从食物中获得硒量为93 μg,从膳食硒补充剂中获得硒量为25 μg。
在中国对于硒膳食补充剂的使用已有严格的规范,特别是不同年龄和人群每日硒膳食补充剂的用量范围已明确规定,见表4(引用国家食品药品监督管理总局食药监食监三便函〔2014〕174号)。

表4 我国硒营养素补充剂的规定用量Table 4 The usage in rule of selenium supplement of China.
注:硒来源为亚硒酸钠。
硒膳食补充剂是一种便捷高效提高硒摄入的方法,且能够定量,但是膳食补充剂的硒源却存在一定的隐患:在美国,膳食补充剂中硒源为亚硒酸钠和硒酵母,而在中国,亚硒酸钠是唯一指定来源,但是,亚硒酸钠存在显著的健康风险。此外,膳食补充剂中防腐剂引起的副作用目前没有明确的说明;而且,膳食补充剂的价格是其向普通人群推广的另一限制因素。
3.2.4 硒生物营养强化 硒生物营养强化是指通过农艺措施、生物技术或育种技术,增加农作物可食部分、畜牧动物或可食微生物的硒含量及其有效形态硒含量的方法。目前主要有3种途径:
①天然硒生物营养强化。尽管中国是典型的缺硒大国,但是仍存在一些天然富硒区,如湖北恩施、陕西安康、贵州开阳、浙江龙游、山东枣庄、四川万源、江西丰城、安徽石台等;美国的南达科他、内布拉斯加、怀俄明、亚利桑那、堪萨斯、北达科他、新墨西哥、蒙他那、犹他等州等也是富硒区。除此之外在爱尔兰、以色列、澳大利亚、墨西哥、哥伦比亚、南非、委内瑞拉、俄罗斯、加拿大等地也存在一些小区域天然富硒区。这些区域土壤中的硒含量可达到0.4 μg/g以上,即硒可以直接通过食物链富集到农作物提高当地居民的硒日摄入量。对湖北恩施的3个富硒村调查结果显示,当地主要农作物中的大米、大豆、块茎作物、叶菜、肉、鸡蛋中的硒含量分别达到0.96 mg/kg、0.71 mg/kg、0.33 mg/kg、0.72 mg/kg、1.72 mg/kg、2.26 mg/kg(鲜重),居民日硒摄入量达到550 μg/d,不仅远远高于中国非富硒区日硒摄入量平均值(26~32 μg/d),而且有可能存在硒摄入量过多的风险[61]。安徽石台县大山村是天然富硒村,海拔1 000米,距离县城距离约50 km,调查结果表明,大山村的大米硒含量达到0.70 mg/kg,是县城大米硒含量(0.038 mg/kg)的约18倍;大山村叶菜硒含量为0.12~0.76 mg/kg,是县城叶菜硒含量(0.02~0.15 mg/kg)的5倍;大山村居民日硒摄入量达到115 μg/d,但是县城居民的日硒摄入量仅为52 μg/d,显著低于大山村[62]。因此,通过食用天然富硒区的自然生物营养强化获取的富硒农作物,可以提高人群膳食硒摄入量。而且,对于高硒地区(如:湖北恩施)应该将当地的高硒农作物售卖到缺硒地区,或者与低硒地区的农作物搭配食用,降低硒摄入过高的风险。美国、加拿大等富硒地区的谷物输出已经影响了购买地区居民的膳食硒摄入量水平。
②农艺措施硒生物营养强化。叶面喷施硒肥可有效提高叶菜类、水果等作物中的硒含量[63]。同时,硒矿物肥料可明显提高土壤中硒获取率和硒肥的利用效率[64]。在芬兰、新西兰和中国,采用无机硒肥的农艺硒生物营养强化策略提高作物硒含量的案例已取得较大成功[65,66]。尤其在芬兰,从1984年在全国范围内使用硒肥后,大多数食物中的硒含量得到了大幅度提升,居民膳食硒摄入量增加了2倍,达到80 μg/d;血清硒水平提高了60%,达到1.40 μmol/L;芬兰由硒摄入量缺乏逐步提升到硒摄入量充足[67]。除此之外,农作物种子硒包膜种植技术将硒肥包膜随种子一起施入土壤,能够实现精准强化、减少了硒肥用量、提高了硒肥利用率、极大地节约成本,也是一种具有广泛前景的农艺硒生物强化措施[68]。
③育种或基因技术硒生物营养强化。硒尽管不是高等植物生长必需的微量元素,但是不同物种对硒元素的吸收和积累效果存在显著差异。因此,选择可以积累硒的作物品种将是一种有效的硒生物营养强化方式。目前,已筛选和培育出了一些硒积累作物品种,如黑稻金龙1号(中国吉林省农业科学院培育)、水稻隆庆4号(江苏省农业科学院培育)。此外,美国科学家识别出硒超积累植物双钩黄芪的硒超积累关键基因为甲基硒代半胱氨酸转移酶(SMT),并将SMT基因导入硒非累积植物拟南芥中,发现该拟南芥植物地上部分比野生型累积多达3倍的硒,并在叶中检测到大量硒-甲基硒代半胱氨酸的和γ-谷氨甲基硒半胱氨酸[69]。但是,育种或基因技术硒生物营养强化尚处于实验室研究阶段,有待进一步开发。
4 展望
综上所述,微量元素硒是谷胱甘肽过氧化物酶、甲状腺素脱碘酶、硒蛋白K、硒蛋白W等多达25种人体硒蛋白的重要组成成分,与抗氧化、激素调节、矿质元素代谢等功能密切相关;目前发现克山病、大骨节病、癌症、心血管疾病、艾滋病等多达13类疾病与硒缺乏有关,但Ⅱ型糖尿病则体现出了与血硒水平的“U”形关系,即:过高或过低的硒水平会增加Ⅱ型糖尿病的患病风险。过量硒的摄入则会导致呕吐、腹泻、指甲变色或变脆、脱发等急性或慢性中毒症状。因此,世界各国和WHO等国际组织针对不同人群制定了硒的每日膳食营养素参考摄入量(DRIs)。可是,全球范围内有中国、沙特、印度、巴西等29个国家存在硒摄入缺乏(隐性饥饿)的问题,仅有澳大利亚、新西兰、瑞士、芬兰、日本、美国、加拿大、委内瑞拉等8个国家人群硒摄入量是充足的。针对广泛存在的硒的“隐性饥饿”问题,目前的应对方式主要是通过增加食物多样性、工业硒强化、硒的膳食补充剂摄入、硒生物营养强化等4种途径来提高人群的硒摄入量。但是,农业上大量使用化肥、追求高产,将会加剧农作物中微量营养的下降(包括硒),以及农产品的重金属污染问题,导致人群的硒的“隐性饥饿”问题进一步恶化[70,71]。因此,为更好地应对硒的“隐性饥饿”问题,一方面需要加强公众健康教育,让公众不仅应关注主量营养健康,还应关注微量营养健康,尽早消除“隐性饥饿”的潜在威胁;另一方面要加强对食物多样性方案、工业硒强化产品、硒的膳食补充剂、硒生物营养强化产品的研究与开发,为科学应对硒的“隐性饥饿”提供解决方案。
[1] Schwarz K, Foltz C M. Selenium as an integral part of factor 3 against dietary necrotic liver degeneration[J]. J. Am. Chem. Soc., 1957, 79(12): 3292-3293.
[2] Rotruck J T, Pope A L, Ganther H E,etal.. Selenium: biochemical role as a component of glutathione peroxidase[J]. Science, 1973,179(4073): 588-590.
[3] 杨光圻, 王光亚, 殷泰安, 等. 我国克山病的分布和硒营养状态的关系[J]. 营养学报, 1982, 4(3): 191-200.
[4] 杨光圻, 王淑真, 周瑞华, 等. 湖北恩施地区原因不明脱发脱甲症病因的研究[J]. 中国医学科学院学报, 1981,3(2): 1-6.
[5] Brown K M, Arthur J R. Selenium, selenoproteins and human health: a review[J]. Public Health Nutr,, 2001, 4(2B): 593-599.
[6] Rayman M P. The importance of selenium to human health[J]. Lancet, 2000,356(9225): 233-241.
[7] Jirong Y, Huiyun P, Zhongzhe Y,etal.. Sodium selenite for treatment of Kashin-Beck disease in children: a systematic review of randomised controlled trials[J]. Osteoarthr.Cartil., 2012, 20(7): 605-613.
[8] 刘 源, 王秀红, 田晓露, 等. 慢型克山病与扩张型心肌病患者血液微量元素测定分析[J]. 中华地方病杂志, 2013, 32(2): 201-204.
[9] 王五一, 李永华, 雒昆利, 等. 大巴山区土壤中硒, 氟的地球化学特征[J]. 地理研究, 2003, 22(2): 177-184.
[10] Zhao Z J, Li Q, Yang P Z,etal.. Selenium: a protective factor for Kaschin-Beck disease in Qing-Tibet plateau[J]. Biol. Trace Element Res., 2013,153(1-3): 1-4.
[11] Clark L C, Combs G F, Turnbull B W,etal.. Effects of selenium supplementation for cancer prevention in patients with carcinoma of the skin: a randomized controlled trial[J]. Jama, 1996, 276(24): 1957-1963.
[12] 刘俊秋, 宁云刚, 时成波, 等. 硒代β-环糊精模拟谷胱甘肽过氧化物酶的研究[J]. 高等学校化学学报, 1998,19(9): 1446-1448.
[13] 郭 健, 高福云, 胡 萍, 等. 硒化合物与抗癌中药配伍的抗肿瘤作用[J]. 实验动物科学, 2008, 25(2): 10-12.
[14] Alwahaibi N, Mohamed J, Alhamadani A. Supplementation of selenium reduces chemical hepatocarcinogenesis in male Sprague-Dawley rats[J]. J. Trace Elements Med. Biol., 2010,24(2): 119-123.
[15] Neve J. Selenium as a risk factor for cardiovascular diseases[J]. J. Cardiovasc. Risk, 1996, 3(1): 42-47.
[16] Bleys J, NavasA A, Guallar E. Serum selenium levels and all-cause, cancer, and cardiovascular mortality among US adults[J]. Arch. Int. Med., 2008, 168(4): 404-410.
[17] Nogales F, Ojeda M L, Fenutría M,etal.. Role of selenium and glutathione peroxidase on development, growth, and oxidative balance in rat offspring[J]. Reproduction, 2013, 146(6): 659-667.
[18] Twagirumukiza M, Nkeramihigo E, Seminega B,etal.. Prevalence of dilated cardiomyopathy in HIV-infected African patients not receiving HAART: a multicenter, observational, prospective, cohort study in Rwanda[J]. Curr. HIV Res., 2007, 5(1): 129-137.
[19] Kupka R, Garland M, Msamanga G,etal.. Selenium status, pregnancy outcomes, and mother-to-child transmission of HIV-1[J]. J. Acquir. Immune Deficiency Syndr., 2005,39(2): 203-210.
[20] Hoffmann P R, Berry M J. The influence of selenium on immune responses[J]. Mol. Nutr. Food Res., 2008,52(11): 1273-1280.
[21] Sanmartin C, Plano D, Font M,etal.. Selenium and clinical trials: new therapeutic evidence for multiple diseases[J]. Curr. Med. Chem., 2011,18(30): 4635-4650.
[22] Plano D, Baquedano Y, Moreno-Mateos D,etal.. Selenocyanates and diselenides: a new class of potent antileishmanial agents[J]. Eur. J. Med. Chem., 2011,46(8): 3315-3323.
[23] Beck M A, Levander O A, Handy J. Selenium deficiency and viral infection[J]. J. Nutr., 2003,133(5): 1463S-1467S.
[24] O’Grady T J, Kitahara C M, Dirienzo A G,etal.. The association between Selenium and other micronutrients and thyroid cancer incidence in the NIH-AARP diet and health study[J]. PLoS ONE,2014,9(10):e110886.
[25] Contempre B, Dumont J E, Denel J F,etal.. Effects of selenium deficiency on thyroid necrosis, fibrosis and proliferation: a possible role in myxoedematous cretinism[J]. Eur. J. Endocrinol., 1995,133(1): 99-109.
[26] Laclaustra M, NavasA A, Stranges S,etal.. Serum selenium concentrations and hypertension in the US population[J]. Circul. Cardiovas. Quality Outcomes, 2009,2(4): 369-376.
[27] Wiernsperger N, Rapin J. Trace elements in glucometabolic disorders: an update[J]. Diabetol. Metabolic Syndrome, 2010,2(1): 1.
[28] Wang X L, Yang T B, Wei J,etal.. Association between serum selenium level and type 2 diabetes mellitus: a non-linear dose-response meta-analysis of observational studies[J]. Nutr. J., 2016,15(1): 1.
[29] Peters M M, Hill K E, Burk R F,etal.. Altered hippocampus synaptic function in selenoprotein P deficient mice[J]. Mol. Neurodegener., 2006,1(1): 1-4.
[30] Markesbery W R, Ehmann W D, Alauddin M,etal.. Brain trace element concentrations in aging[J]. Neurobiol. Aging, 1984,5(1): 19-28.
[31] 刘 琼, 田 静, 陈 平, 等. 硒缺乏与阿尔茨海默症[J]. 生命科学, 2012,24(8):602-610.
[32] Peretz A M, Neve J D, Famaey J P P. Selenium in rheumatic diseases; Seminars in arthritis and rheumatism[C]. Elsevier,1991.
[33] Fairweather-Tait S J, Bao Y, Broadley M R,etal.. Selenium in human health and disease[J]. Antioxid. Redox Signal., 2011,14(7): 1337-1383.
[34] MacFarquhar J K, Broussard D L, Melstrom P,etal.. Acute selenium toxicity associated with a dietary supplement[J]. Arch. Int. Med., 2010,170(3): 256-261.
[35] Hira CK, Partal K, Dhillon K. Dietary selenium intake by men and women in high and low selenium areas of Punjab[J]. Public Health Nutr., 2004,7(01): 39-43.
[36] 夏弈明. 硒[M]. 北京:人民卫生出版社,2004,146-157.
[37] 夏弈明, 李 平, 徐家沅, 等. 中国成人硒需要量研究[J]. 营养学报, 2011,33(2): 109-113.
[38] 程义勇. 中国居民膳食营养素参考摄入量2013修订版简介[J]. 营养学报, 2014,36(4): 313-317.
[39] Yang G Q. Research on selenium-related problems in human health in China [A]. In:Combs G F J, Spallholz J E. Selenium in Biology and Medicine Part B[M]. New York: Van Nostrand Reinhold, 1987, 9-32.
[40] Hellwig J P, Otten J J, Meyers L D. Dietary reference intakes: The essential guide to nutrient requirements[M]. USA:National Academies Press, 2006.
[41] Duffield A J, Thomson C D, Hill K E,etal.. An estimation of selenium requirements for New Zealanders[J]. Am. J. Clin. Nutr., 1999,70(5): 896-903.
[42] Nutrient S. Energy intakes for the European Community[A]. In:Report of the Scientific Committee for Food, 31st Series[C]. DG Industry, 1993.
[43] Kipp A P, Strohm D, Brigelius-Flohe R,etal.. Revised reference values for selenium intake[J]. J. Trace Elem. Med. Biol., 2015,32(1):195-199.
[44] Neve J. Methods in determination of selenium states[J]. J.Trace Elements Electrol. Health Disease, 1991,5(1): 11-17.
[45] Dept. of Health, Great Britain. Dietary Reference Values for Food Energy and Nutrients for the United Kingdom. Report of the Panel on Dietary Reference Values of the Committee on Medical Aspects of Food Policy[R]. HM Stationery Office, 1991.
[46] Monsen E R. Dietary reference intakes for the antioxidant nutrients: vitamin C, vitamin E, selenium, and carotenoids[J]. J. Am. Dietetic Assoc., 2000,100(6): 637-640.
[47] Thomson C, Paterson E. Australian and New Zealand nutrient reference values for selenium[A]. In:Report to the Ministry of Health Department of Human Nutrition[C]. Dunedin: University of Otago, 2001.
[48] Joint FAO, WHO. Vitamin and mineral requirements in human nutrition[R]. FAO, WHO, 2005.
[49] Thomson C D. Selenium and iodine intakes and status in New Zealand and Australia[J]. British J. Nutr., 2004,91(5): 661-672.
[50] Yuan L, Yin X, Zhu Y,etal.. Selenium in plants and soils, and selenosis in Enshi, China: implications for selenium biofortification[M]. Springer,2012,7-31.
[51] Wu Z, Banuelos G S, Lin Z Q,etal.. Biofortification and phytoremediation of selenium in China[J]. Front.Plant Sci., 2015,6(1):136
[52] Zhu Y G, Pilon-Smits E A, Zhao F J,etal.. Selenium in higher plants: Understanding mechanisms for biofortification and phytoremediation[J]. Trends Plant Sci., 2009,14(8): 436-442.
[53] Li N, Gao Z, Luo D,etal.. Selenium level in the environment and the population of Zhoukoudian area, Beijing, China[J]. Sci. Total Environ., 2007,381(1): 105-111.
[54] 任大林, 王笃圣. 121 种食品中锗和硒含量的分析[J]. 中国食物与营养, 1996,(1): 21-22.
[55] Gebhardt S, Lemar L, Haytowitz D,etal.. USDA national nutrient database for standard reference, release 21[R]. USDA-ARS,2012.
[56] Food and Nutrition Board Staff, Panel on Dietary Antioxidants, Institute of Medicine Staff. Dietary Reference Intakes for Vitamin C, Vitamin E, Selenium and Carotenoids: A Report of the Panel on Dietary Antioxidants and Related Compounds, Subcommittees on Upper Reference Levels of Nutrients and of Interpretation and Use of Dietary Reference Intakes and the Standing Committee on the Scientific Evaluation of Dietary Reference Intakes, Food and Nutrition Board, Institute of Medicine[M]. National Academies Press, 2000.
[57] Rayman M P. Selenium and human health[J]. Lancet, 2012,379(9822): 1256-1268.
[58] GB 14880-2012. 食品营养强化剂使用标准 [S]. 中国卫生监督杂志, 2012,19(6): 508-600.
[59] 牟维鹏, 田 园, 朴建华, 等. 亚硒酸钠和硒蛋氨酸的毒性比较[J]. 卫生研究, 2004, 33(6): 700-703.
[60] Bailey R L, Gahche J J, Lentino C V,etal.. Dietary supplement use in the United States, 2003-2006[J]. J. Nutr., doi:2010: jn. 110.133025.
[61] Huang Y, Wang Q, Gao J,etal.. Daily dietary selenium intake in a high selenium area of Enshi, China[J]. Nutrients, 2013, 5(3): 700-710.
[62] Banuelos G S, Tang J F, Hou Y Z,etal.. Environmental Pathways and Dietary Intake of Selenium in a Selenium Rich Rural Community in China: A Natural Biofortification Case Study[M]. CRC Press, 2015,147-148.
[63] Boldrin P F, Faquin V, Ramos S J,etal.. Soil and foliar application of selenium in rice biofortification[J]. J. Food Comp. Anal., 2013,31(2): 238-244.
[64] Lynch J P. Turner review no.14. Roots of the second green revolution[J]. Austr. J. Bot., 2007,55(5): 493-512.
[65] Hartikainen H. Biogeochemistry of selenium and its impact on food chain quality and human health[J]. J. Trace Elements Med. Biol., 2005,18(4): 309-318.
[66] Zhao Q, Yin X. The functional agriculture in China: 5-year practice[J]. Selenium Environ. Human Health, 2013: 162-163.
[67] Alfthan G, Eurola M, Ekholm P,etal.. Effects of nationwide addition of selenium to fertilizers on foods, and animal and human health in Finland: From deficiency to optimal selenium status of the population[J]. J. Trace Elements Med. Biol., 2015, 31: 142-147.
[68] Grant C A, Buckley W T, Wu R. Effect of selenium fertilizer source and rate on grain yield and selenium and cadmium concentration of durum wheat[J]. Can. J. Plant Sci., 2007,87(4): 703-708.
[69] Pilon-Smits E A, LeDuc D L. Phytoremediation of selenium using transgenic plants[J]. Curr. Opin. Biotechnol., 2009,20(2): 207-212.
[70] Li S, Banuelos G S, Wu L,etal.. The changing selenium nutritional status of Chinese residents[J]. Nutrients, 2014,6(3): 1103-1114.
[71] Li S, Banuelos G S, Min J,etal.. Effect of continuous application of inorganic nitrogen fertilizer on selenium concentration in vegetables grown in the Taihu Lake region of China[J]. Plant Soil, 2015,393(1-2): 351-360.
Physiological Function, Deficiency and its Solutions on Selenium: A review
YUAN Li-jun1,2,3, YUAN Lin-xi1,2,3*, YIN Xue-bin1,2,3*,QIN Li-qiang3,4
1.SchoolofEarthandSpaceSciences,UniversityofScienceandTechnologyofChina,Hefei230026,China;2.InstituteofAdvancedTechnology,UniversityofScienceandTechnologyofChina,Hefei230088,China;3.JiangsuBio-EngineeringResearchCentreofSelenium,JiangsuSuzhou215123,China;4.SchoolofPublicHealth,SoochowUniversity,JiangsuSuzhou215123,China
Selenoproteins was identified up to 25 species in human body (eg. GPx, Dio, Sel K, Sel W), which closely associated with antioxidant, hormone regulation and minerals metabolism.This review focused on the research progress of physiological functions, dietary reference intakes (DRIs), dietary intake deficiency (so-called “hidden hunger”) and its solutions on the trace element selenium (Se) in recent 10 years, which was expected to provide reference for Se biofortification research.
selenium; physiological function; dietary intake; hidden hunger; biofortification; coping strategy
2016-08-30; 接受日期:2016-10-10
国家自然科学基金项目(NNSFC31400091);江苏省青年自然科学基金(BK2012195;BK2012202);中国科学技术大学先进技术研究院技术创新项目(2013-1-6)资助。
袁丽君,硕士研究生,主要从事硒生物营养强化研究。E-mail: 1309583422@qq.com。*通信作者:袁林喜,研究员,博士,主要从事硒生物营养强化研究。 E-mail:yuanli@ustc.edu.cn; 尹雪斌,副教授,博士,主要从事功能农业研究。E-mail:xbyin@ustc.edu.cn
10.3969/j.issn.2095-2341.2016.06.03

