肉及肉制品中大鼠成分PCR检测方法研究
李宗梦,赵良娟,马兴,赵宏,郑文杰,张宏伟,武鹏程,尹长城
(1.天津出入境检验检疫局动植物与食品检测中心,天津300461;2.北京华大蛋白质研发中心有限公司,北京101318)
肉及肉制品中大鼠成分PCR检测方法研究
李宗梦1,赵良娟1,马兴1,赵宏1,郑文杰1,张宏伟1,武鹏程2,尹长城2
(1.天津出入境检验检疫局动植物与食品检测中心,天津300461;2.北京华大蛋白质研发中心有限公司,北京101318)
我国肉类掺假现象屡禁不止,尤以使用来源不明的鼠肉冒充高价肉贩卖最为恶劣。褐家鼠(Rattusnorvegicus)俗称大鼠,由于分布广、数量多、体型较大的特点最容易成为肉类掺假的来源。针对我国缺乏肉及肉制品中大鼠成分检测方法的问题,本研究针对包括大鼠在内的共17种动物线粒体cytb基因序列进行分析比对,设计特异性检测引物。该方法特异性好,可检出混合样品中低至0.1%的大鼠成分,灵敏度较高。结果表明,本方法对热处理混合肉样品和市售样品也具有较好的检测能力,灵敏度达到0.1%。本研究为肉类食品安全监管提供了新方法。
肉制品;PCR;大鼠;食品掺假
2013年初随着欧洲“马肉风波”这一食品安全事件的发生,食品掺假这一全球性问题引发了公众对食品安全的担忧以及各国政府的关注。我国常见肉类掺假现象多以在牛羊肉中掺入价格便宜的猪肉、鸭肉为主,更为恶劣的是有媒体报道某些不法商贩用死老鼠肉制成羊肉串进行贩卖。此类恶性掺假行为多见于流动摊贩,难于监管。作为各种疫病传播的载体,人食用鼠肉制品存在感染疫病的风险,还可能导致鼠药二次中毒。由此可见,此类恶性肉类掺假事件已经严重威胁到消费者健康和公共安全,对政府监管部门和检测机构提出了新的挑战。
褐家鼠(Rattusnorvegicus),别称沟鼠、大家鼠或挪威鼠,是我国最常见和危害最大的一种家鼠。由于其体型大、分布广、数量大,最容易成为鼠肉掺假的来源。除此之外,用于科学研究的实验大鼠,如Wistar大鼠[1]、Sprague Dawley大鼠[2]等也属于褐家鼠种。此类大鼠使用量大且经过未知药物处理,其肉制品一旦流入市场,将对食品安全造成严重威胁。
近年来基于核酸和蛋白质的多种分子生物学物种鉴定方法被相继开发和应用。相较于蛋白质,DNA热稳定性高,物种间多态性丰富,使其成为重要分子靶标。其中,线粒体DNA在细胞中含量丰富,进化速度快,用作遗传分析灵敏度高,具有较高的种间多样性和较低的种内变异[3-5]。常用的线粒体靶基因有细胞色素b(cytb)基因[6-8]、12S和16S核糖体RNA亚基[9-10]、D-loop区[11-13]等。基于线粒体靶基因设计特异性引物,应用单重或多重PCR技术对动物源性成分进行定性或半定量鉴别已被研究者广泛采用[14-18]。然而,鼠源性成分尤其是大鼠成分鉴定的研究较少且大多以细胞系污染分析为目的。如Almeida等采用多重PCR及测序技术分析小鼠细胞系中短串联重复序列(Short tandem repeat)进而对其进行鉴别[19]。Higgins等采用单重PCR法,使用商品化试剂盒对胶质细胞系进行鉴别以区分大鼠、小鼠来源的细胞系污染[20]。食品中尤其是肉及肉制品中鼠源性成分鉴别方法鲜见报道。
本研究通过分析褐家鼠(Rattusnorvegicus)及其他常见畜禽品种线粒体细胞色素b(cytb)基因序列,设计并筛选可特异性扩增褐家鼠目的片段的PCR引物,所得PCR产物大小为397 bp。结果显示,该方法特异性好,灵敏度可达到0.1%,适用于肉及肉制品中大鼠源性成分检测。
1 材料
1.1 样品
大鼠新鲜组织样本由天津中医药大学馈赠。其余16种用于特异性实验的动物样本或基因组DNA为本实验室储备样品,均在识别动物整体形态条件下采样,经过基因组测序和比对确认为相应物种。灵敏度实验中作为基质的羊肉样品购买于本地超市,依照行业标准SN/T 2051-2008《食品、化妆品和饲料中牛羊猪源性成分检测方法实时PCR法》确认羊成分。从天津市滨海新区农贸市场、超市、烧烤摊共购买18份羊肉制品。其中羊肉串9份、冷冻羊肉卷、羊肉片6份、羊肉馅3份。从福建省宁化县、龙岩、南平及广西宜州购买可食用鼠肉制品共4份,均为熏制鼠肉干。所有样品使用无菌水清洗去除多余的腌渍酱料、骨、皮部分,使用洁净的均质器进行混匀。
1.2 仪器与试剂
主要仪器包括终点PCR仪(PTC-200,MJResearch,加拿大),GelDoc XR凝胶分析系统(Bio-Rad Laboratories,美国),核酸蛋白分析仪(1510,Thermo Fisher,美国)。动物组织基因组提取试剂盒购自Promega公司;HSEx Taq DNA聚合酶、DL2000 Marker、6 x Loading Buffer购自大连宝生物公司。引物合成和测序均由上海生物工程公司完成。
1.3 引物设计
从GenBank中获得大鼠及其他16种常见畜禽动物线粒体cytb基因序列,物种及序列信息见表1。

表1 物种GenBank序列号Table1 GenBank accession number of anim als
使用Geneious6.0(Biomatters Ltd.,New Zealand)进行序列分析,设计大鼠特性引物Rat-CYT-F1/R1。扩增片段大小为397 bp,引物序列见表2。
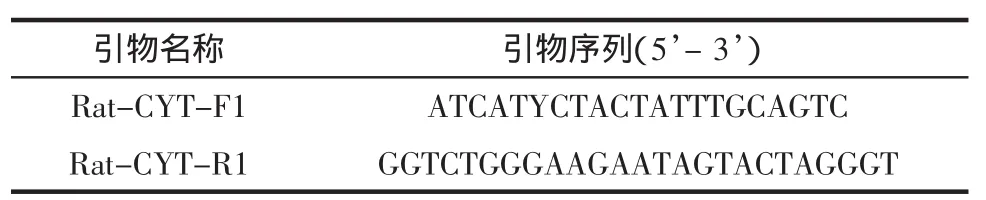
表2 大鼠PCR引物序列Table2 Primer sequenceof ratspecific PCR
2 方法
2.1 基因组DNA提取
依照Promega公司动物组织基因组提取试剂盒操作说明对本研究中所有动物组织进行基因组DNA提取,初始样本量为10mg。
2.2 核酸纯度及浓度测定
提取的DNA样品采用核酸蛋白分析仪进行纯度和浓度测定。A260/A280比值介于1.8~2.0之间的DNA样品用于后续PCR扩增。
2.3 PCR反应体系
20μLPCR反应体系中含10×PCR buffer(含Mg2+)2μL;10mmol/LdNTP混合液2μL;引物(5μmol/L)各0.8μL;HSEx Taq DNA聚合酶(5 U/μL)0.2μL;DNA模板(10μg/mL)1μL。
2.4 PCR扩增条件
94℃预变性5 min;94℃30 s,56℃30 s,72℃ 30 s;72℃5min,30个循环。PCR扩增产物采用琼脂糖凝胶电泳进行检测分析。
3 结果与分析
3.1 引物特异性实验
采用2.3、2.4中PCR体系及反应条件,以无菌水为空白对照,对鸡、鸭、鹅、猫、狗、猪、马、牛、水牛、绵羊、驴、鹿、骆驼、兔、貂、狐狸以及大鼠基因组DNA进行扩增,验证引物的特异性。扩增结果见图1。

图1 引物特异性实验PCR扩增产物电泳图Fig.1 Gelelectrophoresisof PCR products in specificity test
如图1所示,引物Rat-CYT-F1/Rat-CYT-R1对大鼠DNA扩增出阳性条带,扩增片段大小为397 bp。其他16个物种及空白对照扩增为阴性,说明该引物对检测大鼠成分具有良好的特异性。将扩增产物测序、比对,结果显示扩增片段序列分别与大鼠cytb基因目的片段具有100%同源性,进一步确证了PCR扩增的准确性。
3.2 绝对灵敏度实验
将大鼠基因组DNA进行10倍梯度稀释,制成100、10、1、0.1、0.01μg/mL的模板。以无菌水为空白对照,按2.3、2.4中反应体系对模板进行扩增。扩增结果见图2。
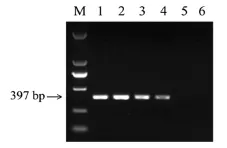
图2 绝对灵敏度实验PCR扩增产物电泳图Fig.2 Gelelectrophoresisof PCR products in absolutesensitivity test
结果显示,随稀释度增加,大鼠阳性扩增条带逐渐减弱,其中模板浓度为100、10、1、0.1μg/mL时均出现阳性条带。而0.01μg/mL及空白对照扩增为阴性。确定其最低绝对灵敏度为0.1μg/mL。
3.3 实际灵敏度实验
选用常见掺假对象羊肉作为基质肉,制备大鼠肉与基质肉的梯度混合样品。混合比例为10%、1%、0.1%、0.01%。混合肉样品进行基因组DNA提取,浓度调整为10μg/mL。以大鼠DNA作为阳性对照,以羊DNA作为阴性对照,以无菌水作为空白对照,按2.3、2.4中反应体系对模板进行扩增。扩增结果见图3。

图3 实际灵敏度实验PCR扩增产物电泳图Fig.3 Gelelectrophoresisof PCR productsam plified from meat m ixture
结果显示,大鼠阳性对照、比例为10%、1%、0.1%的大鼠肉、羊肉混合样品均能扩增出条带。随大鼠肉混合比例下降,条带亮度有下降趋势。而0.01%混合比例及阴性对照、空白对照均未出现扩增条带。该结果显示本方法可用于检测混合肉中大鼠成分,灵敏度可达到0.1%。
3.4 高温处理对方法灵敏度的影响
将3.3中所述大鼠肉、羊肉混合样品经100℃处理30min,按2.1所述方法进行基因组DNA提取。以大鼠DNA作为阳性对照,以羊DNA作为阴性对照,以无菌水作为空白对照,按2.3、2.4中反应体系对模板进行扩增。扩增结果见图4。
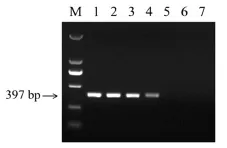
图4 高温处理样品PCR扩增产物电泳图Fig.4 Gelelectrophoresisof PCR productsam plified from heat treatedm eatm ixture
结果显示,10%、1%、0.1%混合肉样品经过高温处理后仍可以成功扩增出目的条带,随大鼠成分比例下降,条带扩增亮度下降趋势相较于未经热处理样品更为明显(见图3)。而0.01%混合比例及阴性对照、空白对照均未出现扩增条带。此结果说明经高温处理的样品应用本方法时,扩增效率会有所降低,但仍能将0.1%混合比例的样品中大鼠成分检出,方法稳健性较好。
3.5 市售肉类样品检测
以大鼠DNA作为阳性对照,以无菌水为空白对照,用建立的方法对18份市售羊肉制品及4份鼠肉制品进行大鼠成分检测。结果见图5。

图5 市售肉类样品大鼠成分扩增产物电泳图Fig.5 Gelelectrophoresisof PCR productsamplified from comm ercialm eat products
凝胶电泳结果显示,从市面购得的所有羊肉制品均未检出大鼠成分,而4种鼠肉制品均检出大鼠成分。空白对照则无扩增。将4种鼠肉制品PCR阳性产物进行测序,结果与GenBank数据库中大鼠基因序列具有>99%同源性。
4 结论
考虑到经济利益和可获得性,小鼠体型小、可获得肉含量不足以驱使鼠肉掺假行为。而分布最广、来源多、肉含量大的褐家鼠(大鼠)则可能成为不法分子非法添加的目标。为解决我国肉及肉制品中大鼠成分检测方法不足的问题,本研究通过搜集大鼠及其他16种常见畜禽动物线粒体cytb基因序列并进行分析比对,设计筛选出大鼠特异性引物。实验结果表明,本方法对16种动物基因组DNA均无非特异扩增,具有很好的特异性。在肉制品加工过程中常见的腌制、熏制及高温加热等处理方式往往造成DNA损伤或降解,最终影响获得的DNA质量[21]。结果表明,本方法可成功检测混合生肉制品及热处理混合肉制品中大鼠成分,灵敏度为0.1%,对于加工肉制品也具有一定的适用性。Fang等报道了采用Taqman探针法可对鼠源性成分进行实时荧光PCR扩增,但该方法无法区分大鼠、小鼠成分[22]。此外,实时荧光PCR方法成本高,对技术人员要求也较高,不利于推广使用。本方法基于传统PCR方法,成本低、操作简便,更适用于一些经费有限的实验室采用,有助于相关部门对肉类食品安全实施监管。
[1] Clause B T.TheWistar Institute Archives:Rats(NotMice)and History[J].MendelNewsletter,1998,2(7):20-24
[2] Crincoli CM,Nikiforov A I,Rihner M O,et al.A 90-day oral(dietary)toxicity and mass balance study of corn starch fiber in Sprague Dawley rats[J].Food Chem Toxicol,2016,97(11):57-69
[3]Murugaiah C,Noor ZM,Mastakim M,etal.Meatspecies identification and Halal authentication analysis usingmitochondrial DNA[J]. MeatScience,2009,83(1):57-61
[4] Girish PS,Anjaneyulu A S,Viswas K N,etal.Meat species identification by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP)ofmitochondrial 12S rRNA gene[J]. MeatScience,2005,70(1):107-112
[5]V Fajardo,IGonzález,M Rojas,etal.A review of currentPCR-based methodologies for the authentication of meats from game animal species[J].Trends in Food Science&Technology,2010,21(8):408-421
[6] Tobe SS,Linacre A M.A multiplex assay to identify 18 European mammal species from mixtures using themitochondrial cytochrome b gene[J].Electrophoresis,2008,29(2):340-347
[7] Kumar D,Singh SP,Karabasanavar N S,et al.Authentication of beef,carabeef,chevon,mutton and pork by a PCR-RFLP assay of mitochondrial cytb gene[J].JFood SciTechnol,2014,51(11):3458-3463
[8]BarakatH,El-Garhy H A,MoustafaMM.Detection ofpork adulteration in processed meat by species-specific PCR-QIAxcel procedurebased on D-loop and cytb genes[J].ApplMicrobiolBiotechnol, 2014,98(23):9805-9816
[9] Karlsson A O,Holmlund G.Identification ofmammal species using species-specific DNA pyrosequencing[J].Forensic Sci Int,2007, 173(1):16-20
[10]Abuzinadah OH,Yacoub H A,El AshmaouiH M,etal.Molecular detection ofadulteration in chicken productsbased onmitochondrial12S rRNA gene[J].MitochondrialDNA,2015,26(3):337-340
[11]Mane BG,Mendiratta SK,Tiwari A K.Polymerase chain reaction assay for Identification of chicken in meat and meat products[J]. Food Chem,2009,116(3):806-810
[12]Girish PS,Haunshi S,Vaithiyanathan S,et al.A rapidmethod for authentication of Buffalo(Bubalusbubalis)meatby Alkaline Lysis method ofDNA extraction and speciesspecific polymerase chain reaction[J].JFood SciTechnol,2013,50(1):141-146
[13]Karabasanavar N S,Singh SP,Kumar D,et al.Detection of pork adulteration by highly-specific PCR assay ofmitochondrial D-loop [J].Food Chem,2014,145(4):530-534
[14]Kesmen Z,Sahin F,Yetim H.PCR assay for the identification ofanimalspecies in cooked sausages[J].MeatScience,2007,77(4):649-653
[15]Martín I,García T,Fajardo V,et al.Technical note:detection of chicken,turkey,duck,and goose tissues in feedstuffsusing speciesspecific polymerase chain reaction[J].JAnim Sci,2007,85(2):452-458
[16]段庆梓,尚柯,张玉,等.多重PCR法用于鸡、鸭肉源性的鉴定[J].食品研究与开发,2014,35(5):90-93
[17]Di Pinto A,Forte V T,Conversano M C,et al.Duplex polymerase chain reaction fordetection ofporkmeatinhorsemeat fresh sausages from Italian retailsources[J].Food Contr,2005,16(5):391-394
[18]Karabasanavar N S,Singh SP,Kumar D,et al.Detection of pork adulteration by highly-specific PCR assay ofmitochondrial D-loop [J].Food Chem,2014,145(4):530-534
[19]Almeida JL,Hill CR,Cole K D.Mouse cell line authentication[J]. Cytotechnology,2014,66(1):133-147
[20]Higgins SC,Steingrimsdottir H,Pilkington G J.Human,mouse or rat?Species authentication of glioma-derived cell cultures[J].J NeurosciMethods,2010,194(1):139-143
[21]Saez R,Sanz Y,ToldráF.PCR-based fingerprinting techniques for rapid detection of animalspecies inmeatproducts[J].MeatScience, 2004,66(3):659-665
[22]Fang X,Zhang C.Detection of adulterated murine components in meatproductsby TaqMan C real-time PCR[J].Food Chem,2016, 192(1):485-490
Detection of Rat Com ponents in M eat and M eat Products by PCR
LIZong-meng1,ZHAO Liang-juan1,MAXing1,ZHAOHong1,ZHENGWen-jie1,ZHANGHong-wei1,WUPeng-cheng2,YINChang-cheng2
(1.Animal,Plantand Foodstuffs Inspection Center,Tianjin Entry-Exit Inspection and Quarantine Bureau,Tianjin 300461,China;2.Beijing Protein Innovation Co.,Ltd.,Beijing101318,China)
Meat fraud has been a problem for a long time in China.Adulteration ofmurinemeatwith unknown resource intohigh pricedmeathasbeen theworst.Brown rat(Rattusnorvegicus)which isnormally referred asrathasbecome themost possible resource formeatadulteration due to its broad distributions,large population and bigger size.There is lack ofdetectionmethod aimingat ratcomponents inmeatandmeatproducts in China. In this study,sequences of cytb gene coming from 17 animal species including ratwas analyzed and a pair of primers specifically targeting ratwas designed.The primers showed high specificity and sensitivity bywhich 0.1 %of ratmeat inmeatmixturewasdetectable.Moreover,thismethod wasalsoapplied to heat treatedmeatmixturesand commercialmeatproductswith sensitivity of0.1%.Thisstudy provided anew tool to control thequality ofmeatproducts forofficial laboratories.
meatproducts;PCR;rat;food fraud
10.3969/j.issn.1005-6521.2016.24.026
2016-10-24
国家质检总局科技项目(2015IK278)
李宗梦(1983—),女(汉),工程师,博士,研究方向:食品安全检测。

