猕猴桃酒主发酵过程中多酚及抗氧化性的研究
戚一曼,樊明涛,程拯艮,黄佳,苗壮
(西北农林科技大学食品科学与工程学院,陕西杨凌712100)
猕猴桃酒主发酵过程中多酚及抗氧化性的研究
戚一曼,樊明涛*,程拯艮,黄佳,苗壮
(西北农林科技大学食品科学与工程学院,陕西杨凌712100)
研究猕猴桃酒发酵过程中总多酚含量、多酚类物质组成以及抗氧化活性(通过DPPH·和ABTS+·自由基清除率法以还原力法测定)的变化规律。结果表明,猕猴桃酒主发酵过程中总多酚含量经历了先上升后下降再上升的复杂变化,抗氧化活性变化与总酚的趋势相似,原儿茶酸、咖啡酸、表儿茶素整体呈现明显上升趋势,绿原酸、对香豆酸整体呈现明显下降趋势。主发酵完成后,猕猴桃酒中儿茶素和表儿茶素含量较高,分别是40.35mg/L和31.02mg/L;没食子酸、咖啡酸和原儿茶酸含量在6.17mg/L~11.26mg/L;绿原酸、阿魏酸、鞣花酸、对香豆酸含量为2.31mg/L~3.72mg/L,根皮苷、根皮素、金丝桃苷含量为0.85mg/L~1.53mg/L。猕猴桃酒多酚组成丰富,抗氧化能力较强,是一类值得推广的果酒。
猕猴桃酒;单体酚;抗氧化;变化
猕猴桃(Actinidia chinensis Planch)是猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)植物的果实,又被称作“奇异果”、“狐狸桃”、藤梨”等。猕猴桃栽培历史悠久,在世界上多个国家均有种植[1],分布较广,在陕西、浙江、福建等地已经形成了一定的产业规模[2],它不仅含有丰富的营养物质,如多种氨基酸、矿物质和微量元素,而且还含有大量的天然抗氧化物质,如多酚、VC、生育酚等[3]。研究表明,猕猴桃具有一定的医疗保健作用,如治疗烧伤[4],降血脂,降血压,预防癌症等[5]。
随着我国猕猴桃产业的发展,猕猴桃的深加工将是猕猴桃产业持续发展的必由之路,而果汁、果酒加工是目前猕猴桃最主要的加工方式,猕猴桃酒是一个新兴的酒种,市场潜力巨大,受到越来越多的关注。多酚是果酒中的重要指标,它决定了果酒的色泽和风味,而且对果酒中的各种保健功效也有很大贡献[6]。而关于猕猴桃酒多酚组成与抗氧化性的研究较少,本试验研究了猕猴桃酒发酵过程中多酚及单体酚和抗氧化能力的变化情况,以期为猕猴桃酒的进一步开发利用提供参考。
1 材料与方法
1.1 材料与试剂
猕猴桃原料:翠香,采于陕西省杨凌区猕猴桃种植基地;酿酒酵母:WLP775,美国常用酿酒酵母。
酚类化合物的标准品:没食子酸(gallic acid)、原儿茶酸(3,4-Dihydroxybenzoic acid)、(+)-儿茶素((+)-catechin hydrate)、表儿茶素(epicatechin)、鞣花酸(ellagic acid)、根皮苷(phlorizin)、根皮素(phloretin)、绿原酸(chlorogenic acid)、咖啡酸(caffeic acid)、对香豆(pcoumaric acid)、阿魏酸(ferulic acid)、金丝桃苷(hyperoside)均为色谱纯:Sigma-Aldrich公司生产。
甲醇(色谱纯)、乙酸(色谱纯)、3-辛醇、没食子酸、Folin-ciocalteu显色剂、碳酸钠、无水乙醇、1,1-二苯-1-苦基苯肼自由基(1,1-diphenyl-2-picryhydrazyl,DPPH)、2,2-氨基-二(3-乙基-苯并噻唑啉-6-磺酸)(2,2-azino-bis-(3-ethylbmzothiazoline-sulfonic acid,ABTS)、磷酸缓冲液、铁氰化钾、三氯乙酸、三氯化铁:购买于杨凌鑫方试剂公司。
1.2 仪器与设备
Waters Breeze 2高效液相色谱仪(W 1525泵、W2707自动进样器、W2998检测器、W2414柱温箱):美国Waters公司;Milli-Q超纯水仪:美国Millipore公司;UV-2800型紫外-可见分光光度计:尤尼柯(上海)仪器公司;HH-S6电热恒温水浴锅:北京科伟永兴生物科技;BS 224S天平(0.1mg):北京赛多利斯科学仪器有限公司。
1.3 酿造工艺
1.3.1 猕猴桃酒酿造工艺流程
猕猴桃→挑选、清洗→破碎榨汁→果汁处理(60 mg/LSO2,150mg/L果胶酶)→装罐→接种(5%酿酒酵母)→发酵→过滤→杀菌→猕猴桃果酒
1.3.2 发酵操作的基本要点
选择软硬适中,成熟度较好,无腐烂发霉的猕猴桃,利用榨汁机打浆;打浆后的果汁经过果胶酶处理24 h后接入酿酒酵母进行酒精发酵;提前挑取保藏在平板上的酿酒酵母在液体培养基中37℃活化18 h~24 h,将活化好的酵母菌按照5%的比例接种于猕猴桃果浆中,搅拌后发酵;发酵温度控制在16℃,发酵期间每天按时搅拌,每天取样离心后取上清液分析有关指标,当发酵的猕猴桃酒糖度不再降低时主发酵结束。
1.4 方法
1.4.1 总酚测定
总酚含量测定采用Folin-ciocalteu法[8]。分别吸取0.5mL没食子酸标准液或样品溶液,分别加水2.5mL、Folin-ciocalteu显色剂0.5mL,7.5%碳酸钠溶液1.5mL。室温下放置2 h后,在765 nm波长下测定其吸光度值,以蒸馏水为空白对照。标准曲线回归方程为:y= 0.006 9x+0.092 7(R2=0.996 2)。
1.4.2 猕猴桃酒发酵过程中单体酚含量的测定[9-10]
色谱柱:Waters symmetry C18色谱柱(250mm× 4.6mm,5μm);流动相A:1%(体积分数)的乙酸水溶液;流动相B:色谱甲醇;梯度洗脱时间程序:0~10min,5%~30%B;10 min~25min,30%~50%B;25 min~30 min,50%~60%B;30 min~35 min,60%~70%B;35 min~40min,70%~5%B;流速:1.0mL/min;柱温:30℃;进样量:20μL;检测器同时采集2个特征吸收波长(280 nm、320 nm)下的信号。
定性定量:根据单体酚标品的保留时间对样品进行多酚组分的定性分析;将各个标品稀释成不同的浓度梯度,在上述色谱条件下进行检测,以浓度为横坐标,峰面积为纵坐标,绘制标准曲线,再依据样品的峰面积计算得到样品中各多酚组分的含量。
1.4.3 体外抗氧化活性测定
DPPH自由基清除能力测定参照Barbara[11]的方法;ABTS+·自由基阳离子清除能力测定参照Re[12]的方法;还原能力的测定参考Zheng[13]的方法。
1.5 数据分析
采用Graphpad prism6作图,SPSS 22.0 Pearson法进行相关分析。
2 结果与讨论
2.1 猕猴桃酒发酵过程中总多酚含量的变化
图1为猕猴桃酒发酵过程中总多酚含量变化趋势图。
本次试验结果表明,接种量较高(10%~20%),乳酸菌发酵产品中蛋白含量变化不大,较低的接种量(3%~5%)的情况下,两种饲料表现出不同的结果。接种量的大小主要体现在菌种的起始分布密度上,随着起始分布密度的提高,乳酸菌生长速度加快,当起始分布密度达到一定程度后,其对乳酸菌的生长促进作用开始减弱,因为可用养分限制了微生物的大量生长,所以当接种量超过10%后所得产品的蛋白指标变化不大。值得一提的是,对于552H,接种量3%时获得了相当高的蛋白含量及其增加率,这应与552H饲料中可利用组分主要为有机大分子以及微环境条件有关,当然,具体机制仍需要进一步研究。
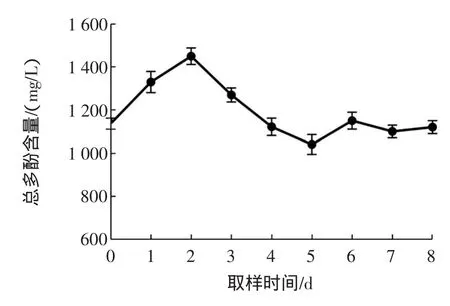
图1 猕猴桃酒发酵过程中总多酚随时间变化曲线图Fig.1 Changesof totalphenolcontent in the kiw iw ine during ferm entation
从图1可以看出,总多酚呈现先上升后下降再上升的趋势。酒精发酵产生的乙醇有利于果肉中酚类的溶出[14],主发酵初期2 d随着酒精的生成,多酚含量增加,随后总酚含量下降,有可能是发酵后期酚类物质的氧化造成;或是猕猴桃酒发酵过程中羟基苯甲酸类化合物与产生的酒精和单宁结合导致[15];或者与发酵液中酵母的代谢有关[16]。这些多酚化合物最重要的化学特征是可以通过疏水键和多元氢键与蛋白质发生结合,也可以与生物碱、多糖等生物大分子发生相似的反应,另外还可以与金属离子发生络合反应[17],这些均可能导致多酚含量下降。第5天以后总酚含量的上升可能是由于一些单体酚化合物的含量升高引起的。
2.2 单体酚的标准色谱图及标准曲线
2.2.1 单体酚标准色谱图
多酚主要是由酚酸类化合物和类黄酮类化合物组成。酚酸类化合物属于小分子量物质,主要分为两类,一类是羟基苯甲酸类化合物,包括没食子酸、原儿茶酸、对羟基苯甲酸等);一类是羟基肉桂酸类化合物包括咖啡酸、绿原酸、对香豆酸、阿魏酸以及它们的衍生物等,它们通常是多酚氧化酶的最适底物,可以赋予果酒金黄色。类黄酮类化合物主要包括:黄酮、黄酮醇、查尔酮以及花色苷等,它们的区别在于苯环上羟基和甲氧基的数量以及位置的不同。图2为单体酚的标准色谱图。
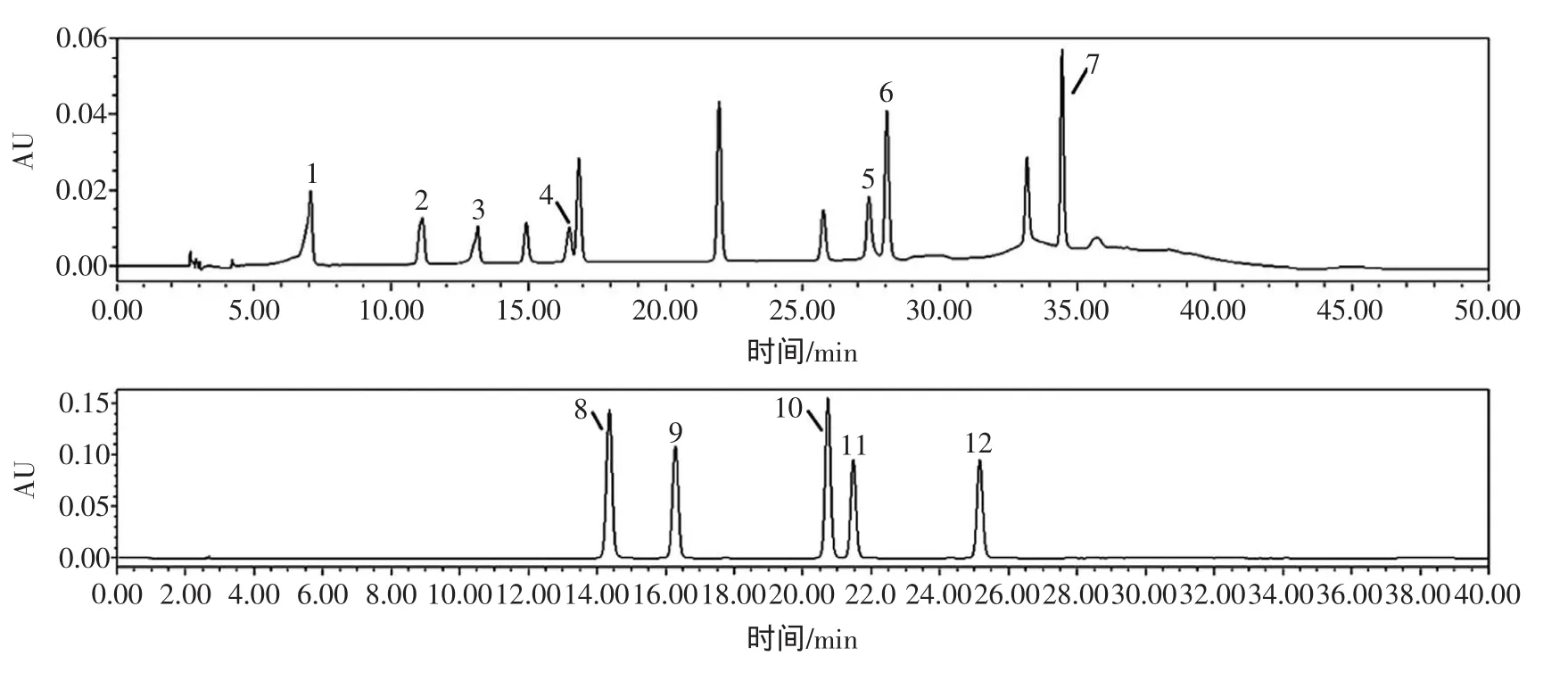
图2 12种混合标准样品在280 nm和320 nm下的标准色谱图Fig.2 HPLC-chromatogram of12mono-phenolsdetected at280 nm and 320 nm
猕猴桃酒中主要含有12种多酚化合物,分别是酚酸类的2种羟基苯甲酸(没食子酸、原儿茶酸)和5种羟基肉桂酸(咖啡酸、绿原酸、对香豆酸、阿魏酸、鞣花酸),以及类黄酮类的黄烷-3-醇(儿茶素、表儿茶素),查尔酮(根皮素、根皮苷)以及黄酮醇苷类化合物(金丝桃苷)。从图2可以看到,利用280 nm和320 nm两种检测波长,可以将12种多酚完全分开,分辨率很高。
2.2.2 单体酚标准曲线
表1为12种单体酚的标准曲线。
如表1所示为单体酚的标准曲线,在试验范围内线性关系良好(R2>0.99),因此所得到的各个标准曲线可以用于样品中单体酚含量测定的定量分析。
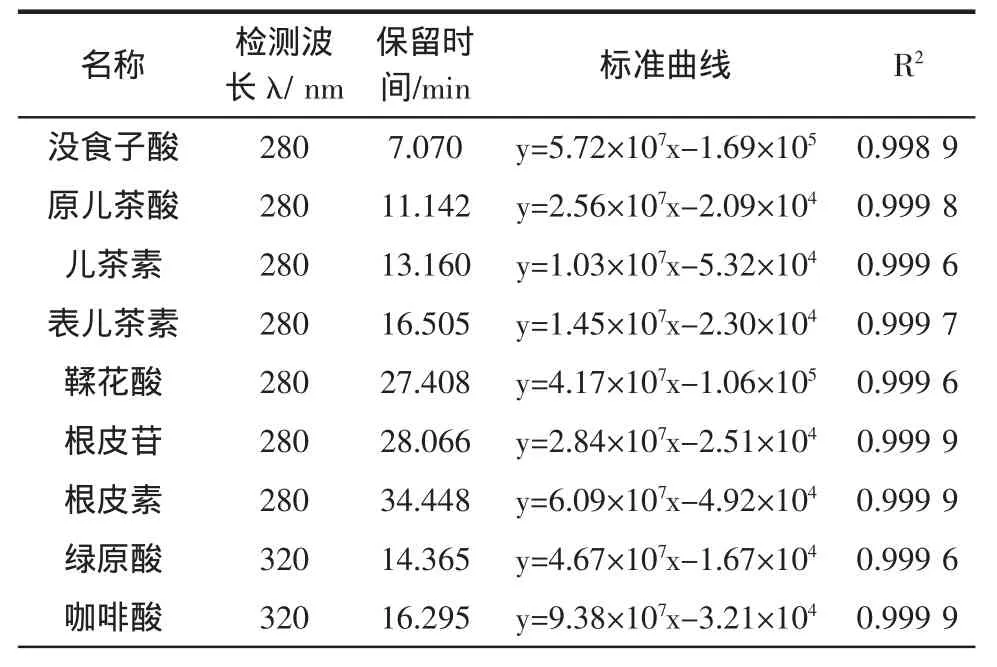
表1 多酚标准品标准曲线Table1 Standard curveof polyphenols
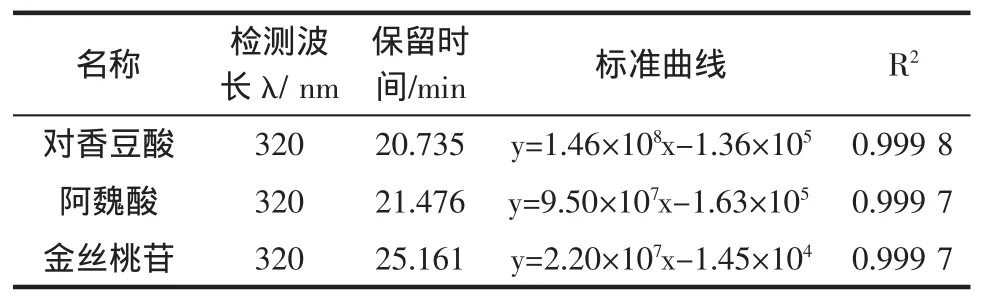
表1 多酚标准品标准曲线Table1 Standard curveofpolyphenols
2.3 猕猴桃酒发酵过程中单体酚含量的变化
图3为猕猴桃酒主发酵过程中没食子酸和原儿茶酸随时间的变化曲线图。

图3 猕猴桃酒发酵过程中没食子酸和儿茶素随时间变化曲线图Fig.3 Changesof gallic acid and 3,4-dihydroxybenzoic contents in thekiw iw ine during ferm entation
由图3可以看出,从发酵开始至发酵结束,猕猴桃酒发酵液中没食子酸含量相比于原儿茶酸含量一直保持相对较高的水平。没食子酸不仅仅来源于水果本身,它也是一类水解和缩合单宁水解的产物[18],猕猴桃酒发酵液中没食子酸的含量呈现出先升高后降低,之后再升高和降低的趋势,发酵过程中在第6天达到了最高值12.44mg/L,最终发酵液中没食子酸的含量为11.26mg/L;原儿茶酸整体呈现上升趋势,发酵开始到第4天一直在上升,在第4天达到了最高值7.10mg/L,第5天降低之后又有轻微上涨趋势,最终发酵液中原儿茶酸的含量为6.17mg/L。
图4为猕猴桃酒主发酵过程中绿原酸和咖啡酸随时间的变化曲线图。
咖啡酸可以增强果酒的稳定性并且提升果酒的品质[6],由图4可以看出猕猴桃酒发酵液中的咖啡酸含量先升高后稍微下降,最终稳定在相对较高的含量,从发酵开始至第6天,咖啡酸含量一直在上升,在第6天出现最高值(10.70mg/L),最终发酵液中咖啡酸的含量是8.94mg/L。绿原酸是氧气存在条件下多酚氧化酶的主要多酚底物,绿原酸的含量在发酵1 d后达到了最大值8.60mg/L,在第2天到第5天内迅速下降,最终发酵液中绿原酸含量降低为3.62mg/L,相比于其发酵过程中最大值降低了57.90%,绿原酸的这种下降趋势可能是由于酸类化合物多酚氧化酶引起的降解造成的[19]。在猕猴桃酒的发酵过程中,咖啡酸和绿原酸的含量变化正好相反,这是因为在猕猴桃酒发酵过程中会有部分绿原酸转换成咖啡酸,造成这种变化的原因可能和发酵液中的溶氧量相关,这个趋势和李国薇等人在苹果酒中的趋势相符[16]。

图4 猕猴桃酒发酵过程中绿原酸和咖啡酸随时间变化曲线图Fig.4 Changesof chlorogenic acid and caffeic acid contents in the kiw iw ine during fermentation
图5 为猕猴桃酒主发酵过程中对香豆酸和阿魏酸随时间的变化曲线图。
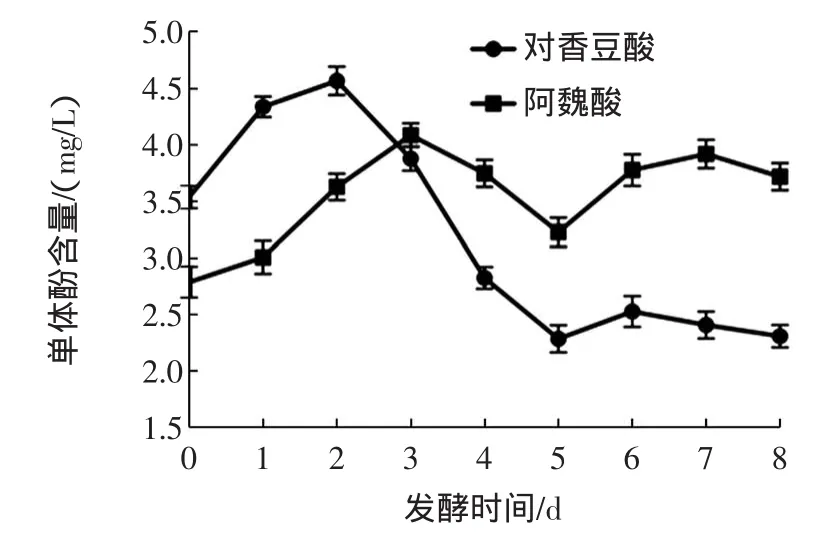
图5 猕猴桃酒发酵过程中对香豆酸、阿魏酸随时间变化曲线图Fig.5 Changesof p-coumaric acid and ferulic acid contents in the kiw iw ine fermentation
对香豆酸的含量与其对应的酒石酸酯的水解以及对香豆酸花青素的水解有关[20]。如图5所示,对香豆酸含量整体呈现下降趋势,在发酵的第3天达到了最大值4.57mg/L,随后对香豆酸含量开始下降,最终发酵液中含量为2.31mg/L,相比于其发酵过程中最大值降低了49.45%。阿魏酸是一类与反式肉桂酸相关的化合物,阿魏酸含量在发酵开始3 d之后,其含量均高于对香豆酸和鞣花酸,阿魏酸含量在第3天达到了最大值4.08mg/L,最终发酵液中含量为3.72mg/L。阿魏酸也是一些香气类化合物形成的前体化合物,它可能在发酵过程中转化为4-乙烯基愈创木酚,香草酸和香草醛[21-22]。在猕猴桃酒发酵过程中还检测出了鞣花酸,其含量波动不大,在2.65mg/L~2.86mg/L之间波动。这3种单体酚的形成都与肉桂酸相关,而肉桂酸的生物合成则是来源于苯丙氨酸氨基水解酶对苯丙氨酸发生的化学反应。
2.3.2 类黄酮化合物
图6为猕猴桃酒主发酵过程中儿茶素和表儿茶素随时间的变化曲线图。
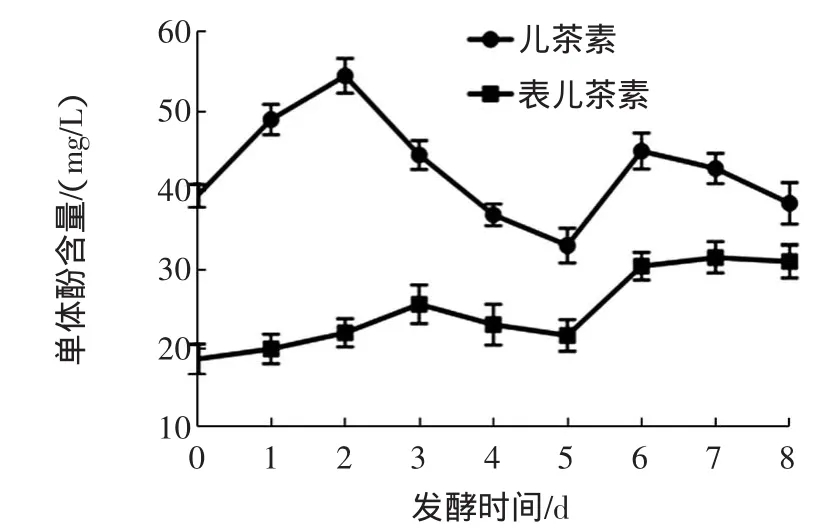
图6 猕猴桃酒发酵过程中(+)-儿茶素和表儿茶素随时间变化曲线图Fig.6 Changesof(+)-catechin hydrateand epicatechin contents in the kiw iwineduring ferm entation
已经有研究表明,黄烷-3-醇是葡萄酒中最主要的单体酚类物质,它们主要来源于葡萄酒发酵时对皮和籽中的浸渍,这类化合物对酒的苦味、涩味及结构具有重要作用[23-24]。在猕猴桃酒发酵过程中黄烷-3-醇组分也呈现出最高的含量。由图6可以看出,在猕猴桃酒发酵液中儿茶素的含量一直高于表儿茶素的含量。表儿茶素含量整体呈现先上升趋势,最终在猕猴桃酒中的,浓度为31.02mg/L,表儿茶素的这种变化可能是由于氧化和聚合反应造成的。儿茶素的含量在猕猴桃酒中最高,在发酵开始至第2天呈现上升趋势,在第2天达到峰值54.51mg/L,比初始含量(29.28mg/L,0 d)高了86.17%。第2天之后迅速下降,在第5天达到最低值后再次上升,最终在在猕猴桃原酒的浓度为40.35mg/L,比初始含量高了37.80%。
猕猴桃酒发酵过程中也检测出了查尔酮类化合物根皮苷和根皮素,在整个猕猴桃酒发酵过程中,根皮苷含量在1.11mg/L~1.53mg/L之间波动,根皮素含量在0.85mg/L~0.99mg/L波动。根皮素糖基化以后可以形成根皮苷,Formm等(2012)研究发现,根皮苷占苹果籽单体多酚的79%~92%[25],它是一类重要的苹果多酚。
猕猴桃酒发酵过程中检测出的黄酮醇苷类化合物是金丝桃苷,黄酮醇由于其自身黄酮结构会会呈现黄色或者浅黄色。金丝桃苷含量在猕猴桃酒发酵过程中呈现降低的趋势,在发酵结束时,金丝桃苷含量只有1.16mg/L。不同样品中黄酮醇苷类化合物含量差别较大,在红葡萄酒中,黄酮醇苷类化合物的含量多数在1mg/L~10mg/L,白葡萄酒中含量在0.1mg/L~0.5mg/L,本试验结果与红葡萄酒中检测到的含量相一致[26]。
2.4 猕猴桃酒发酵过程中抗氧化能力的变化
由于天然成分较为复杂,而且没有一种标准方法可以准确评价物质的抗氧化能力[27],现在使用的抗氧化能力测定方法基于反应机理主要有以下几大类:抑制脂质的氧化降解(过氧化氢法等),清除自由基(OH·自由基清除能力等),清除人工合成自由基(DPPH·,ABTS+·自由基清除能力等),测定还原能力(铁离子还原能力等)或者抑制促氧化剂(如螯合过渡金属)等等[28]。图7为猕猴桃酒主发酵过程中抗氧化能力素随时间的变化曲线图。

图7 猕猴桃酒发酵过程中抗氧化能力随时间变化曲线图Fig.7 Changesof antioxidantactivities in the kiwiw ine during fermentation
自由基清除能力的方法原理相似,自由基的孤电子对在特定波长处具有强吸收呈现一定的颜色,抗氧化剂的存在使得孤电子对的吸收减弱,从而使得颜色变浅,通过测定吸收减弱的程度来评价自由基清除的效果;总还原能力是直接通过吸光度的数值反应抗氧化能力的强弱。如图7所示,左侧坐标轴表示发酵过程中两种自由基DPPH·和ABTS+·的清除能力的大小,右侧坐标轴表示还原力的大小,这三种方法较为一致的衡量了猕猴桃酒发酵过程中抗氧化能力的变化情况,抗氧化能力呈现先上升后下降再上升的趋势,这与发酵过程中酚类化合物的变化一致,在发酵前2天抗氧化能力的上升可能是由于酚类化合物的升高引起,之后的下降可能是由于酚类物质的氧化造成,而第5天以后抗氧化能力又开始上升,可能是由于发酵的后期乙醇的积累使得酒中的酚类物质的生物活性提升,同时也提高了酚类物质的抗氧化能力[14]。在发酵完成的猕猴桃原酒中,DPPH·自由基清除率为73.20%;ABTS+·自由基清除率为82.19%;总还原能力为0.81。
2.5 猕猴桃酒中多酚含量和抗氧化能力的相互关系
表2为猕猴桃酒中总酚含量和抗氧化能力的相关性分析。
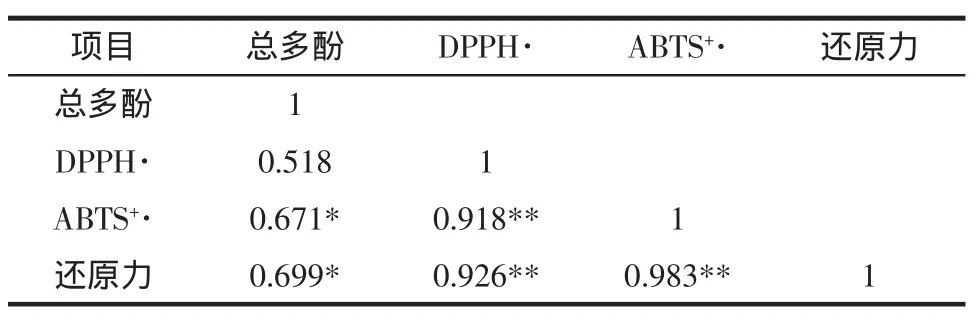
表2 猕猴桃酒中总酚含量和抗氧化能力的相关性分析Table2 Correlation between totalpolyphenolcontentand antioxidantactivitiesof kiw iwine
由表2可知,在猕猴桃酒发酵过程中,除了DPPH·自由基清除率之外,总多酚含量和ABTS+·自由基清除能力以及还原力测定的抗氧化能力均在0.05水平上显著正相关,因此对于猕猴桃酒发酵过程中抗氧化评价中,只需测定总多酚含量来初步预测其抗氧化能力,这样可以大幅度减少工作量,能够快速了解酒发酵过程中的抗氧化的变化情况。
3 结论
本试验以猕猴桃为原料酿造得到猕猴桃酒,通过评价其发酵过程中总多酚、多酚组成及抗氧化能力的变化情况,分析其发酵变化规律,评价得到猕猴桃酒的质量与价值。结果显示,猴桃发酵得到的猕猴桃酒发酵状况良好,多酚含量较高,多酚组成丰富,成品酒具有较强的抗氧化能力。从单体酚组份的分析可以知道,儿茶素和表儿茶素是猕猴桃酒中含量最多的酚类化合物,其次是没食子酸和咖啡酸。在发酵过程中,单体酚发生复杂变化,然而关于其酚类物质变化的原因以及相互转换机理还有待于进一步的研究。除DPPH·法测定抗氧化能力外,多酚含量与ABTS+·清除率以及还原能力具有显著正相关性。总体来讲,猕猴桃酒是一种值得推广的具有丰富营养价值和保健作用的新型果酒,它既丰富了果酒市场,又拓宽了猕猴桃的深加工范围,推动当地经济发展。
[1]刘世珍.中华猕猴桃的营养价值[J].中国食物与营养,2003(5): 47-48
[2]徐小彪,张秋明.中国猕猴桃种质资源的研究与利用[J].植物学通报,2003,20(6):648-655
[3] Bursal E,Gülçin I˙.Polyphenol contentsand in vitro antioxidantactivities of lyophilised aqueous extract of kiwifruit(Actinidia deliciosa)[J].Food Research International,2011,44(5):1482-1489
[4] Hafezi F,Rad H E,Naghibzadeh B,et al.Actinidia deliciosa(kiwifruit),anew drug forenzymatic debridementofacuteburnwounds [J].Burns,2010,36(3):352-355
[5]楼丽君,吕定量,胡增仁,等.猕猴桃根抗肝癌的实验研究[J].中华中医药学刊,2009,27(7):1509-1511
[6] Ye M,Yue T,Yuan Y.Evolution of polyphenols and organic acids during the fermentation of apple cider[J].Journal of the science of food and agriculture,2014,94(14):2951-2957
[7] Miller G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analyticalchemistry,1959,31(3):426-428
[8]ChaovanalikitA,Wrolstad RE.Totalanthocyaninsand totalphenolics of fresh and processed cherriesand their antioxidant properties [J].Journalof food science,2004,69(1):67-72
[9] 徐颖,樊明涛,冉军舰,等.不同品种苹果籽总酚含量与抗氧化相关性研究[J].食品科学,2015,36(1):79-83
[10]韩国民,陈锋,侯敏,等.葡萄酒中14种单体酚的高效液相色谱测定[J].食品科学,2011,32(2):180-183
[11]Barbara K,Anna P,BarbaraM,etal.Phenolic composition and antioxidant properties of polish blue-berried honeysuckle genotypes by HPLC-DAD-MS,HPLC postcolumnderivatization with ABTSor FC,and TLCwith DPPH visualization[J].JournalofAgriculturaland Food Chemistry,2012,60(7):1755-1763
[12]Re R,PellegriniN,Proteggente A,etal.Antioxidantactivity applying an improved ABTS radical cationdescolorizationassay[J].Free radicalbiologyandmedicine,1999,26(9):1231-1237
[13]Zheng Huzhe,Kim Yi,Chung SK.A profile of physicochemical and antioxidant changes during fruit growth for the utilisation of unripe apples[J].Food Chemistry,2012,131(1):106-110
[14]李光宇,彭丽萍.葡萄酒中主要的多酚类化合物及其作用[J].酿酒,2007,34(4):60-61
[15]张莉.西澳葡萄酒色素、多酚及香气质量特特征的研究[D].杨凌:西北农林科技大学,2012
[16]李国薇,樊明涛,王胜利,等.酵母菌种对苹果酒主发酵过程中多酚组成及抗氧化活性的影响[J].中国酿造,2012,31(10):33-37
[17]Kodama N,RamadaM,Nanba H.Addition ofMaitake D-fraction reduces theeffectivedosageofvancamycin for the treatmentof Listeria-infectedmice[J].Japanese Journal of Pharmacology,2001,87(4): 327-332
[18]Rentzsch M,Wilkens A,Winterhalter P.Non-flavonoid phenolic compounds[M]//Wine chemistry and biochemistry.New York: Springer,2009:509-527
[19]Podsedek A,Wilska-Jeszka J,Anders B,etal.Compositional characterisation ofsome apple varieties[J].European Food Research and Technology,2000,210(4):268-272
[20]MonagasM,BartoloméB,Gómez-Cordovés C.Updated knowledge about the presence of phenolic compounds in wine[J].Critical reviewsin food scienceand nutrition,2005,45(2):85-118
[21]Abdelkafi S,Sayadi S,Gam Z B A,et al.Bioconversion of ferulic acid to vanillic acid by Halomonas elongata isolated from table-olive fermentation[J].FEMSmicrobiology letters,2006,262(1):115-120
[22]Donaghy JA,Kelly PF,McKay A.Conversion of ferulic acid to 4-vinyl guaiacol by yeasts isolated from unpasteurised apple juice[J]. Journal of the Science of Food and Agriculture,1999,79(3):453-456
[23]LiH,Wang X,LiY,etal.Polyphenolic compoundsand antioxidant propertiesofselected Chinawines[J].Food Chemistry,2009,112(2): 454-460
[24]Meng JF,Ning PF,Xu TF,etal.Effectof rain-shelter cultivation of Vitis vinifera cv.Cabernet gernischet on the phenolic profile of berry skinsand the incidenceofgrape diseases[J].Molecules,2012, 18(1):381-397
[25]Fromm M,Sandra B,Carle R,et al.Characterization and quantitation of low and highmolecularweight phenolic compounds in apple seeds[J].Journal of Agricultural and Food Chemistry,2012,60(5): 1232-1242
[26]孙翔宇,杜国荣,马婷婷,等.陕西市售国产葡萄酒中多酚类物质的特征与抗氧化能力分析[J].现代食品科技,2014,30(8):242-250
[27]Prior R L,Wu X L,Schaich K.Standardizedmethods for the determination ofantioxidant capacity and phenolics in foods and dietary supplements[J].Journal of Agricultural and Food Chemistry,2005, 53(10):4290-4302
[28]王晓宇,杜国荣,李华.抗氧化能力的体外测定方法研究进展[J].食品与生物技术学报,2012,31(3):247-252
Study on Polyphenol Com position and Antioxidant Properties of K iw iW ine in M ain Fermentation Process
QIYi-man,FANMing-tao*,CHENGZheng-gen,HUANG Jia,MIAOZhuang
(Collegeof Food Scienceand Engineering,NorthwestA&FUniversity,Yangling712100,Shaanxi,China)
Changesof totalpolyphenols,reducing sugar,composition ofpolyphenolsprofilesand theirantioxidantactivities(measured by DPPH·,ABTS+·radicals scavenging and reducing powermethods)of kiwiwine during fermentation wasevaluated in this study.Results showed that the contentof totalpolyphenolswere experienced a complex tendency of increased first then decreased and rebound again,antioxidantactivities changes were similarwith that totalphenolsduringmain fermentation stage.The contentsof3,4-dihydroxybenzoic acid,caffeic acid and epicatechin presented a significantly increased trend overall,but chlorogenic acid and pcoumaric acid showed a cleardownward trend in general.Compared to the12 detected single phenols in the kiwi wineaftermain fermentation,(+)-catechin hydrateand epicatechin had the highestcontents,held 40.35mg/L and 31.02 mg/L respectively;the contents of gallic acid,caffeic acid,and 3,4-dihydroxybenzoic acid were ranged from 6.17 mg/L to 11.26 mg/L;the contents of chlorogenic acid,ferulic acid,ellagic acid and pcoumaric acidwere ranged from 2.31mg/L to3.72mg/L;the contentsofphloridzin,phloretin,hyperosidewere ranged from 0.85mg/L-1.53mg/L.Kiwiwine,with rich mono-phenols and strong antioxidant abilities,is a kind of fruitwineworthy to popularize.
kiwiwine;single phenols;antioxidant;changes
10.3969/j.issn.1005-6521.2016.24.002
2016-03-17
农业部公益性行业专项(201503142-10);陕西省统筹项目(2016KTCQ02-13)
戚一曼(1991—),女(汉),硕士研究生,研究方向:微生物发酵。
*通信作者:樊明涛(1963—),男,博士生导师,教授,研究方向:食品生物技术。

