腔镜手术患者舒芬太尼靶控输注的药动学研究*
刘 维 赵 艳 吴 琼 郭向阳 翟所迪 卢 炜 任宇鹏 孙 谊
(北京大学第三医院麻醉科,北京 100083)
·实验研究·
腔镜手术患者舒芬太尼靶控输注的药动学研究*
刘 维①赵 艳**吴 琼 郭向阳 翟所迪①卢 炜②任宇鹏②孙 谊②
(北京大学第三医院麻醉科,北京 100083)
目的 探讨腔镜手术临床常用浓度舒芬太尼靶控输注(target-controlled infusion,TCI)的药动学特点。 方法2011年6~9月,择期全麻下腔镜手术30例(24~65岁,ASA Ⅰ级或Ⅱ级),应用内嵌Gepts药动学参数的TCI系统输注舒芬太尼,效应室靶浓度随机采用0.2、0.3和0.4 μg/L各10例,复合吸入七氟烷维持麻醉。于不同时点经桡动脉取血至停止TCI后24小时,以液相色谱-质谱联用法测定舒芬太尼的血药浓度。运用非线性混合效应模型分析舒芬太尼群体药动学数据。结果 舒芬太尼TCI的药动学模型为三室模型,其药动学参数为:中央室容积(V1)=15.7 L,快速分布容积(V2)=50.4 L,慢速分布容积(V3)=213.0 L,稳态分布容积(Vdss)=279.2 L;药物总清除率(Cl1)=0.80 L/min,快速分布相清除率(Cl2)=1.09 L/min,慢速分布相清除率(Cl3)=0.27 L/min;快速分布半衰期(t1/2α)=4.6 min,慢速分布半衰期(t1/2β)=68.7 min,清除半衰期(t1/2γ)=739.5 min。年龄、性别和体重对药动学参数无显著影响(P>0.05)。 结论 腔镜手术患者临床常用浓度舒芬太尼TCI的药动学可用三室模型描述。年龄、性别和体重对药动学参数无显著影响。
舒芬太尼; 靶控输注; 药动学; 非线性混合效应模型; 液相色谱-质谱联用
靶控输注(target controlled infusion,TCI)使静脉麻醉更精确、平稳和可控[1~5],舒芬太尼是目前镇痛作用最强的阿片类药物,具有良好的血流动力学稳定性[6~10]。深入研究麻醉药物的药动学规律,对于合理用药、提高麻醉质量和安全性、改善预后具有重要意义。我们前期初步探讨了应用Bovill等[11]的药动学模型进行高浓度舒芬太尼TCI(复合异氟烷全麻)用于长时间手术患者的国人舒芬太尼药动学特点[12]。临床麻醉中,Gepts等[13]的舒芬太尼药动学模型应用广泛。目前,对于应用Gepts等[13]的药动学模型,采用临床常用浓度舒芬太尼TCI(复合七氟烷全麻)用于成人腔镜手术的药动学特点,尚待进一步研究[14,15]。本研究应用内嵌Gepts等[13]药动学模型的TCI系统,采用临床常用浓度舒芬太尼TCI用于腔镜手术患者全麻,观察舒芬太尼TCI的药动学特点,为临床麻醉提供参考。
1 临床资料与方法
本研究经北京大学生物医学伦理委员会审核批准(伦理批件号:IRB00001052-10051),所有受试者均在术前签署知情同意书。
1.1 一般资料
入选标准:ASA Ⅰ级或Ⅱ级,年龄18~65岁,择期在全麻下施行腔镜手术。
排除标准:既往有精神、神经肌肉疾病史,有未经控制的高血压病史,严重心、肺疾病,肝、肾功能异常,长期服用阿片类或镇静催眠类药物史,对阿片类药物有不良反应史,6个月内参加过类似研究,有药物及酒精依赖,或术中失血量>500 ml者。
2011年6~9月入选30例,男12例,女18例。年龄24~65岁,(43.8±12.5)岁。身高147~180 cm,(165.9±8.3)cm。体重45~85 kg,(66.7±10.8)kg。体重指数17.6~35.8,24.2±3.6。手术类型:妇科手术15例(腹腔镜卵巢囊肿剔除术6例,腹腔镜子宫肌瘤剔除术5例,腹腔镜子宫切除术4例),泌尿科手术6例(后腹腔镜手术4例,腹腔镜手术1例,经皮肾镜手术1例),普通外科手术9例(腹腔镜胆囊切除术4例,腹腔镜肝囊肿切除术3例,腹腔镜阑尾切除术2例)。手术时间33~305 min,中位数104 min。靶控输注时间27~194 min,中位数87 min。舒芬太尼用量24.4~129.0 μg,中位数52.2 μg。
1.2 麻醉及监测方法
术前禁食禁饮8 h。入室后开放上肢静脉,以8~10 ml/(kg·h)的速度输注乳酸林格氏液。对侧桡动脉穿刺置管,用于直接测定动脉压和采血。持续监测平均动脉压(mean arterial pressure,MAP)、心电图、心率(heart rate,HR)、脉搏血氧饱和度和脑电双频指数(bispectral index,BIS)。
麻醉诱导前静脉注射东莨菪碱0.3 mg。麻醉诱导:静脉注射丙泊酚2.0~2.5 mg/kg,患者意识消失(呼之不应和睫毛反射消失)后,静脉注射罗库溴铵0.6 mg/kg,应用内嵌Gepts等[13]药动学参数的TCI系统(协奏曲工作站,Fresenius公司,法国),按照随机数字表维持舒芬太尼(Impfstoffwerk Dessau-Tornau公司,德国,批号:100877)的效应室靶浓度(target effect-site concentration,Ce)分别为0.2、0.3和0.4 μg/L(临床常用浓度)各10例。给予罗库溴铵2 min后行气管插管,机械通气,氧流量2 L/min,维持呼气末CO2分压30~35 mm Hg。麻醉维持:术中舒芬太尼TCI的Ce恒定,复合吸入七氟烷(Baxter healthcare公司,美国)维持麻醉,通过观察BIS(术中维持40~60)、MAP及HR(变化幅度不超过基础值的20%)等情况调整七氟烷的浓度以维持适当的麻醉深度。术中根据手术需要间断静脉注射肌松药罗库溴铵。注意保温,监测鼻咽温(维持36~37 ℃)。根据手术进程及TCI系统预计的患者苏醒时间适时停止舒芬太尼TCI,术毕停止吸入七氟烷。
1.3 舒芬太尼血药浓度的测定方法
分别于麻醉诱导前,舒芬太尼TCI开始后1、3、10 min,停止TCI前,停止TCI后20 min、1 h、4 h、12 h及24 h共10个时点经桡动脉取血,每次约1.5 ml,置于肝素抗凝管中,4000 r/min离心10 min,分离血浆,-80 ℃冰冻保存。采用液相色谱-质谱联用技术(liquid chromatography-mass spectrometry/mass spectrometry,LC-MS/MS)[16,17]测定舒芬太尼血药浓度。测定血浆舒芬太尼浓度的线性范围为2~5000 ng/L。
1.4 统计学和药动学分析
协变量分析采用逐步回归法进行正向模型化和逆向剔除。首先将所有协变量依次逐个加入基础模型中,如果使目标函数值(objective function value,OFV)降低大于3.84(P<0.05),则保留该协变量再进行逆向剔除;在逆向剔除过程中,如果使OFV升高大于6.63(P<0.01),则该协变量对药动学参数有显著性影响,并得到最终模型。
最终模型的验证:自举法(bootstrap method)[20]用于评价模型的精确性和稳定性。将自举法计算得出的中位数和95%置信区间(confidential interval,CI)与NONMEM软件分析得出的药动学参数估计值和相对标准误(relative standard error,RSE)进行比较。可视化预测检验(visual predictive check,VPC)用于评价模型的准确性及预测能力。通过最终模型对原数据文件的1000次仿真,建立模型的2.5%、50%和97.5%预测分位数线及其95%预测区间,并与观测数据进行比对,检测数据在此范围内的分布情况。
2 结果
腔镜手术患者临床常用浓度舒芬太尼TCI的药动学可用三室模型描述,药动学参数见表1。年龄、性别、身高、体重、体重指数、手术时间、麻醉时间、TCI时间和舒芬太尼总用量等协变量对药动学参数无显著性影响。
最终模型的验证:自举法得到的参数中位数及其95%CI见表1。可见自举法得出的中位数与最终NONMEM法模型估计值基本一致,说明最终模型稳定可靠。数据的VPC结果见图1,模型1000次仿真得到的95%预测区间能够覆盖大部分观测数据,仿真结果与观测值一致,表明最终模型准确性和预测性良好。
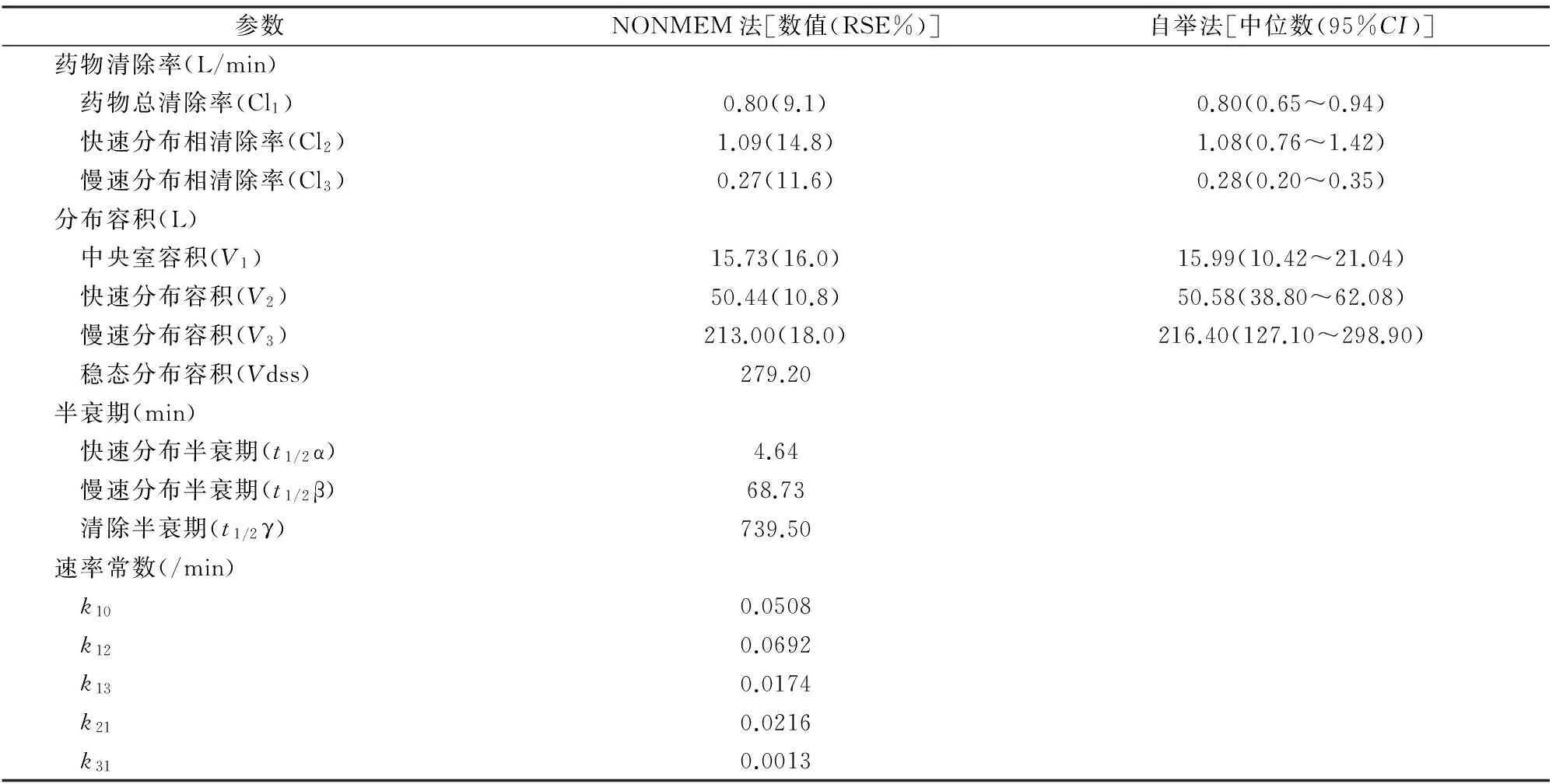
表1 舒芬太尼靶控输注药动学模型参数
NONMEM:非线性混合效应模型(nonlinear mixed-effect model);RSE:相对标准误(relative standard error);CI:置信区间(confidential interval)
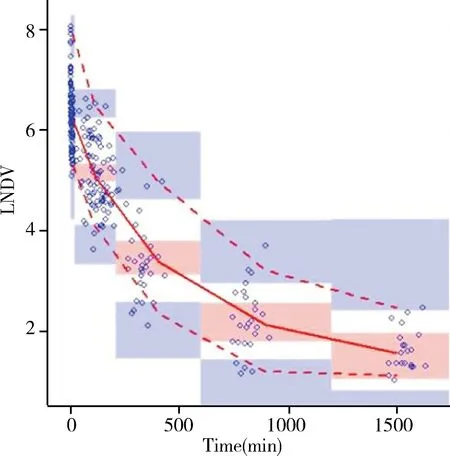
图1 可视化预测检验图(半自然对数坐标图) LNDV:ln of dependent variable,因变量的自然对数值,即血药浓度(ng/L)的自然对数值;Time:给药后时间注:图中蓝色空心圆圈为观测数据,红色虚线和红色实线分别为观测数据(即实测舒芬太尼血药浓度)和预测数据(最终模型预计的血药浓度)的2.5%、97.5%以及50%分位数线,蓝色阴影和红色阴影分别为2.5%、97.5%以及50%预测分位数线的95%置信区间。由图可知,最终模型的准确性和预测性良好
3 讨论
临床常用浓度舒芬太尼TCI的靶浓度为0.2~1 μg/L[21],本研究选择临床常用浓度舒芬太尼TCI(Ce=0.2~0.4 μg/L),复合吸入七氟烷,用于腔镜手术的全身麻醉。TCI以效应室药物浓度为靶浓度(Ce),与以血浆浓度为靶浓度相比,可以更快地达到血浆与效应室药物浓度的平衡(即稳态浓度),而且舒芬太尼具有良好的血流动力学稳定性,故本研究选择以舒芬太尼效应室浓度为靶浓度。
研究证实[16,17],LC-MS/MS精确度和灵敏度高,可用于临床血药浓度的测定及药动学研究。本研究测定舒芬太尼血药浓度的最低检测限为2 ng/L(线性范围内)。关于药动学研究取血样的持续时间,Gepts等[13]提出,为准确计算舒芬太尼终末消除相,取血样应至少至停药后24 h。因此,本研究取动脉血样至停药后24 h。
群体药动学[22,23]将经典的药动学基本原理与统计学模型结合,分析药动学特征中存在的变异性,研究药物体内的群体规律、药动学参数的统计分布及影响因素。由于群体各受试对象的遗传、环境及个体特征等的差异,使群体药动学参数具有很大的个体间变异及个体自身变异。与经典方法相比,群体药动学只需要每个个体提供稀疏血样即可分析,提高了临床研究的可行性。
NONMEM法将所有患者个体间的变异(随机效应)与患者自身影响因素(固定效应),如年龄、性别和体重等因素统一考察,构建群体药动学模型,可排除因样本量小和个别样本测量准确性差造成的误差[18,19,24,25]。
本研究与Gepts等[13]研究得出的舒芬太尼药动学主要参数值近似:本研究中,V1=15.7 L,t1/2γ=739.5 min;Gepts等[13]研究中V1=14.3 L,t1/2γ=769 min。本研究中,30例患者平均年龄43.8岁,平均体重66.7 kg;Gepts等[13]研究中,23例患者平均年龄47岁,平均体重67.8 kg。两研究对象的年龄和体重相似。
我们既往的研究[12]应用Bovill等[11]舒芬太尼药动学参数的TCI系统,探讨高浓度舒芬太尼TCI的药动学。入选12例患者,平均年龄56岁,平均体重53.8 kg,施行长时间手术(平均手术时间6.7 h),平均舒芬太尼用量7.2 μg/kg。得出药动学参数为:V1= 5.4 L,t1/2γ=271.8 min。本研究采用Gepts等模型得出的舒芬太尼药动学参数与之前[12]应用Bovill等模型的研究结果有一定差异,可能由于TCI系统、药动学模型、靶浓度、手术类型以及受试者人群的不同,会对研究结果产生影响。
不同腹腔镜手术的手术时间和麻醉时间不同,这对药动学参数有无影响是值得关注的问题。本研究30例手术时间0.55~5.08 h。在Gepts等[13]的研究中,手术时间0.5~14 h,结果表明年龄和体重对药动学参数无影响,但未提及手术时间和麻醉时间对药动学参数有无影响。在Hudson等[26]的研究中,手术时间(227±70)min,结果显示,手术时间对药动学参数无显著影响。本研究组[12]曾经探讨采用高浓度舒芬太尼TCI用于长时间手术[3.5~12.7 h,(6.7±2.6) h]的药动学,随后的分析[27]结果表明,手术时间对药动学参数无显著影响,与Hudson等[26]的结果一致。
本研究的临床意义在于,初步分析了临床常用浓度舒芬太尼TCI用于国人腔镜手术全麻的药动学规律,为临床麻醉提供参考。腹腔镜手术多数需要CO2气腹,有增加应激反应和导致高碳酸血症的可能性。强效镇痛药舒芬太尼在抑制应激反应方面有一定优势,但其兼具中长效阿片类药的特点。因而,在采用临床常用浓度舒芬太尼TCI时,应提前停药(根据手术进程、靶浓度和TCI系统预计患者苏醒时间等);同时术中应密切监护,适当调整呼吸参数,防治高碳酸血症,维持内环境稳定,以免影响舒芬太尼和其他麻醉药的代谢和消除,使患者平稳、迅速地苏醒。
分析本研究与既往研究舒芬太尼药动学的结果,可见影响舒芬太尼药动学的因素复杂多样,尚需综合考虑,不断探索,深入研究,以期为临床合理用药提供可靠的依据。
1 Struys MM,De Smet T,Glen JI,et al.The history of target-controlled infusion.Anesth Analg,2016,122(1):56-69.
2 Short TG,Hannam JA,Laurent S,et al.Refining target-controlled infusion:an assessment of pharmacodynamic target-controlled infusion of propofol and remifentanil using a response surface model of their combined effects on bispectral index.Anesth Analg,2016,122(1):90-97.
3 Kawano S,Okada H,Iwamuro M,et al.An effective and safe sedation technique combining target-controlled infusion pump with propofol,intravenous pentazocine,and bispectral index monitoring for peroral double-balloon endoscopy.Digestion,2015,91(2):112-116.
4 Liu Y,Li M,Yang D,et al.Closed-loop control better than open-loop control of profofol TCI guided by BIS:a randomized,controlled,multicenter clinical trial to evaluate the CONCERT-CL closed-loop system.PLoS One,2015,10(4):e0123862.
5 Jeleazcov C,Saari TI,Ihmsen H,et al.Changes in total and unbound concentrations of sufentanil during target controlled infusion for cardiac surgery with cardiopulmonary bypass.Br J Anaesth,2012,109(5):698-706.
6 Bhavsar R,Sloth E,Folkersen L,et al.Sufentanil preserves hemodynamics and left ventricular function in patients with ischemic heart disease.Acta Anaesthesiol Scand,2011,55(8):1002-1009.
7 Ji M,Tao J,Cheng M,et al.Endotracheal administration of sufentanil and tetracaine during awake fiberoptic intubation.Am J Ther,2016,23(1):e92-e97.
8 Abdollahpour A,Azadi R,Bandari R,et al.Effects of adding midazolam and sufentanil to intrathecal bupivacaine on analgesia quality and postoperative complications in elective cesarean section.Anesth Pain Med,2015,5(4):e23565.
9 Li B,Wang H,Gao C.Bupivacaine in combination with fentanyl or sufentanil in epidural/intrathecal analgesia for labor:a meta-analysis.J Clin Pharmacol,2015,55(5):584-591.
10 Jove M,Griffin DW,Minkowitz HS,et al.Sufentanil sublingual tablet system for the management of postoperative pain after knee or hip arthroplasty:a randomized,placebo-controlled study.Anesthesiology,2015,123(2):434-443.
11 Bovill JG,Sebel PS Blackburn CL,et al.The pharmacokinetics of sufentanil in surgical patients.Anesthesiology,1984,61(5):502-506.
12 Zhao Y,Wu XM,Duan JL,et al.Pharmacokinetics of sufentanil administered by target-controlled infusion in Chinese surgical patients.Chin Med J,2009,122(3):291-295.
13 Gepts E,Shafer SL,Camu F,et al.Linearity of pharmacokinetics and model estimation of sufentanil.Anesthesiology,1995,83(6):1194-1204.
14 吴 琼,赵 艳,郭向阳.舒芬太尼及其靶控输注的药代动力学研究进展.中国微创外科杂志,2013,13(10):941-943.
15 王 靖,杨承祥,王汉兵,等.舒芬太尼TCI系统用于心脏手术患者CPB结束至术毕的准确性.中华麻醉学杂志,2014,34(10):1231-1233.
16 Manfio JL,Santos VJ,Lanchote VL,et al.Development and validation of an HPLC/MS/MS method for the determination of sufentanil and morphine in human plasma.J AOAC Int,2011,94(1):136-142.
17 Nosseir NS,Michels G,Binder P,et al.Simultaneous detection of ketamine,lorazepam,midazolam and sufentanil in human serum with liquid chromatography-tandem mass spectrometry for monitoring of analgosedation in critically ill patients.J Chromatogr B Analyt Technol Biomed Life Sci,2014,12,973C:133-141.
18 Choi L,Ferrell BA,Vasilevskis EE,et al.Population pharmacokinetics of fentanyl in the critically ill.Crit Care Med,2016,44(1):64-72.
19 Bi SS,Deng CH,Zhou TY,et al.Remifentanil-sevoflurane interaction models of circulatory response to laryngoscopy and circulatory depression.Br J Anaesth,2013,110(5):729-740.
20 Wesley MC,Pereira LM,Scharp LA,et al.Pharmacokinetics of tranexamic acid in neonates,infants,and children undergoing cardiac surgery with cardiopulmonary bypass.Anesthesiology,2015,122(4):746-758.
21 Pandin PC,Cantraine F,Ewalenko P,et al.Predictive accuracy of target-controlled propofol and sufentanil coinfusion in long-lasting surgery.Anesthesiology,2000,93(3):653-661.
22 Sherwin CM,Kiang TK,Spigarelli MG,et al.Fundamentals of population pharmacokinetic modelling:validation methods.Clin Pharmacokinet,2012,51(9):573-590.
23 Bonate PL,Strougo A,Desai A,et al.Guidelines for the quality control of population pharmacokinetic-pharmacodynamic analyses:an industry perspective.AAPS J,2012,14(4):749-758.
24 Mallaysamy S,Johnson MG,Rao PG,et al.Population pharmacokinetics of lamotrigine in Indian epileptic patients.Eur J Clin Pharmacol,2013,69(1):43-52.
25 Wiczling P,Bienert A,Sobczyński P,et al.Pharmacokinetics and pharmacodynamics of propofol in patients undergoing abdominal aortic surgery.Pharmacol Rep,2012,64(1):113-122.
26 Hudson RJ,Bergstrom RG,Thomson IR,et al.Pharmacokinetics of sufentanil in patients undergoing abdominal aortic surgery.Anesthesiology,1989,70(3):426-431.
27 Zhao Y,Duan JL,Wu XM,et al.Two-stage analysis of pharmacokinetics of sufentanil administered by target-controlled infusion in Chinese patients. Chin Med J,2009,122(17):1979-1984.
(修回日期:2016-09-26)
(责任编辑:王惠群)
Pharmacokinetic Study of Sufentanil Administered by Target-controlled Infusion in Patients Undergoing Endoscopic Surgery
LiuWei,ZhaoYan*,WuQiong*,etal.
*DepartmentofAnesthesiology,PekingUniversityThirdHospital,Beijing100083,China
ZhaoYan,E-mail:zhaoyan2004@263.net
Objective To study the pharmacokinetics of sufentanil administered by target-controlled infusion (TCI) at commonly used concentrations in patients undergoing endoscopic surgery. Methods The pharmacokinetic parameters of sufentanil TCI were investigated in 30 patients (ASA Ⅰ or Ⅱ), aged 24-65 years old, scheduled for elective endoscopic surgery under general anesthesia. Induction of anesthesia was started with sufentanil TCI, and target effect-site concentrations of sufentanil were randomly set at 0.2, 0.3 or 0.4 μg/L in each 10 cases, respectively. Anesthesia was maintained with sufentanil TCI, inhalation of sevoflurane and intermittent injection of rocuronium as needed to maintain muscle relaxation. Arterial blood samples were gathered at specific intervals from the beginning of TCI to 24 h after TCI. Plasma concentrations of sufentanil were measured by liquid chromatography-mass spectrometry/mass spectrometry (limit of quantitation was 2 ng/L). The population pharmacokinetic data of sufentanil were analyzed with the nonlinear mixed-effect model. Results The pharmacokinetic pattern of sufentanil TCI was described as a three-compartment model with the following parameters: volume of the central compartment (V1)=15.7 L, volume of the rapidly equilibrating compartment (V2) = 50.4 L, volume of the slowly equilibrating compartment (V3)=213.0 L, volume of distribution at steady state (Vdss) = 279.2 L, total drug clearance (Cl1) = 0.80 L/min, rapid intercompartmental clearance (Cl2) = 1.09 L/min, slow intercompartmental clearance (Cl3) = 0.27 L/min, rapid distribution half-time (t1/2α) = 4.6 min, slow distribution half-time (t1/2β) = 68.7 min, and elimination half-time (t1/2γ) = 739.5 min. No significant relations to age, gender, or body weight were found for any of the pharmacokinetic parameters (P>0.05). Conclusions The pharmacokinetics of sufentanil TCI at commonly used concentrations in patients undergoing endoscopic surgery can be optimally described by a three-compartment model. No significant relations to age, gender, or body weight are found for any of the pharmacokinetic parameters.
Sufentanil; Target-controlled infusion; Pharmacokinetics; Nonlinear mixed-effect model; Liquid chromatography-mass spectrometry/mass spectrometry
北京大学第三医院中青年骨干基金项目(65476-01)
A
1009-6604(2016)12-1131-05
10.3969/j.issn.1009-6604.2016.12.018
2016-07-23)
**通讯作者,E-mail:zhaoyan2004@263.net
①(北京大学第三医院药剂科,北京 100083)
②(北京大学药学院,北京 100083)

