门冬胰岛素晶体的稳定性试验研究
蒋振东,曹春来,马 瑞,杨 琳,卢 巍
(1.遵义医学院珠海校区 人体解剖与组胚学教研室,广东 珠海 519041;2.珠海联邦制药有限公司 生物研究所,广东 珠海 519040)
基础医学研究
门冬胰岛素晶体的稳定性试验研究
蒋振东1,曹春来2,马 瑞2,杨 琳1,卢 巍1
(1.遵义医学院珠海校区 人体解剖与组胚学教研室,广东 珠海 519041;2.珠海联邦制药有限公司 生物研究所,广东 珠海 519040)
目的 本文旨在研究门冬胰岛素原料药结晶后的晶体稳定性,从而降低其在储运过程中质量变化的风险,为制剂提供稳定的原料药产品。方法 门冬胰岛素晶体冻干成粉末后,按照中国药典生物制品有关稳定性试验标准对结晶粉进行影响因素试验、加速试验和长期试验。结果 门冬胰岛素原料药晶体通过稳定性试验,检测的有关物质、高分子蛋白、含量、以及微生物限度的结果均符合中国药典标准。结论 门冬胰岛素原料药晶体不仅符合中国药典标准,而且提高了门冬胰岛素的稳定性,为胰岛素晶体原料提供有力的数据支撑。
门冬胰岛素;糖尿病;晶体;稳定性研究
目前,全球有超过3.82亿的糖尿病患者,而中国18岁以上的糖尿病患者大约有1.14亿[1]。胰岛素是目前治疗糖尿病最有效的药物,但普通胰岛素存在作用时间短、吸收变异大、作用峰值明显、低血糖发生率高等诸多问题,正日益被胰岛素类似物所替代[2]。门冬胰岛素是一种速效胰岛素类似物,是利用基因工程DNA重组技术[3-4]将人胰岛素B链第28位的脯氨酸(Pro)替换为负电荷的门冬氨酸(Asp),利用电荷的排斥作用阻止胰岛素单体或二聚体的自我聚合,使分子间的聚合减少,从而很好地模拟人胰岛素的分泌模式,达到控制血糖的效果。由于门冬胰岛素作用持续时间短,不易与下餐或者夜间胰岛素的作用发生叠加,显著减少了低血糖的发生率[5]。
门冬胰岛素的纯度、含量、杂质等各项指标必须达到国家药典的标准方可制成相应的制剂,而原料药在运输的过程中,如何保持原料药的稳定性对制成的制剂至关重要。就目前技术而言,固态胰岛素中的晶体形式无论从贮藏性能还是后续制剂配方设计等方面都优于液态形式。制备的晶体具有均一稳定的固体分子形式,冻干时间短,样品稳定性高,更适合工业化生产[6-7]。前期我们已经初步研究出门冬胰岛素原料药结晶的方法[8],本研究通过稳定性试验验证门冬胰岛素以晶体形式存在的诸多有利之处,从而解决门冬胰岛素原料在储运过程中质量变化的风险,为制剂提供稳定的原料药产品。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料 门冬胰岛素由珠海联邦制药生物研究所提供,批号:LB13020401,LB13020501,LB13020503。
1.1.2 主要仪器 美国waters-ACQUITY UPLC超高效液相色谱仪,日本岛津LC-20AT高效液相色谱仪,上海一恒科技LRH-150稳定性培养箱,天津大学精密仪器YB-2澄明度检测仪。
1.1.3 主要试剂 甘氨酸(国药集团化学试剂有限公司,批号F2012124),乙酸锌(广东光华化学厂有限公司,批号120813),水饱和酚(北京拜尔迪生物科技公司,批号2011-5. 18),乙酸(西陇化工股份有限公司,批号20120701)。
1.2 方法
1.2.1 门冬胰岛素稳定性试验的分组和指标测定 试验设门冬胰岛素结晶冻干粉为实验组、沉淀的冻干粉为对照组。沉淀的冻干粉调至pH 4.8左右,用锌离子直接调沉淀过滤冻干。两组样品检测的重点项目:①有关物质≤1.5%(指蛋白异构体、杂质),②高分子蛋白质≤1.5%,该2种物质按照《中国药典2015版第四部》—0512高效液相色谱法进行检测[9],含量采用Waters-ACQUITY UPLC高效液相色谱仪(美国Waters公司)进行检测。
门冬胰岛素蛋白纯度、含量的测定:取门冬胰岛素结晶体,用0.01 mol的盐酸配成4 mg/mL,采用超高效液相色谱(UPLC)仪进行色谱分析。色谱条件:C18反相柱,波长214 nm,柱温40 ℃,流动相A:0.2 mol/L无水硫酸钠缓冲液(NaOH调pH 3.0);腈=90:10,流动相B:50%的乙腈,流速0.21 mL/min,柱温40 ℃,进行梯度洗脱(见表1)。
表1 液相色谱法洗脱梯度表
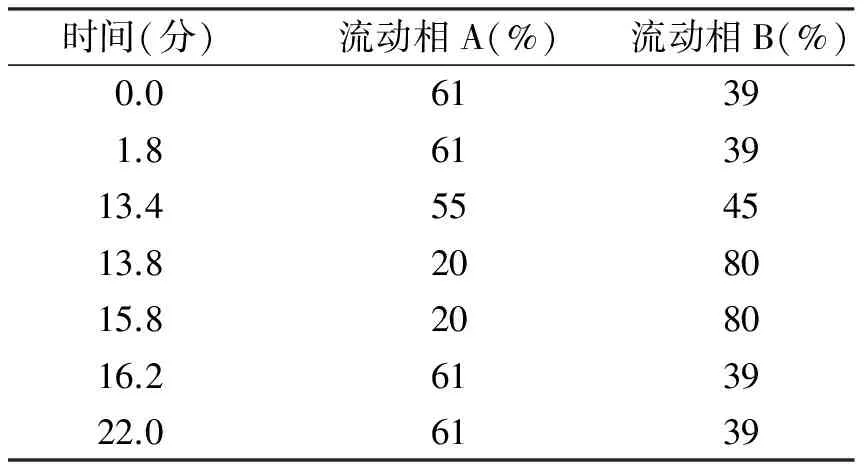
时间(分)流动相A(%)流动相B(%)0.061391.8613913.4554513.8208015.8208016.2613922.06139
样品进行UPLC检测后,记录色谱峰图,以面积归一法和外标法分别计算表达产物的纯度、含量(见图1)。
1.2.2 门冬胰岛素稳定性试验项目 按照中国药典生物制剂稳定性试验的指导原则[10],稳定性试验包括很多影响因素,主要考察了高温、高湿、光照,以及短期加速对试验样品的影响和长期稳定性试验。
高温试验:分别取实验组与对照组样品放置洁净的培养皿中,厚度不超过3 mm,放置40 ℃稳定性培养箱内。分别在3、5、10 d末取样。高温试验主要考察样品性状、有关物质、高分子蛋白质的相关变化。
高湿试验:两组实验样品的处置同高温试验。样本置于稳定性培养箱内,在相对湿度75%±5%、25 ℃条件下,分别考察放置3、5、10 d末样本的吸湿潮解状况。
强光照射试验:实验组与对照组样品培养皿置于YB-2澄明度检测仪置内,在25 ℃、光照强度(4 500±500)Lux条件下,分别考察放置3、5、10 d末样品的稳定性,特别要注意样品的外观变化。
加速试验:①实验组与对照组样品用西林瓶密封后放置在(4±2) ℃、相对湿度75%±5%的稳定性培养箱中放置6个月。在试验期间能对真实湿度和温度进行检测。分别于第1、2、3、6月末取样,按稳定性加速试验项目检测。②考虑到此样品在-20 ℃冰箱中保存,加速试验添加1组(25±2) ℃、相对湿度60%±10%条件下,分别进行第1、2、3、6月末各样品的稳定性加速试验检测。
长期试验:①实验组与对照组样品用西林瓶密封后置于(-20±2) ℃冰箱中,试验期间对真实温度进行检测。分别于0、3、6、9、12月末取样,检测项目同加速试验。②考虑到此样品在-20 ℃冰箱中保存,长期试验添加一组(4±2) ℃、相对湿度60%±10%条件下,分别检测0、3、6、9、12月末样品的稳定性。
2 结果
2.1 门冬胰岛素蛋白纯度、含量的测定 门冬胰岛素结晶后冻干样品进行UPLC检测,记录色谱峰图,以面积归一法和外标法分别计算表达产物的纯度,最后得出门冬胰岛素结晶纯度为99.64%,含量为100.2%,符合要求(见图1)。

图1 UPLC检测门冬胰岛素晶体纯度和含量色谱图
2.2 影响因素试验结果 通过10 d内的高温、高湿和强光照射试验,结果显示实验组和对照组样品的性状均未发生变化,实验组有关物质和高分子蛋白质有所增加,但仍符合药典标准(见表2~4)。
表2 高温试验结果(温度40 ℃)
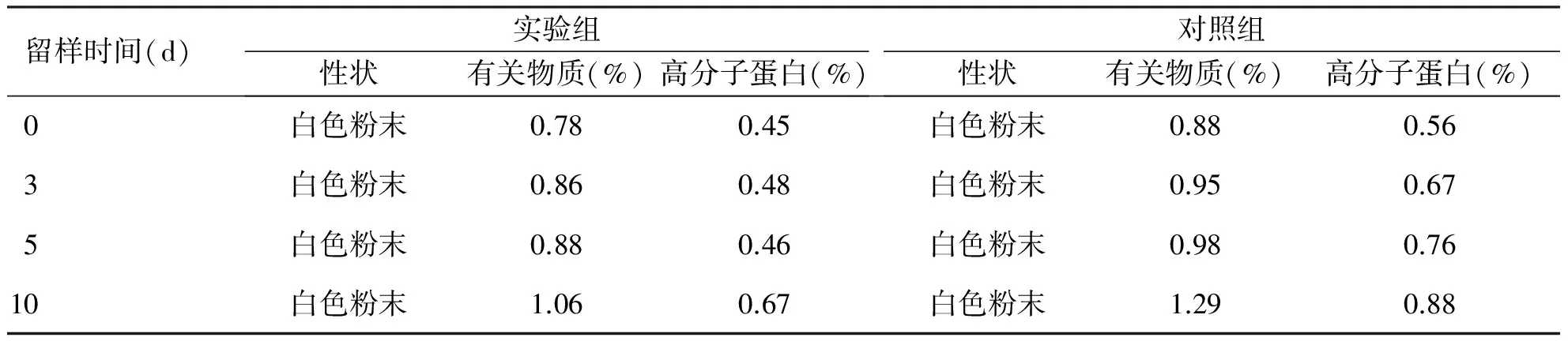
留样时间(d)实验组性状有关物质(%)高分子蛋白(%)对照组性状有关物质(%)高分子蛋白(%)0白色粉末0.780.45白色粉末0.880.563白色粉末0.860.48白色粉末0.950.675白色粉末0.880.46白色粉末0.980.7610白色粉末1.060.67白色粉末1.290.88
表3 高湿试验结果(温度25℃,湿度75%±5%)
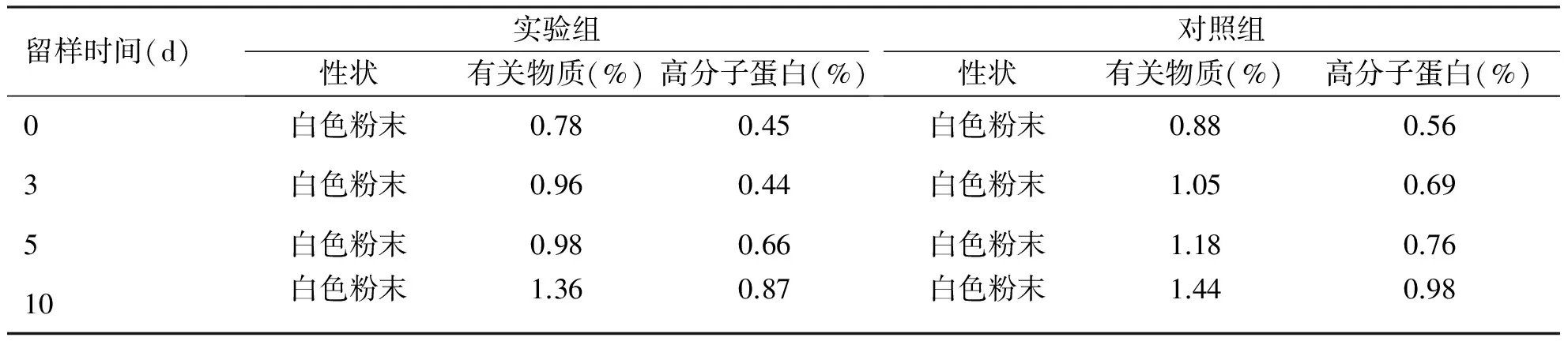
留样时间(d)实验组性状有关物质(%)高分子蛋白(%)对照组性状有关物质(%)高分子蛋白(%)0白色粉末0.780.45白色粉末0.880.563白色粉末0.960.44白色粉末1.050.695白色粉末0.980.66白色粉末1.180.7610白色粉末1.360.87白色粉末1.440.98
表4 照射试验结果[温度25 ℃,光照强度(4 500±500) Lux]
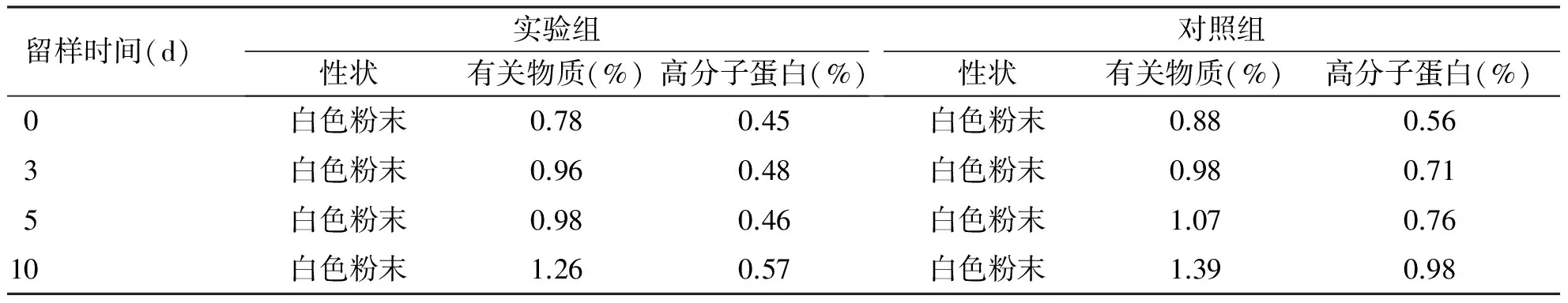
留样时间(d)实验组性状有关物质(%)高分子蛋白(%)对照组性状有关物质(%)高分子蛋白(%)0白色粉末0.780.45白色粉末0.880.563白色粉末0.960.48白色粉末0.980.715白色粉末0.980.46白色粉末1.070.7610白色粉末1.260.57白色粉末1.390.98
2.3 加速试验结果 样品在(4±2) ℃、相对湿度75%±5%条件下,通过6个月的加速试验,两组样品的性状均未发生变化,仍为白色粉末;有关物质、高分子蛋白、干燥失重、含量指标发生不同程度改变,对照组较实验组稳定性数据差(见表5)。
表5 加速试验结果[温度(4±2) ℃,相对湿度75%±5%,单位%]
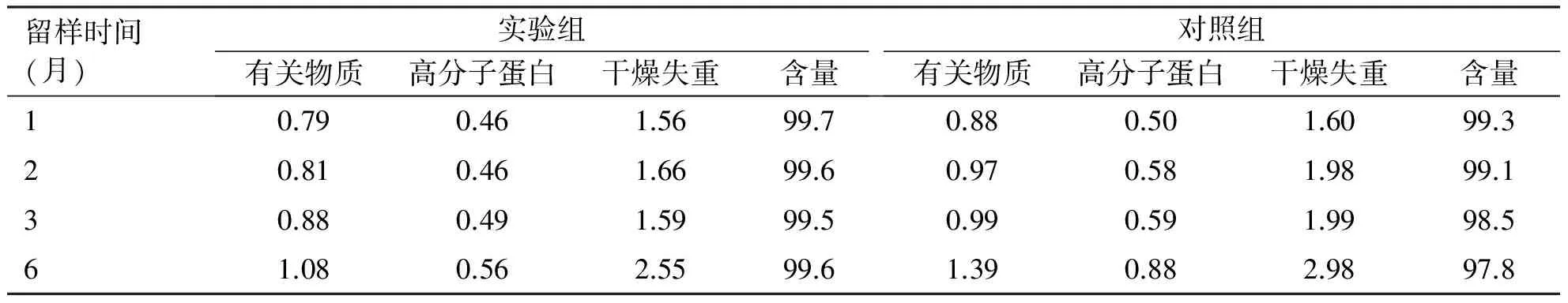
留样时间(月)实验组有关物质高分子蛋白干燥失重含量对照组有关物质高分子蛋白干燥失重含量10.790.461.5699.70.880.501.6099.320.810.461.6699.60.970.581.9899.130.880.491.5999.50.990.591.9998.561.080.562.5599.61.390.882.9897.8
在(25±2)℃、相对湿度60%±10%条件下,6个月内的加速试验结果显示,两组样品仍为白色粉末;有关物质、高分子蛋白、干燥失重、含量指标随着时间延长发生不同程度改变,至6个月时两组稳定性数据均不合格,表明样品不能在常温下保存。(见表6)。
表6 加速试验结果[温度(25±2) ℃,相对湿度60%±10%,单位%]
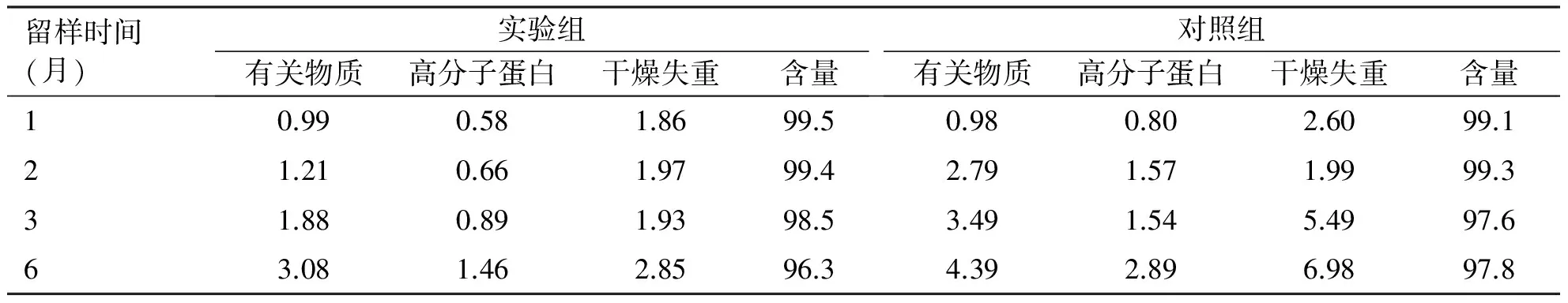
留样时间(月)实验组有关物质高分子蛋白干燥失重含量对照组有关物质高分子蛋白干燥失重含量10.990.581.8699.50.980.802.6099.121.210.661.9799.42.791.571.9999.331.880.891.9398.53.491.545.4997.663.081.462.8596.34.392.896.9897.8
2.4 长期试验结果 样品在(-20±5) ℃储藏12个月的长期试验结果显示,两组样品性状均为白色粉末,未发生变化;有关物质、高分子蛋白、干燥失重、含量等指标均变化较小,符合中国药典要求(见表7)。
表7 长期实验结果[温度(-20±5) ℃,单位%]
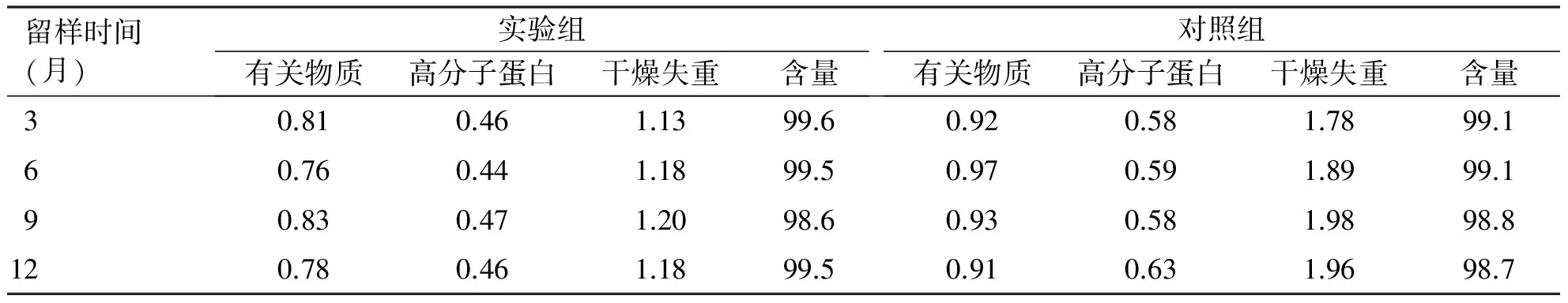
留样时间(月)实验组有关物质高分子蛋白干燥失重含量对照组有关物质高分子蛋白干燥失重含量30.810.461.1399.60.920.581.7899.160.760.441.1899.50.970.591.8999.190.830.471.2098.60.930.581.9898.8120.780.461.1899.50.910.631.9698.7
样品在(4±2)℃储藏12个月长期试验的结果显示,两组样品性状均为白色粉末,未发生变化;有关物质、高分子蛋白、干燥失重、含量指标随着时间延长发生不同程度改变,两组稳定性数据虽然均合格,但储藏至12个月时,检测指标已有较大改变,对照组的变化趋势更为明显(见表8)。
表8 长期实验结果[温度(4±2) ℃,单位%]
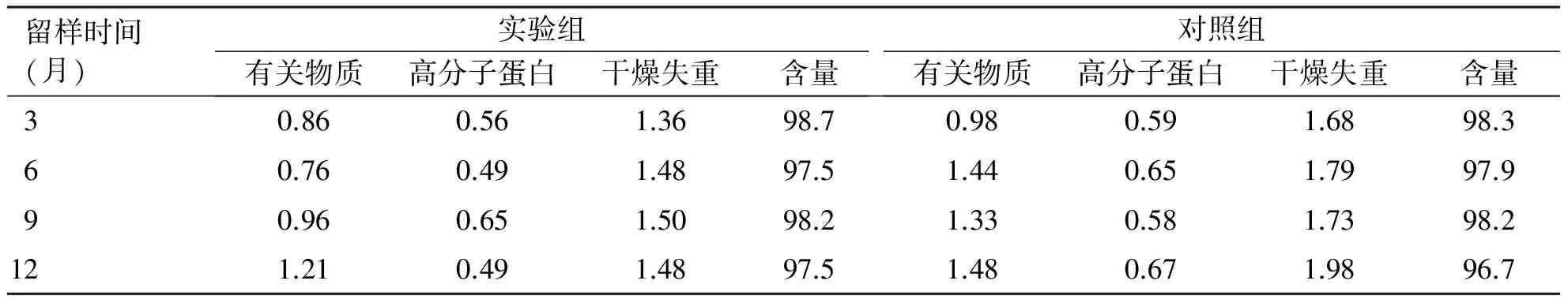
留样时间(月)实验组有关物质高分子蛋白干燥失重含量对照组有关物质高分子蛋白干燥失重含量30.860.561.3698.70.980.591.6898.360.760.491.4897.51.440.651.7997.990.960.651.5098.21.330.581.7398.2121.210.491.4897.51.480.671.9896.7
3 讨论
门冬胰岛素是一种速效胰岛素类似物,原料药的稳定性关系到糖尿病患者的生命安全。产品的纯度、含量、杂质等各项指标必须达到国家药典的标准方可制备成制剂,而原料药在储运的过程中,如何保持稳定性对制剂至关重要。通过稳定性试验检测的重点数据来看,本研究前期发明的门冬胰岛素-锌结晶的方法非常好地解决了这一问题;寻找到一套合适的体系,制备出晶型均一的晶体,晶体的稳定性非常好,特别是加速试验更能反映晶体的稳定性。从影响因素试验的测验结果来看两组样品的稳定性变化较小,表明门冬胰岛素短期发生变化的因素较小。长期试验的数据表明该药物应该冷冻保存更好,这样发生化学变化的风险较小。两组样品按照中国药典进行检测的重点项目含量(100.2%)与纯度(99.64%)达到要求,有关物质(指蛋白异构体、杂质)、高分子蛋白质分别都≤1.5%,符合中国药典标准[9]。
药品的稳定性不仅是通过稳定性试验这一方面来验证的,还要通过动物实验以及临床实验来验证,后期我们会做进一步研究。就目前技术而言,晶体形式无论从贮藏性能还是后续制剂配方设计等方面都优于液态形式;因为晶体形成了较为紧密的空间结构,容易抵御各种物理因素的破坏作用,使得门冬胰岛素冻干原料的含量进一步提升,减少原料中水份,降低发生化学反应的风险。我们通过对门冬胰岛素晶体的研究发现,门冬胰岛素晶体具有均一、稳定的固体分子形式,冻干时间短,样品稳定性高等优点;通过稳定性试验也进一步验证了门冬胰岛素结晶体系的可行性。本研究团队虽然前期发明了门冬胰岛素-锌结晶的方法,制备出晶型均一的晶体,也通过稳定性试验验证了产品的纯度不遭到破坏,指标检测符合药典质量标准[9],为制剂提供了稳定的原料药产品,降低了门冬胰岛素原料在储运过程中质量变化的风险;但是到目前为止,已获得成功并能得到质量优异的胰岛素及其类似物晶体的生产工艺仍不理想,优化结晶技术以及结晶条件是目前胰岛素及其类似物面临的问题。我们需要进一步探索优化具有应用价值的胰岛素的晶体,进而能很好的指导工业化大规模的生产,为胰岛素原料药及蛋白类药物的结晶和晶体研究提供有力的数据支撑。
[1] Xu,Y,Wang L,He J,et al.Prevalence and control of diabetes in Chinese eduits[J]. The Journal of the American Medical Association, 2013, 310(9): 948-959.
[2] 曹凤林,邓少雄. 胰岛素类似物: 糖尿病治疗的新选择[J]. 医学综述,2007,13(1) : 32-34.
[3] Warren M L,Conway M J,Klaff L J,et al. Postprandial versus preprandial dosing of biphasic insulin aspart in elderly type 2 diabetes patients[J]. Diabetes Res ClinPract,2004,66(11): 23-29.
[4] Brange J,Owens D R,Kang S,et al. Monomeric insulins and their experimentaland clinical implications[J]. Diabetes Care,1990,13(7): 923-954.
[5] Von M M,Brinkman C,Hansen T,et al. Differences in phamacokinetics and pharmacodynamics of insulin lispro and aspart in healthy volunteers[J]. Expclin Endoerinol Diabetes,2002,110(37): 416-419.
[6] 曹春来,马瑞,张家行,等. 一种稳定的门冬胰岛素结晶制备方法的研究[J]. 海峡药学,2015, 27(9): 12-15.
[7] 曹春来,马瑞,张家行,等. 门冬胰岛素结晶制备工艺的优化[J]. 医学信息,2015, 27(28):363.
[8] 马瑞,肖拥军,蒋振东,等. 一种制备稳定的门冬胰岛素结晶的方法[P]. 中国专利,2013: CN103342746A.
[9] 国家药典委员会. 中华人民共和国药典(第四部)[M]. 北京: 中国医药科技出版社, 2015:59- 62.
[10] 国家药典委员会. 中华人民共和国药典(第四部)[M]. 北京: 中国医药科技出版社, 2015:354- 356.
[收稿2016-08-23;修回2016-09-09]
(编辑:王 静)
A trial study on stability of insulin aspart crystals
JiangZhendong1,CaoChunlai2,MaRui2,YangLin1,LuWei1,
(1. Department of Human Anatomy, Histology and Embryology, Zhuhai Campus of Zunyi Medical University, Zhuhai Guangdong 519041, China; 2. Institute of Biology, Zhuhai United Laboratories Co. Ltd., Zhuhai Guangdong 519040, China)
Objective With a test on the stability of crystallized crude drugs of insulin aspart, the present article aims to prove that quality can be ensured in crystallized insulin aspart during its transfer, thus improving product stability and offering better ingredients for pharmaceutical preparations. Methods Based on the regulations on stability tests in Chinese Pharmacopoeia, factors test, accelerated test and long-term stability test on freeze-dried crystallized powers of insulin aspart were conducted. Results A test on the stability of crystallized crude drugs of insulin aspart showed the tested elements, polymer proteins, contents, microbial limits all accord with the Chinese Pharmacopoeia. Conclusion Conforming to the Chinese Pharmacopoeia, crystallized crude drugs of insulin aspart can improve the stability of insulin aspart, which offers data support for the crystallization of insulin crude drugs and protein drugs as well as for future studies on crystals.
insulin aspart; diabetes; crystals; stability study
2012财政部蛋白类生物药和疫苗发展专项(NO:2012-16);遵义医学院硕士启动基金资助项目(NO:F-731);遵义医学院校内招标课题资助项目(NO:[2015]F-791)。
曹春来,男,硕士,高级工程师,研究方向:生物技术药物的研究与管理,E-mail:caochunlaixs@163.com。
R977.6
A
1000-2715(2016)05-478-05

