人源脐带间充质干细胞移植治疗大鼠佐剂骨关节炎的对照研究
蒋峰 杨孝兵 张帆 寿旗扬 徐志国
人源脐带间充质干细胞移植治疗大鼠佐剂骨关节炎的对照研究
蒋峰 杨孝兵 张帆 寿旗扬 徐志国
目的 探讨人源脐带间充质干细胞(hUc-MSCs)治疗大鼠佐剂骨关节炎(OA)的价值。方法 将42只大鼠按抽签法分为7组,G组为正常对照组,其余6组进行右后肢膝关节注射0.1%碘乙酸0.1ml造模;A组造模后第6周处死(空白对照);B组造模后第6周注射0.9%氯化钠溶液,第10周处死;C组造模后第6、8周2次注射0.9%氯化钠溶液,第12周处死;D组造模后第6周1次关节腔注射hUc-MSCs,第10周处死;E组造模后第6、8周2次关节腔注射hUc-MSCs,第12周处死;F组造模后第6、8周2次尾静脉注射hUc-MSCs,第12周处死;各组大鼠造模前后和注射后测定关节肿胀度和疼痛评分;处死后取关节组织病理检查。结果 D、E组较B、C组的关节肿胀度均有减小,E组的消肿作用更显著;而F组的消肿作用不明显;D、E组关节疼痛评分较B、C组均有缓解,E组止痛作用更显著;F组的止痛作用与E组相当。Mankin关节软骨病理分级积分结果提示:D组与B组比较无统计学差异;F组低于C组;而E组低于F组。病理检查提示:A组造模后第6周关节组织病理检查类似于OA病理表现,无宿主与移植物的相互排斥反应发生;B组表现类似A组,C组关节病理破坏较B组重;D组滑膜重度增生侵入关节腔,炎症细胞浸润,其病理破坏较A组重,较C组轻,并且软骨染色较浅;E组滑膜增生和炎症较D组轻,软骨染色较D组更浅;F组关节病理表现与E组基本相仿;在饲养、造模、注射、观察的实验过程中,无明显局部或者全身的宿主与移植物相互排斥反应发生,未发现注射部位、关节感染、坏死等不良反应,无意外疾病和死亡发生。结论 2次关节腔注射和尾静脉注射hUc-MSCs均能较好缓解碘乙酸佐剂OA的疼痛,改善滑膜炎症,修复软骨等作用,而且2次关节腔注射hUc-MSCs能更明显能消除关节肿胀,减轻滑膜炎症和软骨损害的病理改变;无明显的不良反应发生;hUc-MSCs治疗OA具有良好的有效性和安全性。
人源脐带间充质干细胞 佐剂 骨关节炎 实验性 移植注射
骨关节炎(osteoarthritis,OA)已成为中老年人群慢性致残,丧失工作能力的第2位原因[1]。OA的病理表现以关节软骨退化、破溃和脱落以及周围软组织炎症、骨质增生为特征;由于关节软骨缺乏血管和神经,且软骨细胞包裹在致密的软骨基质中,不易迁移至损伤区域参与修复,探索软骨损伤修复新方法一直是临床研究的热点问题[2],对于内科非手术治疗无效、伴有关节功能障碍的重度OA,主要通过关节镜手术、开放手术或关节置换术等治疗,但由于手术治疗本身的创伤、疗效的不确定性和术后长期卧床引起的肌肉萎缩、骨质疏松、严重感染、静脉血栓等并发症,使近期和远期疗效均不甚满意。如何从OA病因学入手,解决软骨的再生问题一直是临床医师追求的目标[3]。1994年Brittberg[4]就尝试将自体软骨细胞移植用于治疗膝关节病的软骨缺损,由于软骨细胞来源有限、生物学功能不易保持,而且取材困难、提取细胞的部位会出现软骨损伤和缺损,形成新的软骨损伤等因素,限制了临床的实际应用。因此,近年来研究由对软骨缺损的修复转向干细胞。脐带间充质干细胞(hUc-MSCs)具有获取容易、扩增能力强、归巢性良好、分化为软骨细胞的潜能、无致瘤性、无医学伦理学争议等诸多优点,作为软骨修复的种子细胞具有巨大应用价值[5]。为探讨hUc-MSCs治疗OA的效果,笔者建立大鼠膝关节佐剂OA模型,观察膝关节腔和尾静脉移植注射hUc-MSCs对减轻膝关节肿胀疼痛的疗效以及对受损软骨修复作用和不良反应,现报道如下。
1 材料和方法
1.1 材料 hUc-MSCs由国家干细胞工程产品产业化华东基地、协和华东干细胞基因工程有限公司提供;Wistar雄性大鼠42只,体重200~250g,由浙江中医药大学动物实验研究中心提供,SPF级(合格证编号:2008001628775);清洁级标准饲养。
1.2 方法
1.2.1 实验动物分组和模型制备 按抽签法将42只大鼠分为A~G 7组,每组6只。造模前禁食12h并称重记录,腹腔注射3%戊巴比妥钠溶液(按30mg/kg注射)麻醉;麻醉后仰卧位固定;选择大鼠右后肢膝关节,腔内注射0.1ml的0.1%碘乙酸溶液造模,1周即可引起软骨细胞区域性变性和坏死,软骨基质降解[6],其症状、体征、病程变化和病理表现与OA表现相近[7]。造模后,注射关节部位无菌包扎(不固定)后置于笼内自由活动。
1.2.2 处理方法 A组:造模后第6周按要求测定关节肿胀度、疼痛评分后处死,取关节组织作病理检查;B组:造模后第6周关节腔注射0.9%氯化钠溶液,第10周测定关节肿胀度、疼痛评分后处死,取关节组织作病理检查;C组:造模后第6、8周关节腔注射0.9%氯化钠溶液,第12周测定关节肿胀度、疼痛评分后处死,取关节组织作病理检查;D组:造模后第6周关节腔注射hUc-MSCs,第10周(即注射hUc-MSCs细胞后4周)测定关节肿胀度、疼痛评分后处死,取关节组织作病理检查;E组:造模后第6、8周分别关节腔注射hUc-MSCs,第12周测定关节肿胀度、疼痛评分后处死,取关节组织作病理检查;F组:造模后第6、8周分别尾静脉注射hUc-MSCs,第12周测定关节肿胀度、疼痛评分后处死,取关节组织作病理检查;G组(正常对照组):与6组实验组同时饲养,第6、12周测定关节肿胀度和疼痛评分后处死,取关节组织作病理检查。
1.2.3 注射方法
1.2.3.1 膝关节腔注射方法 将大鼠固定在手术台上,膝关节皮肤局部消毒后使用1ml无菌注射器行膝关节腔注射,每次注射0.9%氯化钠液0.2ml或者移植注射hUc-MSCs细胞1.0×105/ml(约0.2ml)。无菌包扎并标记后置于笼内自由活动,膝关节不固定。
1.2.3.2 大鼠尾静脉注射方法 将大鼠固定在手术台上,尾部局部消毒后使用1ml无菌注射器行尾静脉注射,每次移植注射hUc-MSCs细胞1.0×105/ml(约0.2 ml)。
1.3 大鼠移植注射后的疗效评估时间和方法 (1)关节肿胀度测定:在造模前和造模第4、6、8、10、12周时,采用足趾容积测量仪准确测量并记录每只受试大鼠的足趾容积,计算肿胀度(肿胀度△ml=实验后容积-实验前容积)[8]。(2)关节疼痛:在造模前和造模第4、6、8、10、12周时,将大鼠装进特制的透明塑料筒内,放
于特制的铁架上,尾部和实验的膝关节、后腿伸出筒外,稳定3min后进行测定,将膝关节缓慢伸直,再屈曲膝关节,每隔5s进行1次,共5次。屈曲关节时动物若出现嘶叫或短促而明显的缩腿反应评分为1分,无反应为0分。记录其嘶叫和缩腿评分,每次合计评分为0~5分[9]。
1.4 病理切片的制作 大鼠处死后,取实验膝关节,矢状位切取3mm厚带软骨下骨质的关节软骨,包括关节两端的小段骨组织,尽量剥离附着的肌肉,在中性甲醛溶液中固定72h,于100ml/L硝酸甲醛溶液混合液(100ml/L硝酸+100ml/L中性甲醛溶液+双蒸水补足1L)中脱钙48h,常规脱水,石蜡包理,5μm厚连续切片,分别采用苏木精-伊红染色(HE染色)和番红-固绿染色(SO/FG染色),光学显微镜下观察。
1.5 软骨病理评分 参照Mankin关节软骨病理评分标准进行分级评定:(1)结构评分:正常0分,表层有破坏1分,血管翳与表层破坏2分,浅层裂隙形成到达移行层3分,裂隙局限性深达骨质辐射层4分,深达骨质钙化层缺损负重区5分,全层软骨缺损6分。(2)细胞评分:正常0分,细胞过多、紊乱1分,细胞成簇2分,细胞少3分。(3)SO/FG染色:正常0分,轻度失染1分,中度失染2分,重度失染3分,完全失染4分。(4)潮线的完整性:完整0分,不完整、有血管通过1分。总分0~14分,正常0~2分,轻度病变3~7分,中度病变8~11分,重度病变12~14分,
1.6 统计学处理 应用SPSS19.0统计软件,计量资料采用表示,两组间比较采用t检验,多组间比较采用方差分析,两两比较采用LSD-t检验。
2 结果
2.1 造模前后大鼠的不良反应 42只大鼠在饲养、造模、注射、观察过程中,无明显局部或全身的宿主与移植物排斥反应,未发现关节静脉注射部位感染、坏死等不良反应,无意外疾病和死亡发生。
2.2 各组大鼠关节足趾容积和肿胀度的比较 见表1。
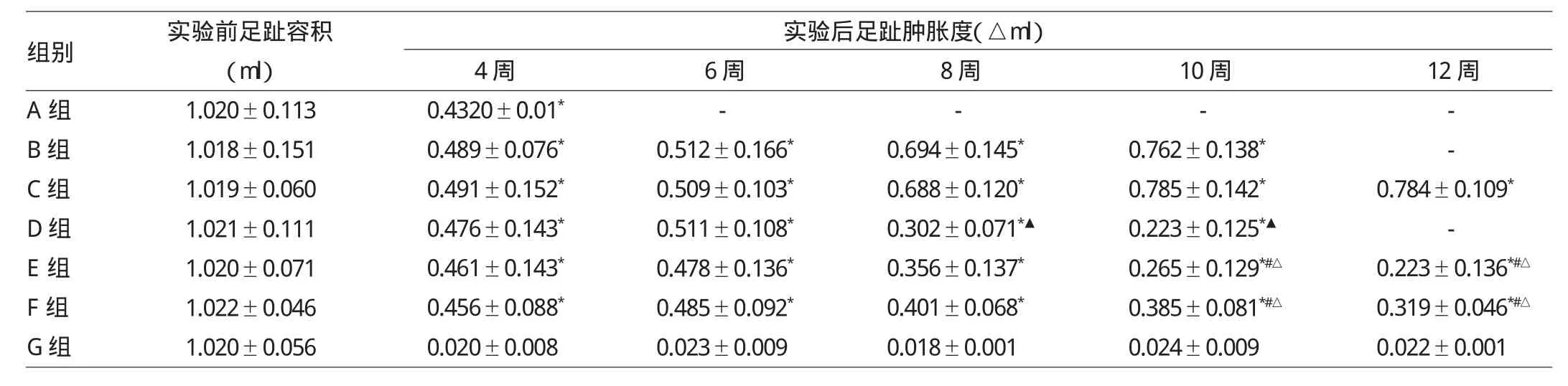
表1 各组大鼠关节足趾容积和肿胀度的比较
由表1可见,D组关节肿胀度较B组小,差异有统计学意义(P<0.05);E组较C组关节肿胀度小,差异有统计学意义(P<0.01);F组较C组关节肿胀度小,差异无统计学意义(P>0.05)。
2.3 各组大鼠关节疼痛评分的比较 见表2。

表2 各组大鼠关节疼痛评分的比较(分)
由表2可见,D组关节疼痛评分较B组减小,差异有统计学意义(P<0.05);E组关节疼痛评分较C组减小,差异有统计学意义(P<0.01);F组关节疼痛评分较C组减小,差异有统计学意义(P<0.05);F组关节疼痛评分较E组减小,差异无统计学意义(P>0.05);E组关节疼痛评分较D组低,差异有统计学意义(P<0.05)。
2.4 各组大鼠关节软骨病理评分与病理检查结果
2.4.1 各组大鼠的关节软骨病理评分的比较 见表3。
2.4.2 各组大鼠关节组织病理检查 G组光镜下关节面光滑、无滑膜增生、无炎症细胞浸润;A组光镜可见关节面欠光滑,细胞坏死、炎症细胞浸润和滑膜增生,无宿主与移植物的相互排斥反应发生,类似于OA病理表现,提示造模方法成功;B组、C组光镜下,B组表现类似A组,提示造模后第6周注射0.9%氯化钠溶液不改变造模后的关节病理影响,C组关节病理破坏较B组重,说明随着时间延长,关节破坏进行性加重;D组病理表现滑膜重度增生侵入关节腔,炎症细胞浸润,其软骨破坏较A组重,较C组轻,并且软骨染色较浅;E组关节滑膜增生和炎症细胞浸润较D组轻,软骨染色较D组更浅,提示关节腔注射hUc-MSCs细胞,对佐剂OA具有减轻炎症、修复软骨的作用,2次注射较1次注射疗效更好;F组关节病理表现软骨着色深,呈紫红色,滑膜增生和炎症细胞浸润与E组基本相仿,提示静脉2次注射hUc-MSCs与关节腔2次注射hUc-MSCs,疗效相当,具有同样的减轻佐剂OA病理炎症、修复软骨的作用(见图1-7,见插页)。
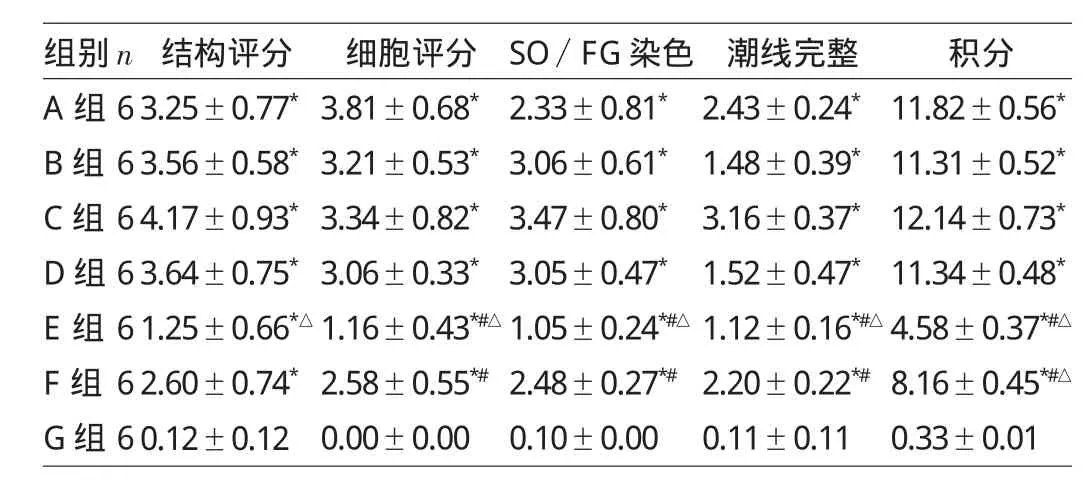
表3 各组大鼠Mankin关节软骨病理评分的比较(分)
3 讨论
目前认为OA的发病是多因素的,至少与机械性、生物性以及免疫性炎症相关,具体机制尚未十分清楚,可能是由于骨的重塑部位软骨损伤、骨膜炎症、骨质增生所致,也可能是软骨下骨质的微创伤、微骨折刺激滑膜、关节囊炎症,各种炎性细胞因子包括前列腺素、白三烯、IL-1、IL-6的释放,引起周围肌肉痉挛疼痛、软组织炎症,造成骨内压增高、骨血供减少,甚至发生缺血坏死[10]。目前OA的治疗方法主要以控制炎症和疼痛症状为主,即使患者症状缓解,仍然没有逆转其病理过程,其关节软骨难以修复,长期疗效不甚满意,近年来越来越多的学者开始关注hUc-MSCs在内的干细胞治疗[11]。
hUc-MSCs起源于中胚层,是干细胞家族的重要成员之一,是成体干细胞的一种,曾被称为塑料贴壁细胞或成纤维细胞集落形成单位,能分化为中胚层的多种成熟组织细胞,如骨、软骨、脂肪、肌肉、软骨和血管内皮等。有研究表明hUc-MSCs表达低水平MHC-II类分子和Fas配体,不表达MHC-I类分子,也不表达共刺激分子B7-1、B7-2、CD40和CD40L[12],所以hUc-MSCs免疫原性非常弱,不激活异基因活化的T淋巴细胞,只有很低的免疫原性和抗原提呈能力,由于人源脐带来源广泛、获取容易,加上具有较好的成软骨潜力,并能通过分泌多种保护性生物活性因子,防止和延缓软骨组织进一步破坏和免疫调节等改善局部微环境的功能,同时具有刺激剩余软骨祖细胞原位再生的能力,以及良好的扩增能力强、归巢性、非致瘤性、无医学伦理学争议等优点,hUc-MSCs已为细胞疗法中的主要选择细胞[13-14]。
有研究表明大鼠膝关节腔注射碘乙酸,可引起大鼠膝关节胫骨平台和股骨裸处软骨全层性的炎性改变,方法简便、创伤小、发展较快、重复性好,能较好模拟人的膝关节OA表型[6-7,15]。本实验大鼠膝关节腔注射碘乙酸后的关节病理检查,可以看到关节面毛糙,细胞坏死和滑膜增生,炎症细胞浸润,同时随着时间延长,关节破坏进行性加重,类似于OA表现,同时碘乙酸诱发的大鼠膝关节有较好的均一性和可比性。
本实验采用碘乙酸佐剂制备OA动物模型,观察发现2次关节腔注射和尾静脉注射hUc-MSCs均能有效缓解关节疼痛,改善滑膜炎症,修复软骨等作用,而且2次关节腔注射hUc-MSCs能更明显消除关节肿胀,减轻滑膜炎症和软骨损害的病理改变;实验中无明显的不良反应发生;进而证实hUc-MSCs治疗OA具有良好的有效性和安全性。本研究存在的主要不足是研究还处于大鼠动物实验阶段;对hUc-MSCs减轻炎症的机制,特别是炎性因子的变化不明了;软骨细胞再生和(或)软骨祖细胞原位再生,以及受损关节软骨修复过程和机制不清。
综上所述,hUc-MSCs能有效缓解骨关节炎疼痛,改善滑膜炎症,修复软骨等,具有较高的安全性和疗效,值得进一步推广和深入研究。
[1]Prade R F,李海峰.膝关节骨关节炎治疗新进展[J].美国医学会杂志(中文版),2000,19(2):90-92.
[2]Galle J,Bader A,Hepp,et al.Mesenchymalstem cells in cartilage repair:state of the art and methods to monitor cellgrowth,differentiation and cartilage regeneration[J].J Curr Med Chem,2010, 17(21):2274-2291.
[3]McCarberg B,Tenzer P.Complexities in the pharmacologic management of osteoarthritis pain[J].Curt Med Res Opin,2013,29 (5):539-548.
[4]Brittherg M,LindahlA,Nilsson A,et al.Treatment ofdeep cartilagedefects in the knee with autologous chondrocyte transplantation [J].N EnglJ Med,1994,331(14):888-899.
[5]Guzmxn R E,Evans M G,Boves S.Mono iodoacctate induced histologic changes in subchondral bone and articular cartilage of rat femorotibial joints;an animal model of osteoarthritis[J].Toxicol Pathol,2003,31(6):619-624.
[6]Pomonis J D,Boulet J M,Gottshall S L,et al.Development and pharmacological characterization of a rat model of osteoarthritis pain[J].Pain,2005,114(3):339-346.
[7]Guingamp C,Gegout Pottie P,Philippe L.Mono-iodoacetate-induced experimentalosteoarthritis:a dose-response study of loss of mobility,morphology,and biochemistry[J].Arthritis Rheum, 1997,40(9):1670-1679.
[8]冯芳,丁志健,刘俊.佐剂性关节炎大鼠模型的实验研究[J].天津药学, 2004,16(2):1-3.
[9]刘端勇,赵海梅,左志琴.全蝎娱蛤对胶原免疫性关节炎大鼠的关节损伤改善作用[J].中药药理与临床,2012,28(4):73-76.
[10]Murphy J M,Fink D J,Hunziker E B,et al.Stem cell therapy in a caprine model of ostcoarthritis[J].Arthritis Rhcum,2003,48 (12):3464-3474.
[11]杨爱成,林辉遂,李杰峰,等.间充质干细胞治疗类风湿关节炎的研究进展[J].风湿病与关节炎,2013,2(7):67-71.
[12]丁志,杨松林.脐带间充质干细胞生物学特性及其分化潜能[J].中国组织工程研究与临床康复杂志,2011,15(1):147-150.
[13]Gupta P K,Das AK,Chullikana A,et al.Mesenchymalstem cells for cartilage repair in osteoarthritis[J].Stem CellRes Ther,2012, 3(4):25.
[14]Tse W T,Pendleton J D,Beyer W M,et al.Suppression of allogenicTcellproliferation by human marrow stromalcells:inplication transplantion[J].Transplantation,2003,75(3):389-397.
[15]Guzmxn R E,Evans M G,Bovcs S.Mono iodoacetate induced histologic changes in subchondral bone and articular cartilage of rat femorotibial joints;an animal model of osteoarthritis[J]. ToxicolPathol,2003,31(6):619-624.
Human umbilical cord-derived mesenchymal stem cells implantation in treatment of rat adjuvant arthritis
JIANG Feng,YANG Xiaobing,ZHANG Fan,et al.Department of Rheumatology and Immunology,Huzhou Third Municipal Hospital,Huzhou 313000,China
Objective To investigate the efficacy of human umbilical cord-derived mesenchymal stem cells(hUc-MSCs) implantation in treatment of rat adjuvant arthritis. Methods Forty two rats were randomly divided into 7 groups with 6 animals in each.Acetic acid was injected in right hind joint to induce the arthritis in groups A,B,C,D,E,F;group G served as blank control group.Rats in group Awere sacrificed at wk 6 after the modelwas made (modelgroup),rats in group B were injected with normal saline at wk 6 and sacrificed at wk 10;rates in group C were injected with normal saline at wk 6,8 and sacrificed at wk 12;rats in group D were injected with hUc-MSCs in articular cavity at wk 6 and sacrificed at wk 10;rats in group E were injected with hUc-MSCs in articular cavity at wk 6,8 and sacrificed at wk 12;rats in group F were injected with hUc-MSCs through tail vein at wk 6,8 and sacrificed at wk 12.The swelling degree and pain degree of rats before and after model made and before and after treatment were evaluated.Pathological examinations in joints were performed after sacrifice. Results Compared with groups B and C,the joint swelling degree of group D and E was reduced and that of group E were significantly reduced while the change of group F was not significant.Compared with groups B and C,the average pain scores of group D and E were reduced and the analgesic effect in group E and F was more significant.The result of the pathological grades of Mankin articular cartilage showed that there was no difference between group D and group B,that of group F was better than group C while that of group E was better than group F.The pathological examination at wk 6 in groups A and B showed the manifestations of osteoarthritis and no graft rejection responses.In group D,the proliferated synovial membrane invading the aricular cavity with infiltration ofinflammatory cells,the pathological damage was more severe than that of group A,but lighter than group C.The synovial proliferation and inflammation in group E was lighter than that in group D,and cartilage staining was more shallow than that in group D.The pathological damage of group F was similar to that in group E. Conclusion The injection of hUc-MSCs in joint or in tail vein can release joint pain of osteoarthritis,improve synovitis,and repair cartilage damage,suggesting that hUc-MSCs implantation is effective and safe for treatment ofosteoarthritis in rats.
hUc-MSCs AdjuvantOsteoarthritis ExperimentalImplatation
2015-11-13)
(本文编辑:严玮雯)
湖州市生物医药重大专项计划(2011ZD2007)
313000 湖州市第三人民医院风湿免疫科(蒋峰、杨孝兵、张帆);浙江中医药大学动物实验研究中心(寿旗扬);协和华东干细胞基因工程有限公司(徐志国)
蒋峰,E-mail:JF2025018@163.com

