反复发作性眩晕豚鼠前庭内侧核毒蕈碱受体M2、M3表达的研究
饶秀丽 尹时华 侯涛 朱子昂 龙吉
广西医科大学第一附属医院耳鼻咽喉头颈外科(南宁530021)
·基础研究·
反复发作性眩晕豚鼠前庭内侧核毒蕈碱受体M2、M3表达的研究
饶秀丽 尹时华 侯涛 朱子昂 龙吉
广西医科大学第一附属医院耳鼻咽喉头颈外科(南宁530021)
目的 制造豚鼠迷路瘘管导致的反复发作的眩晕模型,观察不同时程豚鼠前庭内侧核(MVN)毒蕈碱受体M2、M3亚型的表达变化。以探讨前庭代偿的可能机制。方法选择成年实验用豚鼠88只,并随机分配为A组(假手术组,8只)、B组(单侧迷路损毁组,40只)、C组(迷路瘘管+耳镜鼓气组,40只)。B、C组手术后,依据豚鼠所需不同存活时间(术后1天、3天、1周、2周、3周)随机选取8只,A组作为对照组存活3周。所有豚鼠灌流后取脑干,用免疫组织化学染色,观察前庭内侧核毒蕈碱受体M2、M3亚型的表达变化,并与假手术组比较。结果B、C组术后均可导致双侧MVN区毒蕈碱受体M2、M3亚型表达减少,术后1天表达最少,术后3天至术后7天表达有逐渐增加趋势,术后7天时B组和假手术组比较表达无差异,而C组和假手术组比较表达差异具有统计学意义(P<0.05)。直到术后2周,C组和假手术组比较表达无差异。B、C组术后各时期(术后2周前)相比,C组的表达弱于B组。各组对侧的变化趋势和术侧相同。结论1.豚鼠MVN存在毒蕈碱受体M2、M3亚型,且M3受体的表达可能不及M2受体的丰富。它们可能在前庭代偿的早期促进了前庭代偿的正常进行。2.前庭代偿除胆碱能系统参与外,可能还涉及到其他神经递质或化学物质的参与。3.进一步证明迷路瘘管导致的反复发作性眩晕模型的造模是成功的。
反复发作性眩晕;迷路瘘管;前庭代偿;前庭内侧核;毒蕈碱受体;豚鼠
Fund Project:Natural Science Foundation of Guangxi(the number of fund commitments:2015GXNSFAA414004);Natural Science Foundation of Guangxi(the number of fund commitments:2016GXNSFAA380150).
The fund does not have any conflicts of interest
眩晕是临床的常见病症,涉及临床多学科[1],外周前庭病变所引发的大部分眩晕患者可通过药物、物理治疗或手术得到康复。但是部分外周前庭病变所引发的眩晕患者反复发作呈现慢性过程,且不能通过药物、物理或手术治疗使其康复,给患者的生活和工作带来极大的困扰,同时也使患者出现焦虑、抑郁。因此反复发作性眩晕是临床一大难以解决的问题之一,中枢前庭代偿是这部分患者症状得到缓解和疾病最终得以康复的重要途径,但这种代偿的中枢机制不清。一侧外周前庭部分或完全受损会使受损侧前庭输入下降或缺失并引起静态症状和动态症状。静态症状包括为自发性眼震,受损侧头位偏斜和,动态症状则依赖于评价前庭功能时的刺激,在中枢神经系统的重组下,症状逐渐减轻直至消失,前庭功能全部或部分恢复,这一过程称为前庭代偿。本实验通过制造迷路瘘管,使动物出现反复发作的眩晕,通过观察反复发作性眩晕豚鼠前庭内侧核(me⁃dial vestibular nucleus,MVN)中毒蕈碱受体M2、M3亚型的表达变化,探讨前庭代偿的可能机制。
1 材料与方法
1.1 实验相关准备
选择健康成年实验用豚鼠(250~300g)88只,雌雄不限。电耳镜检查外耳道通畅、鼓膜标志清晰、中耳无感染、耳廓反射正常,无自发性眼震。豚鼠随机分为三组,即A组为假手术组(8只)、B组单侧迷路损毁组(40只),C组为迷路瘘管+耳镜鼓气组(40只),动物由广西医科大学实验动物中心提供。免疫组化试剂盒(聚合物辅助试剂1、二氨基联苯胺( DAB)显色剂、山羊抗兔IgG/辣根过氧化物酶标记物)由北京中杉金桥生物技术有限公司提供,抗M2受体抗体和抗M3受体抗体由美国Abnova公司提供。
1.2 实验方法
1.2.1 造模
三组豚鼠均以左耳为手术耳,均以1%戊巴比妥钠(4ml/kg)腹腔注射麻醉,均剪毛后固定于自制豚鼠手术操作台,均消毒后沿耳后沟中下部做长约1~ 2cm的弧形切口。此后三组豚鼠的手术方式有区别:B组暴露听泡,并用颅钻磨开,用显微剥离子及吸引器打开前庭,吸除耳石器及壶腹嵴等以达到破坏前庭,将浸有无水乙醇的明胶海绵置入前庭,缝合切口。A组(假手术组)打开听泡后不破坏前庭。直接缝合切口。C组手术包括两部分:分离皮肤筋膜及其肌肉,暴露颞线,用直径为1.2mm颅钻钻头在颞线下方钻孔,扩大该孔直至暴露外、上半规管。用直径为0.8mm的颅钻钻头分别在外、上半规管钻下长约2mm的裂隙,术中可见到清亮的淋巴液漏出来,术中应轻柔操作以防钻头将半规管整段磨除。在半规管裂隙周围置入适当的药棉,并滴入1~2滴地塞米松磷酸钠注射液。②在如上的手术留下的孔后方约2cm的位置就是听泡,用颅钻磨开听泡,寻找到圆窗,用针灸针挑开圆窗膜,并将长度适宜消毒过的筛孔状的PE管置入圆窗内,轻轻转动一两圈以破坏圆窗膜。同样以适量的药棉覆盖孔的周围,滴入1~2滴地塞米松磷酸钠注射液。三组豚鼠均在缝合切口后消毒皮肤切口,切口周围涂上红霉素软膏,术后7天内每天给予切口消毒,切口周围涂上适量红霉素软膏。B、C组豚鼠术后按所需存活时间(术后1天、3天、1周、2周、3周)每个时间段随机取8只。C组豚鼠清醒后用鼓气耳镜适当的增加术耳外耳道内的压力,每天1次,B组和A组不做此处理。
1.2.2 前庭代偿指标的记录
豚鼠清醒后出现急性单侧前庭功能失衡症状记为零时,观察并记录动物术后所需存活时间点的自发性眼震、头偏斜及失衡行为评分的动态变化过程。
1.2.3 标本取材及制备
豚鼠饲养到预期时间后,用能使豚鼠处于深麻醉的的1%戊巴比妥钠(约2ml)腹腔注射麻醉豚鼠。将豚鼠仰卧位固定好,做腹部切口,分离开腹腔脏器暴露下腔静脉,用血管钳夹闭下腔静脉。切开横隔,暴露跳动的心脏,小心撕开心包膜,用灌注针头从心尖插入一直到升主动脉,用血管钳夹闭针头固定。先用生理盐水进行快速灌注,当看到肺脏逐渐发白且灌流出来的液体没有血色后换上新鲜配制的4%多聚甲醛(pH7.4)快速灌注,待豚鼠身体逐渐僵硬,缓慢灌注20min后结束,豚鼠断头,剥除颅骨,小心取下脑干,迅速放入新鲜配制的4%多聚甲醛液(pH7.4)中过夜固定,次日借助豚鼠脑干立体图谱进行取材,石蜡包埋后切片。切片厚度为4μm,放置于防脱载玻片上,切片放入65℃恒温烤箱烤片3小时,常温封存。
1.2.4 免疫组化方法
将切片置于65℃恒温烤箱约10 min后拿出;二甲苯脱蜡(四次)和酒精水化(依次100%,90%,80%,70%);蒸馏水冲洗,切片置于0.01 mol/L枸橼酸缓冲液(pH=6.0)放入高压锅高压修复30 min,0.01 mol /L磷酸盐缓冲液浸洗3次×3 min;3%H2O2去离子水室温孵育10 min,0.01 mol/L磷酸盐缓冲液洗3次×3 min;拭去多余液体,禁止干片,标本上滴加适量一抗(美国Abnova公司,抗M2一抗用一抗稀释液按1:200稀释,抗M3一抗用一抗稀释液按1:150稀释)放入湿盒内并4℃过夜;37℃复温20min,0.01 mol/L磷酸盐缓冲液浸洗3次×3 min;滴加聚合物辅助试剂1, 37℃孵育20min,0.01 mol/L磷酸盐缓冲液浸洗3次×3min;滴加山羊抗兔IgG/辣根过氧化物酶标记物,37℃孵育20 min,0.01 mol/L磷酸盐缓冲液3次×3 min;DAB溶液显微镜下显色约1min,蒸馏水冲洗;苏木素复染约2min,蒸馏水冲洗,用1%的盐酸酒精分化,二甲苯透明,待干,中性树脂封片。
对照实验:一抗用0.01 mol/L磷酸盐缓冲液( pH 7.4)替代。
1.2.4 采用olympus图像采集系统和Image-pro plus6.0图像分析软件进行定量分析,每张切片随机选取5个视野,以细胞膜上出现棕黄色颗粒为阳性,测定每个视野下染色的平均光密度值(IOD)。IOD=总光密度值/阳性面积。
1.2.5 统计学方法
所有实验数据用SPSS 16.0软件进行统计分析,术侧与对侧比较采用配对t检验,A、B、C三组术后组间及组内各时间段比较采用方差分析。以±s表示,以P<0.05为差异有统计学意义。
2 结果
2.1 行为学观察的结果
豚鼠在手术后1~2h从麻醉中清醒。A组豚鼠清醒后与手术前(正常)相比无任何异常,B、C组出现术侧急性前庭功能紊乱的症状,主要有快相向健侧的自发性眼震,并伴向术侧的头眼震样摆动(Head nys⁃tagmus),又称头震;头明显偏向术侧。偏斜度甚至超过与躯体纵轴的垂直线;沿躯体纵轴向术侧翻滚;术侧肢体向外伸展,以地面垂直轴为中心向术侧环形转圈。B、C组豚鼠术后的各种失衡症状随时间的推移逐渐减轻并消失,这一过程存在着个体差异,同一时段内失衡症状的减轻程度C组<B组,如术后48h B组豚鼠已无自发性眼震,C组用鼓气耳镜给术耳外耳道适当鼓气仍可出现(5~6次/15秒)的眼震。术后2周和3周,B组各失衡症状均已不存在,C组仍存在头偏斜等失衡症状,且用鼓气耳镜给术耳外耳道适当鼓气仍可出现(5~6次/15秒)的眼震。
2.2 前庭内侧核中毒蕈碱受体M2和M3亚型免疫组化结果毒蕈碱受体M2和M3亚型在各组豚鼠的MVN中均有表达(见图1),表现为细胞膜呈棕黄色,B、C组术后均可诱导术侧MVN区毒蕈碱受体M2、M3亚型免疫反应性表达减少,术后1天表达最少,术后3天至术后7天表达处于上升趋势,术后7天时B组和假手术组比较表达无差异,而C组和假手术组比较表达差异具有统计学意义(P<0.05),直到术后2周,C组和假手术组比较表达无差异。B、C组术后各时期(术后2周前)相比,C组的表达弱于B组。各组对侧的变化趋势和术侧相同。见表1-4。
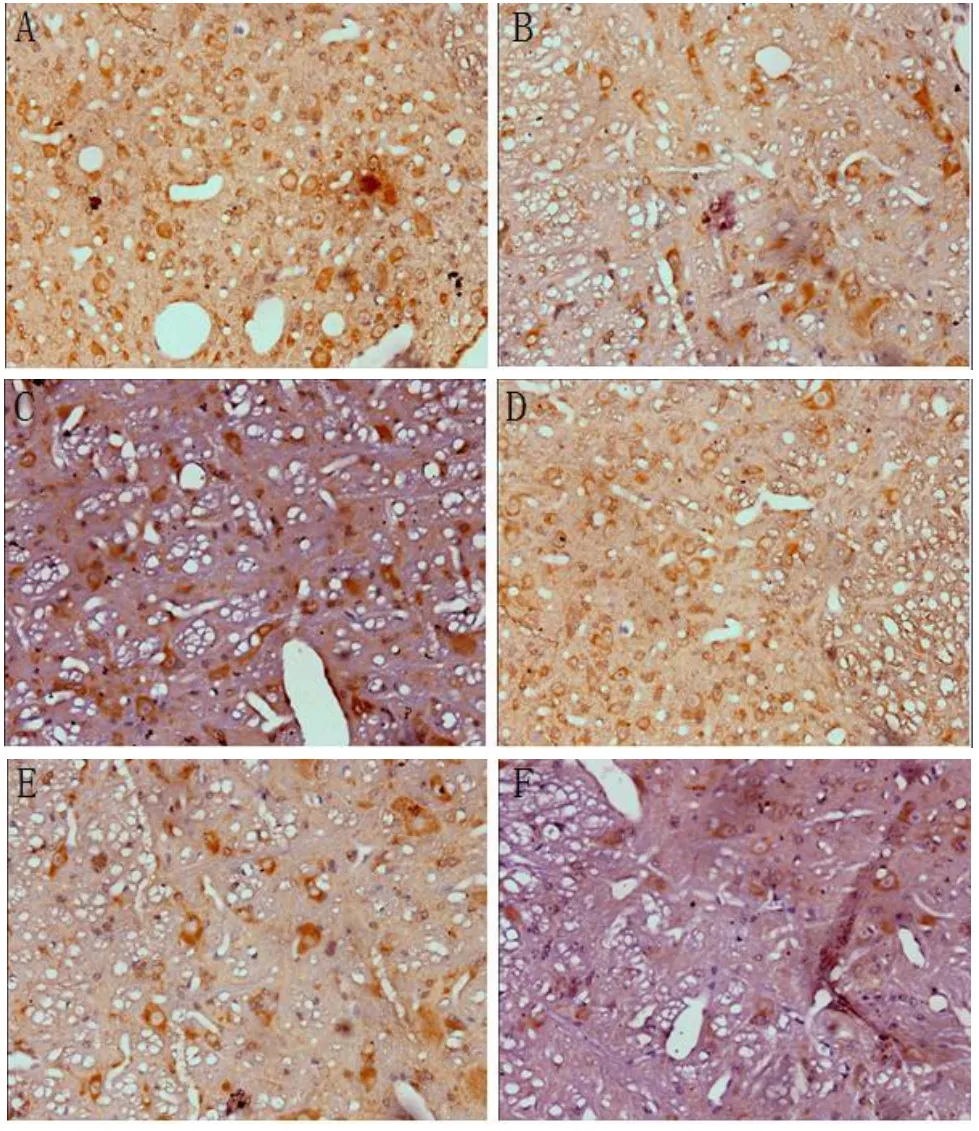
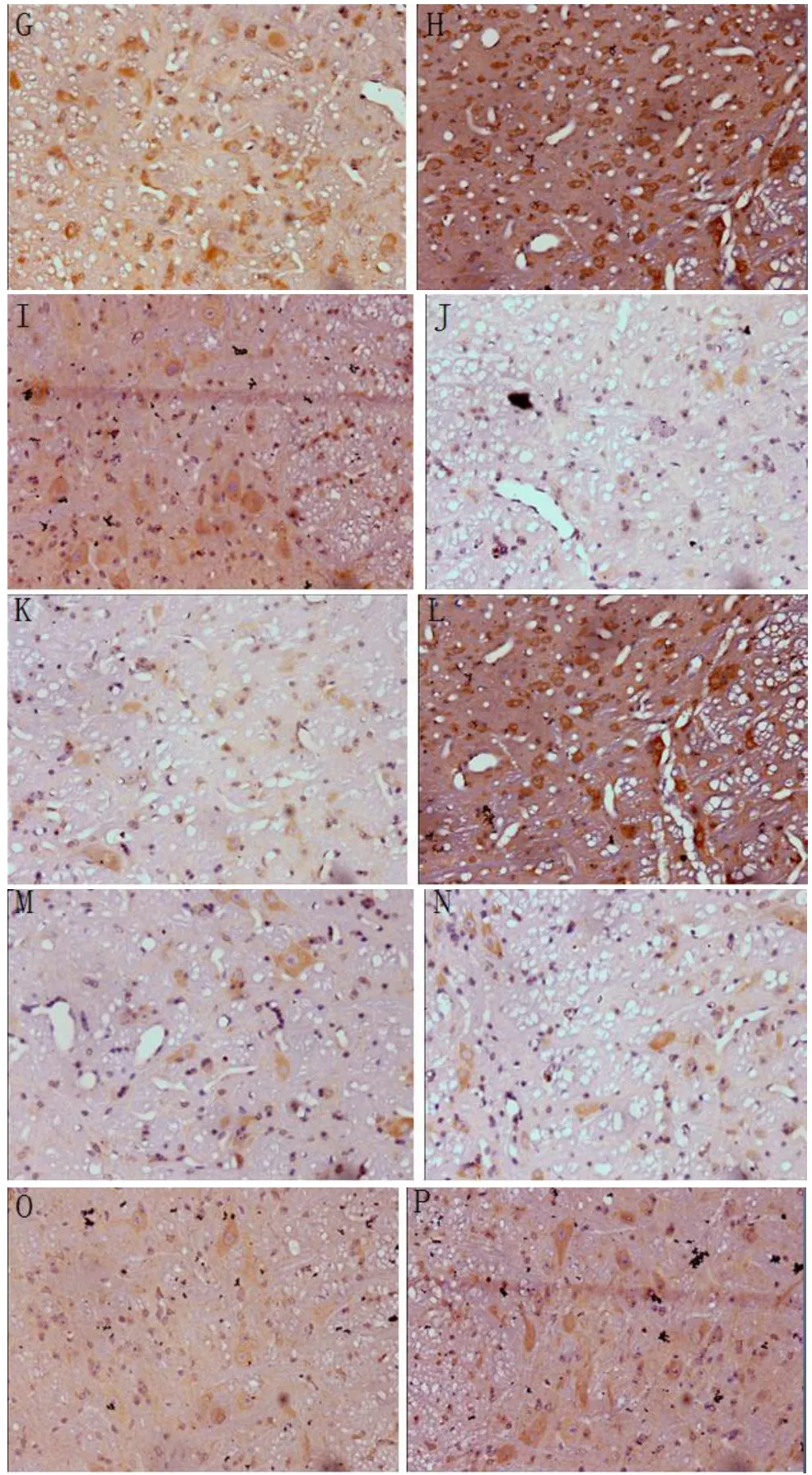
图1 (A-P)豚鼠术后前庭内侧核毒蕈碱受体的表达×400,A:假手术组,M2;B:B组术后1天,M2;C:B组术后3天,M2;D:B组术后1w,M2;E:C组术后1天,M2;F;C组术后3天,M2;G:C组术后1w,M2;H:C组术后2w,M2;I:假手术组,M3;J:B组术后1天,M3; K:B组术后3天,M3;L:B组术后1w,M3;M:C组术后1天,M3;N: C组术后3天,M3;O:C组术后1w,M3;P:C组术后2w,M3.Fig.1 (A-P)The expression of muscarinic receptors in the medial vestibular nucleus of guinea pigs after operation.A:the sham—operated group,M2;B:1days after Operation in group B,M2;C:3days after operation in group B,M2;D:1weeks after operation in group B,M2;E:1days after Operation in group C, M2;F:3days after Operation in group C,M2;G:1weeks after Operation in group C,M2;H:2weeks after Operation in groupC,M2; I:the sham—operated group,M3;J:1days after Operation in group B,M3;K:3days after Operation in group B,M3;L: 1weeks after Operation in group B,M3;M:1days after Operation in group C,M3;N:3days after Operation in group C,M3; O:1weeks after Operation in group C,M3;P:2weeks after Operation in group C,M3.
3 讨论
迷路瘘管也称之为局限性迷路炎或迷路周围炎,即指骨迷路的骨质甚至骨内膜因胆脂瘤基质或肉芽组织等其他病变的侵袭造成缺损所致[2,3]。瘘管大多位于外半规管(75%以上),也可发生于上、后半规管,前庭,耳蜗,或整个迷路,但以发生于半规管较多见。迷路瘘管可引起发作性或激发性眩晕,眩晕多在快速转身、屈体、受到震动、耳内操作(如挖耳等)或压迫耳屏时发作。有文献报道,在有外淋巴瘘存在的情况下,用鼓气耳镜适当的增加或减少患耳外耳道的压力可引起眩晕及自发性眼震[4,5]。
正常平衡功能的保持,有赖于完整的前庭觉、本体觉和视觉,以及它们在中枢神经系统(Central Ner⁃vous System,CNS)内不断被整合的功能。任何一处的病变或功能障碍都将引起平衡紊乱或影响前庭疾病的恢复。其中又以神经元交换较少和信息传递环路较快的前庭系统对维持平衡最为重要。前庭系统的主要功能是对不同的运动状态或头部位置产生位置觉和运动觉的同时,还可以通过调控不同部位肌紧张和躯体运动,使机体尽可能的保持在原有空间位置上,维持一定姿势,保持身体平衡。
突发双侧或单侧前庭功能丧失后,患者立即严重共济失调,步态不稳,受损侧前庭输入下降或缺失引起静态症状和动态症状,表现为眩晕、呕吐和快相向健侧的眼震[6-8],头偏向同侧、站立不稳和向患侧倾倒等平衡障碍[9-12]。在中枢系统的重组下,症状逐渐减轻直至消失,前庭功能部分或全部恢复,这一过程称为前庭代偿(vestibular compensation)[13,14]。一侧前庭终末器受到破坏后不能再生,前庭代偿是两侧前庭中枢共同调节的结果,是中枢性过程。目前己证实参与前庭代偿的结构有[15]:对侧前庭终末器、两侧前庭神经核、视觉系统、本体感觉系统、脊髓、小脑、大脑、下橄榄核、网状结构以及联合纤维通路等。其中前庭神经核在中枢神经系统的代偿性重组中发挥重要的作用,它不仅是一个传入平衡冲动信号的中继站,也是一个将身体各处不断传来的平衡冲动信息进行综合分析和处理的场所。前庭神经核位于脑桥和延髓部分,每侧共有4个,即前庭神经上核、外侧核、内侧核和下核。上核接受来自壶腹嵴的传入神经纤维,外核与内侧核主要接受来自椭圆囊斑及壶腹嵴的传入神经纤维,下核接受所有前庭终器的传入神经纤维。前庭神经内侧核(MVN)的神经元密度很大,是前庭神经核的四个核团中最大的一个,其内有多种神经递质和调质,对调节前庭神经核神经元电活动中有不可替代的作用,并且前庭神经内侧核对前庭代偿有着重要的意义。
许多研究结果表明,体内某些神经递质或化学受体参与了前庭代偿的发生,如组胺能受体、胆碱能受体等。胆碱能受体在中枢神经系统及周围神经系统中均发挥着重要的生理作用,研究证实胆碱能参与调控前庭神经核的活动,并且可能与前庭代偿有关[16,17],Kong等的研究表明,乙酰胆碱存在于前庭神经系统[18]。有研究表明在前庭神经核中,存在大量的毒蕈碱受体,其可能对前庭神经元的活动有着一定的调控作用[19]。文献证实M2和M3可能是前庭内侧核表达量最多的毒蕈碱受体[20]。Calza的研究证实毒蕈碱受体参与了前庭代偿的进行,但没有具体阐述是哪种亚型在前庭代偿中起了作用[21]。Kirsten的研究证实前庭内侧核和前庭外侧核均有胆碱能受体和组胺受体的存在[22],Waller等用细胞外记录的方法研究出大鼠前庭内侧核存在毒蕈碱受体和尼古丁受体,但毒蕈碱受体的表达量更突出;乙酰胆碱受体激动剂可引起前庭内侧核、前庭上核、前庭下核的神经元平均放电率的变化[23]。Phelan等的研究结果表明:尽管前庭内侧核(MVN)的初级传入不是由乙酰胆碱调控的,但胆碱能机制对前庭内侧核神经元兴奋性的调控发挥着重要的作用。这种调节可以直接毒蕈碱受体或尼古丁受体介导的突触前兴奋的形式,也可以毒蕈碱受体作用于突触前GABA能成分而发挥作用的间接形式[24]。Bienhold等人通过对林蛙进行单侧迷路切除后待其失衡症状恢复,全身或淋巴管内应用胆碱酯酶抑制剂,发现林蛙单侧迷路切除后的失衡症状再度重复出现,该研究得出结论一侧前庭功能丧失后,前庭系统的代偿重组涉及到胆碱能突触的修饰[25]。Ishikawa通过对进行单侧迷路切除术后的松鼠猴注射阿托品发现可明显降低自发性眼震的慢相眼速,也可降低减幅摆动旋转性眼震的最大慢相眼速,而注射卡巴胆碱则会出现相反的结果,该研究得出结论单侧迷路切除后阿托品的主要作用位点在前庭神经核的完整侧[26]。Abeln等人通过对单侧迷路切除后完全或部分代偿的林蛙全身或颅内应用拟胆碱类药或抗胆碱酯酶药,发现动物立即出现单侧迷路切除后所有失代偿的症状,得出结论前庭系统的代偿性重组涉及到脑干胆碱能突触的修饰,且它们的量和灵敏性是非对称性分布的[27]。Ujihara等人通过细胞外记录发现前庭内侧核神经元自发活动的放电频率受毒蕈碱受体的调节,ACh和毒蕈碱均能剂量依赖性的增加MVN神经元的自发放电[28]。
表1 同一时段ABC三组之间术侧M2表达及组内不同时段M2表达(±s)Table 1 The expression of M2 receptor in the operative side among three groups at the same time period and in each group ofABC at the different time periods(±s)
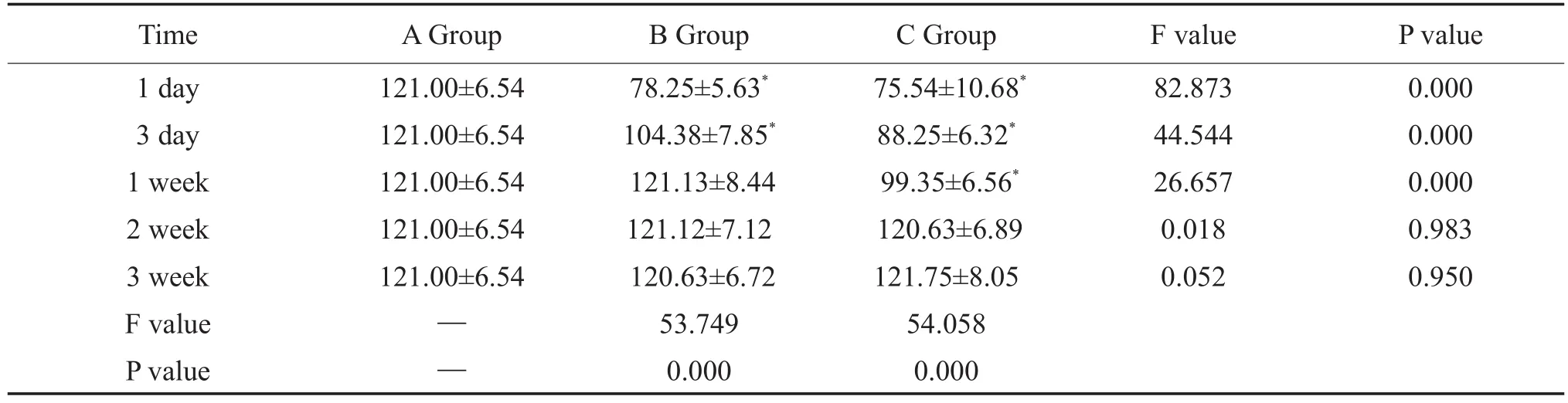
表1 同一时段ABC三组之间术侧M2表达及组内不同时段M2表达(±s)Table 1 The expression of M2 receptor in the operative side among three groups at the same time period and in each group ofABC at the different time periods(±s)
Time 1 day 3 day 1 week 2 week 3 week F value P value AGroup 121.00±6.54 121.00±6.54 121.00±6.54 121.00±6.54 121.00±6.54 F value 82.873 44.544 26.657 0.018 0.052 P value 0.000 0.000 0.000 0.983 0.950——B Group 78.25±5.63*104.38±7.85*121.13±8.44 121.12±7.12 120.63±6.72 53.749 0.000 C Group 75.54±10.68*88.25±6.32*99.35±6.56*120.63±6.89 121.75±8.05 54.058 0.000
表2 同一时段ABC三组之间术侧M3表达及组内不同时段M3表达(±s)Table 2 The expression of M3 receptor in the operative side among three groups at the same time period and in each group ofABC at the different time periods(±s)
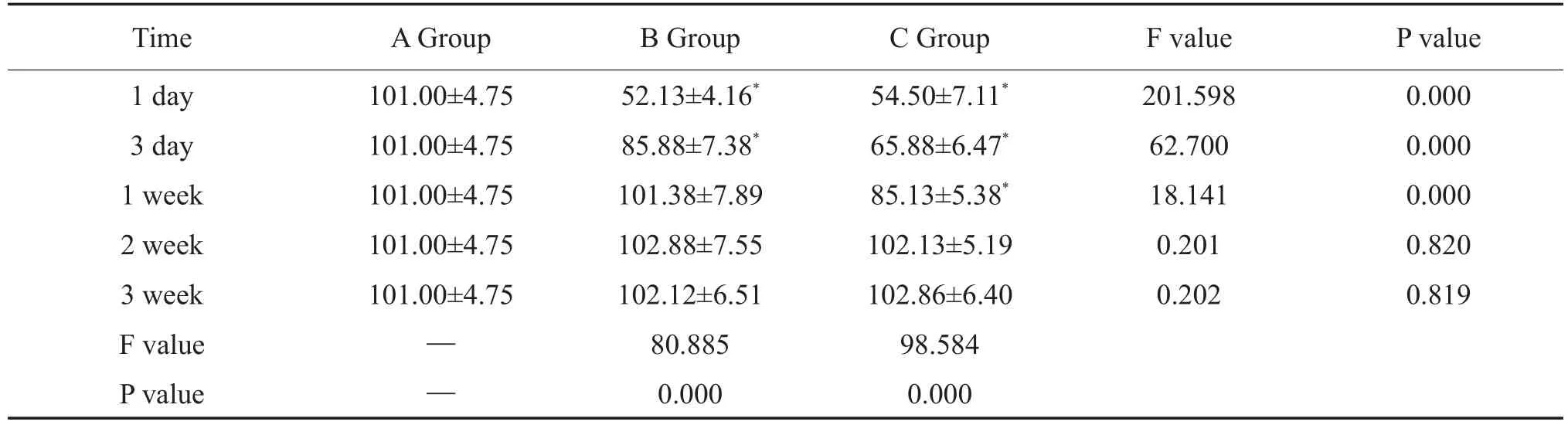
表2 同一时段ABC三组之间术侧M3表达及组内不同时段M3表达(±s)Table 2 The expression of M3 receptor in the operative side among three groups at the same time period and in each group ofABC at the different time periods(±s)
Time 1 day 3 day 1 week 2 week 3 week F value P value AGroup 101.00±4.75 101.00±4.75 101.00±4.75 101.00±4.75 101.00±4.75 F value 201.598 62.700 18.141 0.201 0.202 P value 0.000 0.000 0.000 0.820 0.819——B Group 52.13±4.16*85.88±7.38*101.38±7.89 102.88±7.55 102.12±6.51 80.885 0.000 C Group 54.50±7.11*65.88±6.47*85.13±5.38*102.13±5.19 102.86±6.40 98.584 0.000
表3 ABC三组术后各时段术侧和对侧M2受体的表达(±s)Table 3 The expression of M2 receptor in the operative side and the contralateral side inABC three groups at different time periods after operation(±s)
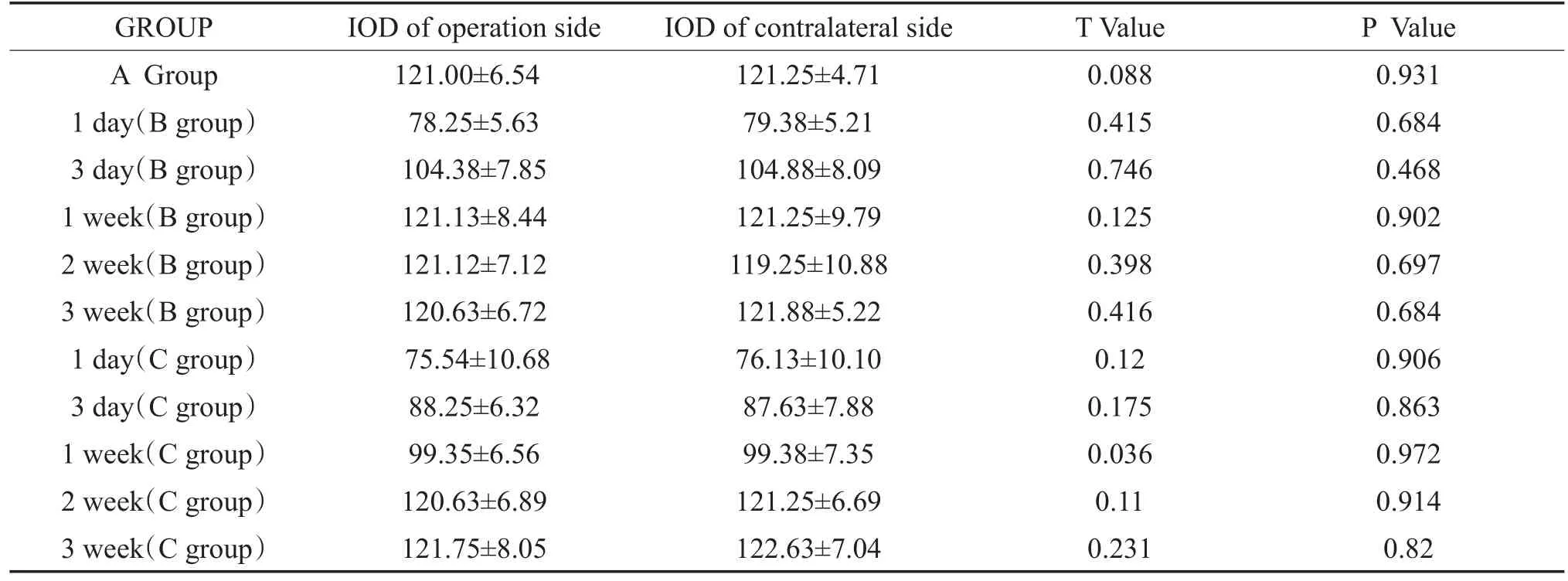
表3 ABC三组术后各时段术侧和对侧M2受体的表达(±s)Table 3 The expression of M2 receptor in the operative side and the contralateral side inABC three groups at different time periods after operation(±s)
GROUP A Group 1 day(B group)3 day(B group)1 week(B group)2 week(B group)3 week(B group)1 day(C group)3 day(C group)1 week(C group)2 week(C group)3 week(C group)IOD of operation side 121.00±6.54 78.25±5.63 104.38±7.85 121.13±8.44 121.12±7.12 120.63±6.72 75.54±10.68 88.25±6.32 99.35±6.56 120.63±6.89 121.75±8.05 IOD of contralateral side 121.25±4.71 79.38±5.21 104.88±8.09 121.25±9.79 119.25±10.88 121.88±5.22 76.13±10.10 87.63±7.88 99.38±7.35 121.25±6.69 122.63±7.04 T Value 0.088 0.415 0.746 0.125 0.398 0.416 0.12 0.175 0.036 0.11 0.231 P Value 0.931 0.684 0.468 0.902 0.697 0.684 0.906 0.863 0.972 0.914 0.82
综上前人的研究,本实验通过制造迷路瘘管,使动物出现反复发作的眩晕,通过观察反复发作性眩晕豚鼠前庭内侧核(medial vestibular nucleus,MVN)中毒蕈碱受体M2、M3亚型的表达变化,探讨其在前庭代偿的可能机制有一定的意义。我们的研究结果表明,B、C组术后均可导致双侧MVN区毒蕈碱受体M2、M3亚型表达减少,术后1天表达最少,术后3天至术后7天表达处于上升趋势,各组对侧的变化趋势和术侧相同。术后7天时B组和假手术组比较表达无差异,B组的免疫组化结果与前庭代偿过程中豚鼠的行为学变化是一致的。术后7天时C组和假手术比较表达差异有统计学意义(P<0.05),直到术后2周,C组和假手术组比较表达无差异。而动物行为学上,术后2周和3周,B组各失衡症状均已不存在,C组仍存在头偏斜等失衡症状,且用鼓气耳镜给术耳外耳道适当鼓气仍可出现(5~6次/15秒)的眼震。因此推断C组免疫组化结果与前庭代偿早期过程中豚鼠的行为学变化是一致的,后期并不一致,我们可得出结论:毒蕈碱受体M2、M3亚型可能在前庭代偿的早期促进了前庭代偿的正常进行,前庭代偿除可能涉及到胆碱能系统的参与外,可能还涉及到其他神经递质或化学物质的参与。从B、C组各时期动物行为学和免疫组化结果相比较可进一步证明迷路瘘管导致的反复发作性眩晕模型的造模是成功的。从B、C组的免疫组化结果我们可得出结论:豚鼠MVN存在毒蕈碱受体M2和M3,且M3受体的表达可能不及M2受体的丰富。前庭代偿是一个中枢过程,其发生机制很复杂,学者们还需要不断地从神经生理学、神经化学及神经药理学等方面来研究其机制。
表4 ABC三组术后各时段术侧和对侧M3受体的表达(±s)Table 4 The expression of M3 receptor in the operative side and the contralateral side inABC three groups at different time periods after operation(±s)
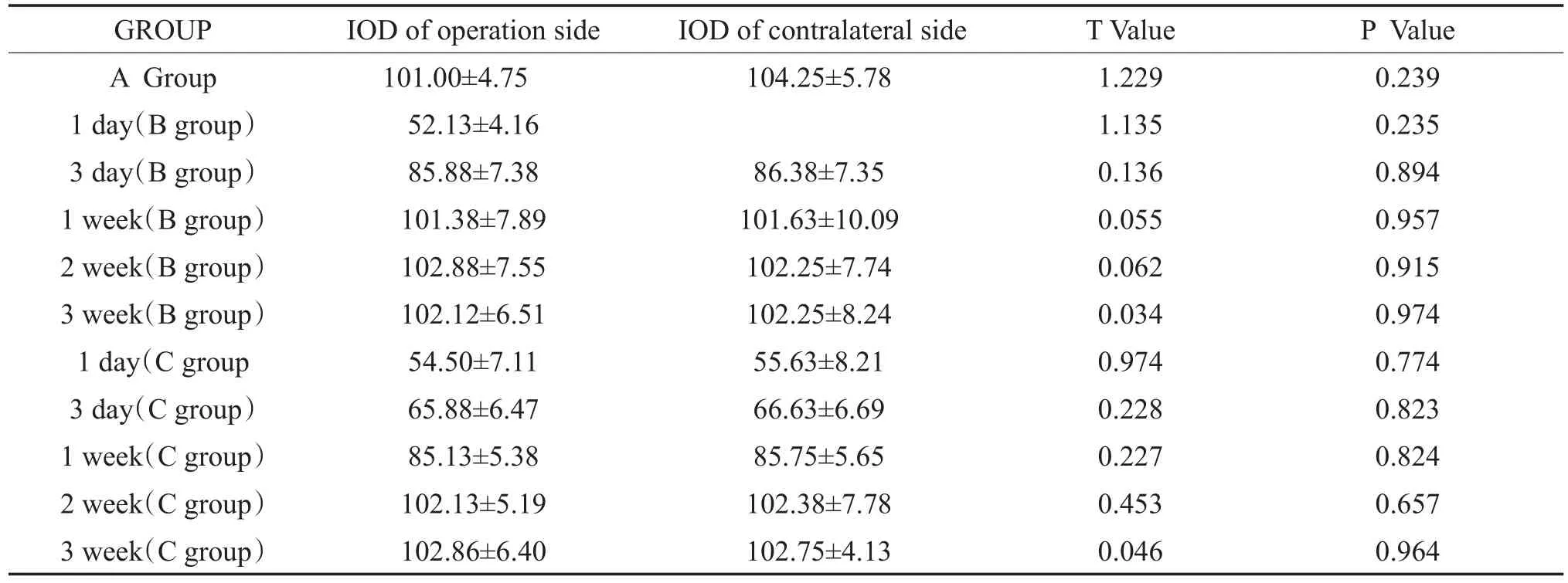
表4 ABC三组术后各时段术侧和对侧M3受体的表达(±s)Table 4 The expression of M3 receptor in the operative side and the contralateral side inABC three groups at different time periods after operation(±s)
由表1-4可知:毒蕈碱受体M2、M3亚型在各组豚鼠的MVN中均有表达,A组(假手术组)跟正常豚鼠的表达一样,B、C组术后均可诱导术侧MVN区毒蕈碱受体M2、M3亚型免疫反应性表达减少,术后1天表达最少,术后3天至术后7天表达处于上升趋势,术后7天时B组和假手术组比较表达无差异,而C组和假手术组比较表达差异具有统计学意义(p<0.05),直到术后2周,C组和假手术组比较表达无差异。B、C组术后各时期(术后2周前)相比,C组的表达弱于B组。各组对侧的变化趋势和术侧相同。。
GROUP A Group 1 day(B group)3 day(B group)1 week(B group)2 week(B group)3 week(B group)1 day(C group 3 day(C group)1 week(C group)2 week(C group)3 week(C group)IOD of operation side 101.00±4.75 52.13±4.16 85.88±7.38 101.38±7.89 102.88±7.55 102.12±6.51 54.50±7.11 65.88±6.47 85.13±5.38 102.13±5.19 102.86±6.40 IOD of contralateral side 104.25±5.78 86.38±7.35 101.63±10.09 102.25±7.74 102.25±8.24 55.63±8.21 66.63±6.69 85.75±5.65 102.38±7.78 102.75±4.13 T Value 1.229 1.135 0.136 0.055 0.062 0.034 0.974 0.228 0.227 0.453 0.046 P Value 0.239 0.235 0.894 0.957 0.915 0.974 0.774 0.823 0.824 0.657 0.964
1 R.RLeker,T.BHur,J.MGomori,etal.Incidence of DWI-positivestroke in patients with vertigo of unclear etiology,prelim-inary results[J]. Neurol res,2013,35(2):123-126.
2 L.B.Minor.Labyrinthine fistulae:pathobiology and management[J]. Curr Opin Otolaryngol Head Neck Surg,2003,11(5):340-346.
3 D.B.Shim,K.M.Ko,M.H.Song,et al.A case of labyrinthine fistu⁃la by cholesteatoma mimicking lateral canal benign paroxysmal posi⁃tional vertigo[J].Korean J Audiol,2014,18(3):153-157.
4 M.Casale,Y.Errante,L.Sabatino,et al.Perilimphatic fistula test:a video clip demonstration[J].Eur Rev Med Pharmacol Sci,2014,18 (23):3549-3550.
5 R.I.Kohut,R.Hinojosa,J.H.Ryu,et al.Update on idiopathic peri⁃lymphaticfistulas[J].OtolaryngolClinNorthAm,1996,29(2): 343-352.
6 B.Tighilet,J.Leonard,L.Bernard-Demanze,et al.Comparative anal⁃ysis of pharmacological treatments with N-acetyl-DL-leucine(Tan⁃ganil)and its two isomers(N-acetyl-L-leucine and N-ace⁃tyl-D-leucine)on vestibular compensation:Behavioral investigation in the cat[J].Eur J Pharmacol,2015,769:342-349.
7 S.Dutheil,M.Lacou,B.Tighilet,et al.Neurogenic potential of the vestibular nuclei and behavioural recovery time course in the adult cat are governed by the nature of the vestibular damage[J].PLoS One,2011,6(8):e22262.
8 K.Mizutari,M.Fujioka,S.Nakagawa,et al.Balance dysfunction re⁃sulting from acute inner ear energy failure is caused primarily by vestibular hair cell damage[J].J Neurosci Res,2010,88(6): 1262-1272.
9 N.Shanidze,K.Lim,J.Dye,et al.Galvanic stimulation of the vestib⁃ular periphery in guinea pigs during passive whole body rotation and self-generated head movement[J].JNeurophysiol,2012,107(8): 2260-2270.
10 王锡温,张庆泉,赵利敏等.前庭神经切断术后的前庭代偿观察[J].中华耳科学杂志,2006,4(04):290-292. Wang XW,Zhang QQ,Zhao LM et al.Postoperative vestibular compensation after vestibular neurectomy[J].Chinese Journal of Otology,2006,4(04):290-292
11 刘波,孔维佳,赖嫦芹等.单侧外周前庭病变患者亚急性期的半规管轻瘫程度与静态姿势平衡[J].中华耳科学杂志,2008,6(03): 306-309. Liu B,Kong WJ,Lai CQ et al.Relationship between static posturog⁃ raphy and canal paresis in patients with unilateral vestibular disor⁃der in the subacute phase[J].Chinese Journal of Otology,2008,6(03): 306-309.
12 S.P.Cass,H.G.Goshgarian,et al.Vestibular compensation after labyrinthectomy and vestibular neurectomy in cats[J].Otolaryngol Head Neck Surg,1991,104(1):14-19.
13 J.N.Eron,N.Davidovics,C.C.Della Santina,et al.Contribution of vestibular efferent system alpha-9 nicotinic receptors to vestibu⁃lo-oculomotor interaction and short-term vestibular compensation after unilateral labyrinthectomy in mice[J].Neurosci Lett,2015,602: 156-161.
14 C.D.Balaban,M.E.Hoffer,K.R.Gottshall,etal.Top-down approach to vestibular compensation:Translational lessons from vestibular reha⁃bilitation[J].Brain Res,2012,1482C:101-111.
15 A.Deak,T.Bacskai,B.Gaal,et al.Effect of unilateral labyrinthec⁃tomy on the molecular composition of perineuronal nets in the later⁃al vestibular nucleus of the rat[J].Neurosci Lett.,2012,513(1):1-5
16 M.P Torte-Hoba,J.H Courjon,M.H Leroy,et al.Acetylcholinester⁃ase activity changes in medial vestibular complex after hemilaby⁃rinthectomy in the rat[J].J Vestib Res,1996,6(2):61-70.
17 C.de Waele,M.Muhlethaler,P.P Vidal,et al.Neurochemistry of the central vestibular pathways[J].Brain Res Brain Res Rev,1995, 20(1):24-46.
18 W.J Kong,B.Hussl,W.FThumfart,et al.Ultrastructural localiza⁃tion of ChAT-like immunoreactivity in the human vestibular pe⁃riphery.Hear Res,1998,119(1-2):96-103.
19 P.Andre,O.Pompeiano,S.R White,et al.Role of muscarinic re⁃ceptors in the celebellar control of the vestibulospinal reflex gain: cellular mechanisms[J].Acta Otolaryngol Suppl,1995,520(1): 87-91.
20 Y.zhu,S.Rchen,H.Lplan,et al.Muscarinic Receptor Subtypes Dif⁃ferentially Control Synaptic Input and Excitability of Cerebel⁃lum-Projecting Medial Vestibular Nucleus Neurons[J].J Neuro⁃chem,2016,Article first published online:15 FEB 2016.
21 L.Calzà,L.Giardino,M.Zanni,et al.Muscarinic and gamma-ami⁃nobutyric acid-ergic receptor changes during vestibular compensa⁃tion.A quantitative autoradiographic study of the vestibular nuclei complex in the rat[J].Eur Arch Otorhinolaryngol,1992;249(1): 34-39.
22 E.B Kirsten,J.N,Sharma,et al.Microiontophoresis of acetylcho⁃line,histamine andtheir antagonists on neurones in the medi⁃al and lateral vestibular nuclei of the cat[J]Neuropharmacology., 1976,15(12):743-753.
23 Y.Sun,H.J.Walleretal,etal..Spontaneous activity in rat vestibular nu⁃clei in brain slices and effects of acetylcholine agonists and antago⁃nists[J].Brain Res,2002,934(1):58-68.
24 K.D.Phelan,J.P.Gallagher,et al.Direct muscarinic and nicotinic re⁃ceptor-mediatedexcitationof rat medial vestibular nucleus neu⁃rons in vitro[J].Synapse,1992,10(4):349-358.
25 H.Bienhold,H.Flohr,et al.Role of cholinergic synapses in vestibu⁃lar compensation[J].Brain Res,1980,195(2):476-478.
26 K.Ishikawa,M.Igarashi,et al.Effect of atropine and carbachol on vestibular compensation in squirrel monkeys[J].Am J Otolaryngol, 1985,6(4):290-296.
27 W.Abeln,H.Bienhold,et al.Influence of cholinomimetics and cho⁃linolytics on vestibular compensation[J].Brain Res,1981,222(2): 458-462.
28 H.Ujihara,A.Akaike,et al.Muscarinic regulation of spontaneously active medial vestibular neurons in vitro[J].Neurosci Lett,1989,106 (1-2):205-210.
Expression of M2/M3 muscarinic receptors in medial vestibular nucleus in guinea pigs with recurrent vertigo
RAO Xiuli,YIN Shihua,HOU Tao,ZHU Ziang,LONG Ji
Department of Otolaryngology-Head and Neck surgery,the First Affiliated Hospital of Guangxi Medical University
Objective To study changes in expression of M2 and M3 muscarinic receptor subtypes in the medial vestibular nucleus using a guinea pig model of recurrent vertigo caused labyrinthine fistula.Method Adult guinea pigs(n=88) were randomly divided to receive sham-operation(group A,n=8),unilateral labyrinth lesioning(group B,n=40),or labyrinthine fistula modeling and pneumatic otoscope treatment(group C,n=40).Guinea pigs in groups B and C were randomly selected to be sacrificed at 1 day,3 days,1 week,2 weeks or 3 weeks post-operatively(n=8 at each time point),while animals in group A were sacrificed at 3 weeks post-operation.Following fixative perfusion,the brain stem was harvested and expression of muscarinic receptors M2 and M3 subtypes in the MVN was examined by immunohistochemistry and compared among different groups.Results Muscarinic receptor M2/M3 subtypes decreased in MVN on both sides after operation in animals from groups B and C.Expression was the lowest at day 1,and rose from day 3 to day 7 after operation.Significant difference was seen between groups A and C at day 7 after operation(P<0.05),but not between groups B and A.At 2 weeks after operation,there was no difference between groups C and A.M2/M3 expression in group C was also weaker than that in group B group before two weeks after operation).There was no side-to-side difference in any groups.Conclusion 1.M2 and M3 muscarinic receptor subtypes are expressed in the MVN in guinea pigs,with seemingly less M3 receptor expression than M2 receptor expression.These receptors may promote the normal process in the early stage of vestibularcompensation.2.In addition to the involvement of the cholinergic system,vestibular compensation may also involve other neurotransmitters or chemical substances.3.The data provide additional evidence supporting the successful modeling of recurrent vertigo by labyrinthine fistula.
recurrent vertigo;labyrinthine fistula;vestibular compensation、medial vestibular nucleus;muscarinic receptors;guinea pigs
R764.1
A
1672-2922(2016)05-674-7
2016-03-14审核人:于宁)
10.3969/j.issn.1672-2922.2016.05.024
广西自然科学基金(基金任务书编号:2015GXNSFAA414004);广西自然科学基金(项目任务书编号:2016GXNSFAA380150)
饶秀丽,硕士研究生,研究方向:眩晕中枢代偿机制的研究
尹时华,Email:shihuayin@126.com

