高强度周期性静水压对人软骨细胞超微结构及II 型胶原分泌的影响
王鑫 白倩 徐奎 裘秀春 范清宇 马保安
高强度周期性静水压对人软骨细胞超微结构及II 型胶原分泌的影响
王鑫 白倩 徐奎 裘秀春 范清宇 马保安
目的 体外观察高强度周期性静水压对人膝关节软骨细胞形态和超微结构及其 II 型胶原分泌水平的影响。方法 取正常成人膝关节软骨组织,采用两步酶消化法体外分离培养软骨细胞,分为 2 组:对照组,不施加压力;高压实验组,应用多功能恒温体外细胞培养中高压静水压力加载装置施加 10.0 mPa 压力,共 5 天,每日 2 h。甲苯胺蓝染色法鉴定软骨细胞;倒置相差显微镜观察加压后软骨细胞形态的变化;利用透射电镜观察加压后软骨细胞内超微结构的变化。II 型胶原免疫组织化学染色法检测并半定量分析加压后软骨细胞 II 型胶原分泌水平的变化。结果 经高强度压力作用后,与对照组相比,高压实验组软骨细胞从形态上由多边形或不规则形变为长梭形,胞膜、胞质回缩,细胞量明显减少,生长稀疏;透射电镜观察显示,高压实验组软骨细胞出现染色体分布不均、染色体边集等细胞凋亡指征;II 型胶原免疫组织化学染色及半定量分析显示,高压实验组软骨细胞染色面积 ( 43.76±5.61 ) %,较对照组染色面积 ( 61.64±6.19 ) % 相比,大小和程度均明显降低 ( P<0.05 )。结论 超过人生理范围的高强度压力作用,可视为一种机械应力损伤,会引起软骨细胞形态和细胞内超微结构的改变,并导致软骨细胞的凋亡和蛋白分泌的下降,以上实验数据的获取,为进一步研究压力损伤与骨关节炎发病机制的联系奠定了实验基础。
软骨细胞;压力;超微结构;透射电镜;显微镜检查,电子,透射;II 型胶原
现今已发现的骨关节炎 ( osteoarthritis,OA ) 病因虽然只有一部分,仍有许多未涉及的领域,但承重关节的负荷因素已经得到肯定,关节内频繁的压力作用和创伤性力量的损伤都会增加关节骨关节炎发生的风险[1]。关节软骨组织主要的生理作用就是支持体重和各种负载,以及减少关节活动时关节骨头之间的摩擦。关节软骨始终暴露在来源于体重、肌肉张力、姿势维持和身体活动所造成的各种压力负荷下。关节软骨具备承受这些压力负荷的能力主要依赖其软骨基质的结构和成分。软骨基质是由软骨细胞产生的,因此它是软骨细胞充分发挥功能的基础[2]。II 型胶原 ( type II co1lage ) 作为软骨细胞基因表达的特异性产物,是软骨基质的主要有机成分,其质和量的改变都会对关节软骨的生物力学特性造成直接影响,与骨关节炎有着密切关系[3-4]。许多体外实验研究都显示机械应力或静水压力 ( HP )对软骨细胞代谢起到重要的调节作用,静水压力的加载强度、作用频率和持续时间的变化也对体外培养软骨细胞的生物合成具有重要影响[5-10]。本研究通过给体外培养的人膝关节软骨细胞施加高强度的周期性静水压力,探讨高压力刺激对人软骨细胞的形态和超微结构,及其 II 型胶原分泌水平的影响。
材料与方法
一、标本取备
实验标本均取自第四军医大学唐都医院骨科手术室急诊截肢患者或骨肿瘤截肢患者的手术废弃标本,从中获得无菌的正常膝关节软骨组织,标本获取均经患者知情同意,共 12 例,其中男 9 例,女3 例,患者平均年龄 ( 27.60±14.53 ) 岁,均无关节病史。
二、实验仪器与试剂
倒置相差显微镜及照相系统 ( Olympus,Japan );透射电子显微镜 ( JEM-2000EX,Japan );多功能恒温体外细胞培养中高压静水压力加载装置;细胞培养箱 ( Thermo,USA );DMEM / F12 培养基、胎牛血清 ( FBS,PAA,Austria );鼠抗-人 II 型胶原一抗( Abcam,UK );二抗试剂盒 ( Gene Tech,China );甲苯胺蓝 ( Sigma,USA );胰蛋白酶 ( Gibco,USA );II 型胶原酶 ( Sigma,USA )。
三、试验方法
1.关节软骨细胞的分离与培养与鉴定:将人膝关节软骨标本移至超净台,去除多余组织,剪切成 1 mm3左右碎块,PBS 冲洗 3 遍;加入 0.25%胰蛋白酶,37 ℃ 消化 30 min,加入含血清培养液终止消化,1000 r / min 离心 5 min,收集细胞;再加入 0.2% II 型胶原酶,37 ℃ 消化 16 h,收集细胞,过滤收集细胞,PBS 洗 2 遍,加入含 10% 血清DMEM / F-12 培养液制成细胞悬液,移入培养瓶内。置于 37 ℃,5% CO2,饱和湿度培养箱内培养。取软骨细胞进行甲苯胺蓝染色鉴定,在 6 孔板的玻片上进行细胞爬片。待细胞贴壁后,弃去培养液,PBS 清洗 2 遍,4% 多聚甲醛固定,1% 甲苯胺蓝( Sigma,USA ) 染色 30 min,无水乙醇脱水,中性树胶封片。倒置相差显微镜下观察并照相记录。
2.实验分组和压力处理:本实验采用自行设计并已申请国家实用新型专利 ( 专利号:CN20322 9539U ) 的多功能恒温体外细胞培养中高压静水压力加载装置进行压力处理。该系统以培养瓶内培养液作为媒介将压力传递给软骨细胞[11-12],以注入压缩气体来升高容器内压力。本实验分为 2 组:正常对照组 ( Control )、高压实验组 ( 10.0 mPa )。将实验用软骨细胞浓度调整为 1×106/ml,待细胞贴壁约20%~30% 时,将高压实验组细胞放入高压恒温静水压加载系统中,加载 10.0 mPa 高强度压力,恒温加压培养,每天加压培养 2 h,共 5 天;正常细胞组为不施加压力的对照组,常规条件下培养。
3.倒置相差显微镜观察:倒置相差显微镜观察压力实验前后对照组和实验组软骨细胞的形态变化和生长情况,并照相记录。
4.透射电镜的标本制备与观察:取正常对照组和高压实验组软骨细胞,用 0.25% 胰蛋白酶消化3 min,充分吹打使细胞完全离壁,置离心管内,3000 r / min,离心半径 14.5 cm,离心 15 min,轻轻吸出上清液,加入 3% 戊二醛固定液,将细胞团( 1 mm3大小 ) 固定 3 h。用 0.1 mol / L 磷酸缓冲液漂洗细胞团 3 次,每次 10 min,加入 1% OsO4固定液后固定 2 h。以 0.1 mol / L 磷酸缓冲液洗 3 次,每次 10 min。用 50%、70%、95% 丙酮系列脱水各10 min。100% 丙酮脱水 2 次,各 10 min。100% 丙酮与包埋剂 ( Epon812 ) 按 1∶1 混合,浸透细胞团30 min,换纯包埋剂过夜。60 ℃ 聚合 24 h,超薄切片 ( 厚度约 50 nm ),醋酸铀、柠檬酸铅双重染色。标本用 JEM-2000EX 透射电镜 ( Bar 2.0 µm ) 观察、照相。
5.II 型胶原免疫组织化学染色:取正常对照组和高压实验组软骨细胞,分别在 6 孔板中的玻片上进行细胞爬片,细胞浓度 1×105/ml。细胞贴壁后,取出并冲洗玻片,4% 多聚甲醛室温固定 20 min,双蒸水冲洗 10 min;1% Tritonx-100 处理 10 min,PBS洗 3 次;3% H2O2处理 15 min,PBS 洗 3 次。血清封闭 20 min,去除血清,滴加 1∶100 稀释的 II 型胶原单克隆抗体,湿盒 4 ℃ 孵育过夜;滴加生物素标记的二抗,温室孵育 1 h。滴加 DAB 显色 3 min,双蒸水冲洗,苏木素复染 30 s,无水乙醇脱水,中性树胶封片,倒置相差显微镜下观察并照相记录。采用图像分析系统 image-pro plus 对两组软骨细胞的染色面积及程度进行半定量分析。每组 10 张片子的染色面积百分比取平均值统计分析对比。
四、统计学处理
结 果
一、甲苯胺蓝染色鉴定软骨细胞
实验用软骨细胞经甲苯胺蓝染色后,细胞内及细胞周围可见蓝紫色异染颗粒,单层生长的软骨细胞区域呈浅蓝色,集落生长或多层生长的软骨细胞区域呈深蓝色 ( 图 1 )。
二、倒置相差显微镜观察
压力加载实验后,正常对照组软骨细胞膜伸展,呈多边形或不规则形,细胞间接触紧密,呈典型铺路石样 ( 图 2a )。高压实验组软骨细胞多呈长梭形,细胞膜不够舒展,胞质回缩,细胞量较少,且生长稀疏 ( 图 2b )。
三、软骨细胞超微结构观察
压力加载实验后,正常对照组软骨细胞细胞核大,核膜完整,核内陷,有 1~3 个大小不等的核仁,核仁明显,主要为常染色质;细胞内粗面内质网发育良好,滑面内质网少见,线粒体结构正常;胞膜完整,胞质内偶见溶酶体、脂滴,胞浆丰富、糖原颗粒密集分布 ( 图 3a )。高压实验组软骨细胞染色体分布不均匀、出现染色体边集等细胞凋亡指征;细胞内粗面内质网扩张,呈囊泡状,线粒体扩张、嵴消失、空泡化;胞膜不完整,胞质内出现大量的溶酶体和脂肪滴,部分细胞内可见到空泡,糖原颗粒失去正常密度 ( 图 3b )。
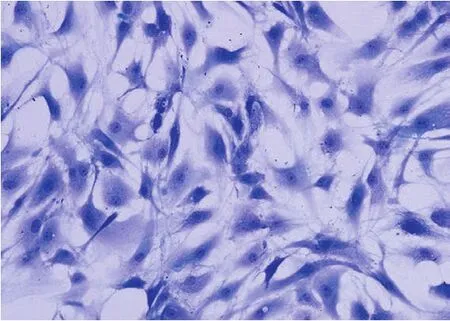
图1 甲苯胺蓝染色鉴定软骨细胞 ( × 200 )Fig.1 Identification of chondrocytes by toluidine blue staining ( × 200 )
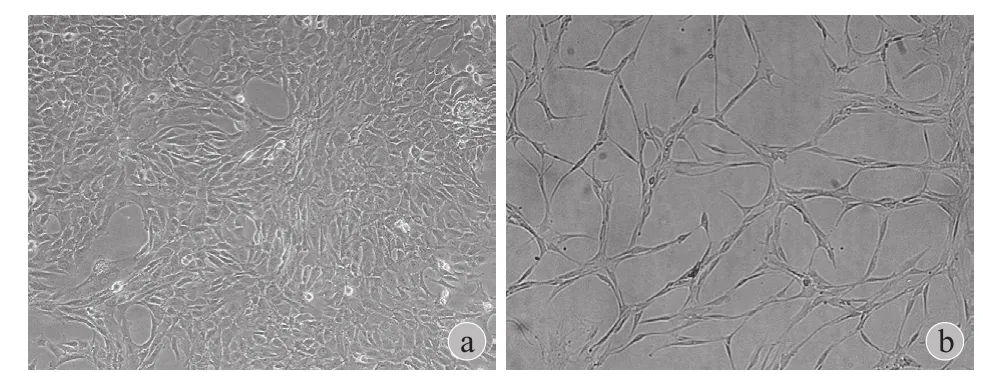
图2 a~b:光学显微镜观察软骨细胞 ( × 100 )Fig.2 a - b: To observe the chondrocytes by light microscopy ( × 100 )
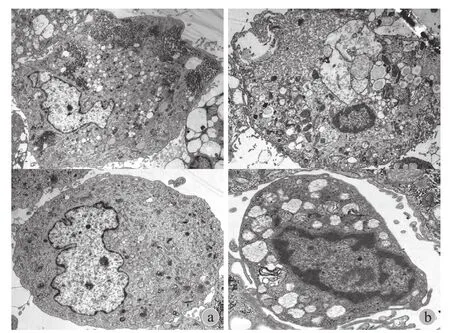
图3 a~b:透射电镜观察软骨细胞超微结构 ( Bar 2.0 µm )Fig.3 a - b: The ultrastructure of chondrocytes were observed by transmission electron microscopy ( Bar 2.0 µm )
四、II 型胶原免疫组织化学染色
压力加载实验后,观察染色图发现,两组软骨细胞 II 型胶原免疫组织化学染色均呈阳性反应,细胞核为苏木素衬染的蓝色,胞浆及细胞外基质染色为棕黄色,且正常对照组软骨细胞 ( 图 4a ) 的染色面积及程度明显高于高压实验组软骨细胞 ( 图 4b )。采用 image-pro plus 系统对两组棕黄色染色面积进行图像分析,正常对照组软骨细胞染色面积百分比为( 61.64±6.19 ) %,高压实验组软骨细胞染色面积百分比为 ( 43.76±5.61 ) %,配对 t 检验结果显示 ( t=6.726 ),差异有统计学意义 ( P<0.05 )。

图4 a~b:II 型胶原免疫组织化学染色 ( × 100 )Fig.4 a - b: Collagen type II immunohistochemical staining ( × 100 )
讨 论
在各种体力活动和体育运动中,承重关节的关节软骨表现出优良的力学性能。有研究表明,关节内适当的机械应力刺激对关节软骨的修复和功能保持具有重要意义[13-14]。与此相反,异常的机械应力( 如持续不断的压力或冲击性压力 ) 会导致软骨细胞的凋亡和软骨基质的降解,并可能最终导致骨性关节炎的发生[15]。另外,关节软骨细胞的代谢能力也取决于机械应力因素的影响[16-17]。体外实验研究显示了压力负荷作为关节软骨细胞代谢调节器的重要性。
在机械应力的作用下,软骨细胞通过改变其代谢水平和力学传导过程来合成和维持软骨基质。软骨细胞对这些机械应力刺激的反应引起了关节软骨基因表达的变化、蛋白质的合成、基质的组成和最终的生物力学性能。Nerucci 等[18]研究了周期性静水压力及持续性静水压力对骨关节炎和正常软骨形态学及超微结构的影响,在接近生理状态的周期性静水压力下正常软骨细胞没有任何改变,骨关节炎的软骨细胞在形态学及超微结构方面均表现出修复,而受持续静水压力的正常及骨关节炎软骨则表现出不同程度的退变,证实静水压力会影响蛋白、细胞骨架和细胞器,压力对软骨细胞的压缩导致细胞和细胞外基质的变形,以及物理化学方面的改变,包括基质液体含量的改变、固定电荷密度的改变、流动离子浓度和渗透压的改变等,且软骨的这种反应会根据压力加载的强度、频率和持续时间来进行调整[5-6,13,19-20]。有研究证实,较低的循环静水压 ( 1~5 mPa ) 对软骨细胞的新陈代谢[21-22]和形态维持有积极的作用[23],在人的日常生活中,正常步态情况下其膝关节经常遇到的压力水平约为 3~5 mPa,这种强度的压力并没有改变软骨细胞的形态、细胞器和骨架结构,而在一些剧烈活动或高负荷损伤中,压力可以达到甚至超过 8~10 mPa[17]。我们采用压力的时间尽可能短 ( 2 h ),以尽量模拟生理条件下人膝关节内的压力环境,目的在于研究周期性高强度静水压 ( 10 mPa ) 对体外培养的人承重关节正常软骨细胞形态、细胞器和蛋白分泌的影响。本实验利用多功能恒温体外细胞培养中高压静水压力加载装置对软骨细胞施加高强度的周期性静水压力后,与未施加压力的对照组比较,在已超出人正常活动膝关节软骨所受压力范围上限的高强度压力( 10 mPa ) 作用下,高压实验组软骨细胞表现出明显的形态学改变,并在微观结构上出现染色体分布不均、染色体边集等细胞凋亡指征。有研究发现,软骨承受压力后会引起软骨细胞胞质内产生相应的反应,如粗面内质网、高尔基体等细胞器含量、结构的变化[24-25],这些变化会直接影响软骨细胞合成基质的功能,软骨细胞胞质主要由不同的胶原成分、蛋白酶、蛋白多糖组成,其中 II 型胶原含量最多并且也是最具特征的指标,可以通过其来确定软骨细胞的表型。II 型胶原免疫组织化学染色见软骨细胞及胞外基质呈棕黄色则为阳性,高压实验组软骨细胞的 II 型胶原分泌和表达量明显减少。说明模拟人生理条件下膝关节在剧烈活动和承受高负荷时关节内所受压力的高强度周期性静水压力可能造成对软骨细胞形态、细胞器和骨架结构的损伤,影响其关键蛋白的分泌,促进软骨细胞的凋亡与坏死。本研究通过体外模拟人负重关节软骨细胞的过度受压情况,试从微观层面和关键蛋白分泌的角度对软骨细胞的压力损伤机制进行探索,除上述结论外,通过实验我们还发现在高强度静水压力作用下,软骨细胞出现细胞凋亡增加的同时伴有相当数量的细胞坏死,对此现象本实验将继续进一步研究。本研究通过已建立的压力实验模型可有效地将静水压力的力学信号传导给细胞,但力学信号是如何转化为细胞的生物学信号,从而发挥作用的,其机制和通路目前尚不明确,也是下一步实验研究的方向。
[1] Felson DT.An update on the pathogenesis and epidemiology of osteoarthritis.Radiologic Clinics North America, 2004, 42(1):1-9.
[2] Poole CA.The structure and function of articular cartilage matrices.Inflammatory Disease and Therapy, 1993, 12:1.
[3] DeGroot J, Verzijl N, Budde M, et a1.Accumulation of advanced glycation end products decreases collagen turnover by bovine chondroeytes.Exp Cell Res, 2001, 266(2):303-310.
[4] Henrotin Y, Addison S, Kraus V, et a1.Type II collagen markers in osteoarthritis: what do they indicate.Curr Opin Rheumatol, 2007, 19(5):444-450.
[5] Hall AC, Urban JPG, Gehl KA.The effects of hydrostatic pressure on matrix synthesis in articular cartilage.J Orthop Res, 1991, 9(1):1-10.
[6] Parkkinen JJ, Ikonen J, Lammi MJ, et al.Effects of cyclic hydrostatic pressure on proteoglycan synthesis in cultured chondrocytes and articular cartilage explants.Arch Biochem Biophys, 1993, 300(1):458-465.
[7] Parkkinen JJ, Ikonen J, Lammi MJ.Arch Biochem Biophys, Torzilli PA, Grigiene R.Continuous cyclic load reduces proteoglycan release from articular cartilage.Osteoarthritis Cartilage, 1998, 6(4):260-268.
[8] Guilak F, Mow VC.The mechanical environment of the chondrocyte: a biphasic finite element model of cell-matrix interactions in articular cartilage.J Biomech, 2000, 33(12): 1663-1673.
[9] Smith RL, Lin J, Trindade MC, et al.Time-dependent effects of intermittent hydrostatic pressure on articular c on rocyte type IIcollagen and aggrecan mRNA expression.J Rehabil Res Dev, 2000, 37(2):153-161.
[10] Toyoda T, Seedhom BB, Yao JQ, et al.Hydrostatic pressure modulates proteoglycan metabolism in chondrocytes seeded in agarose.Arthritis Rheum, 2003, 48(10):2865-2872.
[11] Nakai H, Niimi A, Ueda M, et al.The influence of compressive loading growth of cartilage of the mandibular condyle in vitro.Arch Oral Biol, 1998, 43(7):505-515.
[12] Yousefian J, Firouzian F, Shanfeld J, et al.A new experimental model for studying the response of periodontal ligament cells to hydrostatic pressure.Am J Orthop, 1995, 108(4):402-409.
[13] Grodzinsky AJ, Kim YJ, Buschmann MD, et al.Response of the chondrocyte to mechanical stimuli.Osteoarthritis, 1998: 123-136.
[14] Kiviranta I, Tammi M, Jurvelin J, et al.Articular cartilage thickness and glycosaminoglycan distribution in the young canine knee joint after remobilization of the immobilized limb.J Orthop Res, 1994, 12(2):161-167.
[15] Brandt KD.Insights into the natural history of osteoarthritis provided by the cruciate-deficient dog.Ann New York Acad Sci, 1994, 732(1):199-205.
[16] Urban JPG.The chondrocyte: a cell under pressure.Rheumatology, 1994, 33(10):901-908.
[17] Hodge WA, Fijan RS, Carlson KL, et al.Contact pressures in the human hip joint measured in vivo.Proc Natl Acad Sci USA, 1986, 83(9):2879-2883.
[18] Nerucci F, Fioravanti A, Collodel G, et al.Effect of hydrostatic pressure on morphological and ultrastructural aspects of normal and osteoarthritic human articular chondrocytes.“Bollettino della Societa italiana di biologia sperimentale.” Boll Soc Ital Biol Sper, 1999, 75(9-10):55-62.
[19] Hall AC, Urban JPG, Gehl KA.The effects of hydrostatic pressure on matrix synthesis in articular cartilage.J Orthop Res, 1991, 9(1):1-10.
[20] Korver TH, Van de Stadt RJ, Kiljan E, et al.Effects of loading on the synthesis of proteoglycans in different layers of anatomically intact articular cartilage in vitro.J Rheumatol, 1992, 19(6):905-912.
[21] Nerucci F, Fioravanti A, Cicero MR, et al.Effects of chondroitin sulfate and interleukin-1β on human chondrocyte cultures exposed to pressurization: a biochemical and morphological study.Osteoarthritis Cartilage, 2000, 8(4): 279-287.
[22] Fioravanti A, Cantarini L, Chellini F, et al.Effect of hyaluronic acid (MW 500-730kDa) on proteoglycan and nitric oxide production in human osteoarthritic chondrocyte cultures exposed to hydrostatic pressure.Osteoarthritis Cartilage, 2005, 13(8):688-696.
[23] Fioravanti A, Nerucci F, Annefeld M, et al.Morphological and cytoskeletal aspects of cultivated normal and osteoarthritic human articular chondrocytes after cyclical pressure: a pilot study.Clin Exp Rheum, 2003, 21(6):739-746.
[24] Buschmann MD, Hunziker EB, Kim YJ, et al.Altered aggrecan synthesis correlates with cell and nucleus structure in statically compressed cartilage.J Cell Sci, 1996, 109(4):499-508.
[25] Parkkinen JJ, Lammi MJ, Pelttari A, et al.Altered Golgi apparatus in hydrostatically loaded articular cartilage chondrocytes.Ann Rheum Dis, 1993, 52(3):192-198.
( 本文编辑:李贵存 )
Effects of high-intensity cyclical hydrostatic pressures on the ultrastructure and type II collagen expression of chondrocytes of knee joint in human
WANG Xin, BAI Qian, XU Kui, QIU Xiu-chun, FAN Qing-yu, MA Bao-an.
Lintong Sanatorium, Lanzhou Military Command of Chinese People’s Liberation Army ( PLA ), Xi’an, Shanxi, 710600, PRC
Objective To investigate the effects of high-intensity cyclic hydrostatic pressures on the ultrastructure and type II collagen contents of chondrocytes of the knee joint cultured in vitro in human.Methods The normal chondrocytes of human knee joint were isolated and cultured in vitro.The 3rd generation of chondrocytes were treated with high-intensity cyclical hydrostatic pressures ( 10.0 mPa ) by the multifunctional thermostatic high-insensitive hydrostatic pressure loading device for 2 h per day lasting for 5 days.Toluidine blue staining and immunohistochemical staining of type II collagen were employed to identify the chondrocytes.Cell morphology was observed by light microscopy.The ultrastructure of chondrocytes were observed by transmission electron microscopy ( TEM ).Type II collagen immunohistochemical staining and semi-quantitative analysis were performed to measure contents and expression of type II collagen of chondrocytes in 2 groups.Results Compared with the control group, cell morphology changed from irregular polygon into long spindle, membrane and cytoplasm retracted, the number of cells was reduced significantly and grew sparsely in the 10.0 mPa group.TEM showed that various apoptosis indications such as uneven distribution and margination of chromosomes in the 10.0 mPa group.Collagen type IIimmunohistochemistry and semi-quantitative analysis showed that the percent of stained area of control group and 10.0 mPa group was ( 61.64 ± 6.19 ) % and ( 43.76 ± 5.61 ) %, compared with the control group, the stained area and extent of chondrocytes were significantly decreased in the 10.0 mPa group ( P < 0.05 ).Conclusions The highintensity pressure over human physiological range can be regarded as a mechanical injury to result in cell apoptosis, morphology and intracellular ultrastructural changes of human chondrocytes, and also decrease protein expression ofhuman chondrocytes.These data provide the experimental basis for studying the relationship between stress injury and pathogenesis of osteoarthritis.
Chondrocytes; Pressure; Ultrastructure; Transmission electron microscopy; Collagen type IIchondrocytes pressure; Microscopy, electron, transmission; Collagen type II
10.3969/j.issn.2095-252X.2016.12.009
Q256
710600 西安,中国人民解放军临潼疗养院 ( 王鑫 );710005 西安,中国人民解放军第 518 医院骨科 ( 白倩 );710038 西安,第四军医大学唐都医院全军骨科中心暨全军骨肿瘤研究所 ( 徐奎、裘秀春、范清宇、马保安 )
马保安,Email: maban@fmmu.edu.cn
2016-07-27 )

