玉米中介体亚基ZmMED7基因的克隆及表达分析
王 晶, 赵 军, 宗 娜*
1.中国农业科学院生物技术研究所, 作物基因组与遗传改良研究室玉米功能基因组创新团队, 北京 100081;2.中国农业科学院, 农作物基因资源与基因改良国家重大科学工程, 北京 100081
玉米中介体亚基ZmMED7基因的克隆及表达分析
王 晶1,2, 赵 军1,2, 宗 娜1,2*
1.中国农业科学院生物技术研究所, 作物基因组与遗传改良研究室玉米功能基因组创新团队, 北京 100081;2.中国农业科学院, 农作物基因资源与基因改良国家重大科学工程, 北京 100081
为了研究玉米中介体亚基ZmMED7基因的功能,通过荧光定量PCR技术,研究ZmMED7-1和ZmMED7-2在玉米不同组织中的表达及在ABA处理、盐害和渗透胁迫等逆境条件下的应答反应,并将ZmMED7-1和ZmMED7-2转入拟南芥中研究其基因功能。结果显示,ZmMED7在玉米不同发育时期的组织器官中均有表达,ZmMED7-1和ZmMED7-2分别在V1和V5期的叶片中表达量最高。ABA、盐害和渗透胁迫等处理都能够抑制ZmMED7-1和ZmMED7-2 基因的表达。过表达ZmMED7-1导致拟南芥在种子萌发时期对盐胁迫的耐受能力减弱。研究结果说明:ZmMED7基因作为负调控因子参与了植物逆境胁迫应答反应。
转录中介体;表达分析;逆境胁迫
玉米是世界上除小麦和水稻外最重要的粮食作物和饲料来源,也是全世界总产量最高的粮食作物。在自然环境中,玉米生产常会受到冷、热、旱、涝和盐等非生物逆境的影响[1]。在各种环境胁迫中,干旱和高盐对植物生长发育的影响最大,为适应环境改变,植物进化出了一系列应答机制[1,2]。转录中介体(mediator)是由多个蛋白亚基组成的复合体,是一种重要的转录辅助因子,它将接收的各种生理和发育信号从特定转录因子传递给RNA聚合酶Ⅱ[3,4],从而调控下游基因的表达。研究表明,在植物生长发育的多个阶段包括胚胎发育、花和根的发育及籽粒形成[5]过程中,转录中介体都起到非常重要的作用。此外,转录中介体通过激活植物自身的防卫机制参与抗病信号途径和非生物胁迫应答反应[6,7]。
MED7是转录中介复合体中间模块的一个重要组成亚基[8],在不同物种中具有高度保守性。转录中介复合体中间模块一般由MED1、MED4、 MED7、 MED9、 MED10、 MED21和MED31等7种亚基组成,该模块对于激活子和核心转录机制的连接是必须的。其中,MED7的N端与高度保守的MED31组成了具有独特结构和功能的子模块,Med7N/31二聚体在体内对蛋氨酸代谢及铁运输基因具有正调控功能[9]。在酿酒酵母中,Med7突变引发位于亚端粒X元件附近中介复合体的缺失,从而导致亚端粒基因的沉默[10]。有研究表明,在正常培养条件下,C.albicansCaMed7缺失并不会导致白色念珠菌活力的丧失,但显著影响了白色念珠菌在不同碳源中的存活能力及菌丝和生物膜形成的能力[11]。
植物中关于MED7功能的报道并不多。研究发现,在水稻中,OsMED7通过SA介导的信号转导途径负向调控对白叶枯病菌的防卫反应[12]。水稻和拟南芥中的研究表明,转录中介体不仅可以作为基因表达的基础调节子,在植物发育和非生物胁迫中也扮演了特定角色[8]。ZmMED7是否参与植物发育和对非生物胁迫逆境的应答反应,到目前为止还没有相关报道。本课题组通过同源搜索发现玉米基因组中有2个MED7基因,并且从玉米自交系齐319中克隆得到了ZmMED7-1和ZmMED7-2基因,然后对ZmMED7基因在玉米组织中的表达,及其在ABA、盐害和渗透胁迫等逆境处理下的表达进行了分析。最后构建了ZmMED7基因过表达的转基因拟南芥,并分析了转基因拟南芥在盐胁迫下的萌发情况,以期为进一步研究玉米ZmMED7基因的功能打下基础。
1 材料与方法
1.1 材料
1.1.1 试剂 反转录试剂盒、TaqDNA Polymerase 购自北京全式金生物有限公司;实时定量PCR试剂盒购自TaKaRa公司;ABA、NaCl和PEG均购自Sigma公司;其他试剂均为国产试剂;引物和测序均由北京博爱永华有限公司完成。
1.1.2 植物材料 以玉米自交系齐319和拟南芥Columbia-0为材料。
1.2 方法
玉米材料种植于温室中,温室条件为:白天:26℃,夜晚:18℃,光照16 h,黑暗8 h。采用盆栽的方法,蛭石∶营养土∶黄土=1∶1∶3混和。选取刚萌发的种子,V1、V5时期的叶片、根,吐丝期的雌穗和刚抽雄的雄穗,授粉4 d、8 d和12 d后的籽粒作为研究材料。
1.2.1 ABA激素、盐害和渗透胁迫处理方法 将催芽的玉米齐319种子播种到蛭石中,待其长到一叶一心期(一片真叶一片子叶)开始处理,用不同浓度(0、0.1 μmol/L、0.5 μmol/L、1 μmol/L、5 μmol/L和10 μmol/L)的ABA溶液喷施叶片,然后在不同时间点取材(0、0.25 h、0.5 h、1 h、3 h、6 h、12 h),以喷施水的处理作为对照。盐害和渗透胁迫处理: 将一叶一心期的玉米从蛭石中取出,用自来水冲洗根部,然后将根部浸泡于不同浓度的NaCl(0、100 μmol/L、200 μmol/L、250 μmol/L和300 μmol/L)和PEG(0.5%、10%、15%和20%)溶液中,在不同时间点(0、0.25 h、0.5 h、1 h、3 h、6 h、12 h)取材,以浸泡水的处理作为对照。每一个处理取5株幼苗地上部分混合后迅速冻于液氮中,放于-80℃冰箱中备用。
1.2.2 玉米总RNA提取及反转录 用RNAprep pure Plant Kit(北京天根生物技术有限公司)提取玉米RNA,提取方法参照说明书;RNA的反转录参考北京全式金反转录试剂盒EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix。
1.2.3ZmMED7-1和ZmMED7-2基因的克隆 根据拟南芥MED7蛋白的氨基酸序列,在玉米数据库MaizeGDB中搜索到2个同源性较高的cDNA序列,根据序列的碱基信息,设计了扩增ZmMED7-1和ZmMED7-2基因全长的引物:ZmMED7-1-F/ZmMED7-1-R和ZmMED7-2-F/ZmMED7-2-R(引物序列见表1)。
1.2.4 实时定量RT-PCRZmMED7-1基因和ZmMED7-2基因引物分别为:MED7-1-F/MED7-1-R和MED7-2-F/MED7-2-R,以玉米Q-mACTIN1(GenBank登录号J0123)作为内标基因,引物为Q-mACTIN1-Fw/Q-mACTIN1-Rv(引物序列见表1)。使用ABI公司7500进行反应。基因表达量以2-ΔΔCt方法分析。
1.2.5 过表达载体构建、拟南芥转化和抗逆性鉴定 将ZmMED7-1和ZmMED7-2基因扩增产物和pCAMBIA1300质粒分别用KpnⅠ和BstBⅠ酶切,纯化回收酶切产物,通过T4 DNA连接酶将基因酶切回收产物和质粒酶切回收产物进行连接,将ZmMED7-1和ZmMED7-2分别构建到pCAMBIA1300表达载体上,测序获得正确的重组子。将构建好的pCAMBIA1300-ZmMED7-1和pCAMBIA1300-ZmMED7-2表达载体转化农杆菌感受态细胞GV3101。
表1 基因克隆及实时定量引物
Table 1 The primers of gene cloning and Real-time quantitative.

引物名称引物序列(5'→3')退火温度(℃)ZmMED7-1-F5'-ATGGCAATGGCCACATCAGCATCG-3'57ZmMED7-1-R5'-CTAGTTAGTTTGACTTCCATC-3'57ZmMED7-2-F5'-ATGGCAATGGCCACATCATCATCT-3'57ZmMED7-2-R5'-CTAGTTAGCTTGGCTTGCATC-3'57MED7-1-F5'-ATCAGCATCGTACCCTCCACCT-3'57MED7-1-R5'-CTTGAAGTCAATATTGGGAC-3'57MED7-2-F5'-ATCATCATCTTACCCTCCACCA-3'57MED7-2-R5'-CTTGAAGTCAATATTGGGAC-3'57Q-mACTIN1-Fw5'-ACCTCACCGACCACCTAATG-3'57Q-mACTIN1-Rv5'-CTGAACCTTTCTGACCCAAT-3'57
消毒后的拟南芥种子种植于含有或者不含有200 mmol/L NaCl的1/2 MS平板上,避光置于4℃,春化48 h后培养于植物培养箱中培养(白天22℃,黑暗19℃,光照16 h,黑暗:8 h)。利用花序侵染法[13]将玉米ZmMED7-1和ZmMED7-2基因过表达载体转入拟南芥。将收获的拟南芥种子消毒后播种于含有潮霉素(50 mg/mL)的1/2 MS培养基中筛选,生长7 d 后将存活的拟南芥转移至不含抗生素的1/2 MS培养基中恢复培养7 d,再转移至营养钵(蛭石∶营养土为1∶1)中,PCR鉴定筛选出阳性株系。按照此方法,直至筛选出纯合株系。
2 结果与分析
2.1ZmMED7-1和ZmMED7-2基因的克隆
由图1A所示,扩增得到的ZmMED7-1(GRMZM2G061672)和ZmMED7-2(GRMZM2G-066981)PCR产物均为500 bp左右的特异性条带,切胶回收后连接pEASY-BLUNT载体,测序发现,两基因编码的氨基酸同源性高达96%。
由图1B所示,从齐319自交系中克隆的ZmMED7序列和B73中ZmMED7 CDS相似度高达99%,仅仅有几个核苷酸的差异。从齐319中扩增的ZmMED7-1与B73相比,齐319中+63位点A(腺嘌呤)取代了T(胸腺嘧啶),+101位点的T取代了C(胞嘧啶),+477位点的2个A取代了G(鸟嘌呤);从齐319中扩增的ZmMED7-2与B73相比,齐319中+84位点及+327位点的T取代了C。
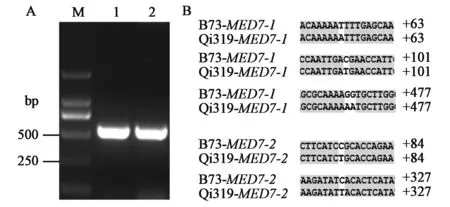
图1 玉米齐319中ZmMED7-1和ZmMED7-2基因的 克隆(A)及其在B73和齐319两个自交系中的序 列差异分析(B)Fig.1 Cloning of ZmMED7-1 and ZmMED7-2 in maize Qi319 (A) and two genes alignment results of the coding sequence of in B73 and Qi319 (B)注:A:M:分子质量标准;1、2:分别代表了ZmMED7-1和ZmMED7-2 PCR产物。
2.2 不同物种间MED7蛋白的同源性比较
利用克隆得到的ZmMED7-1和ZmMED7-2蛋白的氨基酸序列与已经发表的MED7蛋白的氨基酸序列进行比对,结果显示玉米MED7蛋白与拟南芥AtMED7(NP_195970.2)、葡萄VvMED7(XP_002281390.1)、大豆GmMED7(NP_001241256.1) 等MED7具有高度同源性,同源性分别为67%、71%、74%,而且这些MED7蛋白都含有多聚脯氨酸区域,这说明MED7在不同物种间具有高度保守性。

图2 不同物种中MED7蛋白氨基酸序列比对分析Fig.2 Amino acid sequence alignment of MED7 in different species.
2.3 齐319中ZmMED7-1和ZmMED7-2的表达分析
2.3.1ZmMED7-1和ZmMED7-2的组织表达特异性分析 实时定量PCR研究结果表明,在齐319中ZmMED7-1和ZmMED7-2基因在不同发育阶段的组织中均有表达。如图3所示,ZmMED7-1在营养生长初期阶段V1时期的叶片中表达最高,是萌发种子表达量的5倍,吐丝的雌穗中表达次之,在V5时期的根中表达最低;ZmMED7-2在V5时期的叶片中表达最高,是萌发种子表达量的2.5倍,抽雄期的雄穗中表达次之,授粉12 d的籽粒中表达最低。
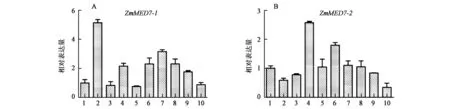
图3 ZmMED7-1(A)和ZmMED7-2(B)在玉米不同发育阶段不同组织中的表达Fig.3 The expression ZmMED7-1(A) and ZmMED7-2(B) in different tissues of maize at different development stage.注:1:萌发种子;2:V1期叶;3:V1期根;4:V5期叶;5:V5期根;6:抽雄期雄穗;7:吐丝期雌穗;8:授粉后4 d的籽粒;9:授粉后8 d的籽粒;10:授粉后12 d的籽粒。
2.3.2ZmMED7-1和ZmMED7-2对不同浓度ABA、NaCl和PEG处理的应答分析 研究选取了一叶一心时期(V1期)的玉米材料进行不同浓度的ABA、NaCl和PEG处理,处理时间为2 h。如图4所示,不同浓度的ABA、NaCl和PEG处理都能够导致ZmMED7-1的表达量下调。其中在0.1 μmol/L ABA,250 mmol/L NaCl和20% PEG处理下ZmMED7-1的表达量最低;ZmMED7-2的表达在不同浓度ABA、NaCl和PEG的处理下也同样受到抑制,其中在0.1 μmol/L ABA,300 mmol/L NaCl和20% PEG处理下ZmMED7-2的表达最低。
2.3.3ZmMED7-1和ZmMED7-2对ABA、NaCl和PEG处理不同时间点的应答分析 为了进一步验证ZmMED7-1和ZmMED7-2基因对ABA、NaCl和PEG处理的响应情况,分别选取1 μmol/L ABA、250 mmol/L NaCl 和20% PEG连续处理V1时期的玉米12 h,然后在不同的时间点取样,分析这两个基因的表达水平。
如图5A所示,1 μmol/L ABA处理下,ZmMED7-1和ZmMED7-2的表达量均表现为下调, 在0.25 h表达量均开始下降,在1 h时表达量均达到最低,随着处理时间增加,表达量开始上升。如图5B所示,250 mmol/L NaCl处理条件下,ZmMED7-1和ZmMED7-2的表达均受到抑制,在3 h时表达量都达到最低,随后表达量开始上升;如图5C所示,20% PEG处理条件下,ZmMED7-1基因的表达表现为下调,在1 h时表达量上升,随着处理时间的增加,表达量随即开始下降,在6 h时达到最低;ZmMED7-2基因的表达量表现为下调表达,在0.5 h和1 h时表达量最低,随着处理时间的增加,表达量上升到未处理水平。
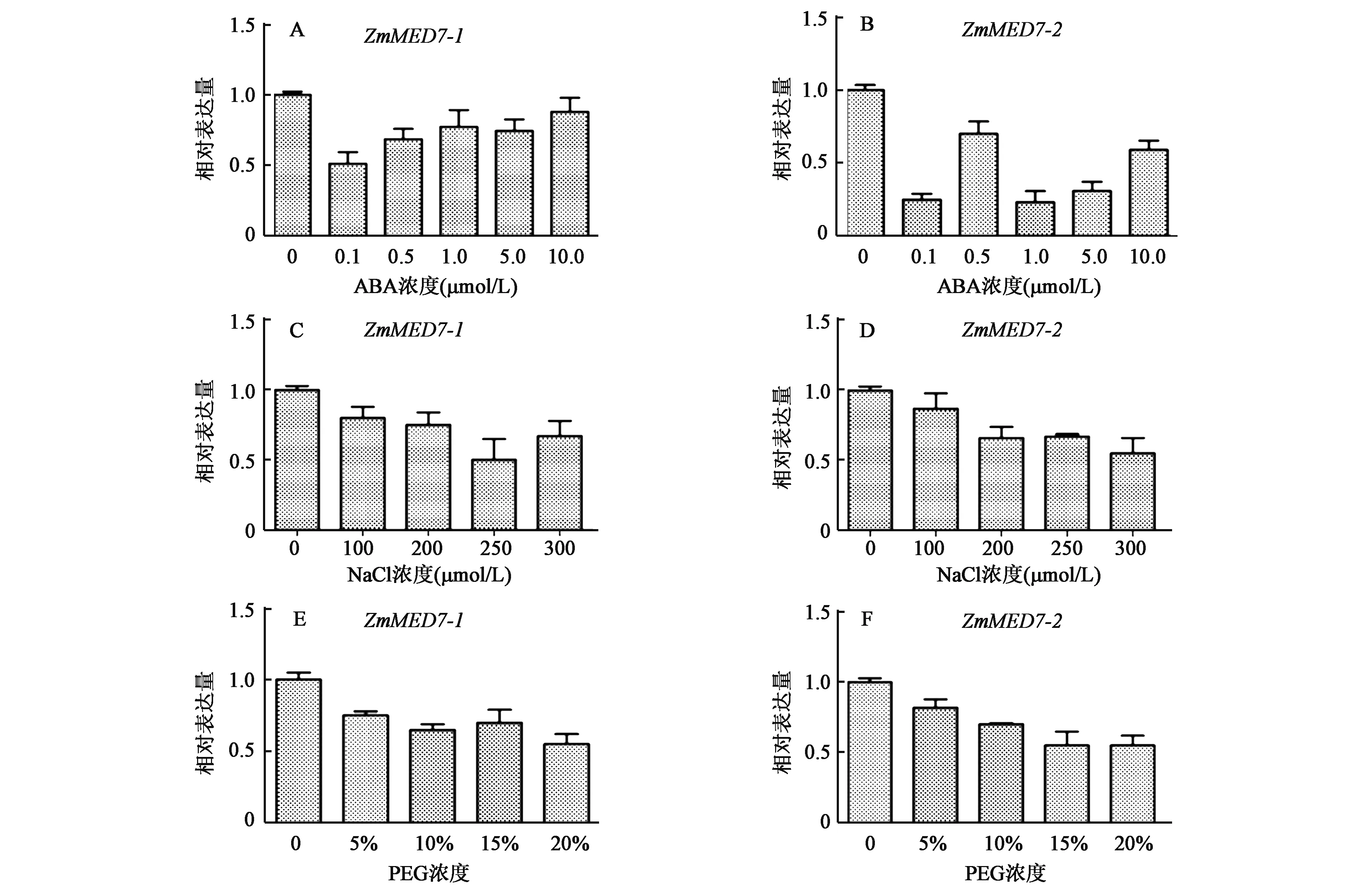
图4 不同浓度 ABA、NaCl和PEG处理下ZmMED7-1和ZmMED7-2基因的表达Fig.4 The expression of ZmMED7-1 and ZmMED7-2 under treatments with ABA、NaCl and PEG. A: 不同浓度ABA处理下ZmMED7-1的表达量;B:不同浓度ABA处理下ZmMED7-2的表达量;C: 不同浓度NaCl处理下ZmMED7-1的表达量;D:不同浓度NaCl处理下ZmMED7-2的表达量;E: 不同浓度PEG处理下ZmMED7-1的表达量;F:不同浓度PEG处理下ZmMED7-2的表达量。
2.4 转基因拟南芥的分子鉴定和NaCl的敏感性分析
2.4.1 转基因拟南芥的分子鉴定 经过T1代抗性筛选共得到ZmMED7-1转基因拟南芥绿色抗性苗123株,ZmMED7-2转基因拟南芥绿色抗性苗150株。随机选取14株进行PCR检测,结果如图4.2所示,阳性率均达到85%,单株收种标记为T2代种子。按照此方法,继续筛选直至筛选出转基因纯合株系。最终选取ZmMED7-1转基因拟南芥纯合株系1-15、3-4和10-2,ZmMED7-2转基因拟南芥纯合株系6-12、9-7和11-6作为实验材料进行NaCl的敏感性鉴定,并利用实时定量PCR检测不同转基因拟南芥株系中ZmMED7-1和ZmMED7-2的表达量 (图6)。
2.4.2 转基因拟南芥对NaCl的敏感性分析 如图7(彩图见封三图版)所示,野生型拟南芥、ZmMED7-1转基因拟南芥及ZmMED7-2转基因拟南芥在含NaCl的培养皿中的萌发率均比不含NaCl的培养皿中的萌发率低。在含有NaCl的培养皿中,ZmMED7-1转基因拟南芥的萌发率与对照组相比显著降低,萌发率由90%左右降至20%左右;ZmMED7-2转基因拟南芥萌发率较对照组相比萌发率没有显著差异。
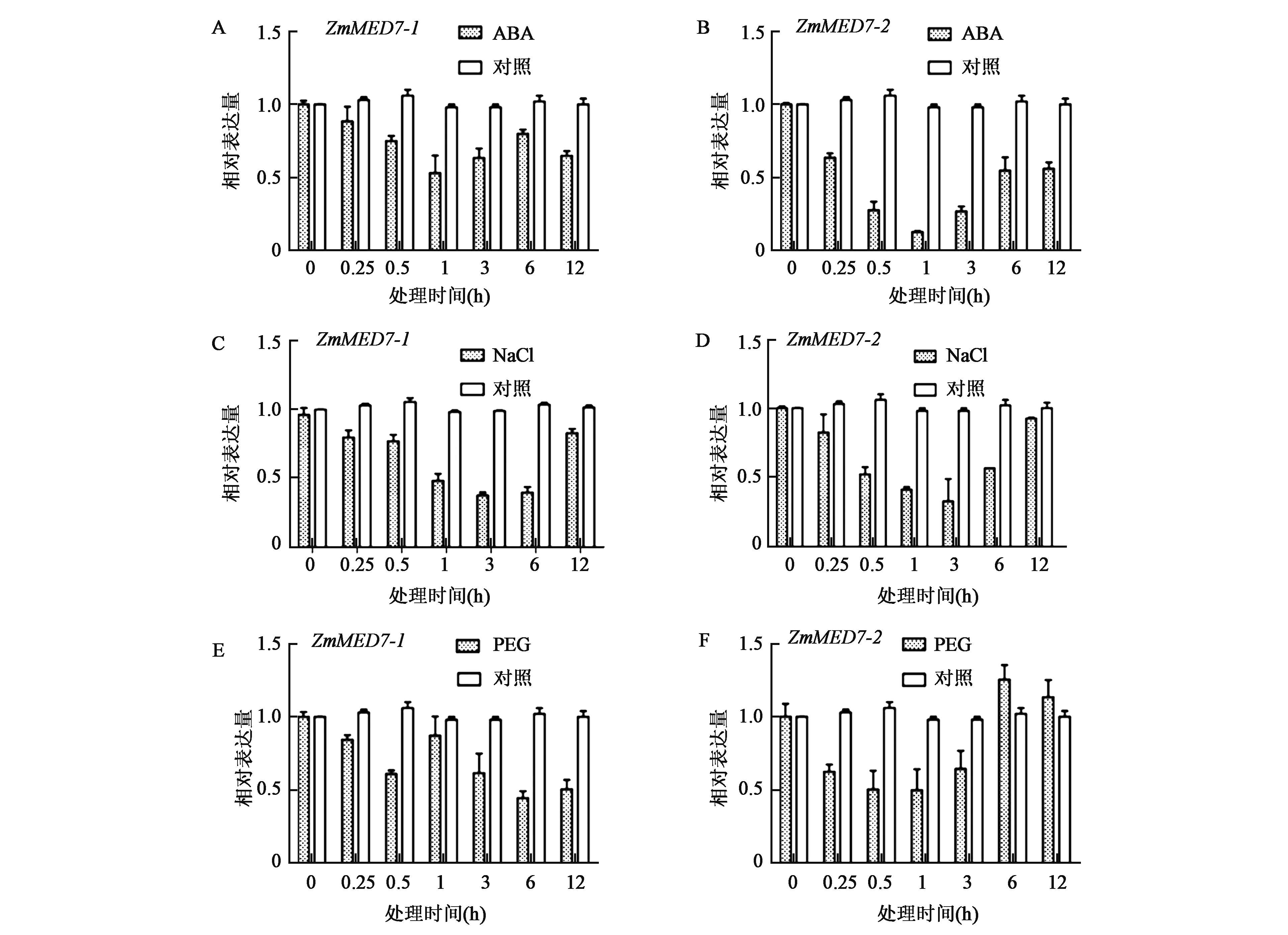
图5 1 μmol/L ABA、250 mmol/L NaCl 和20% PEG处理下ZmMED7-1、ZmMED7-2基因在不同时间点的表达量Fig.5 The expression of ZmMED7-1 and ZmMED7-2 for different time under treatments with 1 μmol/L ABA、 250 mmol/L NaCl and 20% PEG. A: 1 μmol/L ABA处理下ZmMED7-1基因在不同处理时间的表达;B: 1 μmol/L ABA处理下的ZmMED7-2基因在不同处理时间的表达;C: 250 mmol/L NaCl处理下的ZmMED7-1基因在不同处理时间的表达;D: 250 mmol/L NaCl处理下的ZmMED7-2基因在不同处理时间的表达;E: 20% PEG处理下的ZmMED7-1基因在不同处理时间的表达;F: 20% PEG处理下的ZmMED7-2基因在不同处理时间的表达。
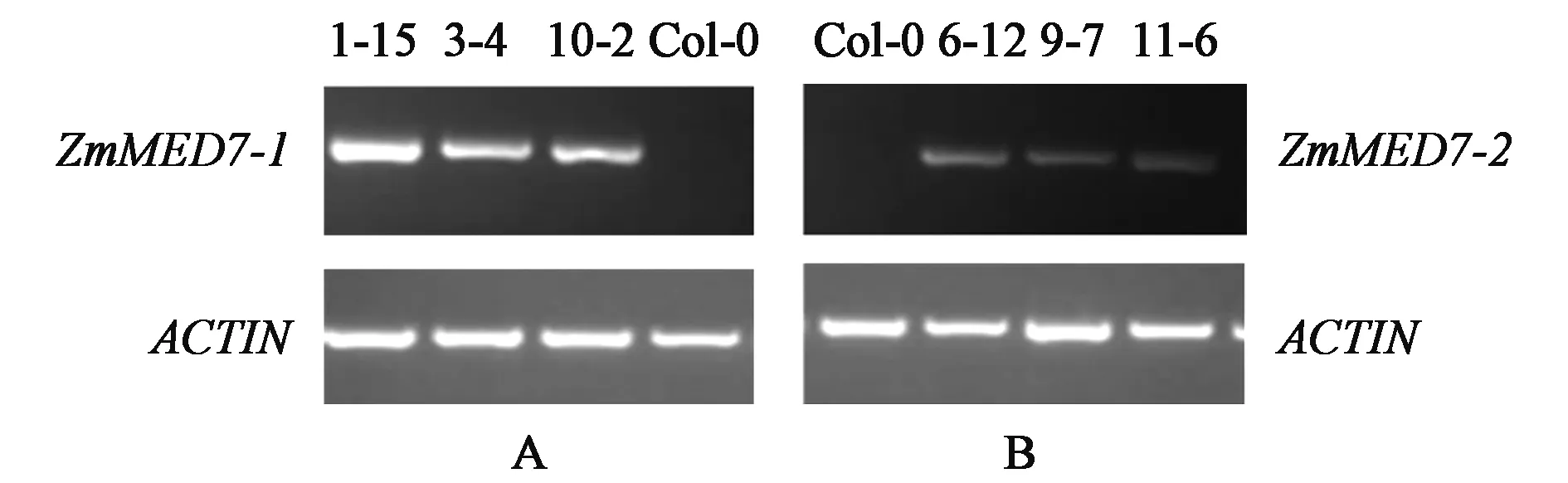
图6 转基因拟南芥不同株系中ZmMED7-1和 ZmMED7-2的表达量Fig.6 The expression of ZmMED7-1 and ZmMED7-2 in transgenic Arabidopsis thaliana. A.转基因拟南芥各个株系中ZmMED7-1的表达量; B.转基因拟南芥各个株系中ZmMED7-2的表达量; Col-0:阴性对照。1-15、3-4、10-2为转ZmMED7-1基因株系;6-12、9-7、11-6为转ZmMED7-2基因株系。
3 讨论
本研究中我们克隆了齐319中的ZmMED7-1和ZmMED7-2。ZmMED7-1和ZmMED7-2基因编码的蛋白含有2个多聚脯氨酸区域,这种结构特征证明了MED7亚基在植物结构上的保守性。
ZmMED7-1在V1时期的叶片中表达最高,在未成熟的雄穗、吐丝的雌穗及授粉4d的籽粒中表达次之,暗示其可能在玉米营养生长早期和生殖发育早期中发挥重要作用。ZmMED7-2在V5时期叶片中的表达较强,在其他不同组织中表达呈现组成型表达模式。ZmMED7-1和ZmMED7-2组织表达模式的差异可能是二者在进化过程中功能分化引起的。水稻OsMED7和玉米ZmMED7-2的组织表达模式相似,水稻OsMED7在授粉6d的胚和胚乳中有较强的表达,在幼苗、茎顶端分生组织、根、成熟叶片、花序生长不同阶段及授粉5~10 d、11~20 d和21~30 d的籽粒等多种组织中表达
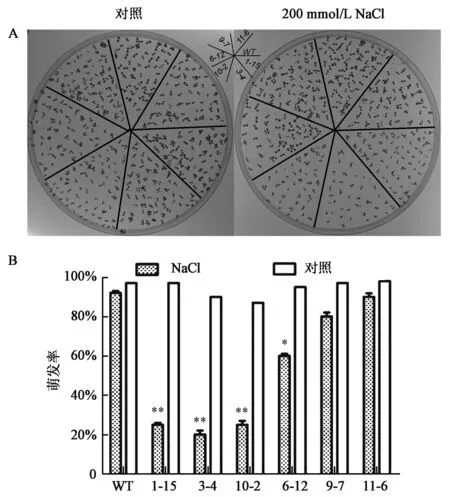
图7 转基因拟南芥的耐盐性鉴定(A)及 萌发率统计(B)Fig.7 The salt resistance of transgenic Arabidopsis thaliana in plate (A) and the survival rates (B).注:WT:野生型;1-15、3-4、10-2为转ZmMED7-1基因株系;6-12、9-7、11-6为转ZmMED7-2基因株系。星号表示不同转基因株系的萌发率与对照相比差异显著(*P<0.05,**P<0.01)。 (彩图见封三图版)
特异性不强,表现出组成型表达的规律[14]。这也进一步验证了MED7亚基在植物进化过程中功能的保守性。
水稻OsMED7能够参与对白叶枯病菌的应答反应。在本研究中ZmMED7-1和ZmMED7-2基因受到ABA、盐害和渗透胁迫的处理后表达下调,ZmMED7-1过表达拟南芥对盐的敏感度降低,说明MED7不仅可以参与对生物胁迫的响应,也可以参与对非生物胁迫的响应。植物生长常受到土壤盐碱化的影响。MED25是目前研究最多的能够参与盐胁迫应答的中介体亚基,Atmed25突变体种子在萌发期对盐胁迫敏感度增加且Med25a突变使得小立碗藓菌株对盐敏感显著增加[15]。ZmMED7-1过表达拟南芥对盐的敏感度明显下降,而ZmMED7-2过表达拟南芥对盐的敏感度没有明显变化,推测这是由两基因表达量差异引起的。
在植物生长发育及对逆境胁迫响应的过程中要依赖多种激素[16]及不同转录因子的参与。在本研究中仅对ZmMED7基因在ABA和非生物逆境处理下的表达做了初步分析,但对于玉米MED7基因是如何参与植物发育及对逆境胁迫应答反应还不清楚,有待进一步验证。不同中介体亚基能够与特定的转录因子结合参与特定的发育过程[5],ZmMED7-1和ZmMED7-2也可能通过与生长发育类相关转录因子互作参与生长发育调节。这些都为进一步研究ZmMED7基因功能提出了研究思路。
ZmMED7-1及ZmMED7-2编码的MED7蛋白均含有多聚脯氨酸区域,在不同物种中具有高度保守性。ZmMED7-1及ZmMED7-2在萌发种子、V1和V5时期叶片和根中、抽雄的雄穗、吐丝的雌穗,授粉4 d、8 d、12 d的籽粒中均有表达,ZmMED7-1及ZmMED7-2分别在V1时期的叶片和V5时期的叶片中表达量最高。ZmMED7-1及ZmMED7-2受 ABA、NaCl、PEG的诱导表达量下调。与非转基因野生型相比ZmMED7-1过表达的转基因拟南芥对NaCl敏感性增强;ZmMED7-2过表达的转基因拟南芥的盐敏感性没有显著改变。
[1] Wang W, Vinocur B, Altman A. Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance[J]. Planta, 2003, 218(1): 1-14.
[2] Zhu J K. Salt and drought stress signal transduction in plants[J]. Ann. Rev. Plant Biol., 2002, 53: 247-273.
[3] 吕建新, 金龙金, 明镇寰.中介体:结构与功能[J]. 生物化学与生物物理进展, 2005,32(8): 712-717.
[4] 尹 娜, 王新娟, 尚永丰. 中介因子复合体在基因转录调控中的作用[J]. 生理科学进展, 2003,34(4): 298-302.
[5] Xu R, Li Y. Control of final organ size by Mediator complex subunit 25 inArabidopsisthaliana[J]. Development, 2011, 138(20): 4545-4554.
[6] Samanta S, Thakur J K. Importance of mediator complex in the regulation and integration of diverse signaling pathways in plants[J]. Front. Plant Sci., 2015, 6: 757.
[7] Kidd B N, Edgar C I, Kumar K K,etal.. The mediator complex subunit PFT1 is a key regulator of jasmonate-dependent defense inArabidopsis[J]. Plant Cell,2009,21(8): 2237-2252.
[8] Mathur S, Vyas S, Kapoor S,etal.. The Mediator complex in plants: structure, phylogeny, and expression profiling of representative genes in a dicot (Arabidopsis) and a monocot (rice) during reproduction and abiotic stress[J]. Plant Physiol., 2011, 157(4): 1609-1627.
[9] Koschubs T, Seizl M, Larivière L,etal.. Identification, structure, and functional requirement of the mediator submodule Med7N/31[J]. EMBO J., 2009, 28(1): 69-80.
[10] Zhu X, Liu B, Carlsten J O,etal.. Mediator influences telomeric silencing and cellular life span[J]. Mol. Cell. Biol., 2011, 31(12): 2413-2421.
[11] Tebbji F, Chen Y, Richard A J,etal.. A functional portrait of Med7 and the mediator complex inCandidaalbicans[J]. PLoS Genet., 2014,10(11): e1004770.
[12] 向 鹏, 龙承波, 罗红丽, 水稻OsMED7基因的克隆及表达分析[J]. 作物杂志, 2013,(3): 21-24.
[13] Zhang X, Henriques R R, Lin S S,etal..Agrobacterium-mediated transformation ofArabidopsisthalianausing the floral dip method[J]. Nat. Prot., 2006, 1(2): 641-646.
[14] 王丰青, 吴为人, 张重义,等, 水稻中介体亚基的表达谱分析及亚细胞定位[J]. 农业生物技术学报, 2012,20(5): 463-472.
[15] Elfving N, Davoine C, Benlloch R,etal.. TheArabidopsisthalianaMed25 mediator subunit integrates environmental cues to control plant development[J]. Proc. Natl. Acad. Sci. USA, 2011, 108(20): 8245-8250.
[16] Nguyen D, Rieu I, Marinai C,etal.. How plants handle multiple stresses: Hormonal interactions underlying responses to abiotic stress and insect herbivory[J]. Plant Mol. Biol., 2016, doi:10.1007/s11103-016-0481-8.
Cloning and Expression Analysis of Maize Mediator Subunit GeneZmMED7
WANG Jing1,2, ZHAO Jun1,2, ZONG Na1,2*
1.FacultyofMaizeFunctionalGenomics,DepartmentofCropGenomeResearchandGeneticImprovement,BiotechnologyResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China;2.NationalKeyFacilityforCropGeneResourcesandGeneticImprovement,CAAS,Beijing100081,China
To study the function of maize mediator subunitZmMED7 gene. We used Real-time Quantitative PCR analysis to study the gene expression levels ofZmMED7-1 andZmMED7-2 in different tissues and under the conditions of abiotic stress, such as ABA、NaCl and PEG treatment. Results showed that: The expressions ofZmMED7-1 andZmMED7-2 could be detected in all the tissues sampled at different development stages, but expression ofZmMED7-1 andZmMED7-2 were highest at the leaves of V1 and V5 stage. Treated by ABA、NaCl and PEG all lead to decreased expression ofZmMED7-1 andZmMED7-2. The germination ofZmMED7-1 over-expression transgenicArabidopsisseeds showed more sensitive to salt stress treatment.ZmMED7 play negative regulator roles in the process of plants responding to salt stress treatment.
mediator complex; expression analysis; abiotic stress
2016-04-25; 接受日期:2016-06-03
国家自然科学基金项目(31170235) 资助。
王晶,硕士研究生,研究方向为植物抗逆分子生物学研究。E-mail:13051524392@163.com。*通信作者:宗娜,副研究员,博士,研究方向为植物抗逆性和籽粒发育分子生物学和分子育种研究。E-mail:zongna@caas.cn
10.3969/j.issn.2095-2341.2016.05.04

