柑橘黄龙病病菌FabD蛋白酶的基因克隆与表达*
王俏玲,何 军,李 攀,朱温平,刘 翔,李永东
(赣南师范大学 化学化工学院,江西 赣州 341000)
·有机药物化学·
柑橘黄龙病病菌FabD蛋白酶的基因克隆与表达*
王俏玲,何 军,李 攀,朱温平,刘 翔,李永东†
(赣南师范大学 化学化工学院,江西 赣州 341000)
柑橘黄龙病病菌(CandidatusLiberibacter)是黄龙病的致病菌.脂肪酸是细胞生物膜的重要组成成分,脂肪酸的生物合成对于病原细菌的生存至关重要.干扰病原菌生物膜的合成将抑制病原菌的生长和繁殖.本研究克隆了柑橘黄龙病病菌脂肪酸合成通路中的关键蛋白酶-丙二酸单酰CoA:ACP转酰基酶(FabD,Malonyl CoA: ACP transacylase)基因,构建了该基因在大肠杆菌系统中的表达载体pET28a-FabD,成功实现了该基因在大肠杆菌系统中的重组表达.结果表明,该蛋白酶在大肠杆菌内为包涵体表达,复性后最终制备得到浓度为0.38 mg/mL的可溶性FabD蛋白酶.
柑橘黄龙病病菌;克隆;蛋白表达;FabD
柑橘黄龙病被称为柑橘的“癌症”,严重影响着包括脐橙在内的柑橘生产安全.柑橘黄龙病最早于1919年在我国广东潮汕地区发现,其致病菌为柑橘黄龙病病菌,一种革兰氏阴性菌[1].脂肪酸是生物细胞膜的重要组成成分,是细胞存活所必需的结构性物质,因此,脂肪酸生物合成对于病原菌的生存和繁殖至关重要[2-3].一般地,脂肪酸合成酶系统分为FAS I和FAS II,FAS II则主要存在于细菌和植物中,由一系列小的分离蛋白组成,每一步反应都由完全不同的单功能酶催化完成[4-5].正是由于FAS II与FAS I差异性较大,FAS II通路中的蛋白酶成为了一个极具潜力的抗生素靶标,受到广泛关注[6-7].
丙二酰-ACP是脂肪酸生物合成的关键原料.FabD蛋白将丙二酰基从丙二酰-CoA转移到酰基载体蛋白(ACP),形成丙二酰ACP和游离CoA-SH[8],是FAS II系统中关键的蛋白酶之一.目前,FabD蛋白酶的抑制剂报道不多[9],黄龙病病菌FabD的研究尚未见报道.本研究以柑橘黄龙病病菌的脂肪酸合成通路中FabD为研究对象,克隆得到该蛋白酶基因,并实现了其在大肠杆菌系统中的重组表达,分离纯化得到可溶性FabD蛋白酶.
1 材料与方法
1.1 材料
实验用柑橘黄龙病基因模板由国家脐橙工程技术中心提供.大肠杆菌DH5ɑ、 BL21(DE3)菌株购自天根生化科技(北京)有限公司,pET28a由实验室保存,限制性内切酶NdeI和BamHI由Takara公司购买,PCR用的Taq酶、克隆所用的酶由南京Vazyme公司购买,其他有机、无机试剂均为分析纯或生物级规格.
1.2 目的基因克隆与鉴定
以野生脐橙病树叶片提取的总核酸为模板,设计基因扩增正向引物P1: 5’- GTGCCGCGCGGCAGCCATATGTCTACAGTGTTGACATTTCCAG-3’和反向引物P2: 5’- ACGGAGCTCGAATTCGGATCCCTAACCAACTATAGATCTGAGCGC-3’.反应体系为:2×AceTaqTMMaser Mix(南京Vazyme公司)25 μL,DNA模板1 μL,正、反向引物各1 μL,ddH2O 22 μL.PCR运行程序(95 ℃ 10 min, 94 ℃ 40 s, 55 ℃ 40 s, 72 ℃ 40 s, 30个循环,末次循环后延伸10 min).将PCR产物进行琼脂糖凝胶电泳验证分析,确定获得特异性的正确的目的基因片段.然后将PCR产物进行电泳、切胶、回收纯化.
1.3 表达载体构建与鉴定
将实验室保存有pET28a质粒用Nde I和BamH I进行双酶切,产物进行琼脂糖凝胶电泳后,切胶、回收纯化.将目的基因与双酶切处理过的DNA片段,按2:1摩尔比,用Clon Express II one step cloning Kit,37 ℃水浴30 min,进行重组连接.重组产物涂布到含有卡纳霉素抗性的固体培养板上,37 ℃培养过夜.挑选单克隆菌落培养12-16 h,提取质粒进行酶切验证,随后将质粒送至上海生工进行精确测序.
1.4 目的蛋白表达及鉴定
将测序正确的重组质粒转化至大肠杆菌菌株BL21(DE3)中,接种单克隆菌落,加入3支4 mL(含卡那霉素50 mg/mL)的LB培养基中,编号为标记为“0”“1”“2”,37 ℃ 200 rpm 培养至OD600约为0.6-0.8(约2.5-3 h).向试管培养液中加入终浓度0.5 mM IPTG(“0”对照组不加 IPTG),“0”“1”放入15 ℃摇床诱导培养过夜,“2”放置37 ℃摇床诱导培养4 h.
分别取“0”“1”“2”试管中各 400-600 μL 培养液离心去除上清液,加入500 μL ddH2O重悬菌体,并再次于4 ℃条件离心去除上清液. 随后,加入50 μL的磷酸缓冲液(PBS)混合重悬沉淀.再加入50 μL的2×SDS上样缓冲液迅速在100 ℃加热样品15 min使蛋白变性,然后进行SDS-PAGE电泳验证.
另取“1”号表达菌液500 μL,4 ℃离心,加500 μL ddH2O重悬菌体,再次离心后,取沉淀加入50 μL重悬,冰浴下超声裂解,随后离心获得上清及沉淀,分别加入适量2×SDS上样缓冲液迅速在100 ℃加热样品15 min使蛋白变性,然后进行SDS-PAGE电泳验证.
1.5 目的蛋白的大量表达
取“1”和“2”保种的菌种20 μL至含50 μg/mL的硫酸卡那霉素的LB培养基中,于摇床(37 ℃,200 rpm)中培养过夜;第二天接种到含50 μg/mL 卡那霉素抗性的500 mL培养基中,摇床(37 ℃,200 rpm)中培养至OD=0.6~0.8时,将摇床温度降至15 ℃,约1 h后加入终浓度0.5 mM的IPTG诱导培养16 h;4 ℃离心收集菌体,并用磷酸缓冲盐(PBS)重悬一次以清洗一遍菌体,备用.
1.6 FabD蛋白包涵体的纯化
用Buffer A(50 mM Tris,150 mM NaCl,1 mM DTT,1% Triton X-100, 1 μg/mL Pepstatin A,1 μg/mL Leupeptin, 20 mM咪唑,pH8.0)重悬菌泥(通常裂解液用量为10-15 mL/g 菌泥);超声裂解,用500 W功率,在冰浴中进行超声;结束后,4 ℃离心弃去上清;包涵体沉淀用裂解液Buffer B(50 mM Tris,150 mM NaCl,6M Urea,20 mM咪唑,pH8.0重悬,裂解液用量10-15 mL/g 包涵体)超声裂解,用500 W功率,在冰浴中进行超声,4 ℃离心保留上清,并用0.45 μm滤膜过滤;用Buffer B平衡3 mL Ni-IDA柱至紫外达到基线;将过滤的上清同平衡后的Ni-IDA柱混合后置于旋转混合仪上4 ℃孵育60-80 min;空层析柱截留含有FabD蛋白的Ni-IDA柱,并用Buffer B冲洗10-20 CV,流速1.0 mL/min,直至紫外示数达到基线;用分别含有50 mM、100 mM、300 mM咪唑的Buffer B洗脱目标蛋白,流速1.5 mL/min, 并收集每个咪唑梯度的洗脱液组分;最后,将收集到的各洗脱组分进行SDS-PAGE电泳.
1.7 目的蛋白的复性与鉴定
将上述收集的目标蛋白用3.5kDa透析袋透析到1 L Buffer C(50 mM Tris,4 mM GSH,0.4 mM GSSG,0.4 M L-Arginine,pH 8.0)中,4 ℃旋转复性24 h,然后将蛋白换液至Buffer D(50 mM Tris,50 mM NaCl,10% Glycerol,2 mM EDTA,2 mM DTT,pH 7.4)中,用磁力搅拌器4 ℃旋转,每隔2-3 h换液一次,总计换液4次;透析结束后,用0.22 μm膜过滤,保存于-80 ℃冰箱.
取一支分装后冻于-80 ℃的FabD蛋白,放置于冰水混合物中待其缓慢融化,融化后查看有无明显悬浮物,并且13 000 rpm,30 min,4 ℃离心后再次观察有无沉淀.将其与BSA(牛血清白蛋白)做对照,进行SDS-PAGE电泳验证,并采用Bradford蛋白浓度测定试剂盒进行蛋白浓度测定.
2 结果
2.1 FabD基因克隆
将PCR产物进行琼脂糖凝胶电泳验证,可以看到一条清晰而专一的扩增条带,其位置在1 000 bp上下,与FabD基因理论值(945 bp)大小相符;将重组转化后,抽提的质粒分别进行单、双酶切验证,双酶切后,在1 000 bp处看到一条特异性条带,与目的基因大小一致,说明重组表达载体构建成功.

图1 FabD小量表达及鉴定SDS-PAGE电泳图
2.2 FabD蛋白表达与鉴定
按1.4中的方法制备样品,进行SDS-PAGE电泳(如图1).对比空白组,实验组中在35 kDa处可观察到一特异性蛋白条带,其大小与FabD蛋白分子量的理论值大小(33.7 kDa)相符,说明目标蛋白实现了表达;表达产物经裂解后,利用SDS-PAGE电泳分析上清和沉淀,表明表达产物在沉淀中,为包涵体表达.
2.4 FabD蛋白纯化
将1.6包涵体纯化的各收集产物进行SDS-PAGE电泳检验(如图2,Lane M:SDS-PAGE Protein marker;Lane 1:包涵体溶解离心后上清;Lane 2:同Ni-IDA孵育的流出液;Lane3-4:50 mM咪唑的Buffer B洗脱液;Lane5-8:100 mM咪唑的Buffer B洗脱液;Lane 9-12:300 mM咪唑的Buffer B洗脱液),可以看到从收集产物3之后,均为较纯的目的蛋白.
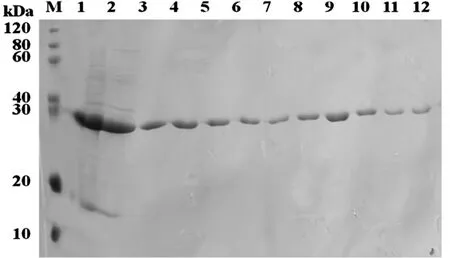
图2 FabD蛋白包涵体纯化结果SDS-PAGE电泳图

图3 FabD蛋白鉴定电泳图及标准曲线
2.5 FabD蛋白复性与鉴定
将复性后的FabD蛋白与BSA(牛血清白蛋白)对照,进行SDS-PAGE分析(如图3左).采用Bradford蛋白浓度测定试剂盒首先制作标准曲线(如图3右),测得复性FabD蛋白溶液的D=0.270,最终换算浓度为0.380 mg/mL.
3 展望
药物靶标蛋白酶晶体结构为基础的药物设计是理性发展新型抗菌药物的基本前提[10-11].柑橘黄龙病病菌脂肪酸的合成对于该病菌细胞的生存必不可少,该通路中各蛋白酶结构功能的研究对于抗黄龙病病菌药物的设计和开发具有重要意义.在ACP(Acyl Carrier Protein)蛋白活化修饰和乙酰辅酶A羧化酶(Acetyl-CoA Carboxylase)底物准备完成之后,柑橘黄龙病病菌蛋白酶FabD催化丙二酸单酰CoA生成丙二酸单酰ACP从而加载到活化的ACP蛋白上,完成脂肪酸合成第一步的原料准备步骤.该蛋白酶基因的克隆和重组蛋白的成功制备,为后续黄龙病病菌FabD蛋白酶的结构功能研究及其抑制剂的筛选打下了坚实的基础.
[1] Bové, J. M. Huanglongbing: a destructive, newly-emerging, century-old disease of citrus[J].Journal of Plant Pathology 2006 Vol. 88 No.1:7-37,2006,88(1):7-37.
[2] Steven D, Clarke. Fatty Acid Synthesis and its Regulation[J].Annual Review of Biochemistry,1983,52(1):537-79.
[3] White S W, Zheng J, Zhang Y M, et al. The Structural Biology of Type II Fatty Acid Biosynthesis[J].Annual Review of Biochemistry, 2005,74(1):791-831.
[4] Yasutaro F, Hiroshi M, Kazutake H. Regulation of fatty acid metabolism in bacteria[J].Molecular Microbiology, 2007,66(4):829-839.
[5] Campbell J W, Jr C J. Bacterial fatty acid biosynthesis: targets for antibacterial drug discovery[J].Annual Review of Microbiology, 2001,55(1):305-332.
[6] Zhang Y M, White S W, Rock C O. Inhibiting bacterial fatty acid synthesis[J].Journal of Biological Chemistry, 2006,281(26):17541-4.
[7] Wright H T, Reynolds K A. Antibacterial targets in fatty acid biosynthesis[J].Current Opinion in Microbiology, 2007,10(5):447-53.
[8] Magnuson K, Jackowski S, Rock C O, et al. Regulation of fatty acid biosynthesis in Escherichia coli[J].Arquivos Brasileiros De Oftalmologia, 1993, 57(3):805-810.
[9] Liu W, Han C, Hu L, et al. Characterization and inhibitor discovery of one novel malonyl-CoA: acyl carrier protein transacylase (MCAT) from Helicobacter pylori[J].Febs Letters, 2006,580(2):697-702.
[10] Payne D J, Warren P V, Holmes D J, et al. Bacterial fatty-acid biosynthesis: a genomics-driven target for antibacterial drμg discovery[J].Drμg Discovery Today, 2001,6(10):537-544.
[11] Schrader F C, Glinca S, Sattler J M, et al. Novel Type II Fatty Acid Biosynthesis (FAS II) Inhibitors as MμLtistage Antimalarial Agents[J].Chemmedchem, 2013,8(3):442-461.
Cloning and Expression Analysis of Malonyl CoA:ACP Transacylase (FabD) from Candidatus Liberibacter Asiaticus
WANG Qiaoling, HE Jun, LI Pan, JU Wenpeng, LIU Xiang, LI Yongdong
(SchoolofChemistryandChemicalEngineering,GannanNormalUniversity,Ganzhou341000,China)
The pathogen ofCitrusHuanglongbingisCandidatusLiberibacte. The fatty acid biosynthesis in pathogenic microorganisms is essential for cell viability. The enzymes involved in the pathway of fatty acid synthase (FAS) have been regarded as targets for antibacterial drug discovery. In this study, one of the fatty acid sythase FabD fromCandidatusLiberibacterasiaticushas been cloned, and the recombinant plasmid of pET28a-FabD was constructed. Finally, the soluble FabD protease of a concentration of 0.38 mg/mL has been obtained successfully by the methods of inclusion body purification and protein refolding.
CitrusHuanglongbing; clone; protein expression; FabD
2016-10-24
10.13698/j.cnki.cn36-1346/c.2016.06.015
江西省科技支撑计划项目(20142BBG70107)
http://www.cnki.net/kcms/detail/36.1037.C.20161209.1515.032.html
S666
A
1004-8332(2016)06-0066-03
† 通讯作者:李永东(1972-),男,江西赣州人,赣南师范大学化学化工学院教授,研究方向:生物化学.

