稀土离子Tb3+对卵清蛋白稳定性的影响
宋 珍, 董金龙, 任跃红, 袁 雯, 张彩凤, 杨斌盛
(1. 太原师范学院化学系, 太原 030012;2. 山西大学分子科学研究所, 化学生物学与分子工程教育部重点实验室, 太原 030006;3. 山西省腐植酸工程技术研究中心, 太原 030012)
稀土离子Tb3+对卵清蛋白稳定性的影响
宋 珍1,3, 董金龙1, 任跃红1, 袁 雯1, 张彩凤1,3, 杨斌盛2
(1. 太原师范学院化学系, 太原 030012;2. 山西大学分子科学研究所, 化学生物学与分子工程教育部重点实验室, 太原 030006;3. 山西省腐植酸工程技术研究中心, 太原 030012)
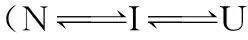
卵清蛋白; Tb3+; 稳定性
蛋白质是生物体中的重要物质, 其在生命体中执行生物功能时, 必须维持特定的三维空间结构[1]. 蛋白质从氨基酸序列折叠成具有生物功能的高级结构时受到很多因素的影响, 如盐的浓度、 温度、 分子伴侣等[2]. 大多数天然态的蛋白都含有1个疏水中心, 侧链通过相互堆积作用稳定蛋白质的天然构型, 极性侧链在外围与溶剂分子相互接触. 降低疏水侧链在水环境中的暴露程度是蛋白质折叠过程的驱动力之一[3]. 蛋白质折叠过程具有高度的复杂性, 使得表征蛋白质部分折叠中间态的构型极其困难[4]. 蛋白质折叠过程中会形成各种中间态, 从一个类似于完全解折叠态的构型到一个类似于天然态的构型[5]. 在天然态和解折叠态之间是否存在或存在多少个中间态引起了科学家的极大兴趣. 蛋白质的氨基酸序列决定了蛋白质折叠态到天然态的路径及天然态的构型. 也有氨基酸序列相同, 但构型不同的蛋白质. 这主要是由于蛋白质的折叠还受到环境因素的影响. 影响蛋白质折叠的作用力主要包括疏水相互作用、 分子间氢键和范德华力等[6].

Fig.1 Structure of Ova(PDB 1Ova) drawn by using Pymol software
卵清蛋白(Ova)是典型的球蛋白, 占蛋清蛋白总量的54%~69%, 分子量为44.5×103, 由385个氨基酸残基组成的单肽链组成, 二级结构中包含30.6%α螺旋和31.4%β折叠片[7]. 卵清蛋白是蛋清蛋白中唯一含有自由巯基的蛋白, 这些巯基都被埋藏在蛋白质的疏水核心部分. 卵清蛋白晶体结构显示其含有3个色氨酸, 可以与钙离子发生相互作用(图1).
研究表明[8~10], 在酸度诱导的卵清蛋白解折叠过程中, 当pH=2左右时会出现一个中间态. 本文使用光谱法研究了稀土离子铽(Tb)与卵清蛋白的相互作用及其对卵清蛋白稳定性的影响. 结果表明, 铽可以与卵清蛋白以2∶1的比例结合. 通过疏水探针2-对甲苯胺基-6-萘磺酸钠(TNS)检测, 铽结合后使得卵清蛋白的疏水表面暴露程度增加. 化学变性剂尿素诱导卵清蛋白解折叠实验结果表明, 卵清蛋白的解折叠是一个三态过程. 铽结合后使得蛋白质稳定性增加.
1 实验部分
1.1 试剂与仪器
七氧化四铽(Tb4O7)购于天津市化学试剂厂; 4-羟乙基哌嗪乙磺酸(Hepes)、 磷酸氢二钾(K2HPO4)、 磷酸二氢钾(KH2PO4)、 磷酸(H3PO4) 和尿素均购于Sigma公司; 卵清蛋白购于百灵威试剂有限公司, 以上试剂均为分析纯.
Varian-Cary Eclipse荧光光谱仪(美国Varian技术有限公司), 激发波长 320 nm, 发射光谱记录范围为325~550 nm, 激发、 发射狭缝为 5 nm, 温度恒定为25 ℃, 所用缓冲溶液为pH=7.4, 10 mmol/L的Hepes; HORIBA-FluoroMax-4型荧光光谱仪(法国HORIBA Jobin Yvon公司), 激发波长 295 nm, 发射光谱记录范围为305~600 nm, 激发、 发射狭缝为 5 nm, 温度恒定为25 ℃, 所用缓冲溶液为pH=7.4的10 mmol/L Hepes; HP 8453型紫外分光光度仪(美国安捷伦有限公司), 光谱记录范围为250~400 nm, 温度恒定为25 ℃, 所用空白样为pH=7.4的10 mmol/L Hepes缓冲溶液.
1.2 溶液配制与数据处理
Tb3+储备液的配制: 称取固定质量的铽氧化物(Tb4O7), 加入适量的稀盐酸溶解后用去离子水定容至容量瓶中, 低温保存. 采用乙二胺四乙酸(EDTA)标准溶液, 用六亚甲基四胺溶液作为缓冲液, 二甲酚橙为指示剂标定Tb3+储备液.
TNS储备液的配制: 称取一定质量的TNS固体, 加入蒸馏水微热溶解后定容至棕色容量瓶中, 避光保存.
两态解折叠曲线按照线性外推法处理, 三态的解折叠曲线按照结构基元模型处理数据[11,12].
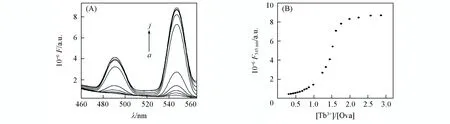
Fig.2 Fluorescence spectra of Ova at different concentrations of Tb3+ in pH=7.4, 10 mmol/L Hepes(A) and titration curve of Ova with Tb3+ addition(B)
2 结果与讨论
2.1 卵清蛋白与铽离子的结合性质
2.1.1 Tb3+敏化的荧光光谱 在pH=7.4的10 mmol/L Hepes缓冲溶液中, 用Tb3+滴定Ova, 结果如图2(A)所示. Tb3+的敏化荧光峰出现在490, 545 nm附近, 是由铽的5D4到7F6,7F5的跃迁引起的. 随着Tb3+的逐渐滴加, Tb3+的敏化荧光峰逐渐增强. 用[Tb3+]/[Ova]作为横坐标对Tb3+在545 nm处的荧光强度作图. 由图2(B)可以看出, 当[Tb3+]/[Ova]<0.5时, Tb3+在545 nm波长下的荧光强度变化较小; 当[Tb3+]/[Ova]>0.8时, 其在545 nm处的荧光强度急剧增大; 当[Tb3+]/[Ova]达到2.0时, Tb3+在545 nm处的荧光强度几乎不再增加. 由滴定曲线可知, Ova可以与Tb3+形成1∶2的复合物.
Tb3+荧光峰的敏化主要是由蛋白质中发光氨基酸(酪氨酸、 色氨酸、 苯丙氨酸)对其能量转移引起的[13,14]. 由图2(B)可以看出, 铽与蛋白质的结合出现两类结合位点: 第一类结合位点结合能力强, 但
敏化较弱, 荧光增强缓慢; 第二类结合位点结合能力弱, 但敏化较强, 荧光增强迅速. 第一阶段荧光缓慢增强主要是由于Tb3+主要结合在离主要的发光氨基酸色氨酸较远的地方, 没有发生合适的能量转移造成的; 而后一阶段Tb3+与色氨酸发生了合适的能量转移. 此外, 用Ca2+溶液滴定Tb3+饱和的蛋白质溶液, 发现Tb3+的荧光敏化峰逐渐减弱, 推测Tb3+可能与Ca2+具有相同的结合位点.
2.1.2 Tb3+引起的蛋白构象变化 TNS是疏水探针, 它在极性环境只有很微弱的荧光, 当周围环境变为疏水环境时, 其荧光强度大幅增强. 室温下, 在pH=7.4, 10 mmol/L Hepes缓冲溶液中, 用TNS滴定蛋白, 结果如图3(A)所示. 可见, 随着TNS滴加量的增加, 其在440 nm处的荧光峰逐渐增强. 用[TNS]/[Ova]对440 nm处的荧光强度作图, 结果如图3(B)所示. 可以看到TNS与Ova的结合比为1∶1. 在固定结合比的基础上, 用Tb3+滴定蛋白与TNS的复合物, 结果如图3(C)所示. 可见, 随着Tb3+滴加量的增加, TNS在440 nm处的荧光强度继续增强. 这是由于Tb3+与蛋白质的结合使得蛋白质的疏水区域暴露程度增大, 从而使得TNS的荧光增强. 当Tb3+与Ova的摩尔比超过2时, TNS的峰几乎不再随Tb3+滴加量的增加而增强. 这也表明, Tb3+可与蛋白形成1∶2的复合物, 并且Tb3+的结合可以使得蛋白质的疏水区域暴露程度增大.

Fig.3 Fluorescence spectra of Ova at different concentrations of TNS in the absence of Ova, in pH=7.4, 10 mmol/L Hepes(A), titration curve of Ova with TNS addition(B) and fluorescence spectra of TNS with the addition of Tb3+ in the presence of Ova in pH=7.4, 10 mmol/L Hepes(C)
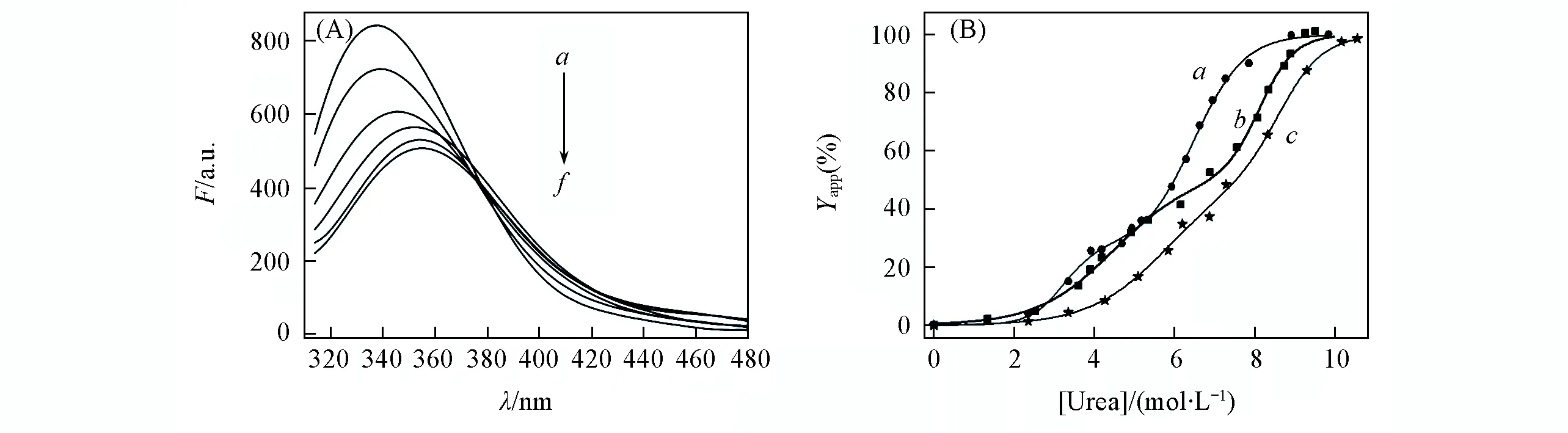
Fig.4 Fluorescence spectra for protein in different concentrations of urea(A) and the unfolding curves of Ova(a), Ova-Ca2+(b), Ova-Tb3+(c) induced by urea(B)
2.2 蛋白质的稳定性
卵清蛋白在天然状态下的最大发射波长为335 nm, 是由于其色氨酸残基处在较疏水的环境中. 随着尿素(化学变性剂)的加入, 蛋白质的荧光峰逐渐从335 nm移动至358 nm, 如图4(A)所示. 可见, 随着尿素的加入, 蛋白质逐渐失去其天然结构, 原来处于较疏水环境中的色氨酸残基逐渐暴露在水溶液环境中. 用380 nm处的荧光强度与325 nm处的荧光强度比值(I380 nm/I325 nm)对[Urea]作图得到蛋白质的解折叠曲线, 结果如图4(B)所示. 利用蛋白质的解折叠百分数(Yapp)衡量蛋白质的解折叠程度.


Table 1 Thermodynamics parameters of proteins from urea-induced unfolding at pH=7.4 and 25 ℃*
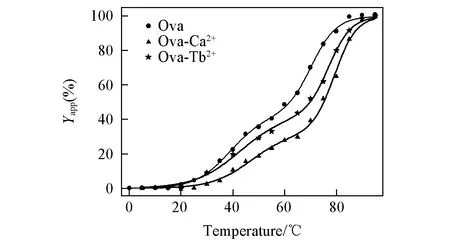
Fig.5 Temperature induced unfolding of Ova, Ova-Ca2+, Ova-Tb3+ in pH=7.4, 10 mmol/L Hepes

图5为温度引起的蛋白质、 钙结合蛋白和铽结合蛋白的解折叠曲线, 可以看到蛋白的解折叠同样也呈现三态. 这也与脲变性得到的结论相吻合. 这3个蛋白的中间态均出现在60 ℃附近.

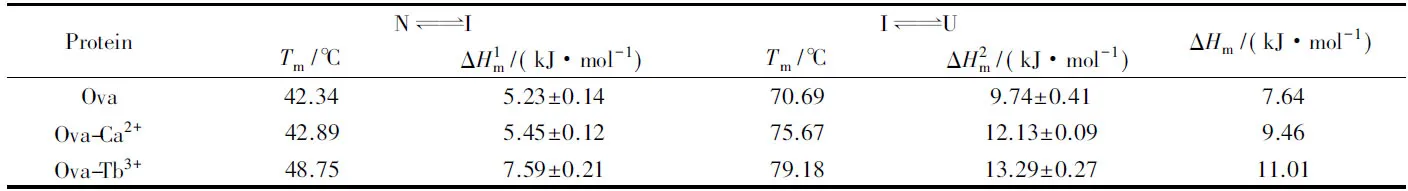
Table 2 Thermal denaturation parameters of proteins at pH=7.4 and 25 ℃*

[1] Buck M., Radford S. E., Dobson C. M.,J.Mol.Biol., 1994, 237(3), 247—254
[2] Tsytlonok M., Itzhaki L. S.,Arch.Biochem.Biophys., 2013, 531(1—2), 14—23
[3] Dobson C. M.,Nature, 2003, 426(6968), 884—890
[4] Arai M., Kuwajima K.,Adv.ProteinChem., 2000, 53, 209—282
[5] Neudecker P., Robustelli P., Cavalli A., Walsh P., Lundström P., Zarrine-Afsar A., Sharpe S., Vendruscolo M., Kay L. E.,Science, 2012, 336(6079), 362—366
[6] Jones S., Reader J. S., Healy M., Capaldi A. P., Ashcroft A. E., Kalverda A. P., Smith D. A., Radford S. E.,Biochemistry, 2000, 39(19), 5672—5682
[7] Stein P. E., Leslie A. G., Finch J. T., Carrell R. W.,J.Mol.Biol., 1991, 221(3), 941—959
[8] Ferreira M. F., Coimbra J. S. R., Garcia R. E. E., Minim L. A., Oliveira F. C., Sousa R. d. C. S.,LWT-FoodSci.Technol., 2007, 40(7), 1304—1307
[9] Ahmad F., Salahuddin A.,Biochemistry, 1976, 15(23), 5168—5175
[10] Naeem A., Khan T. A., Muzaffar M., Ahmad S., Saleemuddin M.,CellBiochem.Biophys., 2011, 59(1), 29—38
[11] Song Z., Ming J., Yang B.,J.Biol.Inorg.Chem., 2014, 19(3), 359—374
[12] Yang B. S., Song Z., Zheng X. Y. A.,Sci.ChinaChem., 2012, 55(7), 1351—1357
[13] Zhang J., Chen W. X., Zhang W., Duan Y., Zhu Y. X., Zhu Y. X., Zhang Y.,Chem.J.ChineseUniversities, 2015, 36(8), 1511—1516(张静, 陈薇晓, 张唯, 段滢, 朱玉秀, 朱亚先, 张勇. 高等学校化学学报, 2015, 36(8), 1511—1516)
[14] Yang S. L., Song P., She W. J., Yang T. L.,Chem.J.ChineseUniversities, 2015, 36(7), 1254—1263(杨水兰, 宋盼, 佘文洁, 杨天林. 高等学校化学学报, 2015, 36(7), 1254—1263)
(Ed.: F, K, M)
Effect of Tb3+on the Stability of Ovalbumin†
† Supported by the National Natural Science Foundation of China(No.21571117), the Returned Oversea Fund of Shanxi Province, China(No.2011085) and the Innovation Project of Undergraduate of Shanxi Normal University, China(No.CXCY1629).
SONG Zhen1,3, DONG Jinlong1, REN Yuehong1, YUAN Wen1, ZHANG Caifeng1,3, YANG Binsheng2*
(1.DepartmentofChemistry,TaiyuanNormalUniversity,Taiyuan030012,China;2.InstituteofMolecularScience,KeyLaboratoryofChemicalBiologyandMolecularEngineeringofMinistryofEducation,ShanxiUniversity,Taiyuan030006,China;3.HumicAcidEngineeringandTechnologyResearchCenterofShanxiProvince,Taiyuan030012,China)

Ovalbumin; Tb3+; Stability
2016-04-20.
日期: 2016-06-30.
国家自然科学基金(批准号: 21571117)、 山西省留学归国基金(批准号: 2011085)和太原师范学院大学生创新项目(批准号: CXCY1629)资助.
10.7503/cjcu20160259
O614; O629.73
A
联系人简介: 杨斌盛, 男, 教授, 主要从事生物无机化学研究. E-mail: yangbs@sxu.edu.cn

