低剂量玉米赤霉烯酮和吸附剂对育成期蛋鸡生长性能、血清生化指标和抗氧化指标的影响
伍宇超 杨维仁 杨在宾 姜淑贞 张桂国 姜新超
(山东农业大学动物科技学院,泰安271018)
低剂量玉米赤霉烯酮和吸附剂对育成期蛋鸡生长性能、血清生化指标和抗氧化指标的影响
伍宇超 杨维仁*杨在宾 姜淑贞 张桂国 姜新超
(山东农业大学动物科技学院,泰安271018)
本试验旨在研究低剂量玉米赤霉烯酮(ZEA)对育成期蛋鸡生长性能、血清生化指标和抗氧化指标的影响,同时评价改性蒙脱石吸附剂(Calibrin-A,CA)的脱毒效果。选取70日龄海兰褐蛋鸡720只,随机分为4组,每组5个重复,每个重复36只鸡。对照组饲喂基础饲粮,试验1组在基础饲粮的基础上添加0.15%的CA,试验2组用自然霉变的玉米蛋白质粉代替基础饲粮中的玉米蛋白质粉,并通过纯ZEA调整饲粮毒素水平(ZEA=0.4mg/kg),试验3组在试验2组的基础上添加0.15%的CA。预试期7d,正试期49d。结果表明:1)低剂量ZEA和CA对育成期蛋鸡的生长性能没有显著影响(P>0.05)。2)低剂量ZEA显著提高育成期蛋鸡试验第25天血清中低密度脂蛋白(LDL)、胆固醇和尿酸的浓度(P<0.05),添加CA能显著降低其血清中LDL、胆固醇和尿酸的浓度(P<0.05)。3)低剂量ZEA显著降低育成期蛋鸡血清中谷胱甘肽过氧化物酶(GSH-Px)(第25天和第47天)和总超氧化物歧化酶(T-SOD)(第47天)活性(P<0.05),显著升高血清中丙二醛(MDA)(第25天和第47天)含量(P<0.05);与低剂量ZEA组相比,添加CA显著升高育成期蛋鸡血清中GSH-Px(第47天)和T-SOD(第47天)活性(P<0.05),显著降低血清中MDA(第25天和第47天)含量(P<0.05)。由此可见,饲粮中0.4mg/kg的ZEA没有影响育成期蛋鸡的生长性能,但显著影响其血清生化指标和抗氧化指标,ZEA组添加CA对血清指标具有显著的改善作用。
育成期蛋鸡;玉米赤霉烯酮;吸附剂;生长性能;代谢;抗氧化
玉米赤霉烯酮(zearalenone,ZEA)又称F-2毒素[1],是由镰刀菌产生的、具有类雌激素活性的真菌毒素,我国北方玉米受此类毒素的污染较为严重[2]。研究表明,ZEA及其代谢产物能够引起很多动物的真菌毒素中毒症[3-5],猪尤为敏感。低剂量ZEA(3mg/kg)对断奶仔猪生长性能没有影响[6-7]。也有研究表明饲粮中含1mg/kg的ZEA会增加断奶仔猪的平均日增重(ADG),对平均日采食量(ADFI)和饲料转化率(FCR)没有影响[8]。但是1.5mg/kg BW的ZEA就可以影响雌性大鼠肝细胞的功能,干扰血液参数[9]。ZEA诱导的肝脏应激导致脂类分泌受到抑制[10-11]。ZEA在1~10μg/mL范围内,导致原代培养的肠上皮细胞内谷胱甘肽(glutathione,GSH)含量降低,超氧化物歧化酶(superoxide dismutase,SOD)活性下降,丙二醛(malonaldehyde,MDA)产生增加,并存在明显的剂量反应关系[12]。动物生产中吸附饲粮霉菌毒素最有效的方法是添加蒙脱石吸附剂,体外试验、鼠和猪的动物试验均已经证实蒙脱石吸附剂能够有效吸附ZEA[13-15]。国内外有关ZEA的大量研究主要集中在猪和小鼠上,低剂量ZEA(0.4mg/kg)对育成期蛋鸡毒性影响的研究尚未见报道。本试验旨在研究低剂量ZEA对育成期蛋鸡生长性能、血清生化指标和抗氧化指标的影响,同时评价改性蒙脱石吸附剂对ZEA毒性的缓解作用,为蛋鸡生产提供参考依据。
1 材料与方法
1.1 试验材料
ZEA:本试验开始前,抽取山东省泰安、济南、聊城和菏泽4个城市121个不同玉米产品进行霉菌毒素检测,选取只含低剂量ZEA的玉米蛋白质粉(粗蛋白质含量51.1%;ZEA含量1.3mg/kg)作为试验材料,同时用ZEA纯品(以色列Fermentek公司生产,纯度保证值为98%)调整饲粮ZEA浓度到0.4mg/kg。
吸附剂:为焙烧改性蒙脱石吸附剂(Calibrin-A,CA),美国Oil-Dri公司提供。
1.2 试验动物与饲养管理
选取70日龄、健康、平均体重(1.07±0.02) kg的海兰褐蛋鸡720只,随机分成4组,每组5个重复,每个重复36只鸡,各组间初始体重差异不显著(P>0.05)。对照组(Contr.)饲喂基础饲粮,试验1组(对照+吸附剂组,Contr.+CA)在基础饲粮的基础上添加0.15%的CA,试验2组(毒素组,Mycot.)用自然霉变的玉米蛋白质粉全部代替基础饲粮中的玉米蛋白质粉配制而成(ZEA=0.4mg/kg),试验3组(毒素+吸附剂组,Mycot.+CA)在试验2组的基础上添加0.15%的CA。预试期7d,正试期49d。试验基础饲粮参考NRC(1994)标准配制,饲粮组成及营养水平见表1。试验蛋鸡采用双向阶梯式鸡笼进行饲养,自由采食和饮水,按正常免疫程序进行免疫接种。
1.3 血样的采集与处理
在试验第25天和第47天,各组每个重复随机选取6只鸡进行翅静脉采血,将用真空促凝管采集的血样30°倾斜放置于37℃水浴锅10min,再转入离心机3000r/min离心10min,分离血清,-20℃保存,待测定血清生化指标和抗氧化指标。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1.4 检测指标与方法
1.4.1 饲粮中毒素的检测
采用免疫亲和柱层析净化,以液相色谱法荧光检测器测定ZEA和黄曲霉毒素的含量,外标法定量。采用免疫亲和层析净化高效液相色谱-串联质谱法,以液相色谱结合紫外检测器测定烟曲霉毒素和呕吐毒素的含量,外标法定量。ZEA、黄曲霉毒素、烟曲霉毒素和呕吐毒素的最低检测限分别为0.1mg/kg、1.0μg/kg、0.25mg/kg和0.1mg/kg,试验各组霉菌毒素含量见表2。
1.4.2 生长性能指标
试验期间以重复为单位,每周记录蛋鸡的采食量和体重,用于计算蛋鸡ADG、ADFI和料重比(F/G)。
1.4.3 血清生化指标
采用COBAS MIRA Plus全自动生化分析仪测定血清生化指标总蛋白、胆固醇、甘油三酯、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和尿酸浓度,所需试剂盒均购于南京建成生物工程研究所。

表2 饲粮中霉菌毒素含量实测值Table 2 The measured mycotoxin contents in diets μg/kg
1.4.4 血清抗氧化指标
总超氧化物歧化酶(T-SOD)活性根据黄嘌呤氧化酶法(羟胺法)测定,根据化学比色法测定谷胱甘肽过氧化物酶(GSH-Px)的活性,根据比色法测定MDA含量,T-SOD活性测试试剂盒(A001-1)、GSH-Px活性测试试剂盒(A005)和MDA含量测试试剂盒(A003)购于南京建成生物工程研究所。
1.5 数据统计分析
试验数据采用SAS 9.2软件进行统计,用双因素方差分析(double-factor ANOVA)进行统计分析,用Duncan氏法进行多重比较,显著性水平为P<0.05。
2 结果与分析
2.1 生长性能
由表3可知,低剂量ZEA对育成期蛋鸡的ADG、ADFI和F/G没有显著影响(P>0.05);添加CA不显著影响育成期蛋鸡的生长性能(P>0.05);ZEA与CA对育成期蛋鸡生长性能指标没有显著的交互作用(P>0.05)。

表3 低剂量ZEA和吸附剂对育成期蛋鸡生长性能的影响Table 3 Effects of low dose ZEA and adsorbent on growth performance of growing-laying hens
2.2 血清生化指标
由表4可知,试验第25天时,与对照组相比,低剂量ZEA组育成期蛋鸡血清中LDL、胆固醇和尿酸浓度显著升高(P<0.05);添加CA显著降低ZEA组蛋鸡血清中的LDL、胆固醇和尿酸浓度(P<0.05),但总蛋白、甘油三酯和HDL浓度差异不显著(P>0.05)。低剂量ZEA和CA不显著影响试验第47天蛋鸡血清生化指标(P>0.05)。ZEA与CA对试验第25天育成期蛋鸡的血清胆固醇浓度具有显著的交互作用(P<0.05)。
2.3 血清抗氧化指标
由表5可知,与对照组相比,低剂量ZEA显著降低育成期蛋鸡血清中GSH-Px(第25天和第47天)和T-SOD(第47天)活性(P<0.05),而MDA(第25天和第47天)含量则显著升高(P<0.05)。与低剂量ZEA组相比,添加CA显著升高了血清中GSH-Px(第47天)和T-SOD(第47天)活性,显著降低了MDA(第25天和第47天)含量(P<0.05)。与对照组相比,添加CA对各项指标均无显著影响(P>0.05)。ZEA与CA对试验第47天育成期蛋鸡血清MDA含量具有显著的交互作用(P<0.05)。
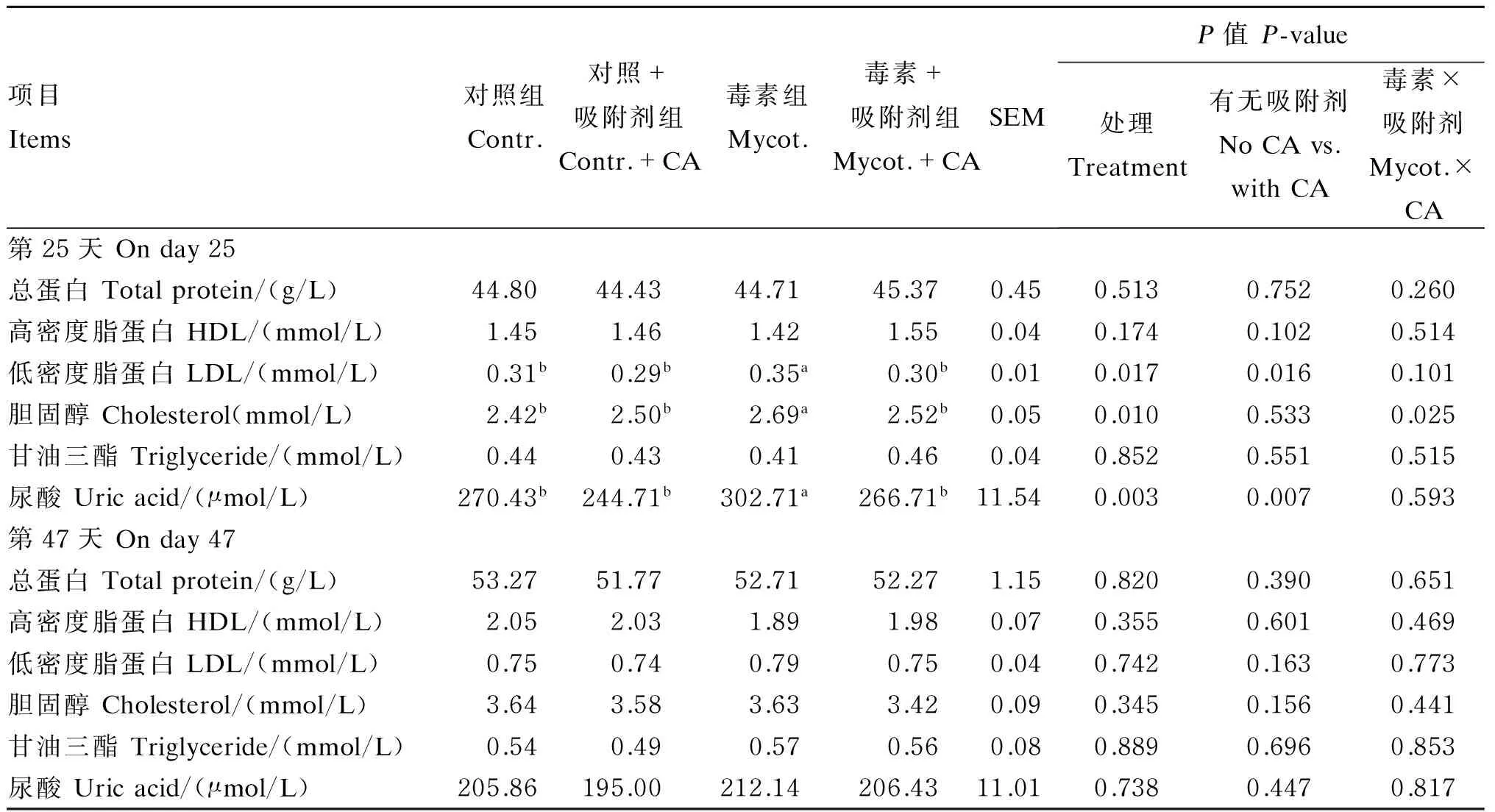
表4 低剂量ZEA和吸附剂对育成期蛋鸡血清生化指标的影响Table 4 Effects of low dose ZEA and adsorbent on serum biochemical indices of growing-laying hens
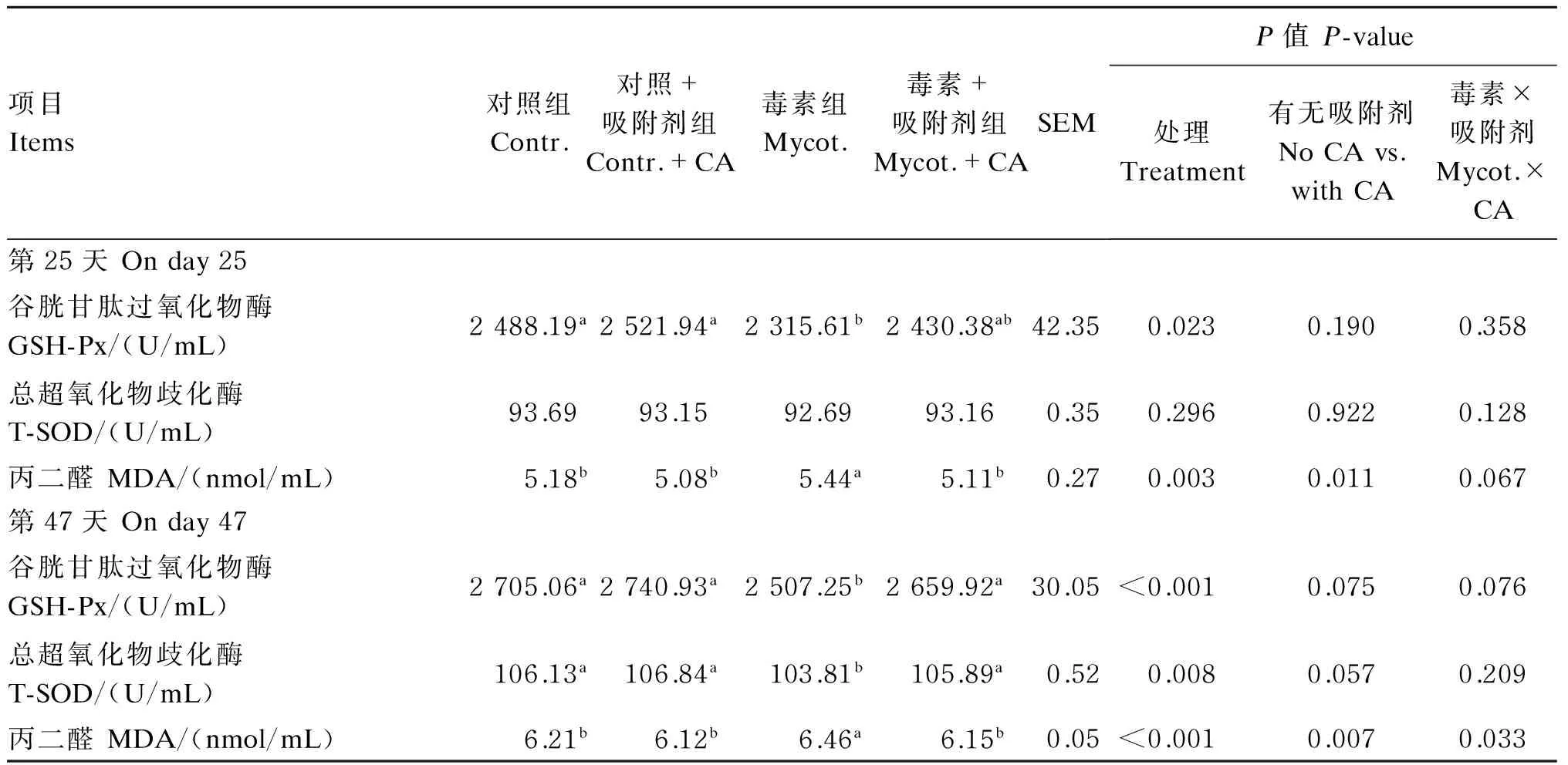
表5 低剂量ZEA和吸附剂对育成期蛋鸡血清抗氧化指标的影响Table 5 Effects of low dose ZEA and adsorbent on serum antioxidant indices of growing-laying hens
3 讨 论
关于ZEA的研究,有些采用直接添加ZEA纯毒素进行[14],有些则采取已知ZEA含量的自然霉变饲粮进行[16],但自然霉变的饲粮中通常含有ZEA以外的一种或多种毒素,对ZEA毒性的研究会产生一定的影响。本试验饲粮选择只含ZEA的霉变玉米蛋白质粉和ZEA纯毒素配制成,经检测除低剂量ZEA外,还有远低于饲料卫生标准限量的黄曲霉毒素,因此,试验饲粮可以用于研究ZEA对育成期蛋鸡毒性的影响。
3.1 低剂量ZEA对育成期蛋鸡生长性能的影响
本试验结果表明,自然霉变玉米蛋白质粉中低剂量ZEA对育成期蛋鸡ADFI、ADG和F/G均无显著影响。Marin等[17]研究表明,小猪饲喂含ZEA(316μg/kg)的全价饲粮对其体重、ADG和ADFI均无影响;Nikaido等[18]用ZEA(0.1或10mg/kg BW)对雌性青春期前大鼠进行饲喂,发现大鼠体重并没有变化,与本试验结果一致。但也有研究表明,随着饲粮中ZEA含量的升高,仔猪的ADG、ADFI和FCR均降低[19],仔猪饲料效率随ZEA添加量的增加而线性增加[20]。出现这种情况,可能与ZEA的含量、试验时间和试验动物有关。
3.2 低剂量ZEA对育成期蛋鸡血清生化指标的影响
本研究表明,含0.4mg/kg ZEA的毒素组育成期蛋鸡血清中胆固醇升高,推测原因可能是因为肝细胞受到损伤。这与孙美乐等[21]研究ZEA对体外培养大鼠肝细胞有损伤作用一致。Ojeda[22]试验也证明了ZEA的雌激素拮抗作用,而雌激素可以增加甘油三酯的合成和脂肪沉积,降低胆固醇的循环水平。本试验第25天ZEA毒素组尿酸升高,而血清中尿酸浓度主要受肾功能、蛋白质摄入量和分解代谢情况的影响,因此可以推测,低剂量ZEA对育成期蛋鸡的肾脏也具有一定毒性,这与在大鼠上的研究一致[23],但是尚需进一步的肾脏免疫组化结果证实。但随着试验时间的增加(试验第47天),ZEA(0.4mg/kg)对育成期蛋鸡血清生化指标的影响不再显著,推测可能是本试验条件下的育成期蛋鸡对ZEA具有自身调节机能,但是尚需重复试验证实。
3.3 低剂量ZEA对育成期蛋鸡血清抗氧化指标的影响
生物机体在正常生命代谢中会产生超氧阴离子自由基(·O2-),由此引起脂质过氧化反应,影响机体的氧化和抗氧化平衡,可能还会改变体内的重要代谢过程如细胞膜代谢、蛋白质生物合成与糖酵解[24]。而T-SOD、GSH-Px和过氧化氢酶(CAT)是机体细胞内清除自由基的主要内源抗氧化物酶[25],且T-SOD广泛存在于生物体的各种组织中,能够清除·O2-,同时,脂质过氧化反应的最终产物是MDA[22]。因此,GSH-Px、T-SOD活性和MDA含量正常对于机体本身氧化和抗氧化平衡非常重要。研究证实,ZEA对氧化损伤程度较大[26-29],2.0和3.2mg/kg ZEA组仔猪血清和肝脏中SOD和GSH-Px的活性显著低于对照组,MDA含量则显著高于对照组[16]。本试验研究发现,到试验第25天,0.4mg/kg ZEA组育成期蛋鸡血清中MDA含量与对照组相比显著升高,而GSH-Px的活性显著降低;而随着试验时间的增加,0.4mg/kg ZEA组育成期蛋鸡血清中T-SOD和GSH-Px的活性显著低于对照组,MDA含量高于对照组,与上述仔猪试验相符。也有试验证明,自然霉变的玉米能提高肝脏SOD活性[30],可能原因是自然霉变玉米中毒素种类比较多,而各种毒素共同作用刺激了机体的自我调节,产生了更多的SOD以清除增加的·O2-。
3.4 改性蒙脱石吸附剂对育成期蛋鸡的影响
研究表明,饲粮中添加沸石或活性炭对断奶仔猪的生长性能没有影响[31-32]。本试验结果也表明,饲粮中添加0.15%的CA对育成期蛋鸡生长性能无显著影响,推测原因可能是饲料中添加0.15%的CA对育成期蛋鸡的肠道不会产生影响,从而不影响其各种营养物质的吸收代谢。Yang等[33]研究表明,肉鸡饲粮中添加0.5%的蒙脱石吸附剂对其血清生化指标并没有影响,本试验研究表明饲粮中添加0.15%的CA对育成期蛋鸡肝脏和血液代谢无显著影响;同时本试验结果也表明,添加0.15%的CA,试验第25天时霉变组中的血清指标LDL、胆固醇和尿酸的含量得到明显改善。低剂量ZEA(1.3mg/kg)的饲粮中添加1或2kg/t的改性蒙脱石Calibrin-Z(CZ)对断奶仔猪血清抗氧化酶和MDA并不能起到改善作用,但有一定改善趋势,当CZ的添加量达到4kg/t时能够对断奶仔猪血清中抗氧化酶和MDA起到改善作用[15]。本试验也证明了在含低剂量ZEA的饲粮中添加0.15%的CA能增加育成期蛋鸡血清中GSH-Px和T-SOD的活性,降低MDA的含量,对育成期蛋鸡机体氧化平衡起到明显作用,与上述断奶仔猪试验基本一致。
4 结 论
本试验条件下:
① 0.4mg/kg的ZEA对育成期蛋鸡生长性能无显著影响。
② 0.4mg/kg的ZEA会增加育成期蛋鸡血清中LDL、胆固醇和尿酸浓度,但随着试验时间的延长毒性逐渐削弱。
③ 0.4mg/kg的ZEA会降低育成期蛋鸡血清中GSH-Px和T-SOD活性,增加MDA含量,且随着试验时间增加毒性会逐渐积累。
④ 与对照组相比,饲粮中添加0.15%的CA不影响育成期蛋鸡的生长性能、血清生化指标和抗氧化指标;与ZEA组相比,添加0.15%的CA能对育成期蛋鸡血清生化指标和抗氧化指标起到显著的改善作用。
[1] 程传民,柏凡,李云,等.2013年玉米赤霉烯酮在饲料原料中的污染分布规律[J].中国畜牧杂志,2014,50(16):68-72,77.
[2] YANG Z B,CHI F,张亮,等.玉米赤霉烯酮对仔猪的养分利用率的影响[J].饲料与畜牧,2012(11):47-48.
[3] KUIPER-GOODMAN T,SCOTT P M,WATANABE H,et al.Risk assessment of the mycotoxin zearalenone[J].Regulatory Toxicology and Pharmacology,1987,7(3):253-306.
[4] HUSSEIN H S,BRASEL J M.Toxicity,metabolism,and impact of mycotoxins on humans and animals[J].Toxicology,2001,167(2):101-134.
[5] 何学军,齐德生.玉米赤霉烯酮的毒性研究进展[J].中国饲料,2006(10):2-5.
[6] 赵虎,杨在宾,杨维仁,等.玉米赤霉烯酮对仔猪生产性能和内脏器官发育影响的研究[J].粮食与饲料工业,2008(10):37-38.
[8] 姚宝强,杨在宾,杨维仁,等.玉米赤霉烯酮及吸附剂对断奶仔猪生产性能、营养物质利用率和肌肉品质的影响[J].饲料工业,2009,30(13):20-24.
[9] KIESSLING K H,PETTERSSON H.Metabolism of zearalenone in rat liver[J].Acta Pharmacologica et Toxicologica,1978,43(4):285-290.
[10] HARRIS W S.Fish oils and plasma lipid and lipoprotein metabolism in humans:a critical review[J].Journal of Lipid Research,1989,30(6):785-807.
[11] WONG S H,NESTEL P J,TRIMBLE R P,et al.The adaptive effects of dietary fish and safflower oil on lipid and lipoprotein metabolism in perfused rat liver[J].Biochimica et Biophysica Acta,1984,792(2):103-109.
[12] 苏军.镰刀菌毒素对猪的抗营养效应及其机制研究[D].博士学位论文.雅安:四川农业大学,2008.
[13] FENG J L,SHAN M,DU H H,et al.Invitroadsorption of zearalenone by cetyltrimethyl ammonium bromide-modified montmorillonite nanocomposites[J].Microporous and Mesoporous Materials,2008,113(1/2/3):99-105.
[15] JANG S Z,YANG Z B,YANG W R,et al.Effect on hepatonephic organs,serum biochemical indices and oxidative stress in post-weaning piglets fed purified zearalenone-contaminated diets with or without Calibrin-Z[J].Journal of Animal Physiology and Animal Nutrition,2012,96(6):1147-1156.
[16] DÖLL S,GERICKE S,DNICKE S,et al.The efficacy of a modified aluminosilicate as a detoxifying agent inFusariumtoxin contaminated maize containing diets for piglets[J].Journal of Animal Physiology and Animal Nutrition,2005,89(9/10):342-358.
[17] MARIN D E,PISTOL G C,NEAGOE L V,et al.Effects of zearalenone on oxidative stress and inflammation in weanling piglets[J].Food and Chemical Toxicology,2013,58:408-415.
[18] NIKAIDO Y,YOSHIZAWA K,DANBARA N,et al.Effects of maternal xenoestrogen exposure on development of the reproductive tract and mammary gland in female CD-1mouse offspring[J].Reproductive Toxicology,2004,18(6):803-811.
[19] HORUGEL K,VERGARA H.Influence of mycotoxins on growth and onset of puberty in growing female pigs[J].Prakt Tierarzt,2003,84:611-614.
[20] JANG S Z,YANG Z B,YANG W R,et al.Effects of purified zearalenone on growth performance,organ size,serum metabolites,and oxidative stress in postweaning gilts[J].Journal of Animal Science,2011,89(10):3008-3015.
[21] 孙美乐,阚文宏,孟宪清,等.玉米赤霉烯酮对体外培养大鼠肝细胞的影响[J].中国地方病防治杂志,1997(2):69-70.
[22] OJEDA S R.Female reproductive function[C]//GRIFFIN J E,OJEDA S R.Textbook of physiology.Oxford:Oxford University Press,2000.
[23] JIA Z Q,LIU M,QU Z,et al.Toxic effects of zearalenone on oxidative stress,infammatory cytokines,biochemical and pathological changes induced by this toxin in the kidney of pregnant rats[J].Environmental Toxicology and Pharmacology,2014,37(2):580-591.
[24] LIU G M,YAN T,WANG J,et al.Biological system responses to zearalenone mycotoxin exposure by integrated metabolomic studies[J].Journal of Agricultural and Food Chemistry,2013,61(46):11212-11221.
[25] MCCORD J M.Superoxide,superoxide dismutase and oxygen toxicity[M]//HODGSON E,BEND J R,PHILPOT R.Reviews in biochemical toxicology.Amsterdam:Elsevier,1979:109-124.
[27] FREEMAN B A,CRAPO J D.Hyperoxia increases oxygen radical production in rat lungs and lung mitochondria[J].Journal of Biological Chemistry,1981,256(21):10986-10992.
[28] KOUADIO J H,DANO S D,MOUKHA S,et al.Effects of combinations ofFusariummycotoxins on the inhibition of macromolecular synthesis,malondialdehyde levels,DNA methylation and fragmentation,and viability in Caco-2cells[J].Toxicon,2007,49(3):306-317.
[29] ZOURGUI L,GOLLI E E,BOUAZIZ C,et al.Cactus (Opuntiaficus-indica) cladodes prevent oxidative damage induced by the mycotoxin zearalenone in Balb/C mice[J].Food and Chemical Toxicology,2008,46(5):1817-1824.
[30] 杨军.自然霉变玉米对肉鸡生长性能和健康影响及霉菌毒素残留研究[D].硕士学位论文.雅安:四川农业大学,2012.
[31] WARD T L,WATKINS K L,SOUTHERN L L,et al.Interactive effects of sodium zeolite-A and copper in growing swine:growth,and bone and tissue mineral concentrations[J].Journal of Animal Science,1991,69(2):726-733.
[32] PIVA A,CASADEI G,PAGLIUCA G,et al.Activated carbon does not prevent the toxicity of culture material containing fumonisin B1when fed to weanling piglets[J].Journal of Animal Science,2005,83(8):1939-1947.
[33] YANG L C,ZHAO Z Y,DENG Y F,et al.Toxicity induced byF.poae-contaminated feed and the protective effect of montmorillonite supplementation in broilers[J].Food and Chemical Toxicology,2014,74:120-130.
(责任编辑 田艳明)
Effects of Low Dose Zearalenone and Adsorbent on Growth Performance, Serum Biochemical and Antioxidant Indices of Growing-Laying Hens
WU Yuchao YANG Weiren*YANG Zaibin JIANG Shuzhen ZHANG Guiguo JIANG Xinchao
(CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Tai'an271018,China)
This experiment was conducted to study the effects of low dose of zearalenone on growth performance, serum biochemical and antioxidant indices of growing-laying hens, and the detoxification effect of adsorbent Calibrin-A (CA) was also evaluated. Seven hundred and twenty 70-day-old Hy-Line Brown laying hens were randomly divided into 4groups with 5replicates and 36hens in each replicate. The control group was given the basal diet. The test group 1was fed the basal diet with 0.15% CA. The test group 2was fed the control diet in which corn gluten meal was replaced by naturally contaminated corn gluten meal (zearalenone=0.4mg/kg). The test group 3was fed the test group 2diet with 0.15% CA. The experiment comprised 7days of adaptation and 49days of measurement period. The results showed as follows: 1) low dose of zearalenone and 0.15% CA had no significant effects on the growth performance of growing-laying hens (P>0.05). 2) Low dose of zearalenone significantly increased low density lipoprotein, cholesterol and uric acid concentrations on day 25in the serum (P<0.05), and the addition of CA significantly decreased the low density lipoprotein, cholesterol and uric acid concentrations in the serum (P<0.05). 3) Low dose of zearalenone significantly decreased the activities of glutathione peroxidase (on day 25and 47) and total superoxide dismutase (on day 47) (P<0.05), but the malondialdehyde content in the serum was significantly increased (on day 25and 47) (P<0.05). Compared with low dose of zearalenone group, the addition of CA significantly increased the activities of glutathione peroxidase (on day 47) and total superoxide dismutase (on day 47) (P<0.05), and significantly decreased the malondialdehyde content in the serum (on day 25and 47) (P<0.05). This experiment shows that 0.4mg/kg zearalenone does not affect the growth performance of growing-laying hens, but it has significant effects on serum biochemical and antioxidant indices, and addition of CA can partly attenuate the detrimental effects of the zearalenone feeding.[ChineseJournalofAnimalNutrition, 2016, 28(4):1137-1144]
growing-laying hens; zearalenone; adsorbent; growing performance; metabolism; antioxidant
10.3969/j.issn.1006-267x.2016.04.023
2015-11-06
伍宇超(1992—),男,湖南永州人,硕士研究生,从事动物营养与饲料科学研究。E-mail: 18853819620@163.com
*通信作者:杨维仁,教授,硕士生导师,E-mail: wryang@sdau.edu.cn
S816.9;S831.5
A
1006-267X(2016)04-1137-08
*Corresponding author, professor, E-mail: wryang@sdau.edu.cn

