不同剂量阿托伐他汀对动脉粥样硬化性肾动脉狭窄及肾功能的影响
沈才杰 陈晓敏 严芸萍 王健 储慧民
不同剂量阿托伐他汀对动脉粥样硬化性肾动脉狭窄及肾功能的影响
沈才杰陈晓敏严芸萍王健储慧民
目的观察不同剂量阿托伐他汀对肾动脉粥样硬化斑块及肾功能的影响。方法经螺旋CT血管成像(SCTA)明确ARAS患者75例,分为两组:阿托伐他汀20 mg组(n=31例)及40 mg组(n=44例),测定服药前及1个月后低密度脂蛋白胆固醇(LDL-C)、超敏C反应蛋白(hs-CRP)、肿瘤坏死因子α(TNF-α)及白介素6(IL-6),计算服药前及随访3年后肾小球滤过率(eGFR)及ARAS百分比。结果LDL-C、hsCRP、TNF-α、IL-6、eGFR、ARAS狭窄率服药前组间无显著性差异(均P>0.05),服药后LDL-C、hs-CRP、TNF-α、IL-6、ARAS狭窄率均较服药前减少(均P<0.05),eGFR增加(P<0.05)。40 mg组患者服药后hs-CRP、TNF-α及IL-6均低于20 mg组(均P<0.01),ARAS斑块减少程度及eGFR显著高于20 mg组(P<0.01)。线性回归分析显示:服药前eGFR与ARAS狭窄率无相关性,服药后eGFR与ARAS狭窄率呈负相关(r=-0.64,P<0.01)。结论阿托伐他汀对肾脏的保护作用具有剂量依赖性,可能与逆转动脉粥样斑块程度及改善炎症有关。
阿托伐他汀;动脉粥样硬化;肾动脉狭窄;肾功能
ARAS是目前肾动脉狭窄的首要病因[1],他汀类药物在有效逆转斑块的同时,可降低心血管疾病相关炎性因子,从而起到多重肾脏保护作用[2-3]。本研究旨在探讨不同剂量阿托伐他汀对ARAS、炎性因子及肾功能损伤的影响,现报道如下。
1 资料和方法
1.1一般资料选择2008年1月至2011年12月在我院(26例)及宁波市第一医院(49例)心内科及肾内科住院,经SCTA明确为ARAS的患者75例,其中男性56例,女性19例,年龄35~78(59.82± 11.39)岁。入选标准:病史中至少有2项动脉粥样硬化的危险因素;肾动脉SCTA显示存在肾动脉狭窄,病变位于肾动脉开口或近段。排除标准:大动脉炎、纤维肌性发育不良、原发性肾脏病患者[2],药物过敏者,6个月内并发急性心肌梗死或急性脑血管意外、严重心功能不全、严重肝功能异常、急慢性感染。
1.2方法
1.2.1治疗方法所有患者均服用血管紧张素转化酶抑制剂(ACEI)/血管紧张素受体阻滞剂(ARB)和(或)钙离子拮抗剂(CCB)及抗血小板聚集药物,严格控制血糖,根据患者入院次序按随机数字表进行分组,分为口服阿托伐他汀(立普妥,美国辉瑞公司生产)20mg组(31例)和40mg组(44例),每晚睡前服用。各组治疗方法经患者知情同意后进行。
1.2.2血清学指标检测采集患者清晨空腹肘静脉血,包括服药前及服药1个月后LDL-C,采用酶联免疫法监测hs-CRP、TNF-α及IL-6。以简化MDRD公式估算治疗前及治疗后2年估算eGFR[单位:ml/(min·1.73 m2)],正常:eGFR>90,轻度肾功能受损:60≤eGFR<90,中度肾功能受损:30≤eGFR<60,重度肾功能受损:<30[4]。
1.2.3SCTA采用美国通用64排或东芝320排CT进行扫描,使用Visipaque100ml,注射速度3~5ml/s。扫描范围自肾上腺至肾脏下极,扫描时间8~10s,用自带软件进行ARAS程度分析,狭窄率(%)=100×[1-(管腔狭窄直径/正常管腔直径)],狭窄程度0级:无狭窄,Ⅰ级≤50%,50%<Ⅱ级≤75%,Ⅲ级>75%,Ⅳ级:100%闭塞,对于多处及双侧ARAS患者,取平均值。
1.2.4安全性及严重心脑血管事件监测第1年每个月,以后每3个月接受肝功能、肌酸激酶、肌红蛋白检测。
1.3统计学处理应用SPSS16.0统计软件,计量资料以表示,多组比较采用方差分析,组间两两比较采用LSD-t检验,或非参数检验(非正态资料);计数资料以百分率表示,组间比较采用χ2检验或Fisher精确检验。对治疗前后eGFR与ARAS狭窄率的相关性进行双变量线性回归分析。
2 结果
2.1两组一般资料的比较见表1。

表1 两组一般资料的比较[例(%)]
由表1可见,两组性别、年龄、严重心力衰竭、高血压、糖尿病、高脂血症体重指数、器质性心脏病、服用药物等一般资料差异均无统计学意义(均P>0.05),其中两组各有2例患者接受血液透析治疗。
2.2两组血清学指标比较见表2。
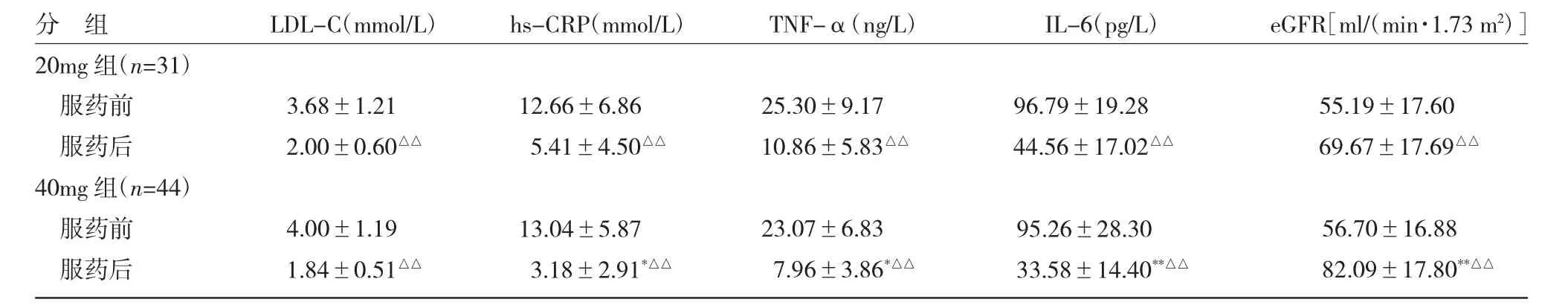
表2 两组血清学指标比较
由表2可见,两组服药前LDL-C、hs-CRP、TNF-α、IL-6、eGFR差异均无统计学意义(均P>0.05),两组服药后LDL-C、hs-CRP、TNF-α、IL-6均较服药前降低(均P<0.05),eGFR较服药前均增加(均P<0.05)。服药后两组LDL-C差异无统计学意义(P>0.05),40mg组服药后hs-CRP、TNF-α、 IL-6均低于20mg组(均P<0.05),eGFR高于20mg组(P<0.01)。20mg组eGFR增高23例(74.19%)、40mg组eGFR增高39例(88.64%),两组差异无统计学意义(P>0.05)。
2.3两组ARAS指标比较见表3。
由表3可见,服药前两组肾功能受损患者比例差异均无统计学意义(均P>0.05),ARAS狭窄率差异无统计学意义(P>0.05);两组服药后ARAS狭窄率较服药前均降低(均P<0.05),40mg组患者服药后ARAS狭窄减少程度高于20mg组(P<0.05)。线性回归分析显示,服药前eGFR与ARAS狭窄率无相关性(r=0.22,P>0.05),服药后eGFR与ARAS狭窄率呈负相关(r=-0.64,P<0.01)。
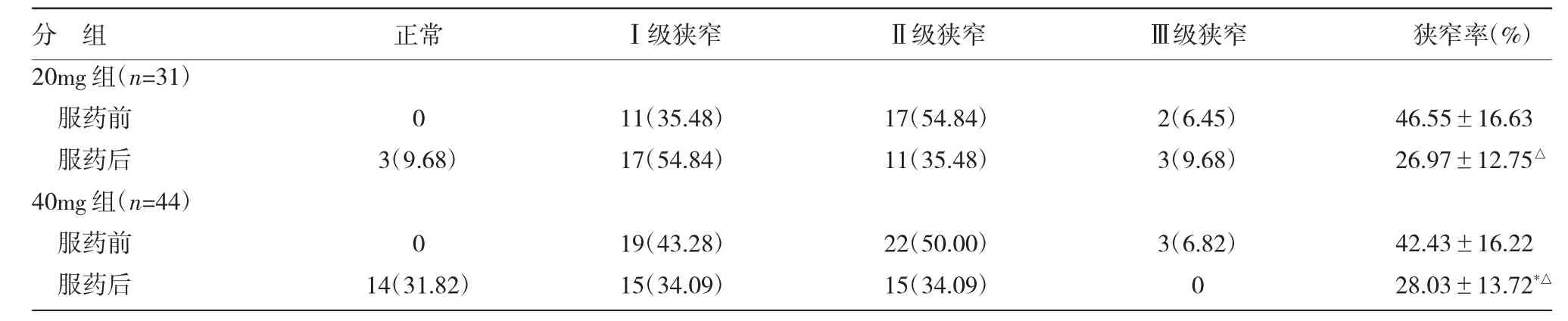
表3 两组ARAS指标比较
2.4安全性及严重心脑血管事件发生情况随访期间,所有患者均未发生与药物相关的严重肝功能受损、肌酸激酶及肌红蛋白明显升高。两组各新增需血液透析1例,严重心脑血管事件7例(13.33%):20mg组发生脑梗死2例、心肌梗死1例(9.68%),40mg组发生脑梗死2例、心肌梗死2例(9.09%),两组严重心脑血管事件发生率差异无统计学意义(χ2=0.01,P>0.05)。
3 讨论
ARAS进展常隐匿但潜在危害极大,如可导致肾血管性高血压和缺血性肾病,SCTA检查因有无创、较高的敏感度和准确度的优势,在临床实践中常作为首选手段[5]。根据国际上多项随机、多盲、多中心、长期随访临床试验结果,他汀类药物已成为一、二级预防ARAS的基础治疗,LDL-C作为引起肾动脉粥样硬化及加速病情发展的主要脂质成分,是衡量降脂的主要参考指标[2,6-8],但目前他汀类药物与ARAS狭窄及eGFR改善的相关大型研究甚少。
本研究患者接受阿托伐他汀治疗前LDL-C水平差异无统计学意义,接受20mg及40mg治疗后LDL-C均明显下降,目前国内外尚无该特殊人群及指定剂量的类似研究,结合2013年ACC/AHA公布的MESA研究结果[8],该治疗研究方案在当初入组时具有很强的创新性。严健华等[6]对疑诊和确诊冠心病患者进行肾动脉造影显示,ARAS狭窄≥50%患者占16.3%,双侧ARAS3.9%,单侧左肾ARAS 6.5%,单侧右肾ARAS5.9%,与本研究结果类似,同时发现危险因素可能与年龄、代谢综合征、冠心病等密切相关,本研究中高血压52例(69.33%)、糖尿病36例(48.00%)、高脂血症72例(96.00%)、严重心力衰竭23例(29.33%)、器质性心脏病15例(20.00%),针对这些高危因素的合理治疗至关重要,但在现实世界研究中进行合理、定量、定时监测往往非常困难。大量基础及临床研究证实,他汀类药物在治疗动脉粥样硬化相关疾病中还发挥抗氧化应激以及抗炎症作用,可以稳定斑块甚至逆转斑块,该效应可独立于LDL-C降低作用之外[7,9-10]。本研究ARAS患者接受不同剂量阿托伐他汀治疗,发现两者LDL-C差异并无统计学意义,但hs-CRP、TNF-α、IL-6较前明显下降,且以高剂量为甚,可见阿托伐他汀在炎症介质调节中效果显著。另有研究对双侧ARAS患者控制高胆固醇血症数年后,经肾动脉造影证实双侧肾动脉狭窄程度均明显减轻[11]。本研究经服用不同强度阿托伐他汀后,ARAS狭窄率较服药前明显减少,且存在剂量依赖性,验证了最新血脂指南建议下不同强度他汀的获益结果[8]。动脉粥样硬化作为一种全身性的疾病,肾动脉与其他部位的动脉粥样硬化可能有着共同的危险因素,本研究虽未对上述患者进行冠状动脉造影比较,但随访发生严重心脑血管事件高达13.33%,间接提示ARAS是心脑血管病事件的重要危险因素[12]。
在肾功能方面,eGFR较肌酐更能准确反映肾脏损伤的严重程度[4]。ASTRAL调查组近来对ARAS患者进行单纯药物治疗与药物+介入治疗效果相比,5年随访周期后结果显示:后组患者每年平均肌酐下降1.6μmol/L,但两者在血压、肾功能、肾脏及心血管事件均无显著差异[13],加上介入诊治中对比剂对肾脏潜在的损伤作用,提示积极有效的药物干预不失为首选治疗方案。WU等[14]对缺血再灌注损伤鼠动物模型进行研究发现阿托伐他汀对肾脏的直接保护机制,可能与抗炎效应及抗氧化有关,另有研究证实长期使用他汀类药物可促生血管,改善了肾脏微血管功能[3],也可能与改善胆固醇栓塞直接相关[8]。本研究患者入组前均存在不同程度IRF,除积极控制肾功能损害相关疾病外,其中接受ACEI/ARB、CCB药物治疗患者分别达62例(82.67%)及54例(72.00%),平均eGFR较服药前明显增加,且存在剂量依赖性,但两组eGFR增加患者比例差异并无统计学意义,提示其可能存在较大的个体差异性,考虑除前述炎症指标及LDL-C改善相关外,可能与狭窄程度有一定关联。Takumi等[15]对33例接受肾动脉支架植入术后患者通过血管内超声检查进行肾功能与斑块范围及性质评估,其中51.52%患者存在双侧肾动脉狭窄(狭窄程度均>60%),平均eGFR 56.4ml/(min· 1.73m2),结果显示,病变处阶差及斑块组分与基线水平eGFR相关性较差,支架植入术后eGFR与不稳定斑块组分及大小呈负相关。本研究结果显示服药前eGFR与ARAS狭窄率无相关性,但服药后两者呈负相关,本研究患者狭窄程度显著低于上述研究加上不同他汀类药物存在的优劣及人群差异性等因素,可能导致eGFR改善程度不一,我们推测阿托伐他汀在减少SRAS狭窄程度也可能以减少不稳定斑块比率及相应数量为主,至于其因素间权重及作用先后需要日后研究进一步证实。
本文也存在一定的局限性。首先,病例组样本量不大;其次,药物服用虽规范,但实际不太可能完全监测各项指标维持正常,如血压、血糖及心力衰竭等;另外,一些潜在影响肾功能药物(如ACEI/ARB、利尿剂等)及生活相关因素(如吸烟、饮酒、缺乏运动等)等可能干扰研究结果;再者,人类肾脏功能随着年龄增大可出现进行性下降,在小样本时可能因个体敏感度影响实验结果。
[1]王梅.缺血性肾脏病的治疗进展[J].中华肾病研究电子杂志,2013, (2)∶56-59.
[2]Todorovic Z,Nesic Z,Stojanovic R,et al.Acute protective effects of simvastatin in the rat model of renal ischemia-reperfusion injury:it is never too late for the pretreatment[J].J Pharmacol Sci,2008,107 (4)∶465-470.
[3]Antoniades C,Bakogiannis C,Tousoulis D,et al.Rapid,direct effects of statin treatment on anerial redox state and nitric oxide bioavailability inhumanatherosclemsisviatetrahydrobiopterin-mediated endothelial nitric oxide synthase coupling[J].Circulation,201l,124(3)∶335-345.
[4]全国eGFR课题协作组.MDRD方程在我国慢性肾脏病患者中的改良和评估[J].中华肾脏病杂志,2006,22(10)∶589-595.
[5]Lao D,Parasher P S,Cho K C,et al.Atherosclerotic Renal Artery Stenosis-Diagnosis and Treatment[J].Mayo Clin Proc,2011,86(7)∶649-657.
[6]严健华,孙璨贤,赵肖奕,等.动脉粥样硬化性肾动脉狭窄的患病率及危险因素分析[J].中华医学杂志,2013,93(11)∶827-831.
[7]Balanescu S,CalmacL,Constantinescu D,et al.Systemic inflammation and early atheroma formation:are they related[J].Maedica(Bucher), 2010,5(4)∶292-301.
[8]Joseph Y,Stefan S,Joseph C,et al.Implications of the New ACC/AHA Cholesterol Guidelines for Primary Atherosclerotic Cardiovascular Disease Event Prevention in a Multi-Ethnic Cohort:MESA[J].Am HeartJ,2015,169(3)∶387-395.e3.
[9]WatersD D.Exploringnew indication for atatinsbeyond atherosclrosis: Successandsetbacks[J].JCariol,2010,55(2)∶155-162.
[10]GounaIi P,Tousoulis D,Antoniades C,et al.Rosuvastatin but not ezetimibe improves endolhelial function in patients with heart failure, by mech aIlisms independent of lipid lowering[J].Int J Cardiol, 2010,142(1)∶87-91.
[11]KhongTK,MissourisCG,BelliAM,etal.Regressionofatherosclerotic renal artery stenosis with aggressive lipid lowering therapy[J].J HumHypertens,2001,15(6)∶431-433.
[12]ed Mast Q,Beufler J J.The prevalence of atherosclemtic renal artery stenosis in risk groups:a systematic literature review[J].J Hypertens, 2009,27∶1333-1340.
[13]ASTRAL Investigators.Revascularization versus medical therapy for renal-arterystenosis[J].NEnglJMed,2009,361(20)∶1953-1962.
[14]Wu K,Lei W,Tian J,et al.Atorvastatin treatment attenuates renal injury in an experimental model of ischemia-reperfusion in rats[J]. BMCNephrol,2014,15(1)∶14.
[15]Takumi T,Mathew V,Barsness G W,et al.The association between renal atherosclerotic plaque characteristics and renal function before and after renal artery intervention[J].Mayo Clin Proc,2011,86 (12)∶1165-1172.
(本文编辑:马雯娜)
Comparison of the effects of different doses of atorvastatin on atherosclerotic renal artery stenosis(ARAS)and renal function
SHEN Caijie,CHEN Xiaomin,YAN Yunping,et al.Department of Cardiology,Ningbo NO.7 Hospital,Ningbo 315000,China
Corresponding author:CHU Huimin,E-mail:shenzihai1101@126.com
ObjectiveTo investigate the effects of different doses of atorvastatin on renal artery atherosclerosis and renal function.Methods75 patients with atherosclerotic renal artery stenosis(ARAS)determined by spiral computed tomographywere enrolled.Theytookatorvastatin 20 mg daily(group 1,n=31)or40 mg daily(group 2,n=44).LDL-C,hs-CRP, tumor TNF-α and IL-6 were measured before and one month after treatment.The eGFR and renal artery stenosis were calculated before and 3 years lateraftertreatment.ResultsLDL-C,hs-CRP,TNF-α,IL-6,eGFR,and the degree ofARAS were not significant difference between two groups before treatment.They decreased significantly except the eGFR increased significantlyaftertreatmentin both groups(allP<0.05).hs-CRP,TNF-αand IL-6 were significantlylower,while the eGFRand the improvementofARAS were significantlyhigherin group 2 than in group 1(allP<0.01).The eGFRwas negativly related to the percentage of ARAS after treatment(r=-0.42,P<0.05)but not before treatment.ConclusionAtorvastatin improves renalfunction in dose-dependentmanner.Itmaybe related to the reduction ofinflammatoryand ARAS.
Atorvastatin;Atherosclerosis;Renal artery stenosis;Renal function
315202浙江省宁波市第七医院心内科(沈才杰、严芸萍),浙江省宁波市第一医院心内科
储慧民,E-mail:shenzihai1101@126.com
(2015-10-14)

