茶多酚对人前列腺癌PC-3M细胞中Survivin mRNA和蛋白表达的影响
严正强 杨远清 卢启海
茶多酚对人前列腺癌PC-3M细胞中Survivin mRNA和蛋白表达的影响
严正强 杨远清 卢启海
目的 探讨茶多酚对人前列腺癌PC-3M细胞中调控细胞凋亡的生存素(Survivin)mRNA和蛋白表达的影响。方法在人前列腺癌PC-3M细胞培养器皿中分别加入用完全培养液稀释的0、40、60、80μg/ml茶多酚溶液,24、48h后应用RT-PCR和Western blot检测并比较Survivin mRNA、蛋白表达水平。结果 与0μg/ml组相比,40μg/ml组加入茶多酚48h后Survivin mRNA、蛋白表达水平均明显下调(均P<0.05);60、80μg/ml组加入茶多酚24、48h后Survivin mRNA、蛋白表达水平均明显下调(均P<0.05),其中80μg/ml组下调最为明显(均P<0.05);大致呈剂量、时间依赖性(均P<0.05)。结论 茶多酚可下调Survivin mRNA和蛋白表达水平,促进人前列腺癌PC-3M细胞调亡,在一定范围内呈剂量、时间依赖性。
茶多酚 前列腺癌 PC-3M细胞 细胞凋亡 生存素
茶叶是世界上三大饮品之一,经常饮用茶对人体健康有利。国内外学者证实茶多酚具有抗肿瘤、抗基因突变、抗菌消炎、抗动脉粥样硬化、抗氧化、降压、降糖等多种生物学功能[1-5]。前列腺癌是老年男性高发的恶性肿瘤,是欧美等发达国家男性仅次于肺癌的第二大恶性肿瘤[6],但在中国、日本等长期饮茶的亚洲国家,前列腺癌发病率远低于欧美等发达国家[7-9]。因此,笔者就茶多酚对人雄激素非依赖性前列腺癌PC-3M细胞中调控细胞凋亡的生存素(Survivin)mRNA和蛋白表达的影响作一探讨,以期为前列腺癌的治疗提供新线索。
1 材料与方法
1.1 试剂与仪器 茶多酚(98%)购自广州市齐云生物技术有限公司,胎牛血清购自依科赛(上海)生物制品有限公司,改良达尔伯克培养基(IMDM)购自美国GIBCO公司,Survivin抗体、β-Actin抗体均购自武汉博士德生物工程有限公司,Survivin、甘油醛-3-磷酸脱氢酶(GAPDH)引物由上海生工生物工程技术服务有限公司合成。RT-PCR使用美国GeneAmp公司的PCR扩增仪9700型,蛋白电泳使用美国Bio-rad公司的蛋白质电泳装置、电转移系统,数据拍照记录使用上海Tanon凝胶成像系统2500R。
1.2 细胞株及培养条件 人前列腺癌PC-3M细胞株由吉林大学前列腺防治研究中心馈赠,培养在含10%胎牛血清的IMDM培养液中,置37℃、5%CO2湿化的培养箱中;待细胞融合70%~80%培养孔(瓶)时,将培养液更换为用完全培养液稀释的茶多酚溶液,其终浓度分别为0、40、60、80μg/ml,24、48h后检测Survivin mRNA和蛋白表达水平。
1.3 检测方法
1.3.1 RT-PCR检测人前列腺癌PC-3M细胞中Survivin mRNA表达水平 加药处理24、48h后提取细胞总RNA,应用半定量RT-PCR方法扩增目的基因Survivin和内参基因GAPDH,引物序列见表1。使用GIS凝胶分析软件进行光密度扫描分析,用Survivin产物与内参GAPDH产物的电泳亮度比值表示Survivin mRNA表达水平。

表1 Survivin与GAPDH的引物序列
1.3.2 Western blot检测人前列腺癌PC-3M细胞中Survivin蛋白表达水平 加药处理24、48h后收集、提取细胞总蛋白,应用Bio-rad法进行定量,取30μg蛋白进行12%聚丙烯酰氨凝胶电泳,电泳结束后转移蛋白至聚偏氟乙烯膜上,用5%脱脂奶粉、4℃封闭过夜,含0.05%Tween20的TBS缓冲液(TBST)洗膜3次,室温加入1∶400兔抗人Survivin抗体,孵育2h,TBST洗膜3次,加入1∶2 000稀释的羊抗兔IgG/AP,室温孵育2h,TBST洗膜3次,5-溴-4-氯-3-吲哚基-磷酸盐/四唑硝基蓝溶液显色。运用GIS凝胶分析软件进行光密度扫描分析,用Survivin蛋白与内参β-actin蛋白的电泳条带亮度比值表示Survivin蛋白表达水平。
1.4 统计学处理 应用SPSS17.0统计软件。上述实验步骤重复3次,所得数据用表示,多组间比较采用多因素方差分析。
2 结果
2.1 各组Survivin mRNA表达水平的比较 与0μg/ml组相比,40μg/ml组加入茶多酚48h后Survivin mRNA表达水平明显下调(P<0.05);60、80μg/ml组加入茶多酚24、48h后Survivin mRNA表达水平均明显下调(均P<0.05),其中80μg/ml组下调最为明显(均P<0.05),见图1和表2。茶多酚可从mRNA表达水平下调Survivin基因转录,大致呈剂量、时间依赖性(均P<0.05),见图2。

图1 各组SurvivinmRNA表达的电泳图

表2 各组SurvivinmRNA表达水平比较

图2 各组SurvivinmRNA表达水平与茶多酚剂量、时间的效应图(a:剂量效应;b:时间效应)
2.2 各组Survivin蛋白表达水平比较 与0μg/ml组相比,40μg/ml组加入茶多酚48h后Survivin蛋白表达水平明显下调(P<0.05);60、80μg/ml组加入茶多酚24、48h后Survivin蛋白表达水平均明显下调(均P<0.05),其中80μg/ml组下调最为明显(均P<0.05),见图3和表3。茶多酚可从蛋白表达水平下调Survivin基因转录,大致呈剂量、时间依赖性(均P<0.05),见图4。

图3 各组Survivin蛋白表达的电泳图
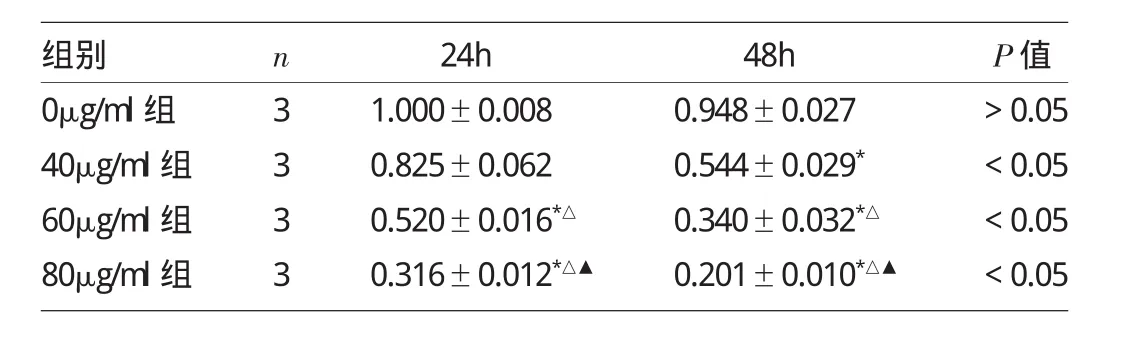
表3 各组Survivin蛋白表达水平比较
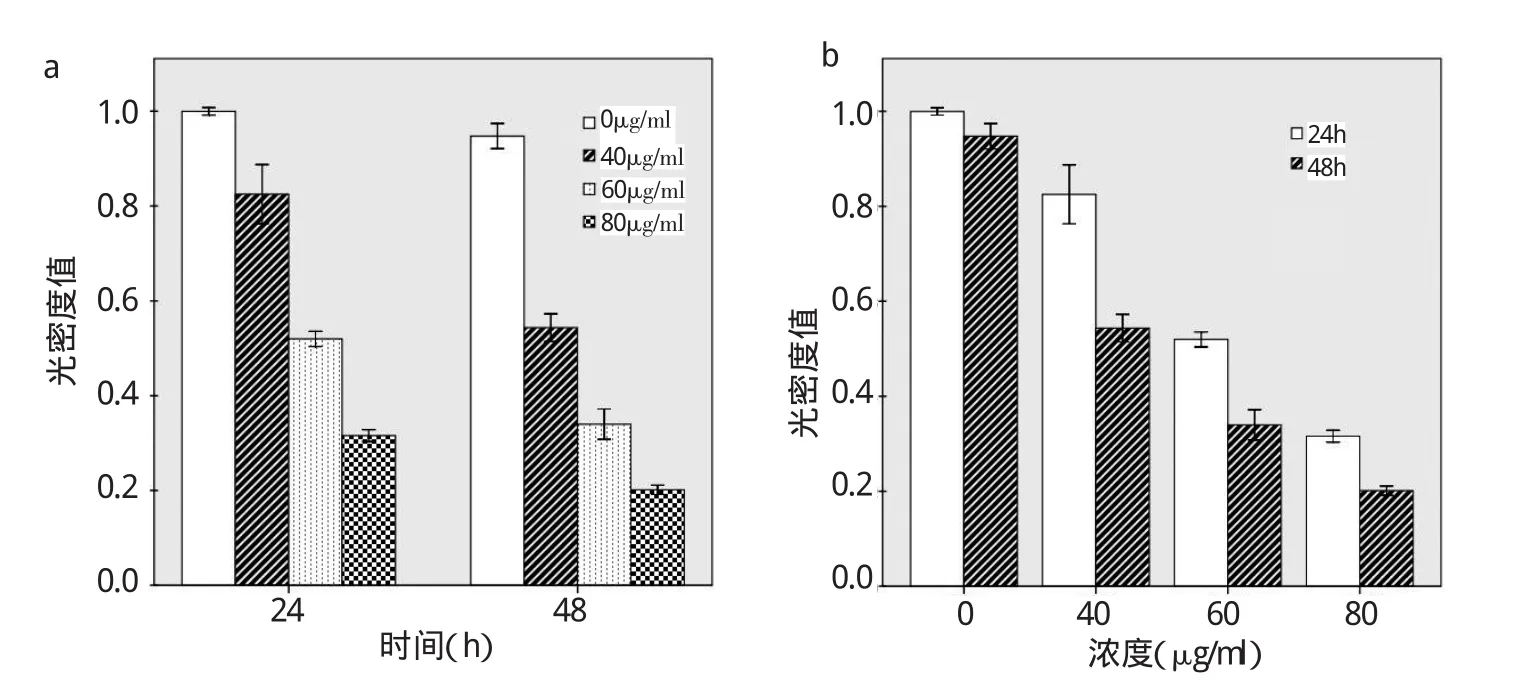
图4 各组Survivin蛋白表达水平与茶多酚剂量、时间的效应图(a:剂量效应;b:时间效应)
3 讨论
肿瘤的发生、发展与细胞凋亡密切相关。细胞凋亡又称程序性细胞死亡,是为维持内环境稳定,由基因控制的细胞自主有序的主动死亡过程。诱导肿瘤细胞凋亡是当前今治疗癌症的主要方法[10]。细胞凋亡是一个复杂的信号传导、蛋白酶级联反应过程,天冬氨酸特异性半胱氨酸蛋白酶(Caspase)、凋亡抑制蛋白(IAPs)是调控凋亡反应的重要因子,其中Caspase-3是凋亡级联反应的必经之路,Tamm等[11]、郑雪梅等[12]通过体外实验证实Survivin可抑制Caspase-3的活性。
Survivin是目前发现最小的IAPs家族成员,由142个氨基酸构成,分子量16.5kDa,表达于细胞周期的G2/ M期,定位于细胞有丝分裂的纺锤体。1997年耶鲁大学Ambrosini等[13]通过效应细胞蛋白酶受体-1(EPR-1)的cDNA在人类基因组文库中筛选克隆发现,它与EPR-1均位于染色体(17q25)的75-130Kb的基因簇上,由3个内含子和4个外显子构成,两者区别在于EPR-1 mRNA长度为 1.3Kb,Survivin mRNA长度为 1.9Kb。Survivin与其他IAPs家族成员不同之处在于只含有1 个BIR序列,羧基端无环指结构而是1个由40个氨基酸组成的两性α-螺旋结构代之。目前研究认为Survivin抗凋亡作用的机制如下:(1)通过BIR分子中的氨基酸残基Trp67、Pro33和Cys84与Caspase-3、Caspase-7结合,从而抑制其活性;(2)通过α-螺旋结构与细胞有丝分裂微管结合,使Survivin与有丝分裂酶CDK1-cyclin B形成复合体,引起Survivin磷酸化,形成Survivin-Caspase-9复合物,从而抑制Caspase-9的活性;(3)Survivin与CDK4结合,引起CDK2-cyclin E的激活和pRB磷酸化,释放p21,最终导致CDK4与Procaspase相互作用而抑制细胞凋亡。Survivin的表达具有区域、时相选择性,在胚胎组织、肿瘤中高表达,在正常组织中不表达或仅少量表达,在癌旁组织中不表达。Tamm等[11]对美国国立癌症研究院抗癌药物筛选计划所选用的60种人肿瘤细胞株检测发现均有Survivin表达,且在乳腺癌、肺癌中表达最高,在肾癌中表达最低;国内学者郑雪梅等[12]研究结果亦持该观点。Rohayem等[14]报道在肺癌、结肠癌患者血清中Survivin抗体明显增高,提示Survivin可作为肺癌、结肠癌的标志物。Duffy等[15]实验表明膀胱癌患者尿液中可检测出Survivin抗体,因此Survivin亦可用于膀胱癌早期诊断及预后判断。由于Survivin在肿瘤组织中表达的特异性和本身结构的特殊性,即其唯一的BIR区若发生cys84→ala84A突变或THr34→Ala形成Survivin(T34A)则将丧失抑制凋亡的能力[8,10],Survivin靶向阻断的抗肿瘤治疗具有无可替代的优势[16]:(1)Survivin靶向阻断可促进肿瘤细胞凋亡并抑制其增殖,而正常组织不受影响;(2)由于Survivin与EPR-1位于染色体(17q25)的同一基因簇,且两者编码序列广泛互补,故通过2个天然反义转录物的相互作用可以调节细胞凋亡;(3)由于Survivin基因突变体的存在,将其转染至细胞体内,亦可调节细胞凋亡。
之前有研究证实不同浓度的茶多酚作用于人前列腺癌PC-3M细胞后,细胞凋亡明显增强[17];本研究亦证实茶多酚可从mRNA和蛋白表达水平下调Survivin基因转录,从而能促进人前列腺癌PC-3M细胞的凋亡,在一定范围内呈剂量、时间依赖性。
[1] Boon N.Health potential for functional green teas[J].Int J Vitam Nutr Res,2008,78(6):275-281.
[2] Huang C H,Tsai S J,Wang YJ,et al.EGCG inhibits protein synthesis,lipogenesis,and cell cycle progression through activation of AMPK in p53 positive and negative human hepatoma cells[J]. MolNutr Food Res,2009,53(9):1156-1165.
[3] UiJ,Kondo K,Sawada T,et al.Survivaloffoodborne pathogens in grain products and the effect ofcatechins[J].Shokuhin Eiseigaku Zasshi,2009,50(3):126-130.
[4] Lambert J D,Yang C S.Cancer chemopreventive activity and bioavailability of tea and tea polyphenols[J].Mutat Res,2003 (523-524):201-208.
[5] Hayatsu H,Inada N,KakutaniT,et al.Suppression of genotoxicity ofcarcinogens by(-)-epigallocatechin gallate[J].Prev Med,1992, 21(3):370-376.
[6] Pickle L W,Hao Y,Jemal A,et al.A new method of estimating U-nited States and state-level cancer incidence counts for the current calendar year[J].CACancer J Clin,2007,57(1):30-42.
[7] Kurahashi N,Sasazuki S,Iwasaki M.Green tea consumption and prostate cancer risk in Japanese men:A prospective study [J].Am J Epidemiol,2008,167(1):71-77.
[8] Magoha G A.Overview of prostate cancer in indigenous black Africans and blacks ofAfrican ancestry in diaspora 1935-2007[J]. East Afr Med J,2007,84(9 Suppl):S3-11.
[9] Dale W,Vijayakumar S,Lawlor E F,et al.Prostate cancer,race, and socioeconomic status:inadequate adjustment for social factors in assessing racial differences[J].Prostate,1996,29(5):271-281.
[10] Kerr J F,Winterford C M,Harmon B V.Apoptosis.Its significance in cancer and cancer therapy[J].Cancer,1994,73(8):2013-2026.
[11] Tamm I,Wang Y,Sausville E,et al.IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas(CD95), Bax,caspases and anticancer drugs[J].Cancer Res,1998,58 (23):5315-5320.
[12] 郑雪梅,宋华.Survivin和Caspase-3在乳癌组织的表达及相关性[J].齐鲁医学杂志,2009(05):377-379,382.
[13] AmbrosiniG,Adida C,Sirugo G,et al.Induction ofapoptosis and inhibition of cell proliferation by survivin gene targeting[J].J Biol Chem,1998,273(18):11177-11182.
[14] Rohayem J,Diestelkoetter P,Weigle B,et al.Antibody response to the tumor-associated inhibitor of apoptosis protein survivin in cancer patients[J].Cancer Res,2000,60(7):1815-1817.
[15] Duffy MJ,O'Donovan N,Brennan D J,et al.Survivin:a promising tumor biomarker[J].Cancer Lett,2007,249(1):49-60.
[16] Ryan B M,O'Donovan N,Duffy MJ.Survivin:a new target for anti-cancer therapy[J].Cancer Treat Rev,2009,35(7):553-62.
[17] 毛小强,那万里,赵丹,等.茶多酚对前列腺癌PC-3M细胞增殖与凋亡的影响[J].中国实验诊断学,2010(2):170-173.
Effect of tea polyphenols on mRNA and protein expression of survivin in prostate cancer PC-3M cells
YAN Zhengqiang,YANG Yunqing,LU Qihai.Department of Urology,Ningbo Medical Center Lihuili Eastern Hospital,Ningbo 315103,China
【 Abstract】 Objective To investigate the effect of tea polyphenols on the mRNA and protein expression of survivin in prostate cancer PC-3M cells. Methods Human prostate cancer PC-3M cells were treated with 40,60,80μg/ml tea polyphenol for 24h or 48h,the mRNA and protein expression of survivin in PC-3M cells were detected by RT-PCR and western blot, respectively. Results The mRNA and protein expression of survivin in PC-3M cells treated with 60μg/ml and 80μg/ml for 24h and 48h was significantly decreased in a dose-dependent and time-dependent manner(P<0.05). Conclusion Tea polyphenols can promote apoptosis of human prostate cancer PC-3M cells,which is related to the down-regulation of survivin gene transcription and translation.
Tea polyphenolProstate cancerPC-3Mcells Apoptosis Survivin
2016-04-11)
(本文编辑:陈丹)
315103 宁波市医疗中心李惠利东部医院泌尿外科(严正强、杨远清);广西科技大学附属柳州市人民医院泌尿外科(卢启海)
严正强,E-mail:mqyz@tom.com

