三种常见针叶树种的细根形态比较
贾全全,刘琪璟 ,梁 宇
(1. 北京林业大学 林学院,北京100083;2. 中国科学院植物研究所,北京 100093)
三种常见针叶树种的细根形态比较
贾全全1,刘琪璟1,梁 宇2
(1. 北京林业大学 林学院,北京100083;2. 中国科学院植物研究所,北京 100093)
细根(< 2 mm) 具有复杂的分支结构,其形态和功能具有高度的种内和种间异质性,而细根形态特征的研究是全面认识其功能的基础。为了解物种水平上细根形态的变异特征,本文在我国不同气候区分别选取了马尾松Pinus massoniana、油松P. tabulaeformis和兴安落叶松Larix gmelinii三种代表本气候区的优势针叶树种为研究对象,对其1~5级细根的直径、根长、比根长和组织密度等形态特征进行了比较分析。结果表明,三个针叶树种1~5级细根形态变化具有明显的规律,根序与各根序的直径、根长和比根长均有显著的指数关系。三个树种的所有细根形态特征均表现出低级根序间(1~3级)的变异幅度小,高级根序间(3~5级)变异幅度大的特点。在同一根序内,不同树种间的细根平均直径、根长和比根长存在显著差异,而组织密度没有显著区别。其中亚热带树种马尾松的平均直径和根长均明显大于兴安落叶松(寒温带)和油松(温带),而落叶松和油松间没有显著差异。油松的比根长最大,与兴安落叶松和马尾松间存在显著差异,而落叶松和马尾松间没有显著差异。
马尾松;油松;兴安落叶松;细根;形态;根序
细根作为植物吸收养分和水分的功能器官,虽然仅占根系生物量的3%~30%[1],但其生理活性很强,且处于不断周转的动态过程中[2-3],假设细根每年周转1次,那么每年将消耗全球陆地生态系统净初级生产力的33%[4],而且细根死亡和分解过程释放大量碳和养分[5-6],归还到土壤中的有机碳和养分往往超过地上部分,成为森林生态系统中重要的碳汇和养分库[4,7-8]。所以深入了解细根的结构和功能,对全面认识地下生态系统碳和养分循环过程具有重要意义。
分支结构是植物根系重要的形态特征[9],细根为了获取植物所需的养分和水分,可以延伸到土壤中的任何空隙[10],这使得细根的分支系统具有高度的复杂性和可塑性[11]。按照Pregitzer等[12]提出的根序法划分细根,有助于我们更好地认识其结构与功能的关系[13-14]。在以往的研究中,无论是南方还是北方树种,无论是针叶还是阔叶树种,随着根序的增加,细根的直径和根长增加,而比根长降低[12,15-16]。不同根序间细根的碳含量变化不大[17-18],但非结构性碳水化合物和纤维素随根序的增加而升高,木质素含量随根序的增加而明显降低[19]。氮和磷含量随根序的增加而降低[19-20]。细根的呼吸速率和氮含量是密切相关的,也就是说随着根序的增加,根的呼吸速率是逐渐降低的[21-22]。
植物根系通过特异性吸收策略竞争土壤资源,因此在同一根序不同树种间细根形态也存在较大的差异[8,23-25]。通过对温带快速生长和慢速生长树种的前2级细根进行比较,发现无论是幼苗还是成熟树木,速生树种的细根直径较细且比根长较高,但组织密度区别不大[26-27]。除生长速率对细根形态有影响以外,系统进化和菌根侵染也对细根形态有显著影响[23]。在对北美9个树种前3级细根的研究中发现,被子植物的平均直径低于裸子植物,而比根长高于裸子植物近2倍[12]。此外,细根还受土壤水分、养分以及气候等因素的影响很大[28-29]。因此了解不同物种间细根形态特征,找到根系的变异规律成为根系生态学研究领域的重要内容。
目前国内关于树木根系形态结构方面的研究多集中在阔叶树种[15,25],而对针叶树种的报道较少。为此,本文在我国亚热带、温带和寒温带地区分别选取各气候带的优势针叶树种马尾松Pinus massoniana、油松P. tabulaeformis和兴安落叶松Larix gmelinii的根系为研究对象,测定其1~5级细根的形态参数(直径、根长、比根长和组织密度),旨在比较这3个针叶树种的细根形态特征,分析他们在不同根序间的变化规律。以期增进我们对树木细根分支结构的了解,为针叶树木细根结构特征的研究提供参考数据。
1 研究区概况及研究对象
马尾松是我国亚热带植被次生演替的先锋树种[30]。马尾松林是我国亚热带东南部湿润地区分布最广、资源最丰富的森林类型,既有天然林也有人工林[31-32]。本研究于2010年7月进行马尾松细根取样工作。取样地点位于浙江省古田山国家级自然保护区天然次生林(29°13′N,118°07′E),海拔高度为200~1 246 m[33]。该地区受海洋性气候影响较深,冬暖夏凉,温暖湿润,属于中亚热带常绿阔叶林地带,优势树种为甜槠、木荷和马尾松[34]。本区年均降水量1 963.7 mm,年均温15.3℃,相对湿度92.4%,无霜期约250 d[33]。
油松耐低温、干旱和瘠薄,是我国温带针叶林中分布最广的森林群落,也是我国北方地区最主要的造林树种之一[35-36]。油松林是北京地区低、中山区的地带性植被类型[37]。于2012年7月进行油松细根取样工作。取样地点位于北京怀柔山区油松人工林(40°32′N,116°63′E)。海拔高度为300~900 m,冬季受西伯利亚冷空气控制,寒冷干燥;夏季受海洋性气团影响,温暖湿润。四季分明,雨热同期,干湿冷暖变化剧烈,属于暖温带半湿润大陆性季风气候。年均温10℃,年降水量500 mm,无霜期约190 d[38]。
兴安落叶松林是我国东北寒温带针叶林区北段的地带性植被类型,兴安落叶松是该地带的优势树种[31]。于2013年7月进行兴安落叶松细根取样工作。取样地点位于内蒙古大兴安岭满归林业局天然杜香——兴安落叶松林(50°30′N,121°05′E)。海拔高度为 507 ~ 1 409 m,受西伯利亚高压冷气团影响,冬季长而寒冷,夏季短促多雨。属寒温带大陆性季风气候。本区年均降水量437.4 mm,年均温-5.8℃,相对湿度为71%,无霜期约80 d[39]。
2 研究方法
2.1 根系取样
每个树种随机选取3株生长正常的样木,确定目标树后,沿主根开始逐级挖掘直到细根部分,挖取时尽量不弄断细根以保证分支的完整性。每株树平均挖取5个完整分支。将采好的样品放入贴有标签的封口袋中。马尾松和油松样品当天运回后放入-20℃冰箱中冷冻保存。兴安落叶松的细根放入浓度10%的酒精内浸泡保存。
2.2 根系分级与形态测定
先将细根用冷水清洗干净,然后将根段放在30 cm×35 cm的搪瓷方盘中,加入少量的低温去离子水。按照Pregitzer等[12]介绍的方法进行分级。最末端具有根尖的定义为1级根,两个1级根相交形成2级根,依此类推直到5级根。将分好级别的根放在40倍解剖镜下测量其直径和长度(±0.025 mm),每个树种平均1级根测量300个,2级根240个,3级根150个,4级和5级根各测量90个左右。然后将各级细根分别装入信封,放入65℃烘箱中烘干至恒重 (约48 h) 并称量所有样品的干重。
2.3 数据分析
首先计算每个树种各级根的平均直径、根长、比根长 (speci fi c root length, SRL,等于根的总长度除以生物量) 和组织密度 (tissue density, TD,等于根的生物量除以总体积) 以及相应的标准误差。然后采用单因素方差分析对每个形态指标进行检验,并用LSD检验 (α= 0.05) 对不同树种同一根序的平均直径、根长、比根长和组织密度进行差异显著性检验。相邻根序直径的变异幅度等于相邻根序平均直径之差,再除以前一级根的直径所得的百分数。根长和比根长的变异幅度也按相同的方法计算。细根各形态参数的变异系数(coef fi cient of variability, CV)等于三个树种各参数的标准差与平均值之比。
3 结 果
3.1 细根形态的表观特征
三个针叶树种的细根形态存在明显区别(图1)。兴安落叶松根系分支强度最高,侧根水平分布范围较广,多集中在土壤表层,低级根直径较粗,细根呈人字型的分支结构(图1A)。油松的主根发达,长且垂直深入地下,高级根表皮呈土黄色,而低级根呈黑色,直径较细,多为二叉分支(图1B)。马尾松低级根的根长较短但直径较粗,呈黑色 (图1C)。1级根多为三个一簇,有规律地生长,与高级根区别明显,高级根表皮多呈红褐色且极易脱落。
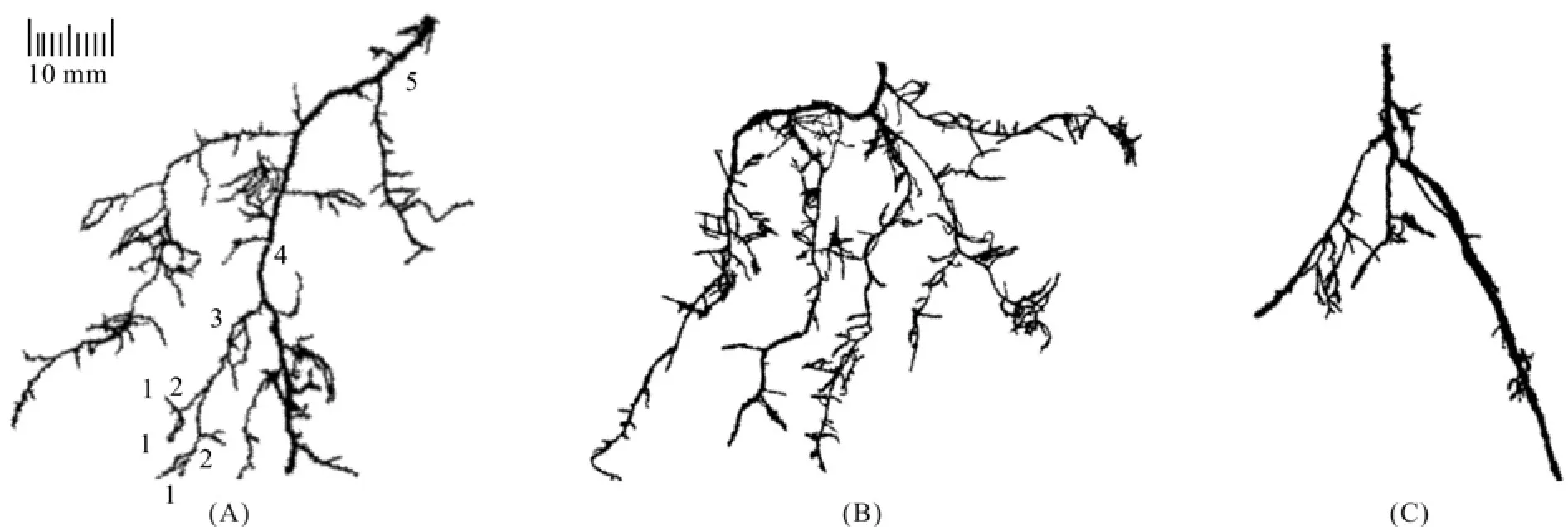
图1 三种针叶树 (A兴安落叶松,B油松,C马尾松) 的细根分支结构照片Fig. 1 Root branching systems of Larix gmelinii (A), Pinus tabulaeformis (B), and P. massoniana (C)
3.2 细根形态的差异比较
三个针叶树种1~5级细根形态变化具有明显的规律性,随着根序的升高,直径和根长增加 (图2A、B),而比根长降低 (图2C)。在它们与根序的回归分析中发现,三个树种前5级根序与各根序的平均直径、根长和比根长均有显著的指数函数关系,且预测精度很高,R2值为0.83~0.96 (表1)。每个树种的组织密度在不同根序间都没有明显的变化规律 (图2D)。
在同一根序内,不同树种间的细根平均直径、根长和比根长存在显著差异 (P< 0.05) (图2A、B和C),而组织密度没有显著区别 (P>0.05) (图2D)。其中亚热带树种马尾松1级根平均直径为0.28 mm,平均根长为2.92 mm,明显大于兴安落叶松 (寒温带) 和油松 (温带),且与油松直径和根长之间均存在显著差异 (P<0.05),油松1级根的平均直径和根长分别为0.23 mm和1.74 mm,分别小于兴安落叶松1级根的平均直径 (0.26 mm)和根长(2.49 mm),但二者之间差异不显著 (P> 0.05)。2~5级细根直径和根长的变化规律同1级根相似(图2A、B)。油松1级根的比根长最大 (67.16 m·g-1),与兴安落叶松和马尾松间存在显著差异 (P< 0.05),兴安落叶松和马尾松1级根的比根长分别为44.01 m·g-1和 50.66 m·g-1,二者之间没有显著差异 (P> 0.05),各级细根比根长在树种间的变化模式相似(图2C)。三个树种的组织密度在同一根序间都没有明显差异 (图2D)(P> 0.05)。
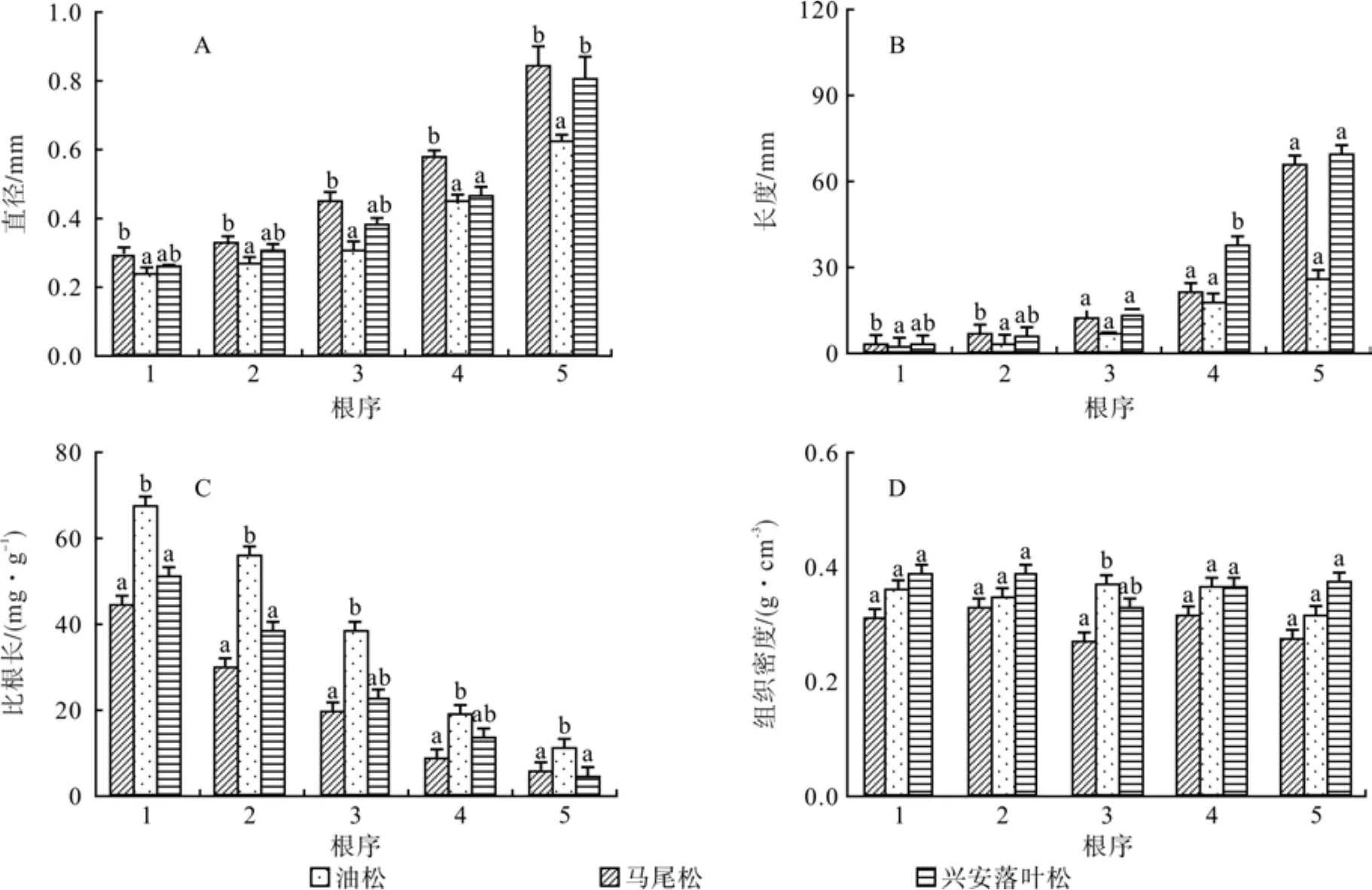
图2 三种针叶树1~5级细根形态的差异比较Fig. 2 Differences of root morphology indices of the fi rst fi ve orders among three species
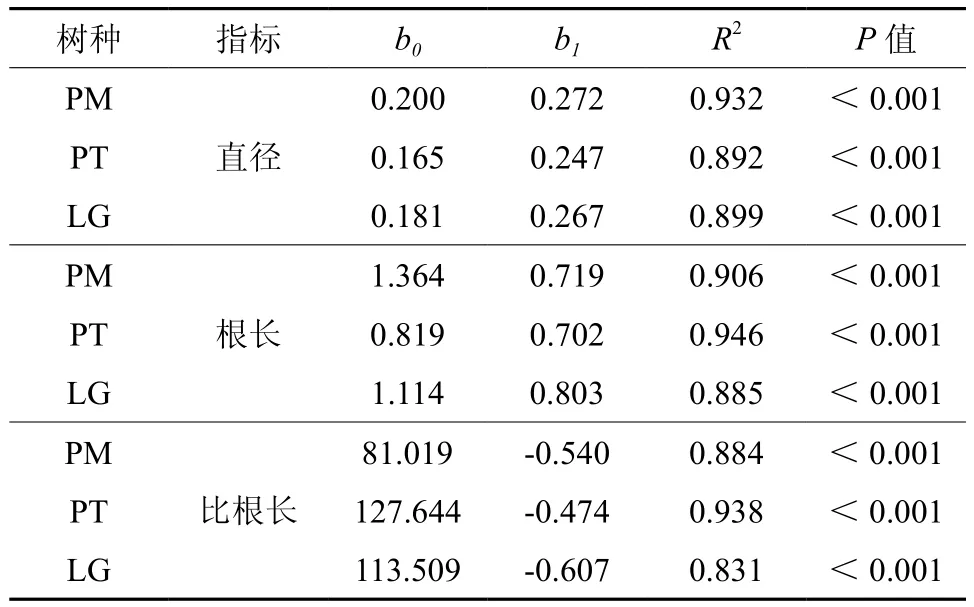
表1 平均直径、根长和比根长与根序之间的回归模型Table 1 Relationships of mean diameter, length and SRL with branch orders by means of regression for three tree species (n = 15)
3.3 细根形态的变异程度
由于三个树种不同根序间的组织密度没有显著差异 (P> 0.05) (图2D),所以这里只分析平均直径、根长和比根长相邻根序间的变异幅度。各形态参数的变异幅度表示种内相邻根序的变化情况。三个树种根直径和比根长的变异幅度较小,平均在28%~43%;而根长的变异幅度较大,最小变异幅度达50% (表2)。三个树种的各形态参数都是在低级根序间 (1~3级) 的变异幅度较小,高级根序间 (3~5级) 较大 (表2)。其中油松的各形态参数的变异最小,直径、根长和比根长的变异幅度平均为28%、101%和35%,其次是马尾松,兴安落叶松的三个根性状变异幅度最大 (表2)。
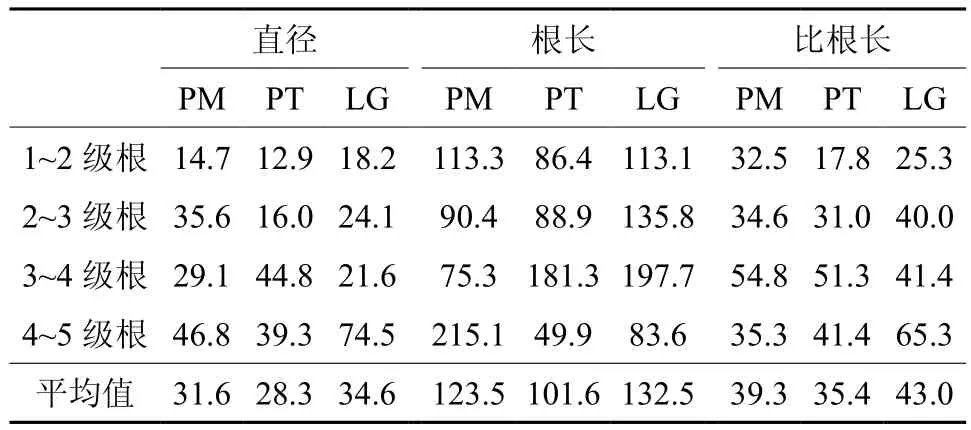
表2 三种针叶树相邻根序平均直径、根长和比根长的变异幅度Table 2 Percentage of change in mean diameter, length and SRL between neighboring branch orders (%)
各级根的变异系数表示同一根序内三个树种各形态参数的种间差异。如图3所示,根长和比根长各级根的变异系数较大,而直径和组织密度的变异系数较小。通过比较不同根序间各形态参数的变异系数发现,随着根序的增加,根长和比根长的变异系数明显增加。1级根根长的变异系数为0.25,而5级根的变异系数为0.45,比根长各级根的变异系数为0.22~0.47之间。1~5级根直径和组织密度的变异系数分别为0.10~0.18和0.08~0.16。虽然不同根序间直径和组织密度的变异系数未表现出一致的变化趋势,但都是3级根的变异系数最大,3级根直径和组织密度的变异系数分别为0.18和0.16 (图3)。

图3 三种针叶树1~5级细根形态的变异系数Fig. 3 CV of morphology (diameter, length, SRL and TD)of fi ne roots in the fi rst fi ve orders from three species
4 讨 论
根系在适应复杂的土壤环境过程中,形成了高度异质的分支系统[14,29]。不同树种间分支结构的差异体现了他们对土壤资源利用能力的不同[24,40]。我们通过对三个针叶树细根形态的研究发现,无论是在同一树种不同根序之间,还是在同一根序不同树种之间都存在较大的差异。
按照Pregitzer等[12]定义的细根等级划分方法,每个根序的根都是从上一根级发育而来的,即1级根在2级根上分支形成,2级根在3级根上分支形成,依此类推。因此,相邻根序间的细根形态具有一定的相关性[29]。我们的研究结果也符合这个规律,细根形态随根序有规律的变化,平均直径和根长随根序的升高而增加,比根长随根序的升高而降低,而且他们与根序之间存在明显的指数关系,且相关系数很高 (表1),因此,根序是预测细根形态变异的重要因子。
结果显示低级根的形态变异幅度小于高级根(表2),这说明随着根序的增加,根的形态变异增大。王向荣等[28]对水曲柳和落叶松不同根序间细根直径的变异研究,以及刘佳等[41]对5个亚热带树种的细根构型及功能特征分析发现,在同一物种内,随着根序等级的增加,直径变异系数增大。而且在不同物种之间的研究发现,根长和比根长的变异系数也随着根序的增加而增大 (图2)。这可能与根功能的转变有关。以往的研究结果表明,低级根 (通常指1、2级) 属于吸收根,没有次生生长,有菌根侵染,寿命较短;3级根在吸收和运输功能间过渡,开始出现次生生长;而高级根 (指4级根以上) 具有次生生长,没有菌根侵染,寿命较长,空间位置稳定,主要起运输和支持的作用[13-14]。也就是说随着根序的增加,根的功能从吸收向运输和支持作用转变,这可能是根系形态变异增大的原因。为了扩展到养分充足的地方,根系可以向土壤中的任何空隙生长[10],而粗根是连接吸收根 (细根) 与植物地上部分的桥梁,可能受土壤环境的影响较大。
研究表明越原始或古老的树种,各级根的直径越粗[12,42]。与同是亚热带的树种相比,马尾松各级细根的平均直径略大于古田山亚热带森林48个阔叶树种的平均直径[17]。与以往报道的相似气候条件下的针叶树种相比,马尾松前3级根直径和比根长均大于南美的湿地松;兴安落叶松与美国赤松前3级根的平均直径基本相等,但比根长略大[12]。在我国温带20种阔叶树种细根形态的研究中发现,内生菌根侵染的树种平均直径、根长和比根长均大于外生菌根侵染的树种[15]。本研究中温带树种油松细根受外生菌根侵染[43],平均直径、根长和比根长均小于文献报道的9个内生菌根侵染的树种,这符合以往的研究结论[15]。与同是外生菌根侵染的阔叶树种相比,油松的平均直径较大,比根长较小,这可能是由于油松属于较原始的裸子植物[12,15]。
不同树种间细根形态的差异反应了他们养分吸收策略的差异[44-45]。比根长是指单位生物量根的总长度,是衡量细根吸收功能的重要指标[23]。在养分贫瘠的土壤,通常在同等的碳投入下,植物通过增加细根的总吸收面积来提高对养分的吸收能力,也就是说贫瘠土壤中的细根比根长通常较大[46-47]。在三个针叶树种中,油松各级根的平均直径最细,比根长最大,这说明油松细根的养分吸收效率相对较高,这也许就是油松具有抗旱、耐贫瘠的特性,能够成为我国北方荒山造林树种的主要原因之一[48]。马尾松的平均直径最粗,而比根长最小,这可能与马尾松的生长环境有关[49]。亚热带地区降雨量充沛,生长季较长,通过高碳投入来降低细根的周转可能更经济[29,50]。
根据常文静和郭大立[29]在热带、亚热带和温带地区细根直径变异研究得出的结论推测亚热带针叶树种的细根直径>温带>寒温带。本研究结果显示,亚热带树种马尾松的平均直径和根长均明显大于兴安落叶(寒温带)和油松(温带),但兴安落叶松和油松的直径和根长没有显著差异。推测与研究结果略有不同,这可能是由于三个树种都是针叶树,属同科物种,受植物自身遗传特性的影响大于气候对细根形态的影响。通过在北美25个树种前2级细根变异的研究中发现,同一地点种间性状的变异大于不同地点树种性状的变异[23],这说明种间变异对细根的影响大于气候因素。当然,本研究的结果只是个别树种的比较,关于影响细根形态差异的原因,还需要更多树种的细根形态数据进行验证。
[1]Vogt K A, Vogt D J, Palmiotto P A,et al.Review of root dynamics in forest ecosystems grouped by climate, climatic forest type and species [J]. Plant and soil, 1996, 187(2): 159-219.
[2]Yuan Z Y, Chen H Y H. Fine root biomass, production, turnover rates, and nutrient contents in boreal forest ecosystems in relation to species, climate, fertility, and stand age: literature review and meta-analyses[J]. Critical Reviews in Plant Sciences, 2010,29(4): 204-221.
[3]McCormack M L, Adams T S, Smithwick E A H,et al. Predicting fine root lifespan from plant functional traits in temperate trees[J]. New Phytologist, 2012, 195(4): 823-831.
[4]Jackson R B, Mooney H A, Schulze E D. A global budget for fi ne root biomass, surface area, and nutrient contents[J]. Proceedings of the national Academy of Sciences, 1997, 94(14): 7362-7366.
[5]Fahey T J, Hughes J W. Fine root dynamics in a northern hardwood forest ecosystem, Hubbard Brook Experimental Forest,NH[J]. Journal of Ecology, 1994, 82(3): 533-548.
[6]Zhou Y, Su J Q, Janssens I A,et al. Fine root and litterfall dynamics of three Korean pine (Pinus koraiensis) forests along an altitudinal gradient[J]. Plant and Soil, 2014, 374(1-2): 19-32.
[7]Raich J W, Nadelhoffer K J. Belowground carbon allocation in forest ecosystems: global trends[J]. Ecology, 1989, 70(5): 1346-1354.
[8]Xiang W H, Wu W, Tong J,et al.Differences in fi ne root traits between early and late-successional tree species in a Chinese subtropical forest[J]. Forestry, 2013, 86(3): 343-351.
[9]Fitter A H, Stickland T R. Architectural analysis of plant root systems. III. Studies on plants under field conditions[J]. New Phytologist, 1992, 121(2): 243-248.
[10]Pregitzer K S. Fine roots of trees: a new perspective[J]. New Phytologist, 2002, 154(2): 267-270.
[11]王向荣, 谷加存, 梅莉, 等. 水曲柳和落叶松细根形态及母根与子根比例关系[J]. 生态学报, 2006, 26(6): 1686-1692.
[12]Pregitzer K S, DeForest J L, Burton A J,et al. Fine root architecture of nine North American trees[J]. Ecological Monographs, 2002, 72(2): 293-309.
[13]Guo D L, Xia M X, Wei X,et al. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species[J].New Phytologist, 2008, 180(3): 673-683.
[14]Valenzuela-Estrada L R, Vera-Caraballo V, Ruth L E,et al.Root anatomy, morphology, and longevity among root orders in Vaccinium corymbosum (Ericaceae)[J]. American journal of botany, 2008, 95(12): 1506-1514.
[15]师 伟, 王政权, 刘金梁, 等. 帽儿山天然次生林20个阔叶树种细根形态[J]. 植物生态学报, 2008, 32(6): 1217-1226.
[16]熊德成, 黄锦学, 杨智杰, 等. 亚热带6 种树种细根序级结构和形态特征[J]. 生态学报, 2012, 32(6): 1888-1897.
[17]贾全全. 古田山亚热带森林50个主要树种细根功能属性及其与叶片相关性研究[D].齐齐哈尔:齐齐哈尔大学,2011.
[18]熊德成, 黄锦学, 杨智杰, 等. 亚热带六种天然林树种细根养分异质性[J]. 生态学报, 2012, 32(14): 4343-4351.
[19]Guo D L, Mitchell R J, Hendricks J J. Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest[J]. Oecologia, 2004, 140(3): 450-457.
[20]于立忠, 丁国泉, 朱教君, 等. 施肥对日本落叶松人工林细根生物量的影响[J]. 应用生态学报, 2007, 18(4): 713-720.
[21]Pregitzer K S, Laskowski M J, Burton A J,et al.Variation in sugar maple root respiration with root diameter and soil depth[J].Tree Physiology, 1998, 18(10): 665-670.
[22]贾淑霞, 赵妍丽, 丁国泉, 等. 落叶松和水曲柳不同根序细根形态结构、组织氮浓度与根呼吸的关系[J]. 植物学报, 2010,45(2): 174-181.
[23]Comas L H, Eissenstat D M. Patterns in root trait variation among 25 co-existing North American forest species[J]. New Phytologist, 2009, 182(4): 919-928.
[24]Ugawa S, Miura S, Iwamoto K,et al.Vertical patterns of fi ne root biomass, morphology and nitrogen concentration in a subalpine fi r-wave forest[J]. Plant and soil, 2010, 335(1): 469-478.
[25]许 旸, 谷加存, 董雪云, 等. 海南岛4个热带阔叶树种前5级细根的形态、解剖结构和组织碳氮含量[J]. 植物生态学报,2011, 35(9): 955-964.
[26]Comas L H, Bouma T J, Eissenstat D M. Linking root traits to potential growth rate in six temperate tree species[J]. Oecologia,2002, 132(1): 34-43.
[27]Comas L H, Eissenstat D M. Linking fi ne root traits to maximum potential growth rate among 11 mature temperate tree species[J].Functional Ecology, 2004, 18(3): 388-397.
[28]王向荣, 王政权, 韩有志, 等. 水曲柳和落叶松不同根序之间细根直径的变异研究[J]. 植物生态学报,2005,29(6):871-877.
[29]常文静, 郭大立. 中国温带、亚热带和热带森林45个常见树种细根直径变异[J]. 植物生态学报, 2008, 32(6): 1248-1257.
[30]金国庆, 秦国峰, 刘伟宏, 等.不同林龄马尾松的种源选择效果[J]. 林业科学,2011,47(2): 39-45.
[31]冯宗炜,王效科,吴 刚.中国森林生态系统的生物量和生产力[M]. 北京:科学出版社. 1999, 52, 100.
[32]周政贤.中国马尾松[M]. 北京: 中国林业出版社, 2001.
[33]楼炉焕, 金水虎. 浙江古田山自然保护区种子植物区系分析[J].北京林业大学学报, 2000, 22(5): 33-39.
[34]祝燕, 赵谷风, 张俪文, 等. 古田山中亚热带常绿阔叶林动态监测样地——群落组成与结构[J]. 植物生态学报, 2008,32(2): 262-273.
[35]马钦彦.油松分布区气侯区划[J]. 北京林业大学学报,1989,(2): 1-9.
[36]张笑菁, 赵秀海, 康峰峰, 等. 太岳山油松天然林林木的空间格局[J]. 生态学报, 2010,(18): 4821-4827.
[37]陈灵芝.暖温带森林生态系统结构与功能的研究[M]. 北京:科学出版社.1997.
[38]Dai X, Chen L, Huang J. The restoration of the destroyed forest vegetation in Yunmeng Mountain, Beijing[J]. Vegetatio, 1990,87(2): 145-150.
[39]张 恒. 满归林业局天然林可持续经营对策的研究[D]. 哈尔滨: 东北林业大学. 2008.
[40]刘丽娜, 徐程扬, 段永宏, 等. 北京市3种针叶绿化树种根系结构分析[J]. 北京林业大学学报, 2008, 30(1): 34-39.
[41]刘 佳, 项文化, 徐 晓, 等. 湖南会同5个亚热带树种的细根构型及功能特征分析[J]. 植物生态学报, 2010,34(8):938-945.
[42]Chen W, Zeng H, Eissenstat D M,et al. Variation of fi rst-order root traits across climatic gradients and evolutionary trends in geological time[J]. Global Ecology and Biogeography, 2013,22(7): 846-856.
[43]张海涵, 唐 明, 陈 辉, 等. 不同生态条件下油松 (Pinus tabulaeformis) 菌根根际土壤微生物群落[J]. 生态学报, 2007,27(12): 5463-5470.
[44]Zangaro W, Nishidate F R, Vandresen J,et al. Root mycorrhizal colonization and plant responsiveness are related to root plasticity, soil fertility and successional status of native woody species in southern Brazil[J]. Journal of Tropical Ecology, 2007,23(1): 53-62.
[45]Holdaway R J, Richardson S J, Dickie I A,et al. Species- and community- level patterns in fine root traits along a 120 000-year soil chronosequence in temperate rain forest[J]. Journal of Ecology, 2011, 99(4): 954-963.
[46]Eissenstat D M. Costs and bene fi ts of constructing roots of small diameter[J]. Journal of Plant Nutrition, 1992, 15(6): 763-782.
[47]Wright I J, Westoby M. Differences in seedling growth behaviour among species: trait correlations across species, and trait shifts along nutrient compared to rainfall gradients[J]. Journal of Ecology, 1999, 87(1): 85-97.
[48]尹丽娟, 张永利. 油松——荒山造林的先锋树种[J]. 中国林业, 2009, (7): 51.
[49]周 玮,周运超,叶立鹏. 中龄林马尾松细根固土作用的调控[J]. 中南林业科技大学学报, 2015,35(1): 18-23.
[50]Eissenstat D M, Yanai R D. Plant Roots: the HidenHalf[M]. New York: Marcel Dekker Inc, 2002: 221-238.
Fine root morphology of three common conifer tree species
JIA Quan-quan1, LIU Qi-jing1, LIANG Yu2
(1. College of Forestry, Beijing Forestry University, Beijing 100083, China;2. Institute of Botany, Chinese Academy of Sciences, Beijing 100093, China)
Fine root, merely accounting for a small part of root system, is a metabolically active but poorly documented fraction of whole individual plants. It is functionally very important for individual trees, as it not only acquires resources and water for growth, but also plays a major role in carbon sequestration because of its rapid turnover rate. Fine root is also a branch system that comprises of multiple sub-branch orders. Study on morphological characteristics of fi ne root is the basis for comprehensive understanding its function. To investigate the variations in fi ne root morphological feature at species level, fi ne roots of three coniferous tree species (Pinus massoniana,P. tabulaeformis, andLarix gmelinii) were sampled from three climatic regions (subtropical, temperate and cold temperate forest) in China. Root samples were collected by excavating roots with at least fi ve branching orders, from root tip toward root collar. Roots were dissected into separate single main branches by branching orders before the dimensions were measured under a 40× stereomicroscope with an ocular micrometer (±0.025 mm). The primary goal of this study was to compare the morphological characteristics in terms of diameter, length, speci fi c root length (SRL) and tissue density (TD) by root orders. Our results show that distinct patterns across root orders, from the fi rst to the fi fth order, were identi fi ed among the three species. Root diameter, length and SRL exhibited an exponential relationship with root orders. Intraspeci fi c variations of all root traits for lower orders (1st to 3rd) were smaller than those for higher orders (3rd to 5th). Mean diameter, length and SRL of the three species with the same root order appeared significant in disparity,whereas TD did not show much difference. Mean root diameter (0.28~0.83 mm) and length (2.92~65.48 mm) ofP. massonianafrom subtropical forest were significantly larger than that ofP. tabulaeformisandL. gmelinii(P< 0.05), whileP. tabulaeformisfrom temperate forest revealed little difference withL. gmeliniifrom cold temperate forest within fi ve branching orders.P. tabulaeformishad the largest SRL (67.16~10.88 m·g-1) among the three species across all root orders. SRL ofL. gmeliniiwas insigni fi cantly larger thanP.massoniana(P> 0.05). These results imply that the intraspeci fi c variation of root traits between adjacent orders is associated with the functional diversity of fi ne roots. The climatic impact on root traits is expected to be less than the phylogeney of plant itself. Since the above comparison was only made on individual species, further researches of root morphology for more species are needed for validating the cause of root trait variation among species from different environments.
Pinus massoniana;P. tabulaeformis;Larix gmelinii; fi ne root; morphology; root order
S718.42
A
1673-923X(2016)02-0033-07
10.14067/j.cnki.1673-923x.2016.02.006
http: //qks.csuft.edu.cn
2014-09-14
国家高技术研究发展计划 (863计划)(2013AA122003)
贾全全,博士研究生
刘琪璟,教授,博导;E-mail:liuqijing@gmail.com
贾全全,刘琪璟,梁 宇,等. 三种常见针叶树种的细根形态比较[J].中南林业科技大学学报,2016, 36(2): 33-39.
[本文编校:吴 彬]

