新Cry1B蛋白基因的筛选与鉴定
米怡,罗舒予,高建华*,王兴春*
(1.山西农业大学 生命科学学院,山西 太谷 030801; 2.山西农业大学农业生物工程研究所,山西 太谷 030801)
新Cry1B蛋白基因的筛选与鉴定
米怡1,2,罗舒予1,高建华1,2*,王兴春1,2*
(1.山西农业大学 生命科学学院,山西 太谷 030801; 2.山西农业大学农业生物工程研究所,山西 太谷 030801)
[目的]Cry1B类杀虫蛋白对鳞翅目和鞘翅目昆虫具有较好的杀虫活性,具有广阔的应用前景。为进一步挖掘并研究Cry1B类蛋白。[方法]本文使用一对引物对24个Bt菌株进行定性PCR反应,尝试筛选新的cry1B基因。该引物能够扩增包括Cry1B蛋白N-端3个结构域在内的718个氨基酸编码序列。[结果]共有8个菌株包含cry1B基因,约占筛选菌株的33.3%。序列分析发现,获得8个基因中有6个为新基因,其中6-1和15-1基因编码氨基酸序列与Cry1Bd1完全相同;9-1、10-1、18-1、20-1和21-1对应氨基酸序列与Cry1Bd1的一致性≥98.5%;而4-1基因编码的氨基酸序列与Cry1Bb1和Cry1Bc1蛋白N-端仅差1个氨基酸,需要进一步鉴定C-端长尾的编码序列以判断其所属亚类。[结论]本研究获得6种新型Cry1B蛋白基因,为进一步解析这类蛋白的杀虫活性和机理提供了丰富的材料。
苏云金芽孢杆菌;cry1B基因;基因筛选;序列分析
目前,苏云金芽孢杆菌(Bacillusthuringiensis,Bt)表达的晶体杀虫蛋白依然是转基因抗虫作物的主要功能蛋白。其中,Cry1B类对鳞翅目的欧洲玉米螟(Ostrinianubilalis)、亚洲玉米螟(Ostriniafurnacalis)、小菜蛾(Plutellaxylostella)、马铃薯块茎蛾(Phthorimaeaoperculella)、菜粉蝶(Pierisrapae)、小蔗螟(Diatraeasaccharalis)等害虫均具有良好的活性[1~5];同时,Cry1Ba对马铃薯甲虫(Leptinotarsadecemlineata)和咖啡果小蠹(Hypothenemushampei)等鞘翅目害虫也具有一定杀虫活性[1, 6]。根据已有报道,Cry1B在靶标体内的受体与常用的Cry1Ab、Cry1F、Cry9C不同[7~9],不易产生交叉抗性。因此,该类蛋白具有较大的应用潜力。
Cry1B类蛋白全长约140 kDa。其N-端包含典型的三个结构域(Domain I、II和III),是主要的杀虫区域;而C-端长尾,用于促进伴孢晶体的形成[10]。本研究设计一对通用引物,在24个Bt菌株中,筛选cry1B基因。共筛选出8个基因,并对其编码氨基酸序列进行同源性分析,为后期研究相应氨基酸变化与杀虫活性的关系奠定基础。
1 材料与方法
1.1 材料
本文涉及的菌株包括:大肠杆菌(Escherichiacoli)DH5α菌株、24份Bt菌株。
本文涉及的分子生物学试剂包括:用于PCR反应的Takara Premix Taq(货号RR003A);用于基因克隆的Takara pMD19载体(货号6013)和天根大肠杆菌DH5α感受态细胞;DNA标准分子量为Thermo Scientific GeneRuler 1 kb DNA Ladder(货号#SM0313);Takara限制性内切酶BamHI和SacI(货号1010S和1078S);质粒提取使用天根快速质粒小提试剂盒(货号DP105);DNA片段凝胶回收使用天根通用型DNA纯化回收试剂盒(货号DP214)。
1.2 方法
1.2.1cry1B基因的筛选
将Bt菌株28.5 ℃,200 r·min-1培养过夜。将2 mL菌液放入离心管,然后12 000 r·min-1离心3 min,收集细胞沉淀。细胞用2 mL ddH2O重悬,作为PCR反应的模板。使用引物1B-F(5'-GGATCCATGACTTCAAATA GGAAAAATGAGA ATG)和1B-R(5'-GAGCTCTTATAAGTTTCTTTCATCACTGAGTCG)进行PCR反应,预期大小约2.1 kb。反应体系为2×Premix Taq 12.5 μL、上下游引物各0.5 μL、模板0.5 μL、最后加入11 μL ddH2O。反应条件为95 ℃预变性5 min;30个扩增循环(包括95 ℃,40 s;58 ℃,40 s;72 ℃,2 min);最后72 ℃,延伸10 min。
1.2.2cry1B基因的克隆及鉴定
将PCR产物割胶回收(按产品说明书操作)。然后将回收片段连接pMD19载体(总10 μL体系,包括:目的片段4 μL;pMD19-vector 1 μL;Solution I 5 μL),16 ℃反应过夜。将连接产物转化大肠杆菌DH5α感受态细胞,并进行蓝白斑筛选。将获得的克隆分别提取质粒(按产品说明书操作),并使用限制性内切酶BamHI和SacI进行双酶切鉴定。最后,对鉴定正确的克隆,进行测序和序列分析。
1.2.3 氨基酸序列同源性分析
将测序获得的各个基因编码氨基酸序列导入MEGA7,并与Cry1Ba1、Cry1Bb1、Cry1Bc1、Cry1Bd1、Cry1Bf1、Cry1Bg1和Cry1Bh1等7个已知的Cry1B类蛋白进行比对。然后按照Neighbor-Joining法[11]构建系统发育树,分析其亲缘关系。
2 结果与分析
使用引物1B-F和1B-R对24个Bt菌株进行PCR筛选,预期大小约2.1 kb。筛选结果显示,4号、6号、9号、10号、15号、18号、20号和21号菌株均为阳性,且扩增产物与预期大小一致(图1A)。
将上述8份PCR产物进行纯化和T-克隆。然后对相应的克隆的质粒进行双酶切鉴定。结果显示,每个PCR产物均获得了正确的T-克隆(图1B)。比如,图1B中4号菌株的PCR产物T-克隆的两个单克隆均正确,本文将其克隆基因命名为4-1和4-2基因,对应编码蛋白命名为4-1和4-2蛋白。其它菌株PCR产物的T-克隆基因和对应编码蛋白的命名以此类推。
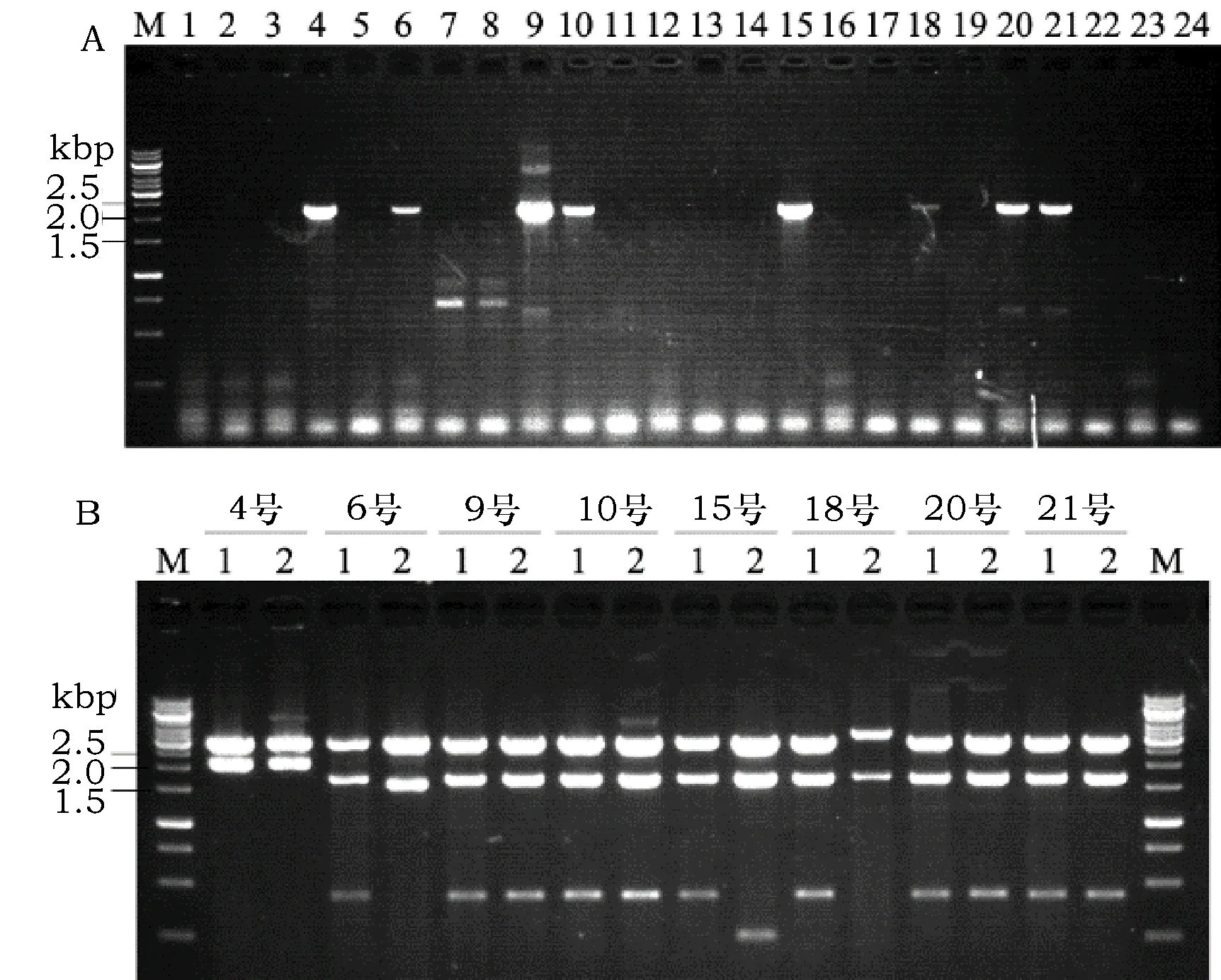
图1 cry1B基因的筛选(A)及PCR产物T-克隆的鉴定(B)Fig.1 Results of screening cry1B genes by PCR method (A) and the restriction map of T-clones of the putative cry1B genes
将正确的T-克隆测序,并将其编码的蛋白质序列与已知的Cry1B蛋白亚类N-端对应序列进行比对(图2A)并分析其亲缘关系。结果显示,6-1、9-1、10-1、15-1和21-1等基因编码蛋白与Cry1Bd1属于一个分支;18-1和20-1蛋白属于一个分支;而4-1蛋白与Cry1Bc1和Cry1Bb1更接近(图2B)。进一步进行分析发现,6-1和15-1氨基酸序列完全一致,且与Cry1Bd1蛋白N-端序列相同;10-1和9-1蛋白与Cry1Bd1蛋白N-端序列分别只有两个氨基酸的差异;21-1蛋白与Cry1Bd1有3个氨基酸不同,相似性均大于99.5%。20-1和18-1蛋白之间有3个氨基酸不同,且与Cry1Bd1一致性分别为98.5%和98.6%,与Cry1Bh1相似性均约93%。4-1蛋白与Cry1Bc1和Cry1Bb1只有1个氨基酸不同。

图2 新Cry1B蛋白特异位点示意图(A, 三角形标注)及其与已知蛋白亲缘关系(B, Neighbor-Joining method[11])Fig.2 The phylogenetic tree of the Cry1B proteins
3 结论与讨论
本文从24个菌株中筛选cry1B基因,获得了8个阳性结果,占33.3%。8个cry1B基因中,7个编码的氨基酸序列与Cry1Bd1高度相似,尤其是6-1和15-1与Cry1Bd1蛋白N-端序列完全一致。只有一个基因4-1编码序列与Cry1Bb1和Cry1Bc1蛋白N-端高度相似,仅1个氨基酸不同。当然,如果需要具体确认这8个新基因的分类地位并命名,还需要进一步确定其C-端序列。比如,Cry1Bb1和Cry1Bc1蛋白N-端序列完全相同,而C-端序列表现出较大差异。因此,根据本文测定的4-1基因序列暂时无法确定其与Cry1Bb1和Cry1Bc1的亲疏关系。
本文报道的新基因丰富了Cry1B蛋白变异库,为研究Cry1B蛋白活性和杀虫机理提供了更多的材料。比如,18-1和20-1分支,与Cry1Bd1蛋白的主要氨基酸差异集中在蛋白的N-端(图2A)。该区域在Cry蛋白激活时被切除[12],因此与杀虫活性关系可能较小。而其他4个新基因(不包括6-1和15-1)编码氨基酸与相应Cry1B蛋白的差异区域分别分布于结构域I、II和III中(图2A),因此在杀虫活性或靶标识别上可能存在潜在差异。
综上,本文通过筛选获得了8个潜在的新型cry1B基因,将进一步确定其完整基因的序列,从而确定其分类地位。另外,新基因的获得对进一步研究其杀虫活性或机理提供了丰富的材料。
[1]Bradley D, Harkey M A, Kim M K, et al. The insecticidal CryIB crystal protein ofBacillusthuringiensisssp.thuringiensishas dual specificity to coleopteran and lepidopteran larvae[J]. Journal of Invertebrate Pathology, 1995,65(2):162-173.
[2]刘楠,王少丽,宋福平,等.Cry1Ba3、Cry1Ia8蛋白对Cry1Ac抗性小菜蛾的杀虫活性研究[J].植物保护,2010,36(2):66-70.
[3]林承喜,束长龙,翟元娜,等.苏云金芽胞杆菌Cry1Ba3蛋白定点突变对杀小菜蛾活性的影响[J].植物保护,2011,37(6):75-81,101.
[4]尹凤翔,孙凯,束长龙,等.Cry1Ba3蛋白对亚洲玉米螟杀虫活性测定及其与BBMVs的结合分析[J].植物保护,2014,40(2):22-27.
[5]Tan S Y, Cayabyab B F, Alcantara E P, et al. Comparative susceptibility ofOstriniafurnacalis,OstrinianubilalisandDiatraeasaccharalis(Lepidoptera: Crambidae) toBacillusthuringiensisCry1 toxins[J]. Crop Protection, 2011,30(9):1184-1189.
[6]López-Pazos S A, Rojas Arias A C, Ospina S A, et al. Activity ofBacillusthuringiensishybrid protein against a lepidopteran and a coleopteran pest[J]. FEMS Microbiology Letters, 2010,302(2):93-98.
[7]Hernández-Rodríguez CS, Hernández-Martínez P, Van Rie J, et al. Shared midgut binding sites for Cry1A.105, Cry1Aa, Cry1Ab, Cry1Ac and Cry1Fa proteins fromBacillusthuringiensisin two important corn pests, Ostrinia nubilalis and Spodoptera frugiperda[J]. PLoS ONE, 2013,8(7):e68164.
[8]Lira J, Beringer J, Burton S, et al. Insecticidal activity ofBacillusthuringiensisCry1Bh1 againstOstrinianubilalis(Hübner) (Lepidoptera: Crambidae) and other lepidopteran pests[J]. Applied and Environmental Microbiology, 2013,79(24):7590-7597.
[9]Hernández-Martínez P, Hernández-Rodríguez C S, Van Rie J, et al. Different binding sites forBacillusthuringiensisCry1Ba and Cry9Ca proteins in the European corn borer,Ostrinianubilalis(Hübner)[J]. Journal of Invertebrate Pathology,2014,120:1-3.
[10]Schnepf E, Crickmore N, Van Rie J, et al.Bacillusthuringiensisand its pesticidal crystal proteins[J]. Microbiology and molecular biology reviews: MMBR,1998,62(3):775-806.
[11]Saitou NNei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution, 1987,4(4):406-425.
[12]Pardo-López L, Soberón MBravo A.Bacillusthuringiensisinsecticidal three-domain Cry toxins: mode of action, insect resistance and consequences for crop protection[J]. FEMS Microbiology Reviews,2013,37(1):3-22.
(编辑:武英耀)
Screening and identification of novelcry1Bgenes
Mi yi1,2, Luo Shuyu1, Gao Jianhua1,2*, Wang Xingchun1,2*
(1.Collegeoflifescience,ShanxiAgriculturalUniversity,Shanxi030801,China, 2.InstituteofAgriculturalBioengineering,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]Cry1B toxins from Bt strains are toxic against some lepidoptera and coleopteran pests and therefore are good candidates for insect pest management. In this paper, we screened newcry1Bgenes from 24 Bt strains.[Methods]PCR method was used for new genes screening and the chosen primer pair can amplified the sequences encoding the 718 amino acids of N-terminal of Cry1B proteins.[Results]The results showed that about 33.3 per cent strains (8 of 24 strains) containedcry1Bgenes. Sequencing analysis revealed that 6-1 and 15-1 genes encodes same polypeptides as Cry1Bd1. And 9-1, 10-1, 18-1, 20-1 and 21-1 represented higher amino acid sequence identity than 98.5% with Cry1Bd1. There was only one amino acid difference between the deduced protein of 4-1 gene and N-terminal Cry1Bb1 or Cry1Bc1, so further identifying C-terminal encoding sequence would be necessary to conclude its classification.[Conclusion]In summary, we obtained 6 novelcry1Bgenes which can be ideal candidates for researching insecticidal activity and action mode of Cry1B proteins.
Bacillusthuringiensis,cry1Bgene, Gene screening, Sequence analysis
2016-09-21
2016-10-22
米怡(1992-),女(汉),山西运城人,在读硕士研究生,研究方向:Bt杀虫蛋白杀虫机理研究
*通讯作者:王兴春,教授,博士生导师,Tel: 13593101640,E-mail:wxingchun@163.com;高建华,副教授,硕士生导师,Tel: 18235430887,E-mail:gaojh_edu@163.com
国家自然科学基金项目(31601690);山西省基础研究项目自然科学基金面上项目(2015011080);山西农业大学科技创新基金(2014015)
Q78
A
1671-8151(2016)12-0875-04

