杂色鲍AP-1的克隆及在发育和弧菌感染后的表达分析
王国栋,和四梅,张丽莉,王艺磊
( 集美大学 水产学院,农业部东海海水健康养殖重点实验室,福建 厦门361021;集美大学 水产生物技术研究所,福建 厦门 361021 )
杂色鲍AP-1的克隆及在发育和弧菌感染后的表达分析
王国栋,和四梅,张丽莉,王艺磊
( 集美大学 水产学院,农业部东海海水健康养殖重点实验室,福建 厦门361021;集美大学 水产生物技术研究所,福建 厦门 361021 )
激活蛋白1(AP-1)是具有亮氨酸拉链功能域的转录因子,参与了发育和免疫等多个生物学过程。为研究该基因在杂色鲍发育和免疫中的作用,本研究克隆了杂色鲍AP-1基因的全长cDNA(命名为HdAP-1),并分析了HdAP-1在各组织、各发育时期以及副溶血弧菌刺激后的表达特征。结果表明,HdAP-1 cDNA 全长为 1482 bp,5′非编码区域(5′UTR)为133 bp,3′UTR为 401 bp,开放阅读框为948 bp。该基因编码蛋白预测分子量为 34.83 ku,等电点为9.43,具有典型AP-1蛋白家族的Jun转录因子功能域和bZIP功能域。HdAP-1在所检测7个组织中均有表达,其中血淋巴表达量最高,鳃、肾、肠和黏液腺的表达量次之,肝胰腺和外套膜表达量最低。自受精卵至囊胚期HdAP-1的表达量显著低于原肠胚 (P<0.05),由原肠胚到担轮幼虫该基因表达量继续上升,担轮幼虫至匍匐幼虫期均维持较高的表达水平,变态后在稚鲍中的表达量下降。在副溶血弧菌感染24 h后,HdAP-1表达量显著上升(P<0.05)。其他时段该基因的表达量与对照组相比差异不显著 (P>0.05)。
杂色鲍;激活蛋白(AP-1);基因表达;发育;细菌感染
激活蛋白1(AP-1)蛋白家族是一类亮氨酸拉链转录因子,能够调节细胞增殖、迁移、存活、生长、分化和凋亡等细胞过程[1-2]。在哺乳动物细胞中,AP-1能够形成同聚二聚体或与同家族的jun、fos和atf等形成异聚二聚体,并可以与特异DNA基序[TGA/C(G)TCA]结合[2]。通过与DNA基序结合,AP-1复合体能够控制细胞因子在不同类型组织和细胞中的表达[3-5],在调节炎症方面具有重要作用[3]。作为先天免疫反应的重要分子,AP-1的激活受TLR、TNF和RIG等多个信号传导通路的调控[6-7],同时还需要干扰素和白介素等多种细胞因子参与[8-9]。由于AP-1能够和很多分子发生相互作用,参与了多个生物学过程,所以在哺乳动物中研究较为透彻。已有诸多报道表明,AP-1蛋白家族的重要成员Jun转录因子参与了哺乳动物的免疫防御[10-11]。鉴于AP-1能够调控大量免疫相关基因的表达,开展无脊椎动物AP-1基因的研究可以对其先天免疫应答作用机制的探讨提供一定参考[12]。
海洋无脊椎动物AP-1的研究相对较少,在皱纹盘鲍(Haliotisdiscushannai)[13]、香港巨牡蛎(Crasstreahongkongensis)[14]、菲律宾蛤仔(Ruditapesphilippinarum)[15]和凡纳滨对虾(Litopenaeusvannamei)[12]中有报道表明,其参与了免疫过程。杂色鲍(H.diversicolor)自然分布于我国东南沿海地带,是我国主要的养殖贝类之一。近年来因种质退化以及养殖规模工厂化和集约化程度的不断提高等原因导致杂色鲍爆发性病害频发[17],成为阻碍我国杂色鲍的养殖发展的主要因素。副溶血弧菌(Vibrioparahaemolyticus)是杂色鲍的主要病原菌之一,常导致杂色鲍的大量死亡[18-19]。因此,笔者进行了杂色鲍AP-1基因的克隆和在副溶血弧菌感染后的表达分析研究。希望研究结果为了解杂色鲍的免疫机制提供科学依据。
1 材料与方法
1.1 试验动物
壳长4.5~5.0 cm杂色鲍购自厦门大嶝岛养殖场,试验前暂养于新鲜海水中,投喂新鲜的江蓠和海带。每两天换水一次,保持海水溶氧量>5 mg/L,水温控制在其最适生长温度23~25 ℃。饲养两周后,用于杂色鲍的育苗、成体取样以及细菌感染试验。
1.2 杂色鲍各组织以及发育各时期样品采集
取10只健康杂色鲍,解剖后分别采集肝胰腺、血淋巴细胞、上足、鳃、肾、黏液腺、肠和外套膜。所取的组织液氮速冻后,存于-80 ℃备用。用手术刀在鲍腹足中央切开约1 cm缺口,用胶头滴管吸取血液于离心管中,4 ℃,2000 r/min离心10 min,弃上清液后,获得血淋巴细胞。
选取体质健壮,足肌活动敏捷,性腺外观饱满,雌雄各30只为亲鲍。采用综合诱导法分别对雌雄亲鲍刺激。亲鲍分雌雄两组,经0.5~1 h的阴干刺激后,用紫外线照射海水(200~300 mW·h/L),处理2~4 h,然后经 ±3 ℃的变温刺激,即可获得精子和卵子。随后进行人工授精,精卵分别收集到一塑料容器中。受精时,卵子密度20~100 个/mL,精子密度5×105个/mL,不断轻轻搅动水体,加速精卵结合,受精后及时洗精卵3~4次,每次间隔约30 min。将受精卵转至水温(25 ± 1) ℃、盐度32 ± 1 的新鲜海水中继续培养,用普通光学显微镜观察卵裂状况。收集受精卵、2细胞期、4细胞期、桑葚胚、囊胚期、原肠期、担轮幼虫、面盘期幼虫、匍匐幼虫和变态后稚鲍,将采集样品液氮速冻后,存于-80 ℃待用。
1.3 副溶血弧菌细菌感染试验
参照文献[19-20]的方法进行。杂色鲍经2 周驯养后,在腹足肌肉注射 50 μL 密度为 1.1×108cfu/mL的副溶血弧菌菌液,对照组注射 50 μL 灭菌新鲜海水。在注射后的0、3、6、12、24、48 h,分别取试验组和对照各10只杂色鲍的血淋巴和鳃放入液氮速冻,存于-80 ℃待用。
1.4 总RNA提取和cDNA的合成
样品由-80 ℃转至Trizol溶液 (Roche公司) 中,按照说明书提取样品总RNA,1.5%琼脂糖凝胶电泳检测后,微量紫外分光光度计测定浓度和纯度。
取1.5 μg总RNA与分别与1 μL oligo (dT) (10 μmol/L) 或1 μL 3′CDS primer (10 μmol/L)或1 μL 5′CDS primer (10 μmol/L) 混合,按照SMART PCR Synthesis Kit (Clontech 公司) 的说明合成cDNA。逆转录所用引物见表1。
1.5 HdAP-1基因的克隆及序列分析
根据杂色鲍转录组筛选得到的HdAP-1片段,用Primer 3(http://primer3.ut.ee/)设计的RACE引物扩增其全长cDNA,并进行3′RACE和5′RACE,用head to toe PCR验证其开发阅读框的正确性。PCR产物琼脂糖电泳后,割胶纯化,送至生工生物工程(上海)股份有限公司,用Sanger法双端测序。所用引物见表1。
采用美国国立生物技术信息中心NCBI的Vecscreen去掉测序载体序列,用bl2seq拼接序列,经blastx和ORF Finder确定其开放阅读框后,用欧洲分子生物学开放软件包(http://imed.med.ucm.es/EMBOSS/) 的prettyseq程序进行核酸序列和蛋白序列翻译。使用ExPASy (http://www.expasy.org/)预测其编码蛋白等电点及分子量,使用NetPhos 2.0 Server (http:∥www.cbs.dtu.dk/services/NetPhos/)预测磷酸化位点,使用NetNGlyc 1.0 Server(http:∥www.cbs.dtu.dk/services/NetNGlyc/) 预测糖基化位点,TMHMM2.0 Server (http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测蛋白跨膜结构域,利用BioEdit软件进行序列的多重比对,利用MEGA 4.0软件中邻位相接法构建系统进化树。

表1 所用引物及其序列
1.6 实时定量PCR
利用表1的定量引物,以oligo (dT)逆转录合成cDNA为模板,按照SYBR Green Realtime PCR Master Mix (TOYOBO公司)的说明进行实时定量PCR。依据杂色鲍内参基因稳定性的研究结果[18,21],发育阶段以YB1为内参基因,其他以β-actin为内参基因。检测扩增产物溶解曲线和扩增曲线,并测序,以验证扩增特异性。每个时相分析10个样品,计算每个样品的2-ΔΔCt为RQ值,基因的表达水平表示为RQ平均值±标准差。组织表达和发育阶段用ANOVA进行数据方差分析,Duncan多重比较分析各组织和各阶段表达的差异性,弧菌感染进行t检验分析,显著性差异表示为P<0.05。
2 结 果
2.1 HdAP-1全长cDNA克隆
HdAP-1 cDNA 全长为 1482 bp,包括 133 bp 的 5′非编码区域,401 bp 3′非编码区域和 948 bp 开放阅读框,该开放阅读框编码 315 个氨基酸(图1)。推导蛋白的预测分子量为 34.83 ku,等电点为 9.43。包含Jun转录因子功能域(Jun transcription factor domain, 38~226 aa )和 bZIP功能域(basic leucine zipper domain, 235~299 aa ),2个糖基化位点,19 个磷酸化位点。Blastp比对结果显示,本试验所得序列与盘鲍AP-1(ADQ43242.1)、太平洋牡蛎AP-1(C.gigas, EKC41210.1)、 菲律宾蛤仔AP-1(ADZ48236.1)和斑马鱼(Daniorerio, NP_956881.1)的一致性分别达到97%、63%、56%和45%。

图1 HdAP-1基因cDNA及推导的氨基酸序列终止密码子(taa)和加尾信号(AATAAA)用粗体表示,方框表示磷酸化位点,圆圈表示糖基化位点,下划线部分 Jun转录因子功能域(38~226 aa),虚线线部分为跨膜区域 (235~299 aa).
2.2 同源分析和系统发育分析
将HdAP-1推导的氨基酸序列与其他物种的 AP-1蛋白进行多重序列比对(图2),结果显示有一个相对保守bZIP结构域。其中亮氨酸拉链基序以每隔7个氨基酸残基出现一个亮氨酸为特征,并且亮氨酸前后一般会有碱性氨基酸残基(R)。

图2 杂色鲍和其他物种的AP-1氨基酸序列比较分析方框为bZIP功能域,箭头部分为亮氨酸拉链基序的亮氨酸残基.杂色鲍、香港巨牡蛎、斑马鱼、原鸡(Gallus gallus)和人等5个物种的AP-1蛋白的登录号分别为AGE82886.1、AHF51977.1、NP_956281.1、NP_001026460.1和NP_002219.1.
采用 MEGA 4.0 软件,以邻位相连法构建系统进化树。HdAP-1首先与盘鲍的AP-1聚为一支,然后与双壳类聚为贝类一组。同时,脊椎动物也聚为一组,然后与海胆聚在一起,最后与贝类聚在一起(图3)。

图3 AP-1氨基酸序列的NJ系统进化树
2.3 组织、发育和弧菌感染的表达分析
HdAP-1在检测7个组织中均有表达,以血淋巴中表达量最高,显著高于其他组织(P<0.05),鳃、肾、肠和黏液腺的表达量次之,而肝胰腺和外套膜表达最低,显著低于其他组织(P<0.05) (图4)。
自受精至囊胚期,HdAP-1表达量一直维持非常低的表达水平,显著低于其他发育阶段(P<0.05)。自原肠胚期开始的表达量显著上升,发育到幼虫阶段时HdAP-1表达量最高,显著高于其他阶段(P<0.05)。变态成为稚鲍后表达量显著下降(P<0.05) (图5)。
在副溶血弧菌感染24 h后,HdAP-1表达量显著上升(P<0.05)。其他取样时相,该基因的表达量在弧菌感染组与对照组间差异不显著(P>0.05) (图6)。
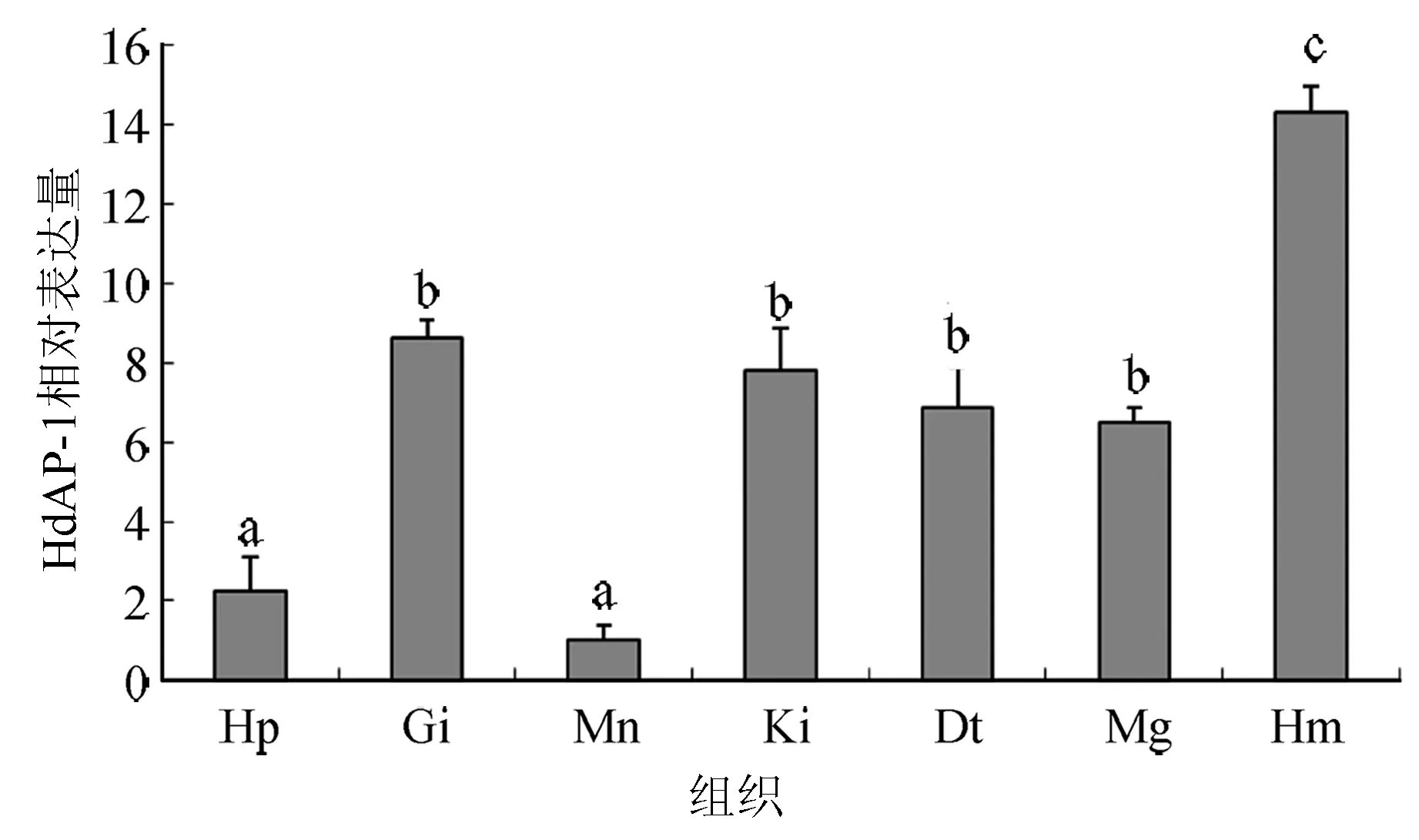
图4 HdAP-1基因各组织相对表达量Hp:肝胰腺,Gi:鳃,Mn:外套膜,Ki:肾,Dt:消化道,Mg:黏液腺,Hm:血淋巴.相同字母表示差异不显著(P>0.05), 不相同字母差异显著(P<0.05).
3 讨 论
AP-1作为转录因子参与众多生物学过程,其结构具有AP-1蛋白家族的典型特征,即N端具有Jun功能域,C端具有bZIP功能域。bZIP功能域高度保守,可以形成二聚体,并且能够和DNA大沟结合[22]。比对结果表明,HdAP-1的bZIP功能域与人、斑马鱼具有高度的保守性。HdAP-1具有多个磷酸化位点,这表明其活性受到翻译后磷酸化修饰调控。酪蛋白激酶Ⅱ、糖原合成酶激酶3β和核糖体S6激酶2等能够通过磷酸化调节AP-1的活性[1]。人AP-1的S63/S73/T91/T93/T231/T243等6个与活性相关的磷酸化位点在杂色鲍中也高度保守。本试验所得HdAP-1中,这些保守的氨基酸残基也可以通过磷酸化来调节HdAP-1的活性。

图5 HdAP-1基因在各发育阶段的表达量FE:受精卵,2C:2细胞期,4C:4细胞期,MO:桑葚胚期,BL:囊胚期,GA:原肠胚期,TR:担轮幼虫, VE:面盘幼虫,CR:匍匐幼虫,JU:稚鲍.相同字母表示没有显著差异(P>0.05), 不相同字母表示有显著差异(P<0.05).

图6 HdAP-1基因在副溶血弧菌感染后表达变化*表示对照组和弧菌感染组存在显著性差异(P<0.05).
HdAP-1基因在杂色鲍所检测组织中具有表达,这与盘鲍、凡纳滨对虾和菲律宾蛤仔的AP-1相同[12-13,15],与AP-1基因家族成员在各组织中呈组成型表达类似[1]。AP-1的表达模式具有细胞或组织类型特异性,在不同的细胞或组织调节转录各自特异的基因,因而能够发挥不同的作用[22-24]。HdAP-1在血淋巴中表达量最高,这与凡纳滨对虾和菲律宾蛤仔相同[12-15]。鉴于杂色鲍血淋巴在免疫反应中具有重要作用[25],HdAP-1在血淋巴的高表达可能表明其在免疫过程中具有一定作用。在鳃、黏液腺、消化道等与外界刺激物直接接触的组织同样也具有较高的表达水平,表明其除了参与免疫过程外,可能在细胞凋亡等过程也具有重要作用[26]。这与同样与凡纳滨对虾和菲律宾蛤仔类似[12-15]。但是HdAP-1在各组织的表达水平与盘鲍差别很大,在血淋巴、外套膜等组织表达水平甚至完全相反[13]。这可能是因采用不同内参所致。盘鲍的组织表达的内参基因采用的是核糖体蛋白L17(EF103427),凡纳滨对虾、菲律宾蛤仔和杂色鲍均以β-actin为内参基因。
在鼠中大量的功能获得或缺失试验证明了AP-1参与了发育过程的调控[1]。本试验中在原肠胚时期HdAP-1的表达水平显著上升,在担轮幼虫至匍匐幼虫阶段一直处于较高的表达水平。在原肠胚阶段,细胞开始大量的分化和迁移。AP-1作为转录因子参与了细胞分化、迁移和转化[1]。因此在原肠胚时期,HdAP-1的表达量显著上升。杂色鲍的幼虫需经历担轮幼虫、面盘幼虫和匍匐幼虫3个阶段。不同阶段的幼虫形态结构差别巨大,细胞需要大量增殖、分化和迁移。之后需要经历变态,成为在生态习性和机体结构同成体类似的稚鲍。变态过程中需要经历细胞分化和组织重构,是细胞凋亡比较旺盛的阶段[27-28]。因此在整个幼虫时期,参与调节细胞增殖、分化、迁移和凋亡的HdAP-1维持在一个表达较高的水平。此外,鲍幼虫变态一般需要外界环境因子的刺激来激活[27]。果蝇中的证据表明AP-1可以作为一个通用开关选择性表达遗传信息来响应外界环境的变化[28]。这是变态前的匍匐幼虫HdAP-1高表达的原因之一。
AP-1能够响应各种生理、病理和环境刺激,包括细胞因子、生长因子、神经递质、多肽激素、紫外线辐射、细菌和病毒感染[29-32]。盘鲍、菲律宾蛤仔和凡纳滨对虾等无脊椎动物在病原刺激后AP-1表达量都有显著性变化[12-13,15]。HdAP-1在弧菌处理后表达量显著上升,与上述3种无脊椎动物的AP-1表达类似。表明在无脊椎动物AP-1能够响应病原的刺激。在弧菌感染前24 h,HdAP-1的表达水平在对照组和弧菌注射组间几乎相同,表明该基因在副溶血弧菌侵染前并未发挥防御作用。在24 h,弧菌注射组HdAP-1的表达量才显著高于对照组,表明该基因参与了防御弧菌过程。AP-1的活性主要受MAPK信号通路调控[1],在免疫信号传导中属于下游效应基因。在免疫应答的起始阶段,主要是模式识别蛋白和信号通路上游因子参与病原的识别和信号的传导[20]。例如,杂色鲍Toll样信号通路的上游接头分子IRAK4,在弧菌感染3 h表达量就显著上升。而AP-1作为下游效应基因,直接激活其他免疫防御基因,参与病原的清除过程,因此在病原进入机体一段时间后才大量表达。
本试验克隆了HdAP-1的全长cDNA,其编码蛋白含有Jun和bZIP功能域,具备AP-1蛋白家族典型特征。该基因在各组织均有表达,以血淋巴含量最高,并在弧菌感染24 h时表达量显著上升,这表明该基因参与了免疫防御。在发育过程,HdAP-1在担轮幼虫至匍匐幼虫阶段表达量最高,这表明其在幼虫细胞增殖、分化、迁移和凋亡中具有重要作用。希望这些研究结果为杂色鲍的发育和免疫研究提供有益帮助。
[1] Ye N, Ding Y, Wild C, et al.Small molecular inhibitors targeting activator protein 1 (AP-1) [J]. Journal of Medicinal Chemistry, 2014, 57(16):6930-6948.
[2] Vesely P W, Staber P B, Hoefler G, et al. Translational regulation mechanisms of AP-1 proteins[J]. Mutat Res, 2009, 682(1):7-12.
[3] Karin M,Shaulian E. AP-1:linking hydrogen peroxide and oxidative stress to the control of cell proliferation and death [J]. IUBMB Life, 2001, 52(1/2):17-24.
[4] Adcock I M.Transcription factors as activators of gene transcription:AP-1 and NF-kappa B [J]. Monaldi Arch Chest Dis, 1997, 52(2):178-186.
[5] Jochum W, Passegue E, Wagner E F. AP-1 in mouse development and tumorigenesis [J]. Oncogene, 2001, 20(19):2401-2412.
[6] Karpus O N, Heutinck K M, Wijnker P J, et al. Triggering of the dsRNA sensors TLR3, MDA5, and RIG-I induces CD55 expression in synovial fibroblasts [J]. PloS One 2012, 7(5):35606.
[7] Redhu N S, Saleh A, Halayko A J, et al. Essential role of NF-kappaB and AP-1 transcription factors in TNF-alpha-induced TSLP expression in human airway smooth muscle cells [J]. Am J Physiol Lung Cell Mol Physiol, 2011, 44(3):479-485.
[8] Wehkamp J, Harder J, Wehkamp K, et al. NF-kappaB- and AP-1-mediated induction of human betadefensin-2 in intestinal epithelial cells byEscherichiacoliNissle 1917:a novel effect of a probiotic bacterium [J]. Infect Immunol, 2004, 72(10):5750-5758.
[9] Saadane A, Eastman J,Berger M, et al. Parthenolide inhibits ERK and AP-1 which are dysregulated and contribute to excessive IL-8 expression and secretion in cysticbrosis cells [J]. J Inamm (Lond), 2011, 8(44):7867-7884.
[10] Chiu R, Boyle W J, Meek J, et al. The c-Fos protein interacts with c-Jun/AP-1 to stimulate transcription of AP-1 responsive genes [J]. Cell,1988,54(4):541-552.
[11] Kim J, Woolridge S, Biffi R, et al.Members of the AP-1 family, c-Jun and c-Fos, functionally interact with JC virus early regulatory protein large T antigen [J]. J Virol, 2003, 77(9):5241-5252.
[12] 吴冰, 刘逸尘, 张亦陈,等. 凡纳滨对虾AP-1基因的克隆和表达特征分析[J]. 水产学报, 2014, 38(9):1294-1301.
[13] De Z M, Nikapitiya C, Lee Y, et al.First molluscan transcription factor activator protein-1 (AP-1) member from disk abalone and its expression profiling against immune challenge and tissue injury [J]. Fish and Shellfish Immunol, 2010, 29(6):1028-1036.
[14] Xiang Z, Qu F, Li J, et al. Activator protein-1 (AP-1) and response to pathogen infection in the Hong Kong oyster (Crassostreahongkongensis) [J]. Fish and Shellfish Immunol, 2013, 36(1):83-89.
[15] Wu L, Zhang L, Zhao J, et al.Cloning and expression of a transcription factor activator protein-1 (AP-1) member identified from Manila clamVenerupisphilippinarum[J]. Gene, 2015, 557(1):106-111.
[16] 王江勇, 郭志勋, 冯娟, 等. 养殖杂色鲍暴发病超微病理学研究[J]. 海洋科学, 2007, 31(3):28-32.
[17] 陈政强, 陈昌生, 战文斌. 低氧胁迫对九孔鲍免疫防御因子的影响[J]. 水产学报, 2012, 36(11):1739-1747.
[18] Li N, Zhang Z P, Zhang L L, et al. Insulin-like growth factor binding protein 7, a member of insulin-like growth factor signal pathway, involved in immune response of small abaloneHaliotisdiversicolor[J]. Fish and Shellfish Immunol, 2012, 33(2):229-242.
[19] Wang G, Zhang Z, Lin S, et al.A homologue of dermatopontin fromHaliotisdiversicolorand its response to pathogenic infection [J]. Aquacul Res, 2015,46(7):1537-1549.
[20] Ge H, Wang G, Zhang L, et al.Molecular cloning and expression of interleukin-1 receptor-associated kinase 4, an important mediator of Toll-like receptor signal pathway, from small abaloneHaliotisdiversicolor[J]. Fish and Shellfish Immunol, 2011, 30(4/5):1138-1146.
[21] Chen J, Chen Z S, Huang Z X, et al. Stable expression of Y-box protein 1 gene in early development of the abaloneHaliotisdiversicolor[J]. Int J Dev Biol, 2012, 56(5):369-375.
[22] Glover J N, Harrison S C. Crystal structure of the heterodimeric bZIP transcription factor c-Fos-c-Jun bound to DNA[J]. Nature, 1995, 373(6511):257-261.
[23] Angel P, Karin M. The role of Jun, Fos and the AP-1 complex in cell-proliferation and transformation[J]. Biochim Biophys Acta, 1991, 1072(2/3):129-157.
[24] Ryseck R P, Bravo R. c-JUN, JUN B and JUN D differ in their binding affinities to AP-1 and CRE consensus sequences:effect of FOS proteins[J]. Oncogene, 1991, 6(4):533-542.
[25] Cheng W, Hsiao I S, Hsu C H. Change in water temperature on the immune response of Taiwan abaloneHaliotisdiversicolorsupertextaand its susceptibility toVibrioparahaemolyticus[J]. Fish and Shellfish Immunol, 2004, 17(3):235-243.
[26] Ameryar M,Wisniewska M,Weitzman J B. A role for AP-1 in apoptosis:the case for and against [J]. Biochimie, 2003, 85(8):747-752.
[27] 王国栋, 张丽莉, 王艺磊. 鲍幼虫变态分子机制的研究进展[J]. 集美大学学报:自然科学版, 2012, 17(2):101-108.
[28] Allen R G,Oberley L W, Elwell J H, et al. Developmental patterns in the antioxidant defenses of the housefly,Muscadomestica[J]. J Cell Physiol, 1991, 146(2):270-276.
[29] Kockel L, Homsy J G, Bohmann D. Drosophila AP-1:lessons from an invertebrate [J]. Oncogene, 2001, 20(19):2347-2364.
[30] Shaulian E, Karin M. AP-1 as a regulator of cell life and death[J]. Nat Cell Biol, 2002, 4(5):131-136.
[31] Suto M J, Ransone L J. Novel approaches for the treatment of inflammatory diseases:inhibitors of NF-kappaB and AP-1[J]. Chem Inform, 1998, 29(6):515-528.
[32] Wang A, Al-Kuhlani M, Johnston S C, et al. Transcription factor complex AP-1 mediates inflammation initiated byChlamydiapneumoniaeinfection[J]. Cell Microbiol, 2013, 15(5):779-794.
MolecularCloningandExpressionofActivatorProtein-1inSmallAbaloneHaliotisdiversicolorduringDevelopmentandBacterialChallenge
WANG Guodong, HE Simei, ZHANG Lili, WANG Yilei
( Key Laboratory of Healthy Mariculture for the East China Sea, Ministry of Agriculture, Fisheries College, Jimei University, Xiamen 361021, China; Institute of Aquaculture Biotechnology, Jimei University, Xiamen 361021, China )
Activator protein-1 (AP-1) is a transcription factor, which is characterized by highly conserved dimeric leucine zipper DNA-binding domain, and participates in development and immune processes. In order to evaluate the effect of AP-1 gene in development and immune response, the full cDNA of AP-1 gene (HdAP-1) was cloned in small abaloneHaliotisdiversicolorand challenged byVibrioparahaemolyticusand expressed during development of the abalone by real time PCR. The full cDNA of HdAP-1 was 1482 bp, and 5′/3′untranslated region had 133/401 bp, with a 948 bp open reading frame. The calculated molecular mass of encoded protein was 34.83 ku and the predicted pI 9.43. HdAP-1 contained Jun and bZIP domains, a highly conserved domains of AP-1 protein family. HdAP-1 was detected in all examined tissues. There was the maxmal expression level in hemolymph, middle expression level in gill/kidney/digestive tract/mucus gland, the minimal level in hepatopancreas/mantle. There was a low expression level from fertilized eggs to blastula stage, significantly lower than in gastrula stage (P<0.05). The expression of HdAP-1 continuously increased from gastrula stage to trochophore stage, with a high level from trochophore to creeping larva stage, and low level after metamorphosis. There was significant up-regulation of HdAP-1 24 h afterV.parahaemolyticuschallenge (P<0.05), without significant difference between control and bacterial challenge in other phase (P>0.05).
Haliotisdiversicolor; activator protein-1(AP-1); gene expression; development; bacterial infection
10.16378/j.cnki.1003-1111.2016.03.006
S917
A
1003-1111(2016)03-0227-07
2015-07-24;
2015-09-15.
国家自然科学基金资助项目(41006105,41176152);福建省自然科学基金资助项目(2015J01142);福建省高校杰出青年科研人才项目(JA12183).
王国栋(1977-),男,副教授;研究方向:水生动物遗传育种.E-mail:gdwang@jmu.edu.cn.通讯作者:王艺磊(1963-)女,教授;研究方向:水产经济动物功能基因组学,蛋白质组学,水产生物技术.E-mail:ylwang@jmu.edu.cn.

