复方丹参片丹参酮类化合物含量测定
黄思勇, 金显平
(恩施职业技术学院,湖北恩施 445000)
复方丹参片丹参酮类化合物含量测定
黄思勇, 金显平
(恩施职业技术学院,湖北恩施 445000)
[目的]完善复方丹参片的质量标准。[方法]采用高效液相色谱法(HPLC)测定复方丹参片中丹参酮类成分的含量。[结果]丹参酮ⅡA在0.10~0.50 μg时线性关系良好,平均加样回收率为100.59%,相对标准偏差为1.38%。[结论]该方法简便快速、重现性好,可作为复方丹参片质量控制的方法。
复方丹参片;丹参酮类化合物;含量测定;高效液相色谱法(HPLC)
复方丹参片由丹参、三七、冰片三味中药组成,具有活血化瘀、理气止痛的功效[1]。《中国药典》2015年版复方丹参片含量测定中对丹参药材的丹参酮ⅡA、丹酚酸B含量进行了测定,对三七药材的人参皂苷Rg1、Rb1、三七皂苷R1、人参皂苷Re进行了含量测定,该质量标准对复方丹参片的主药丹参、处方中贵重中药材三七的含量进行了测定,符合复方制剂质量控制指标的要求[2]。为使复方丹参片的质量控制更加准确和全面,笔者选取丹参酮ⅡA作为对照,采用一测多评法对复方丹参片中丹参酮类化合物的含量进行了测定。
1 材料与方法
1.1 材料
1.1.1 主要仪器。高效液相色谱仪:DIONEX(U3000);色谱工作站:Chameleon;检测器:VWD3100紫外;色谱柱:Acclaim 120 C18(5 μm,250.0 mm×4.6 mm);分析天平:AL204 (感量0.1mg,METTLER TOLEDO);KQ-2500超声波清洗仪(江苏省昆山市超声仪器有限公司)。
1.1.2 药剂与试剂。复方丹参片:市售品,规格为每片重0.32 g,相当于饮片0.60 g。丹参酮ⅡA对照品:批号110766-201520,含量以98.9%计,购买于中国食品药品检定研究院。乙腈为色谱纯,其余试剂为分析纯,水为纯净水。
1.2 方法
1.2.1 对照品溶液的配制。称取适量丹参酮ⅡA对照品置于棕色量瓶中,加甲醇制成浓度为20 μg/mL的溶液即为对照品溶液。
1.2.2 供试品溶液的配制。称取1.0 g复方丹参片粉末(过三号筛),置于50 mL棕色量瓶中,加甲醇定量,称定重量,超声处理30 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,初滤,0.45 μm有机系微孔滤膜过滤,取续滤液,即为供试品溶液。
1.2.3 色谱条件[2]。以Acclaim 120 C18柱(4.6 mm×250.0 mm,5 μm)为色谱柱;以乙腈为流动相A,以0.02%磷酸溶液为流动相B,按照表1中的规定梯度进行洗脱;柱温为30 ℃;检测波长为270 nm;进样量为10 μL。

表1 流动相梯度洗脱
1.2.4 丹参酮线性关系考察。吸取丹参酮ⅡA对照品溶液5、10、15、20、25 μL,分别注入液相色谱仪,测定丹参酮ⅡA峰面积。
1.2.5 精密度试验。吸取丹参酮ⅡA对照品溶液10 μL注入高效液相色谱仪,重复进样6次,测定丹参酮ⅡA峰面积。
1.2.6 供试品溶液的稳定性试验。取复方丹参片供试品溶液,于0、2、4、6、12 h分别吸取10 μL注入液相色谱仪,测定丹参酮ⅡA、隐丹参酮、丹参酮I峰面积。
1.2.7 重现性试验。取同一批样品6份,每份1.0 g,按照供试品溶液的制备方法和含量测定方法进行样品制备及含量测定。
1.2.8 加样回收率试验。取已知含量的样品6份,每份1.0 g,置于50 mL棕色量瓶中,分别加入适量丹参酮ⅡA对照品,按照供试品溶液的制备方法和含量测定方法进行样品制备及含量测定。
1.2.9 样品含量测定。取3批样品进行含量测定,以丹参酮ⅡA对照品为参照,以其相应的峰为S峰,计算隐丹参酮、丹参酮I的相对保留时间,其相对保留时间应在规定值的±5%范围内[2]。相对保留时间及校正因子见表2。以丹参酮ⅡA的峰面积为对照,分别乘以校正因子,计算隐丹参酮、丹参酮I、丹参酮ⅡA的含量[2]。
2 结果与分析
2.1 丹参酮线性关系 以丹参酮ⅡA的进样量C(μg)为横坐标、参酮ⅡA的峰面积A为纵坐标绘制标准曲线,计算得到线性回归方程:A=606.84.34C-1.106,r=0.999 6(n=5)。结果表明,在0.10~0.50 μg范围内参酮ⅡA的进样量与峰面积线性关系较好。由图1可知,丹参酮类化合物的峰与其相邻的成分峰分离效果好,满足测定要求。
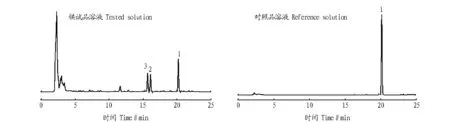
注:1.丹参酮ⅡA;2.丹参酮I;3.隐丹参酮。Note: 1. Tanshinones ⅡA; 2. Tanshinones I; 3. Cryptotanshinone. 图1 供试品种和对照品的HPLC图谱Fig.1 HPLC of tested substances and reference substances
2.2 精密度 结果表明,6次测得丹参酮ⅡA峰面积的相对标准偏差为1.37%,仪器的精密度良好。
2.3 稳定性 结果表明,测得丹参酮ⅡA峰面积的相对标准偏差为1.02%,隐丹参酮峰面积的相对标准偏差为0.88%,丹参酮I峰面积的相对标准偏差为1.02%。表明复方丹参片供试品溶液至少在12 h内稳定。
2.4 重现性 结果表明,该批样品中丹参酮类化合物含量的平均值为1.12 mg/片,相对标准偏差为1.70%(n=6)。
表2 各待测成分相对保留时间及校正因子
Table 2 Relative retention time and correction factor of tested components

待测成分(峰)Testedcomp⁃onents(peak)相对保留时间Relativeretentiontime∥min校正因子Correctionfactor隐丹参酮Cryptotanshinone0.751.18丹参酮ITanshinonesI0.791.31丹参酮ⅡATanshinonesⅡA1.001.00
2.5 加样回收率 结果表明,丹参酮ⅡA的平均加样回收率为100.89%,相对标准偏差为1.44%。表明该试验方法准确可靠。
2.6 样品含量测定 结果表明,3批样品的丹参酮类化合物含量为1.13、1.11、1.13 mg/片。
3 结论与讨论
《中国药典》2015年版一部对复方丹参片的含量测定中[2]对丹酚酸B和丹参酮ⅡA进行了含量测定;金樟照等[3-10]采用高效液相色谱技术对不同产地的丹参药材、丹参饮片进行了指纹图谱研究,结果表明不同产地的丹参药材、丹参饮片的共性成分有差别,但都含有脂溶性成分丹参酮ⅡA、隐丹参酮、丹参酮I,以及水溶性成分丹酚酸B。因此,《中国药典》2015年版对复方丹参片中的丹参选择丹参酮ⅡA、丹酚酸B作为含量测定的指标性成分较合理。但丹参酮类成分仅选用丹参酮ⅡA作为指标性成分不能够全部反映不同产地丹参药材生产的复方丹参片的质量。《中国药典》2015年版一部对丹参药材的质量控制也选取了丹参酮类成分,因此,该研究认为选取丹参酮类成分控制复方丹参片的质量更合理。参照《中国药典》2015年版一部丹参药材的测定方法,采取高效液相色谱技术对丹参酮类成分进行含量测定,方法可行,简单,重现性好,可以作为复方丹参片中丹参酮类成分的含量测定方法。以丹参酮类化合物的含量作为复方丹参片中丹参含量测定的控制指标,可以减少或避免因丹参产地不同而影响复方丹参片的质量。参考文献
[1] 冯萍,黄思勇.复方丹参片质量标准的研究[J].湖北民族学院学报(医学版),2011,28(2):29-31.
[2] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:76-77.
[3] 金樟照,祝明,张文婷,等.不同产地丹参水溶性成分和脂溶性成分指纹图谱测定及相关性研究[J].中草药,2004,35(10):1174-1177.
[4] 袁晓,高俊飞,袁萍.不同产地丹参药材HPLC指纹图谱分析及4种菲醌类成分含量的比较[J].植物资源与环境学报,2012,21(4):62-66.
[5] 阎正,阎海荣,赵坤娇,等.丹参药材的HPLC指纹图谱[J].河北大学学报(自然科学版),2008,28(1):69-73.
[6] 张文生,叶正良,岳洪水,等.丹参药材指纹图谱研究[J].中药材,2001,24(7):478-480.
[7] 李佩,舒成仁,刘莹,等.丹参饮片高效液相指纹图谱及其分级研究[J].湖北中医药大学学报,2015,17(5):50-54.
[8] 程茜菲,刘银环,许苗苗,等.丹参饮片HPLC指纹图谱研究[J].西北药学杂志,2013,28(6):556-558.
[9] 范春芳,吴志恒,李亮.不同产地丹参药材指纹图谱比较研究[J].武警医学院学报,2011,20(7):529-531.
[10] 王立萍,周凤琴.近十年来丹参指纹图谱的研究进展[J].齐鲁药事,2009,28(2):101-103.
Determination of Tanshinones Content in Danshen Tablets
HUANG Si-yong, JIN Xian-ping
(Enshi Technical College, Enshi, Hubei 445000)
[Objective] To improve the quality standard of Danshen tablets. [Method] Tanshinones content in Danshen tablets was detected by HPLC method. [Result] Tanshinones ⅡA showed good linear relationship within the range of 0.10-0.50 μg; the average recovery rate was 100.59%(RSD=1.38%). [Conclusion] This method is simple, rapid and reproducible, it can be used as a method for quality control of Danshen tablets.
Danshen tablets; Tanshinones; Content determination;HPLC
黄思勇(1982- ),男,湖北建始人,讲师,从事药品质量控制研究。
2016-09-18
S 567.5+3
A
0517-6611(2016)33-0121-02

