鲍鱼内脏内源蛋白酶特性的研究
李梅娟,刘 丹,贾 真,陈小艺,方 婷,陈锦权
(福建农林大学食品科学学院,福建福州 350002)
鲍鱼内脏内源蛋白酶特性的研究
李梅娟,刘 丹,贾 真,陈小艺,方 婷,陈锦权*
(福建农林大学食品科学学院,福建福州 350002)
本文研究了鲍鱼内脏内源蛋白酶(内源酶)的性质。分别探讨了pH、温度、金属离子和特异性蛋白酶抑制剂对内源酶活性的影响。结果表明内源酶蛋白质含量为125.10 mg/mL。钠离子在浓度(0~1.36 mol/L)范围明显促进内源酶活性,钙离子有稳定酶活作用,对酶活无显著影响,而高浓度的钠离子,铜离子和锌离子会抑制酶活。内源酶在最适pH4左右和pH7左右,有较高的酶活和很好的热稳定性,且能被胃蛋白酶抑制剂(Pepstain)、丝氨酸蛋白酶抑制剂(PMSF)、胰蛋白酶抑制剂(SBTI)和胰凝乳蛋白酶抑制剂(TPCK)抑制。本研究可为缩短传统制作鲍鱼酱油发酵时间提供理论依据。
鲍鱼内脏,内源性蛋白酶,酶活性,相对分子量
鲍鱼(Abalone),属于软体动物,鲍螺科鲍属,由于其较高的商业价值,在全世界范围内有大量养殖[1-2]。中国传统的珍贵海味有“鲍、参、翅、肚”,然而鲍位于榜首,其肉质柔嫩细滑、鲜而不腻、滋味浓郁,深受全世界人们的喜爱。鲍鱼不单是一种名贵的食材,还有着丰富的药用价值[3]。鲍鱼内脏内源蛋白酶主要指内脏消化系统中的酶,大部分为蛋白酶(催化蛋白质水解的酶类的总称,包括胰蛋白酶、胃蛋白酶、组织蛋白酶等)。现阶段蛋白酶酶学性质的研究内容主要是:酶的活力与温度、pH、酶浓度、底物浓度、酶激活剂和激活方法、酶抑制剂的关系;蛋白酶的相对分子大小[4]等。研究发现,影响内源酶活性的因素主要有pH、温度、金属离子,其中常见的金属离子激活剂有Na+、Zn2+、Ca2+、Cu2+。目前,常用特异性抑制剂确定蛋白酶的种类,最为常见的抑制剂有胰蛋白酶抑制剂(TLCK、SBTI等),胰凝乳蛋白酶抑制剂(TPCK等),胃蛋白酶抑制剂(Pepstain等),金属蛋白酶抑制剂(EDTA等)[5]。国内对鲍鱼内脏内源蛋白酶特性的研究目前甚少,主要集中在研究鲍鱼内脏消化系统中酶的种类[6-8]。
自溶[9]是指当机体受到物理因素(如热、辐射)、化学因素(如强酸、强碱、有毒物质)和生物因素(如病原体)等环境因素的刺激后,诱发自身酶系将自身的组织结构破坏、降解从而引起自身死亡的现象。在进行自溶水解工艺条件优化时,要根据原料内源酶的特点,合理地利用促进内源酶活力的因素[10]。因此,研究并合理利用内源酶的特性,选择鲍鱼内脏最佳的自溶水解条件,不仅能够缩短传统酱油发酵过程中自溶时间,而且可以减少发酵成本。同时,该研究充分利用了鲍鱼内脏的资源,提高了其产品附加值,对扩大我国居民相对缺乏的动物蛋白来源具有重大意义。因此,笔者探究了pH、温度和不同浓度的Na+,Cu2+,Ca2+,Zn2+对内源酶活性的影响,使用 PMSF,Pepstain,SBTI,TPCK 和 EDTA 来探究内源酶的特性,为加速鲍鱼内脏自溶水解和缩短传统鲍鱼酱油发酵时间提供理论依据。
1 材料与方法
1.1 材料与仪器
鲍鱼内脏 由福建省漳州市诏安海联食品食品有限公司提供;三羟甲基氨基甲烷(Tris),牛血清白蛋白(BSA)蛋白质标准液,裂解液(Urea,Thiaurea,DTT,CHAPS,carrier amphoLytes),考马斯亮蓝 G-250,血红蛋白,偶氮酪蛋白(Na-苯甲酰-DL-精氨酸-对硝基酰胺盐酸盐BApNA),丝氨酸蛋白酶抑制剂(PMSF)、胰蛋白酶抑制剂(SBTI)、胰凝乳蛋白酶抑制剂(TPCK),丙烯酰胺,十二烷基硫酸钠(SDS),高氯酸铵(AP),四甲基乙二胺(TEMED) 均购自上海国药集团化学试剂有限公司;胃蛋白酶抑制剂 Sigma公司;其他试剂均为分析纯及以上级别。
高速台式冷冻离心机(TGL-16M) 长沙湘仪离心机仪器有限公司;组织捣碎匀浆机、磁力搅拌器 上海精密仪器设备有限公司;Sartorius BS110S Max 110 g电子天平 北京赛多利斯天平有限公司;精密酸度计 上海精密仪器设备有限公司;分光光度计 上海圣科仪器设备有限公司;恒温水浴锅 天津市泰斯特仪器有限公司;电泳仪 深圳赛泰克生物科技有限公司。
1.2 实验方法
1.2.1 内源酶液的制备及蛋白质含量的测定 经冷冻的鲍鱼内脏,以1∶1(w/w)加入pH为8.0的50 mmol/L Tris-HCL 缓冲液;高速匀浆后,低温浸提过夜;10500 r/min 离心10 min 后取上清液,并于-30 ℃保存;所有操作未经特殊说明,均在4 ℃下进行。采用Bradford法[10]测定鲍鱼内脏内源酶液(以下简称:内源酶液)中蛋白质的含量。
1.2.2 酶活力测定方法 酶活力(enzyme activity)也称为酶活性,是指酶催化一定化学反应的能力。酶活力的大小可用在一定条件下,酶催化某一化学反应的速度来表示,酶催化反应速度愈大,酶活力愈高,反之活力愈低。蛋白酶活性是指在一定pH(pH3.6或pH7.0)和40 ℃温度条件下,每分钟水解酪蛋白产生1 μg酪氨酸定义为一个蛋白酶活力单位。采用福林酚法测定各组酶活[10]。
1.2.2.1 pH对内源酶活力的影响 先将 2% 酪蛋白溶液与内源酶液分别于40 ℃下保温3 min,确保内源酶液有高酶活;在1~11号试管中分别加入缓冲液1 mL(pH分别为2、3、4、5、6、7、8、9、10、11、12),再依次加入保温好的2%酪蛋白溶液与内源酶液各1 mL;震荡摇匀,置于40 ℃ 水浴中处理1 h后,快速加入2 mL三氯乙酸(0.4 mol/L),终止内源酶水解反应。并将各酶解液置于4000 r/min条件下,离心10 min,各取1 mL上清液,分别加入5 mL碳酸钠(0.4 mol/L)和1 mL福林-酚试剂,摇匀;静置20 min后,于360 nm下分别测定其吸光度。重复操作三次。
1.2.2.2 温度对内源酶活力的影响 测定方法同1.2.2.1 pH对内源酶活力的影响,其中不同之处为:加入内源酶液的缓冲液 pH分别为4、7.5、8,在每个pH下,水浴处理分别为4、30、40、50、60、65、70 ℃,以研究最适pH下内源酶的热稳定性。结果用百分数表示,以各相应pH下50 ℃的酶活力为100%。相对酶活的公式(1)如下:
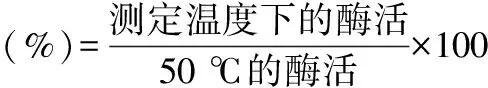
式(1)
1.2.2.3 金属离子对内源酶活力的影响 在正常的缓冲体系中加入一定量的金属离子,使Na+终浓度为0.000、0.680、1.360、2.040 mol/L,Cu2+的终浓度为0.000、0.006、0.008、0.012 mol/L,Ca2+的终浓度为0.000、0.020、0.040、0.060 mol/L 和Zn2+的终浓度为0.000、0.005、0.010、0.01 mol/L[11];将以上四种金属离子配成不同浓度的盐酸盐溶液,在40 ℃时将盐酸盐溶液加入到内源酶液中,以未添加金属离子的内源酶液为对照组,采用福林酚法测定各组酶活[10],并以相对酶活力来考察各金属离子对内源酶活性的影响,其中相对酶活力的计算公式(2)如下:

式(2)
1.2.3 胃蛋白酶活性的测定 取5 μL内源酶液加入到含有0.5%血红蛋白的0.1 mol/L Gly-HCl(pH2.0)缓冲液中,置于25 ℃水浴中孵育30 min后,加入浓度为12% 的三氯醋酸溶液 0.5 mL,震荡摇匀后,3000 r/min 离心15 min,取1 mL上清液,于280 nm下测定其吸光度值。重复测定三次,取平均值。通过公式(3)计算内源酶液中胃蛋白酶活力[12]:
活力(units/mg)=(Abs280/min)×反应混合体积(mL)/0.051×反应时间(min)×蛋白质含量(mg)
式(3)
1.2.4 胰蛋白酶活性的测定 取25 μL内源酶液加入到1.25 mL 新鲜配制的1 mmol/L BApNA(在含有20 mmol/L的CaCl2的50 mmol/L Tris-HCL缓冲液(pH7.5)中溶解),置于37 ℃水浴中孵育10 min后,加入30%醋酸1 mL终止反应,置于3000 r/min条件下离心15 min,取上清液并于410 nm条件下测定其吸光值。重复操作三次,取平均值,并根据公式(1~4)计算内源酶液中胰蛋白酶的活力[12]。
活力(units/mg)=(Abs410/min)×1000×反应混合体积(mL)/8800×蛋白质含量(mg)
式(4)
1.2.5 胰凝乳蛋白酶活性的测定 取10 μL内源酶液加入到750 μL新鲜配制的0.1 mmol/L SAPNA(以含有20 mmol/L CaCl2,pH为7.5的Tris-HCL为缓冲液)中[12];在30 ℃,410 nm下记录3 min内的吸光值,计算公式同1.2.4。
1.2.6 抑制剂对内源酶活性的影响 参考Serviere-Zaragoza[13]选用蛋白酶特异性抑制剂确定内源酶液中所含酶的种类。本实验所选用的抑制剂有:0.5 mmol/L PMSF(丝氨酸蛋白酶抑制剂)、0.001 mmol/L Pepstain(胃蛋白酶抑制剂)、0.1 g/L SBTI(胰蛋白酶抑制剂)、5 mmol/L TPCK(胰凝乳蛋白酶抑制剂)及10 mmol/L EDTA(金属蛋白酶抑制剂)。具体操作步骤如下:内源酶液分别与各特异性抑制剂以1∶1(v∶v)混合,以 2% 的酪蛋白溶液为底物,分别将10 mL混合液加入到选择性缓冲液(pH为2~12)中进行,并均置于26 ℃条件下水浴1 h,而后均加入12%的三氯醋酸终止各反应,随后将各反应液在4000 r/min条件下,离心10 min,各取1 mL上清液,分别加入5 mL碳酸钠(0.4 mol/L)和1 mL福林-酚试剂,摇匀;静置20 min后,于360 nm下分别测定其吸光度。并通过式(1)~式(5)计算各抑制剂对酶活性的抑制效果:
抑制率(%)=不含抑制剂的酶活-含抑制剂的酶活/不含抑制剂的酶活×100
式(5)
2 结果与讨论
2.1 内源酶中蛋白质的含量
绘制标准曲线如图1所示,并可得到标准蛋白质曲线:y=29.3x-0.0053,相关系数为0.9947,式中y:吸光值(OD值);x:蛋白质标准含量(mg/mL)。采用Bradford法,将实验实际测定的稀释后内源酶液的吸光值,并将吸光度值带入标准曲线进行换算,可得内源酶液中蛋白质的含量为:125.10 mg/mL。
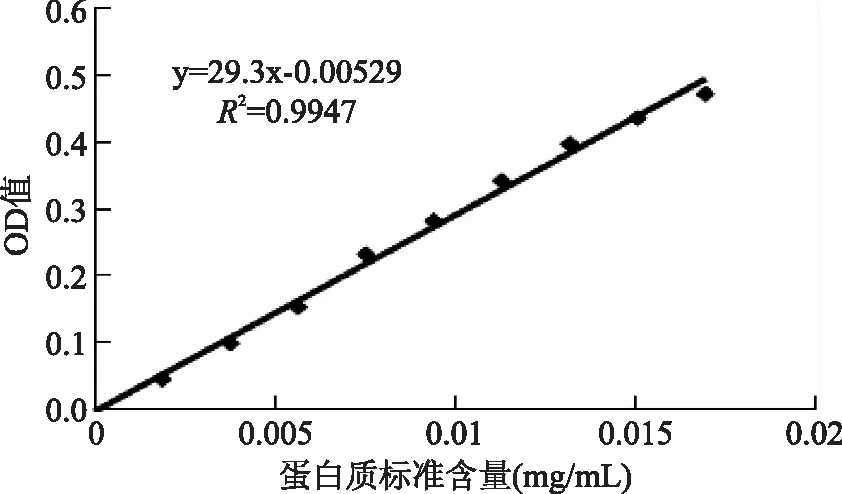
图1 标准曲线Fig.1 Standard curve
2.2 pH对内源酶活性的影响
不同pH条件下对内源酶活性的影响,如图2所示。内源酶显示了两个活性高峰,分别在pH4左右和pH7左右。E. Serviere-Zaragoza[13]等人在墨西哥蓝色鲍鱼的肝胰腺中发现,在pH为2~5的范围内蛋白酶活力很强;而且pH7.5时,雌性鲍鱼肠中的胰凝乳蛋白酶活力增加到238%。同时,以1%偶氮酪蛋白和2%酸性血红蛋白为底物测定pH对墨西哥绿色鲍鱼蛋白酶活力的影响,结果表明在酸性pH范围(pH为2~4)有蛋白酶活力高峰。这与本实验的pH4左右以及pH7左右出现蛋白酶活力高峰是相似的。
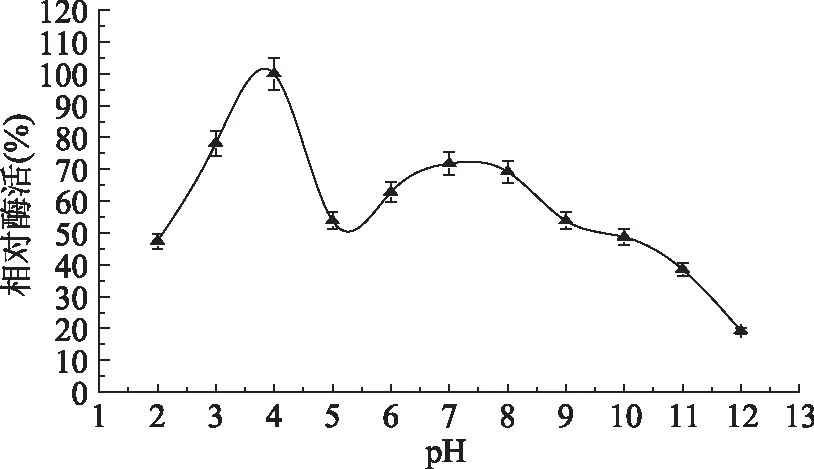
图2 pH对内源酶活性的影响Fig.2 Effect of pH on the endogenous protease activity
2.3 温度对内源酶活性的影响
图3表明:当pH为4时,温度在4~50 ℃范围内,相对酶活力随着温度的增大而增大,50 ℃的蛋白酶活力最高(100%);在50~60 ℃蛋白酶活力仍较强,而当温度超过60 ℃后,相对酶活力急速下降,在70 ℃时相对酶活力降至1.5%。由此可知,在pH为4时内源酶的热稳定性较好。当pH为7.5时,温度在4~40 ℃范围内,相对酶活力随着温度的增大而增大,当温度为40 ℃时,相对酶活力达到最大(118.6%);在40~50 ℃蛋白酶活力仍较强,然而当温度超过50 ℃,其相对酶活力急速下降,在70 ℃时相对酶活力降至3.4%。因此,在pH为7.5时内源酶的热稳定性较好。当pH为8时,温度在4~60 ℃范围内,相对酶活力随着温度的增大而增大;最大相对酶活力为121.0%(60 ℃),当温度超过65 ℃后,其相对酶活力急速下降,70 ℃时相对酶活力降至最低(37.6%)。综上所述,在pH为8时,内源酶的热稳定性很好;而pH为4和7.5时内源酶的热稳定性较好。
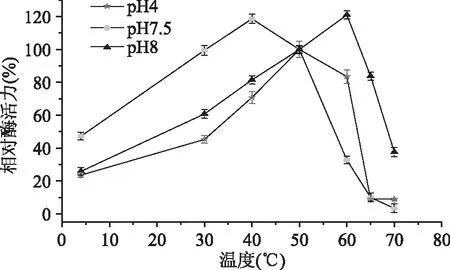
图3 温度对内源酶活性的影响Fig.3 Effects of temperature on the endogenous protease activity
2.4 金属离子对内源酶活性的影响
不同的金属离子对蛋白酶活性有促进作用或者抑制作用,且同一种金属离子在不同的离子浓度下对蛋白酶活力的作用(促进或抑制作用)也不同。从图4A中可以看出,钠离子在浓度(0~1.36 mol/L)范围内对内源酶活性有显著促进作用(p<0.05),即内源酶活性随着钠离子浓度的增加而增加,且当钠离子浓度为1.36 mol/L时,酶活力最高,为135.1%;而2.04 mol/L钠离子对内源酶活力有抑制作用。出现该现象的原因可能是由于高浓度的钠离子形成的高渗透压作用及离子间的静电作用破坏了混合内源酶中某些酶的结构,从而导致部分蛋白酶失活,进而使整体内源酶活性降低。图4B表明钙离子对内源酶活力具有促进作用但效果不显著(p>0.05),当钙离子浓度为0.06 mol/L时,有最大的相对蛋白酶活力108.8%,其原因可能是适当浓度的钙离子能增加胰蛋白酶等蛋白酶螺旋结构的稳定性,使得蛋白质不易被水解[6]。由图4C可知,Cu2+和Zn2+对蛋白酶活力均有显著抑制作用(p<0.05), 并且随着其浓度的增加,抑制作用增强,其中Cu2+最大浓度(0.012 mol/L)对应的相对蛋白酶活力为83.5%。Zn2+最大浓度(0.015 mol/l)对应的相对蛋白酶活力为68.5%,这是由于锌离子对混合内源酶中的羧肽酶有抑制作用[13,15]。
表2 抑制剂在不同pH下对内源酶活性的影响(%)
Table 2 Effect of inhibitors on the activity of endogenous proteases(%)
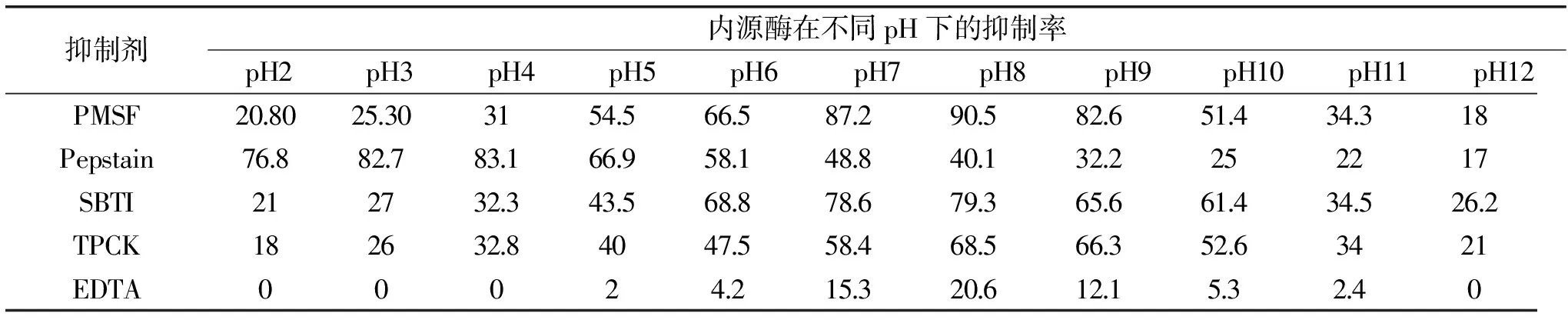
抑制剂内源酶在不同pH下的抑制率pH2pH3pH4pH5pH6pH7pH8pH9pH10pH11pH12PMSF208025303154566587290582651434318Pepstain768827831669581488401322252217SBTI2127323435688786793656614345262TPCK1826328404755846856635263421EDTA00024215320612153240
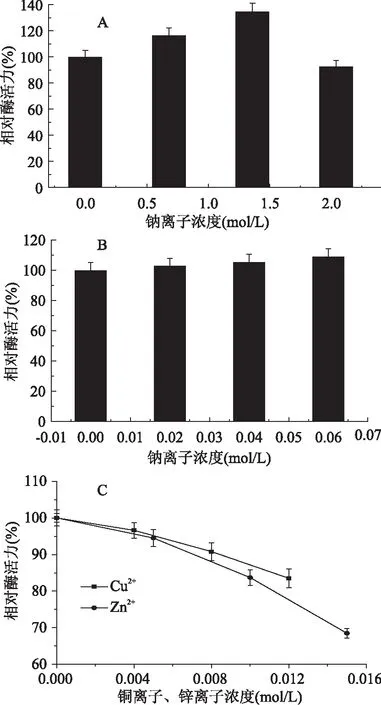
图4 属离子对内源酶活性的影响对内源酶活性的影响(n=3)Fig.4 Metal ions on the endogenous protease activity(n=3)
综上所述可知,1.36 mol/L的钠离子对内源酶活力的促进作用较强且低于或高于该浓度酶活性均降低;钙离子对内源酶活性具有稳定作用,即不同浓度的钙离子对酶活性影响不显著;而铜离子和锌离子对内源酶活力有显著抑制作用。
2.5 胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶活性的比较
表1为内源酶中类胃蛋白酶、类胰蛋白酶、类胰凝乳蛋白酶活力大小,结果表明混合蛋白酶中有类胃蛋白酶、类胰蛋白酶和类胰凝乳蛋白酶的酶。内源酶中各蛋白酶活力从大到小顺序为:胃蛋白酶>胰蛋白酶>胰凝乳蛋白酶,其中胃蛋白酶酶活力最大,从而验证和解释了内源酶酶活力最适pH环境为酸性(pH为3~4),且胰蛋白酶和胰凝乳蛋白酶的酶活也相对较高,因而在pH为7~8的中碱性环境中混合内源蛋白酶也具有相对较高的活力。这与E. Serviere-Zaragoza[13]对鲍鱼蛋白酶的研究是相似的。
表1 内源酶中特异性蛋白酶的酶活力
Table 1 ProteoLytic activity of specific proteases fromol/Lendogenous protease

底物蛋白酶活力(units/mg)血红蛋白内源酶中类胃蛋白酶722±001BApNA内源酶中类胰蛋白酶590±003SAPNA内源酶中类胰凝乳蛋白酶527±002
2.6 抑制剂对内源酶活性的影响
不同抑制剂在不同pH环境中对内源酶活性的影响如表2所示,PMSF抑制剂在中碱性(pH为7~9)范围内对内源酶活力具有显著抑制作用(p<0.05),且最大抑制率为 90.5%±1.21%(pH8)E. Serviere-Zaragoza[10]等人报道,用PMSF处理后的鲍鱼蛋白酶液进行电泳的结果表明,PMSF导致蛋白酶条带的减少,说明蛋白酶液中至少有一种丝氨酸蛋白酶。Pepstain抑制剂在酸性(pH为2~6)环境下对内源酶活力有显著影响(p<0.05),当pH为3~4的时,Pepstain对内源酶活力的抑制率大于82.7%,抑制作用最强。SBTI抑制剂在中碱性(pH为7~9)范围内对内源酶活力的抑制作用较强,最大抑制率79.3%(pH8)。吕英涛[3]等人研究SBTI对鯷鱼胰蛋白酶活的影响,发现SBTI对鯷鱼胰蛋白酶的抑制作用强烈,抑制率高达90%。TPCK抑制剂在中性和碱性(pH为7~10)条件下对内源酶活力抑制作用较强,其中在 pH8~9 范围内,其抑制作用最强,抑制率超过66%。EDTA抑制剂在pH7~9 的范围内对内源酶有微弱的抑制作用,最大抑制率为 20.6%(pH8)。综上所述,特异性抑制剂对内源酶的最大抑制率从高到低依次是:
PMSF(90.5%)>Pepstain(83.1%)>SBTI(79.3%)>TPCK(68.5%)>EDTA(20.6%),即丝氨酸蛋白酶抑制剂>胃蛋白酶抑制剂>胰蛋白酶抑制剂>胰凝乳蛋白酶抑制剂>金属蛋白酶抑制剂。由此可以说明,内源酶中可能存在丝氨酸蛋白酶、类胃蛋白酶、类胰蛋白酶和类胰凝乳蛋白酶。
3 结论
经测定,本实验所用的内源酶液中蛋白质含量为125.10 mg/mL。并分别研究了pH、温度、金属离子及特异性蛋白酶抑制剂对内源酶活力的影响,结果表明:内源酶中至少有三类蛋白酶即类胃蛋白酶、类胰蛋白酶、类胰凝乳蛋白酶;内源酶最适pH为4左右和7左右;当pH为3~4时,内源酶有很高的酶活力和很好的热稳定性,且能被Pepstain抑制;当pH为7~8时,内源酶有较高的酶活力,且能被PMSF、SBTI、TPCK抑制,其中在pH为8时,内源酶的热稳定性很好;而pH为4和7.5时内源酶的热稳定性较好。不同金属离子对酶活力的影响各异:钠离子在低浓度范围内(0~1.36 mol/L)对内源蛋白酶活性有促进作用,钙离子对内源酶活力没有显著影响,而铜离子和锌离子对蛋白酶活性有抑制作用。
[1]Guo X. Use and exchange of genetic resources in molluscan aquaculture[J]. Rev Aquac,2009,1:251-259.
[2]Lafarga de la Cruz F,Gallardo-Escárate C. Intraspecies and interspecies hybrids in Haliotis:natural and experimental evidence and its impact on abalone aquaculture[J]. Rev Aquac,2011,3:74-99.
[3]易美华,王锡彬,周秋华,等.海南鲍营养成分及活性物质的分析研究[J].农牧产品开发,1997,12:35-38.
[4]郑宝东. 食品酶学[M]. 南京:东南大学出版社,2006,1-4.
[5]黄烨,谢锐田,何建妹,等.罗非鱼肠道胰蛋白酶和猪胰蛋白酶性质对比研究[J].食品工业科技,2011,32(5):215-218,222.
[6]吕英涛,康从民,王琳,等. 鳀鱼胰蛋白酶的分离纯化及性质初步研究[J]. 食品科学,2010,31(1):181-184.
[7]Bougatef A,Souissi N,Fakhfakh N,et al. Purification and characterization of trypsin from the viscera of sardine(Sardina pilchardus). Food Chemistry,2007,102(1):343-350.
[8]Klomklao S,BenjakuL S,Kishimura H. 24kua Trypsin:A predominant protease purified fromol/Lthe viscera of hybrid catfish(Clarias macrocephalus×Clarias gariepinus). Food Chemistry,2011,129(3):739-746.
[9]顾晨光,王建军. 虾脑酱的制作[J]. 食品科学,1991,(7):23-24.
[10]银凤,周爱梅,张祥刚,等.南美白对虾虾头主要自溶酶的分离纯化及鉴定[J].食品与发酵工业,2011,37(3):23-26.
[11]刘娜,张美香,王一. 不同浓度对酸性蛋白酶活性的影响[J].安徽农业科学,2010,38(32):18043-18044.
[12]Garc′IA-carreno FL,Navarrete Del Toro MA,Serviere-Zaragoza E. Digestive enzymes in juvenile green abalone,Haliotis fulgens,fed natural food[J]. Comparative Biochemistry and Physiology,Part B,Biochemistry & Molecular Biology,2003,134(1):143-150.
[13]Serviere-Zaragoza E,Del Toro MA,Garcia-Carren FL. Protein-hydrolyzing enzymes in the digestive systems of the adult Mexican blue abalone,Haliotis fuLgens(Gastropoda)[J]. Aquaculture 1997,157:325-336.
[14]C. Picos-Garc′a,F.L. Garc′a-Carreo,E. Serviere-Zaragoza.Digestive proteases in juvenile Mexican green abalone,Haliotis fulgens[J].Aquaculture,2000,181:157-170.
[15]吴朝朝,刘华,赵利,等. 淡水鱼加工下脚料自溶水解工艺的研究[J]. 中国酿造,2014,(5):120-124.
Characteristics of endogenous proteases from ablone(HaliotisDiscusHannaiIno)viscera
LI Mei-juan,LIU Dan,JIA Zhen,CHEN Xiao-yi,FANG Ting,CHEN Jin-quan*
(Fujian Agriculture and Forestry University,College of Food Science,Fuzhou 350002,China)
Toresearchthecharacteristicsofendogenousproteasesfromabalone(Haliotis Discus Hannai Ino)viscera.TheeffectsofpH,temperature,metalionsandspecificproteaseinhibitorsonendogenousproteasesactivitywereinvestigated.Theresultsshowedthatthecontentofendogenousproteaseswas125.10mg/mL.Theproteaseactivitycouldbeincreasedatlowconcentrations(0~1.36mol/L)ofNa+,andtheactivityofproteasetendedtobestableunderthepresenceofCa2+,however,highconcentrationsofNa+,Cu2+andZn2+significantlyinhibitedtheactivityofprotease.TheoptimumworkingpHofendogenousproteaseswerelocatedatabout4and7atwhichconditionproteaseshowedhighactivityandgoodthermalstability.EndogenousproteasescouldbeinhibitedbyPepstain,PMSF(phenyl-methyl-sulphonyl-fluoride),SBTI(soybeantrypsininhibitor)andTPCK(tosyl-phenylalaninechloromethyl-ketone).Theresearchcanprovidetheoreticalbasisforshorteningthetraditionalfermentationtimeofabalonesauce.
abaloneviscera;endogenousprotease;proteaseactivity;relativemolecularweight
2016-04-27
李梅娟 (1991-),女,硕士研究生,研究方向:农产品加工及贮藏,E-mail:15392487183@163.com。
*通讯作者:陈锦权(1954-),男,博士,教授,研究方向:水产加工,非热力加工技术,E-mail:chenjq6613@163.com。
国家自然科学基金(3140101191);福建省发改委项目:闽发改投资[2014]168号; 福建省高水平大学建设项目(612014043)。
TS254.9
A
1002-0306(2016)19-0081-05
10.13386/j.issn1002-0306.2016.19.007

