乌桕硬脂酰-酰基载体蛋白脱饱和酶基因的克隆及表达
牛 蓓,徐 莺,宋 君,郭晓恒,符 佳,邹 亮,陈 放*,高孝锦,郭 静
(1.成都大学医学院,四川 成都 610106;2.四川大学生命科学学院,四川 成都 610064;3.四川省农业科学院分析检测中心,四川 成都 610066)
乌桕硬脂酰-酰基载体蛋白脱饱和酶基因的克隆及表达
牛 蓓1,徐 莺2,宋 君3,郭晓恒1,符 佳1,邹 亮1,陈 放2*,高孝锦1,郭 静1
(1.成都大学医学院,四川 成都 610106;2.四川大学生命科学学院,四川 成都 610064;3.四川省农业科学院分析检测中心,四川 成都 610066)
硬脂酰-酰基载体蛋白脱饱和酶是植物脂肪酸合成代谢的关键酶,直接调节膜脂和贮脂中饱和脂肪酸和不饱和脂肪酸的比例。本研究通过RT-PCR及RACE技术, 克隆乌桕硬脂酰-酰基载体蛋白脱饱和酶(SsSAD)的cDNA全长序列。结果显示,该序列包含1个1191 bp的完整的开放阅读框(GenBank登录号为EF079655),编码396个氨基酸,含33个氨基酸的叶绿体转移肽。其成熟肽含有363个氨基酸,推测其分子量为41.5 kDa,等电点为5.42。同源性分析及同源建模数据显示SsSAD和其它物种的SAD有较高的同源性,含有1个保守结构域。构建原核表达载体pMAL-SsSAD,转入大肠杆菌DH5α,并对诱导表达条件进行优化。
乌桕;硬脂酰-酰基载体蛋白脱饱和酶;克隆;生物信息学分析;原核表达
近年来,全球能源紧张,导致生物柴油倍受重视。早期英法美各国以油料农作物为主,进行生物柴油的开发[1-3],但这会占用过多的耕地面积。木本植物具有能量密度高,一次性种植多年收益的特点[4]。因而,各国研究者开始对本土油料树种资源进行筛选,力求寻找到种子中富含油酸、亚油酸等不饱和脂肪酸的树种加以开发利用[5]。乌桕为我国四大油料树种之一,其种子含油量高达41 %~47 %[6-7],其中饱和脂肪酸含量约为40 %,不饱和脂肪酸含量约占60 %[8],脂肪酸的碳链长度主要集中在C17~C20,与普通生物柴油主要成分的碳链长度类似[9],因此开展乌桕生物质能的研究,具有一定的实用价值。
植物硬脂酰-酰基载体蛋白(ACP)脱饱和酶(SAD)是一种脂肪酸合成代谢的关键酶。它催化硬脂酰-ACP脱饱和,在第9~10碳原子之间脱氢形成一个双键,产生油酰-ACP,是植物典型不饱和脂肪酸生物合成途径的第一步脱饱和酶,可直接调节膜脂和贮脂中饱和脂肪酸和不饱和脂肪酸的比例[10],参与植物衰老调控、化学防御等生理过程[7,10]。近年来,该酶的分子机理及应用引起了人们的广泛重视。除了从蓖麻、水稻、拟南芥、油菜、玉米、菠菜等植物[9]中陆续分离到SAD基因外,转基因研究数据显示SAD基因的RNA干扰[11]和核酶处理[12],都能改变转基因作物中的饱和与不饱和C16及 C18脂肪酸的含量。
因此,本研究通过RT-PCR及RACE技术, 从乌桕中克隆出硬脂酰-酰基载体蛋白脱饱和酶(SsSAD)的cDNA全长序列,对其进行生物信息学分析。构建原核表达载体pMAL-SsSAD,转入大肠杆菌DH5α,在不同时间、不同IPTG浓度和不同温度条件下进行诱导,得到目的蛋白。为今后进一步深入研究乌桕SAD基因的表达情况、功能,以及基因调控奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 植物材料 乌桕种子采于四川洪雅县。立即冻存于液氮中,而后放于-80 ℃的冰箱中备用。
1.1.2 主要试剂 大肠杆菌JM109菌株为四川大学资源与开发实验室保存。测序和亚克隆载体pMD18-T (TaKaRa, Dalian, China)。原核表达载体pMAL-c2E (Biolab, USA)。大肠杆菌DH5α表达菌株。ExTaq酶、反转录酶(AMV)、各种限制性内切酶都购于TaKaRa。VentR DNA聚合酶购自BioLabs。小量胶回收试剂盒,PCR产物回收试剂盒购自上海华舜公司。IPTG、琼脂糖、琼脂粉、Tris、SDS购于Amersham。
1.2 实验方法
1.2.1 RNA的提取 采用张容等人[13]的方法对总RNA进行提取。提出的RNA先经DNase37 ℃保温30 min,除去DNA,再参照植物RNA提取试剂盒使用手册(华舜)纯化。回收的RNA经过纯度和浓度检测后,存放-80 ℃备用。
1.2.2 乌桕硬脂酰-ACP脱饱和酶基因的克隆 保守区片段、5′端和3′端RECE片段[14]克隆:通过BLAST对比,根据保守区设计一对简并引物91和92(表1)。用纯化的RNA为模板,以oligo(dT)18为反转录引物,进行反转录。再以反转录的cDNA为模板,扩增得到乌桕硬脂酰-ACP脱饱和酶基因cDNA保守片段。对扩增片段跑胶、回收并测序比对验证其正确性。根据保守片段的测序结果,设计5个特异引物(931,932,951,952和953)以及2个通用引物AP1和AP2(表1)。通过5′-RACE和3′-RACE的方法,分别扩增得到SsSAD基因的5′端和3′端片段。所有反应程序均为:95 ℃ 5 min ;35个循环(94 ℃ 40 s,50 ℃ 50 s,72 ℃ 1 min),72 ℃延伸8 min,4 ℃保温。所得的产物经电泳检测,并回收、连接、转化、测序。测序结果在NCBI的Blastn 进行比对分析,验证克隆片段是否属于SAD基因。

表1 基因克隆及表达所用引物序列
全长cDNA片段和阅读框的克隆:根据拼接片段设计引物9c1和9c2、9ORF1和9ORF2,采用高保真VentR DNA聚合酶分别克隆SsSAD基因的cDNA全长和阅读框序列。反应程序为:95 ℃ 5 min;35个循环(94 ℃ 40 s,50 ℃ 50 s,72 ℃ 2 min), 72 ℃延伸10 min,4 ℃保温。所得的产物经电泳检测,并回收、连接、转化、测序。所得序列在NCBI的Blastn 进行比对分析,验证克隆片段是否属于SAD基因。
1.2.3 硬脂酰-ACP脱饱和酶基因生物信息学分析 使用的生物软件:DNAMAN6.0、Clustalx 1.8、TreeView、 Primer Primer5.0、Vector NIT 7.0,DNA star,COOT,PyMOL, MEGA6.0。使用的网上的数据库和在线分析:
Blast: http://blast.ncbi.nlm.nih.gov/Blast.cgi;
ORF finder: http://www.ncbi.nlm.nih.gov/gorf/gorf.html;
Compute pI/Mw: http://www.expasy.org/tools/pi_tool.html;
综上可知,随着日中有“金鸡”说法的出现与流传,自宋以后,学者们又试图从如镜像、折射的角度;或从阴阳互藏、阴阳交感的理论,来推测日中为何会有“鸡”。但由前引北宋董逌的《跋月宫图》中驳斥当时人“知日中为乌,而不知为鸡”之语,以及以上各家的解释亦可发现:宋代以后的人们,对于此说可能已多有质疑。
TMHMM: http://www.cbs.dtu.dk/services/TMHMM-2.0/;
Protparam: http://web.expasy.org/protparam/;
CD Search: http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi;
Swiss-model: http://swissmodel.expasy.org/;
ChloroP: http://www.cbs.dtu.dk/services/ChloroP/;
SOPMA:https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html。
外源基因的诱导表达和SDS-PAGE检测[15]:挑取含重组质粒的DH5α单菌落接种于含Amp(100 mg/L)的LB中,37 ℃振荡培养过夜,次日按5 %的比例转接到新鲜培养基中,37 ℃振荡培养30 min左右,至菌液的OD600达到0.6。将菌液分成13份。一份不加IPTG,10 000 r/min离心1 min,收集菌体保存于-20 ℃;其余12份按表2所列进行诱导,分别于1、2、3、5 h,取出相应的1 mL的菌液,10 000 r/min离心1 min,收集菌体保存于-20 ℃。同时做pMAL-c2E空载的DH5α菌对照。 以pMAL-SsSAD重组不加IPTG诱导的菌体和pMAL-c2E空载菌作为本底表达对照,将各处理收获的菌体进行SDS-PAGE(12 %)分析。
2 结果与分析
2.1 硬脂酰-ACP脱饱和酶基因全长cDNA的克隆
根据其他物种在GenBank中登录的硬脂酰-ACP脱饱和酶基因的保守序列设计简并引物,以乌桕种子cDNA为模板,扩增出长约473 bp的片段(图1-1)。将测序结果在NCBI数据库进行Blastn比对,其与蓖麻 (X56508), 麻疯树(DQ084491)和拟南芥 (AF395441.1)有很高的同源性, 分别为94 %, 92 %和84 %,因此初步推测其为乌桕的硬脂酰-ACP脱饱和酶基因的保守区片段。根据该保守区序列设计特异引物,通过巢式PCR扩增到约658 bp 3′端片段(图1-2),又采用TdT末端加尾和巢式PCR的方法扩增得到约656 bp 5′端片段(图1-3)。采用软件Vecter NTI suite 7.0的ContigExpress软件对三段序列进行拼接,得到全长cDNA。用NCBI中的ORF finder对序列分析发现,全长cDNA包含一个完整的开放阅读框1191 bp,编码396个氨基酸.根据拼接序列,设计引物9ORF1和9ORF2、9c1和9c2,得到乌桕的硬脂酰-ACP脱饱和酶基因阅读框和全长cDNA(图1-4和图1-5)。GenBank登录号为EF079655。
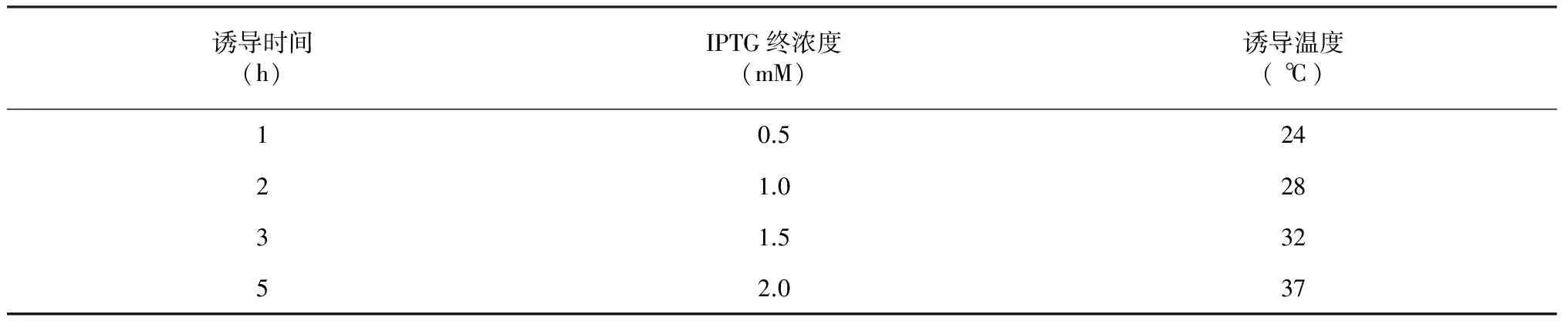
表2 SsSAD基因原核诱导表达的时间、浓度和温度条件优化
注:诱导温度优化时,加入IPTG终浓度为1 mM,诱导时间为2 h;诱导时间优化时,加入IPTG终浓度为1 mM, 温度为37 ℃;IPTG浓度梯度优化时,诱导时间为2 h,温度为37 ℃。

1:SsSAD基因中间cDNA片段;2: SsSAD基因3′端cDNA片段;3: SsSAD基因5′端cDNA片段(箭头处); 4: SsSAD基因ORF;5: SsSAD基因全长(箭头处)1: The middle fragments; 2: The 3′fragments of SsSAD gene; 3: 5′fragments of SsSAD gene (arrow); 4: ORF of SsSAD gene; 5:The full-length cDNA of SsSAD (arrow)图1 乌桕的SsSAD基因片段、ORF和全长cDNA的克隆Fig.1 Amplification of fragments, ORF and the full-length cDNA of SsSAD gene

1-SAD:Sapium sebiferum SAD (ABN13874);2-SAD: Olea europaeafruit SAD (AAB67840) ;3-SAD:Ricinus communis SAD (CAA39859); 4-SAD:Jatropha curcas SAD(AAY86086); 5-SAD:Helianthus annuus SAD (AAB65144); 6-SAD:Sesamum indicum SAD (BAA07681);7-SAD:Glycinemax SAD (AAX86050); 8-SAD:Gossypium hirsutum SAD(CAB75356);9-SAD:Carthamus tinctorius SAD (AAA33021); 10-SAD:Oryza sativa SAD(NP001045215); 11-SAD: Brassica napus SAD (CAA52786.1);12-SAD:Arabidopsis thaliana (AtSAD) (AAK85232.1);叶绿体转移肽, 2. Π型酶保守区;1.a chloroplast transit peptide,2. conservative district of Π enzyme图2 SsSAD基因推测的氨基酸序列与其他植物SADs的同源比对Fig.2 Amino acid sequence alignment of Sapium sebiferum SsSAD and other plant SADs
2.2 乌桕的SsSAD的氨基酸序列分析
利用在线蛋白质分析软件ChloroP和Compute pI/Mw进行分析,发现该蛋白前端含一个33个氨基酸的叶绿体转移肽(图2)。其成熟肽的分子量为41.5 kDa,等电点为5.42。其中,含中性疏水性氨基酸 43.7 %,中性亲水性氨基酸 27.8 %,酸性氨基酸 14.1 %,碱性氨基酸 14.4 % 。TMHMM-2.0预测结果显示,该蛋白没跨膜结构,位于膜外。高级结构预测显示,α螺旋是SsSAD成熟肽的主要结构元件,其含量占50.28 %,此外,无规则卷曲占28.45 %,β片层占12.28 %,β折叠占9.12 %。同源性比对结果显示,乌桕SsSAD全长氨基酸序列和其他物种有较高的同源性(76.24 %~92.57 %),具有1个高度保守的基序(图2)。

图3 13种植物的SAD的N-J系统进化树分析Fig.3 Phylogenetic N-J tree analysis of SADs from 13 plants
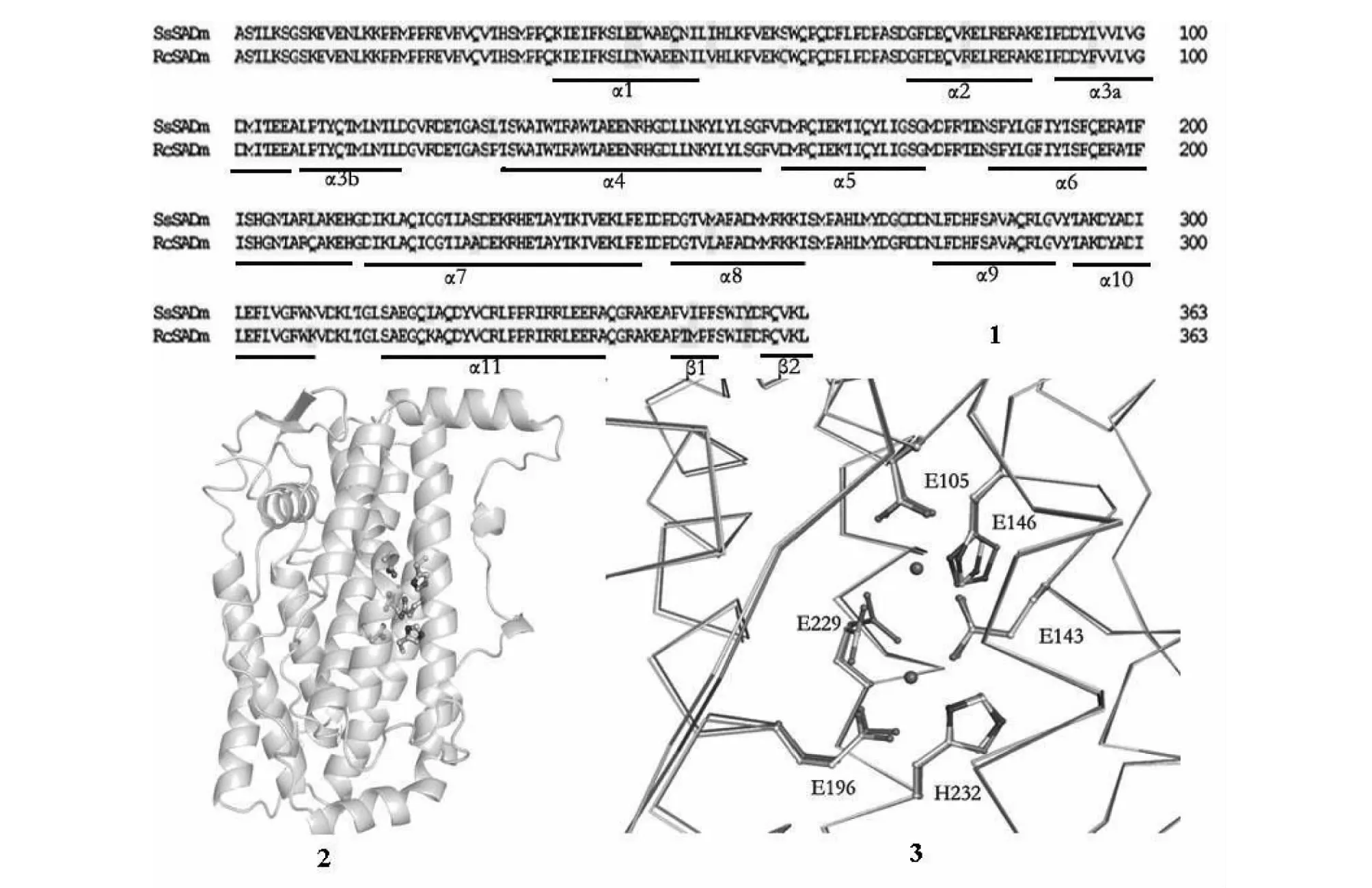
1: SsSAD和RcSAD成熟肽氨基酸的比对; 2:SsSAD蛋白预测的3D结构;3: SsSAD和RcSAD活性中心的对比,浅灰色为SsSAD的活性中心,深灰色为RcSAD的活性中心1: Amino acid squences comparison between mature SsSAD and RcSAD; 2:The predicted 3D protein structure of mature SsSAD;3:Comparison in active domains from SsSAD and RcSAD;Light gray: Active domains from SsSAD; Deep gray: Active domains from RcSAD图4 SsSAD成熟肽的空间结构Fig.4 The spatial structure of mature SsSAD
采用MEGA6.0 对13种植物的SAD进行N-J系统进化树分析,图3显示乌桕的SAD与大戟科的麻疯树、蓖麻、油桐和木油桐的SAD在同一个分枝,亲缘关系很近。
氨基酸序列比对显示乌桕SsSAD成熟肽的氨基酸与蓖麻的硬脂酰-ACP脱饱和酶成熟肽RcSAD具有较高的相似性,这两条多肽在酶活性中心的4个α-螺旋上,氨基酸几乎完全一致(图4-1)。通过同源建模预测乌桕硬脂酰-ACP脱饱和酶的3D结构(图4-2)。将乌桕SsSAD成熟肽与蓖麻的RcSAD成熟肽的结构进行重叠,结果显示这2个蛋白在活性中心的6个氨基酸完全一致,其余部分几乎完全重合(图4-3)。
2.3 乌桕的SsSAD的原核表达
为进一步研究SsSAD基因的表达情况,将切去叶绿体转移肽的SsSAD基因ORF序列与pMAL载体重组,构建了原核表达的pMAL-SsSAD重组质粒,并将此重组质粒转入大肠杆菌DH5α菌株中,经IPTG诱导后,对表达产物进行了SDS-PAGE电泳检测。通过对蛋白质电泳图分析,pMAL-SsSAD重组质粒在IPTG诱导作用下,出现了一条新的蛋白质条带,分子量约为81 kDa,扣除载体上约40 kDa的malE麦芽糖结合蛋白,即得到一个约为41 kDa的蛋白质,这与SsSAD蛋白理论分子量相符。此外,又对转化子做了温度梯度、诱导时间梯度和IPTG浓度梯度的诱导,优化诱导条件。实验结果显示:当菌体在不同温度梯度下,用相同IPTG浓度(1 mM)下诱导2 h,发现在37 ℃的时候,表达产物最高(图5)。这说明37 ℃是菌体表达产物的最适温度;在37 ℃、1 mM IPTG浓度诱导下,目的蛋白随诱导时间的增加而增多(图6);而在37 ℃下,用不同浓度梯度的IPTG诱导2 h后,目的蛋白表达量基本一致,说明IPTG浓度的变化对pMAL-SsSAD重组质粒的诱导表达没有明显的影响(图7)。

1:空载诱导对照; 2:蛋白质分子量Marker; 3:未诱导重组对照; 4:37 ℃诱导; 5:32 ℃诱导; 6:28 ℃诱导;7:24° ℃诱导; 箭头所指条带为目的蛋白1:Empty vector induced by IPTG as control1; 2:Protein marker; 3:No induced recombinant plasmid as control2; 4:Induced in 37 ℃; 5:Induced in 32 ℃; 6: Induced in 28 ℃; 7 :Induced in 24 ℃; Arrow stripe for target protein 图5 温度梯度对SsSAD基因的原核表达影响Fig.5 Effects of temperature gradient on prokaryotic expression of SsSAD

1:蛋白质分子量Marker; 2.空载诱导对照; 3. 未诱导的重组对照; 4:诱导5 h; 5:诱导3 h; 6:诱导2 h; 7: 诱导1 h; 箭头所指条带为目的蛋白1:Protein marker; 2: Empty vector induced by IPTG as control1; 3: No induced recombinant plasmid as control2; 4: Induced in 5 h; 5: Induced in 3 h; 6: Induced in 2 h; 7: Induced in1 h; Arrow stripe for target protein 图6 时间梯度对SsSAD基因的原核表达影响Fig.6 Effect of time gradient on prokaryotic expression of SsSAD

1:2 mM IPTG诱导; 2:1.5 mM IPTG诱导; 3:1 mM IPTG诱导; 4: 0.5 mM IPTG诱导; 5:空载诱导对照; 6:蛋白质分子量Marker; 7:未诱导重组对照; 箭头所指条带为目的蛋白1: Induced by 2 mM IPTG; 2: Induced by 1.5 mM IPTG; 3:Induced by1 mM IPTG; 4: Induced by 0.5 mM IPTG; 5: Empty vector induced by IPTG as control1; 6:Protein marker; 7: No induced recombinant plasmid as control2; Arrow stripe for target protein图7 IPTG梯度对SsSAD基因的原核表达影响Fig.7 Effect of IPTG gradient on prokaryotic expression of SsSAD
3 讨论与结论
Lindqvist Y.[16]于1996年报道蓖麻的硬脂酰-ACP脱饱和酶的晶体结构,这就为预测同家族的SAD蛋白结构提供了一个平台。通过蓖麻RcSAD成熟肽和乌桕SsSAD成熟肽的比对,采用同源建模的方法得到乌桕硬脂酰-ACP脱饱和酶的结构。其具有11个α-螺旋,包含的氨基酸分别为:α1(36~51)、α2(75~88)、α3a(91~106)、α3b(108~118)、α4(130~158)、α5(161~176)、α6(184~213)、α7(215~245)、α8(249~262)、α9(278~290)、α10(293~309)、α11(317~341)(图4-1)。这些螺旋中的9个α-螺旋(α3~α11)形成一个反向平行的α-螺旋束,其中α3、α4、α6和α7形成的一个四螺旋束结构[16]。该结构位于SsSAD的保守区,并含有着一个由两个铁原子组成的二铁中心[17]。图4-2和图4-3结构中深灰色的球代表Fe原子。Fe原子的6个配基即是四螺旋束的6个氨基酸的侧链或其基团,其中一个铁原子的配基是E196、H232,另一个铁原子的配基是E105、H146,而E143、E229是两个铁原子的桥连配基[16-17]。将蓖麻RcSAD和乌桕SsSAD蛋白结构重叠,比较二者在结构上的差异。图4-3显示这2个蛋白在活性中心的6个氨基酸完全一致,其余部分几乎完全重合。两铁原子之间均通过一个氧原子相连,形成非常对称的Fe-O-Fe二铁氧簇,二铁中心及部分四螺旋束的氨基酸侧链或基团形成酶活性中心[17-18]。从结构推测两者的功能也十分相近, 特异性的底物硬脂酰 -ACP 分子通过与位于二聚体分子表面的凹槽内部的酶活性中心结合,进行脂肪酸碳链第9~10碳原子的氧化还原反应[9,18]。
为下一步蛋白的活性鉴定提供一定结构基础,构建pMAL-c2E-大肠杆菌DH5α的原核表达体系来诱导蛋白表达。成功获得分子量约为 41.5 kDa 的蛋白质,推测该蛋白可能是乌桕SsSAD 天然二聚体的寡聚单体形态。
[1]Allawzi M, Kandah M I.Parametric study of biodiesel production from used soybean oil[J]. European Journal of Lipid Science & Technology, 2008, 110(8):760-767.
[2]丁丽芹,何 力,郝 平. 国外生物燃料的发展及现状[J]. 现代化工, 2002,22(11):55-56.
[3]Cao W L, Han H W, Zhang J C. Preparation of biodiesel from soybean oil using supercritical methanol and co-solvent [J]. Fuel, 2005, 84(4):347-351.
[4]罗 艳,刘 梅. 开发木本油料植物作为生物柴油原料的研究[J]. 中国生物工程杂志, 2007, 27(7):68-74.
[5]李星霖, 刘巧霞, 程志全, 等. 沪苏皖主要非粮生物柴油能源植物资源的调查与含油量分析[J]. 华东师范大学学报(自然科学版), 2015(1) : 212-223.
[6]陈 玉,杨光忠. 乌桕化学成分研究进展[J]. 天然产物研究与开发, 1999, 11(5):114-120.
[7]刘火安,姚 波. 乌桕油脂成分作为生物柴油原料的研究进展[J]. 基因组学与应用生物学, 2010, 29(2):402-408.
[8]Niu B, Ye H X, Xu Y, et al. Cloning and characterization of a novel Δ12-fatty acid desaturase gene from the treeSapiumsebiferum[J].Biotechnology Letters, 2007, 29(6): 959-964.
[9]章文乐, 蒲婧懿, 朱梦媛, 等. 黄连木 PcSAD 基因的克隆及分析[J].基因组学与应用生物学,2013,32(4): 503-509.
[10]张羽航, 鲍时翔, 郑学勤,等. 脂肪酸脱饱和酶的研究进展[J]. 生物技术通报, 1998(4):109-109.
[11]Liu Q, Singh P S, Green G A. High-stearic and High-oleic cottonseed oils produced by hairpin RNA-mediated post-transcriptional gene silencing [J]. Plant Physiology, 2002, 129(129): 1732-1743.
[12]Merlo A O, Cowen N, Delate T, et al. Ribozymes targeted to stearoyl-ACP △9desaturase mRNA produce heritable increases of stearic acid in transgenic maize leaves [J]. The Plant Cell, 1998, 10(10): 1603-1622.
[13]Zhang R, Zheng Y F, Wu Y, et al. A Simple and Efficient Method for Preparation of Plant RNAs[J]. Hereditas., 28(5): 583-584.
[14]Hoang L T, Liang J S, Carreras I, et al. Novel SAA gene products in mice defined by rapid amplification of complementary DNA ends(3’ and 5’ RACE) [J]. Amyloid-journal of Protein Folding Disorders, 2009, 2(2): 75-82.
[15]Cao Y J, Xian M, Yang J M, et al. Heterologous expression of stearoyl-acyl carrier protein desaturase(S-ACP-DES) from Arabidopsis thaliana inEscherichiacoli, protein expression and purification[J]. Protein Expression & Purification, 2010, 69(2):209-214.
[16]Lindqvist Y, Huang W, Schneider G, et al. Crystal structure of △9stearoyl-acyl carrier protein desaturase from castor seed and its relationship to other di-iron proteins[J].EMBO J, 1996, 15(16): 4081-4092.
[17]罗 通,邓骛远,张富丽.植物硬脂酰-酰基载体蛋白脱饱和酶[J].生命的化学, 2006, 26(2):133-136.
[18]Fox B G, Shanklin J, Somerville C, et al. Stearoylacyl carrier protein △9desaturase from Ricinus communis is a diiron-oxo protein[J].PNAS, 1993, 90(6):2486-2490.
(责任编辑 陈 虹)
Cloning and Expression of Stearoyl-acyl Carrier Protein Desaturase Gene fromSapiumsebiferum
NIU Bei1, XU Ying2, SONG Jun3, GUO Xiao-heng1, FU Jia1, ZHOU Liang1, CHEN Fang2*, GAO Xiao-jin1, GUO Jing1
(1.School of Medical, Chengdu University, Sichuan Chengdu 610106,China; 2.College of Life Science, Sichuan University, Sichuan Chengdu 610064,China; 3.Analysis and Test Center of Sichuan Academy of Agriculture Science, Sichuan Chengdu 610066,China)
Stearoyl-acyl carrier protein (stearoyl-ACP) desaturase catalyzes the first desaturation step in seed oil biosynthesis, converting stearoyl-ACP to oleoyl-ACP. It plays a key role in determining the ratio of saturated fatty acids to unsaturated fatty acids in membrane lipids and store lipids form plants. In this study, cDNA sequence ofSsSADgene was cloned by RT-PCR and RACE technology. The result showed that a full-lengthSsSADgene contained an 1191 bp open reading frame (ORF) encoding 396 amino acid residues (GenBank accession number: EF079655), which had a chloroplast transit peptide of 33 amino acids. The mature peptide contained 363 amino acids, and the calculated molecular weight and isoelectric point of the mature protein were predicted to be 41.5 kDa and 5.42, respectively. The amino acid sequence having a conserved region had a much higher match with other stearoyl-acyl carrier protein desaturases (SADs) by homology modeling analysis. The recombinant plasmid pMAL-SsSAD was constructed and expressed inE.coliDH5α, and its best induction conditions were optimized.
Sapiumsebiferum; Stearoyl-acyl carrier protein desaturase; Cloning; Bioinformatics analysis; Prokaryotic expression
1001-4829(2016)08-1806-07
10.16213/j.cnki.scjas.2016.08.009
2016-01-12
四川省教育厅项目“油料树种乌桕的FAD2基因表达调控研究”(12ZB178); 成都大学自然科学青年基金“大戟科药用植物活性物质筛选”(2010XJZ29); 成都大学大学生创新训练计划孵化培育项目“乌桕硬脂酰-酰基载体蛋白脱饱和酶基因的克隆和表达分析”
牛 蓓,女,四川成都人,博士,研究方向:生物化学与分子生物学,E-mail: niubeiucd@126.com,*为通讯作者。
S565
A

