彭泽鲫F1、F2代雌雄鱼Vtg B和ZP2表达及卵黄蛋白原含量差异研究
郑 尧,陈家长,邴旭文,王在照
( 1. 中国水产科学研究院 淡水渔业研究中心,农业部淡水鱼类遗传育种与养殖生物学重点开放实验室,农业部长江下游渔业资源环境科学观测实验站,中国水产科学研究院内陆渔业生态环境与资源重点开放实验室,南京农业大学渔业学院,无锡 江苏 214081; 2. 西北农林科技大学 动物科技学院,陕西省农业分子生物学重点实验室,杨凌 陕西 712100 )
彭泽鲫F1、F2代雌雄鱼Vtg B和ZP2表达及卵黄蛋白原含量差异研究
郑 尧1,陈家长1,邴旭文1,王在照2
( 1. 中国水产科学研究院 淡水渔业研究中心,农业部淡水鱼类遗传育种与养殖生物学重点开放实验室,农业部长江下游渔业资源环境科学观测实验站,中国水产科学研究院内陆渔业生态环境与资源重点开放实验室,南京农业大学渔业学院,无锡 江苏 214081; 2. 西北农林科技大学 动物科技学院,陕西省农业分子生物学重点实验室,杨凌 陕西 712100 )
雌核发育彭泽鲫后代理论上应为全雌群体,前期研究发现实验室养殖彭泽鲫F1代(相比池塘养殖)和实验室高密度养殖F2代(1.28尾/L, 相比低密度0.64尾/L)组中出现了高比例的雄鱼。之前研究认为Vtg B和ZP2基因是雌性特异性表达的基因,本试验对F1、F2代雌雄鱼Vtg B和ZP2表达及卵黄蛋白原含量差异进行研究,结果发现,实验室养殖F1代雄鱼性腺中Vtg B和ZP2的表达分别极显著和显著高于雌鱼(P<0.01,P<0.05);池塘养殖F1代雄鱼性腺中Vtg B和ZP2的表达分别极显著高于和低于雌鱼(P<0.01);F2代低密度养殖组中雄鱼性腺中ZP2的表达极显著高于雌鱼(P<0.01)。实验室养殖F1代雄鱼肝胰脏中Vtg B和ZP2的表达分别极显著高于和低于雌鱼(P<0.01);池塘养殖F1代雄鱼肝胰脏Vtg B和ZP2的表达均极显著低于雌鱼(P<0.01);F2代雄鱼肝胰脏中Vtg B和ZP2的表达极显著高于雌鱼(P<0.01)。F1代实验室养殖雄鱼全鱼卵黄蛋白原含量极显著低于雌鱼(P<0.01);F1代池塘养殖雄鱼性腺、肝胰脏中卵黄蛋白原含量分别极显著高于和低于雌鱼(P<0.01);F2代雄鱼性腺、肝胰脏中卵黄蛋白原含量极显著高于雌鱼(P<0.01)。本研究表明,彭泽鲫Vtg B和ZP2基因并非雌性特异性表达,且不同的养殖方式、密度影响雌雄鱼Vtg B和ZP2表达及卵黄蛋白原含量。
雌核发育;彭泽鲫;卵黄蛋白原;透明带蛋白;基因表达
卵黄蛋白原(Vtg)即卵黄蛋白的前体,是一种大分子量的磷酸酯糖蛋白。在雌二醇刺激下,卵黄蛋白原能在肝脏中合成,通过血液运输,最后被运送到卵巢中作为胚胎发育的营养源[1]。透明带蛋白(ZP)包含四种亚型:ZP1(ZPB)、ZP2(ZPA)、ZP3(ZPC)和ZPX。在硬骨鱼类中,对ZPB和ZPC基因及其功能的研究相对较多。一般说来,卵母细胞能够合成透明带蛋白,且在体内无卵母细胞存在时,机体也能够合成透明带蛋白[2]。在硬骨鱼中,透明带蛋白主要在肝脏和卵巢中合成,其表达模式分为卵巢特异性表达、肝脏特异性表达或在卵巢和肝脏组织中共同表达[3]。透明带蛋白基因的表达与卵细胞的发生有重要的关系,青鳉(Oryziaslatipes)中卵巢特异性表达的透明带蛋白基因在卵细胞直径达到45 μm时才可检测到表达;雄性青鳉肝脏特异性表达的透明带蛋白基因在正常情况下几乎不表达,当受到雌激素影响时,透明带蛋白会被诱导有较高的表达[4-5]。雌激素能够调控青鳉肝脏中透明带蛋白的合成[6];但斑马鱼(Daniorerio)卵巢透明带蛋白表达则较为灵活,受雌激素的调控影响较小[7-8]。在鱼类中,一般认为卵黄蛋白原和透明带蛋白是雌鱼的特异蛋白,且都能被雌激素雌二醇诱导,但是雄鱼的肝胰脏中也有卵黄原蛋白和透明带蛋白基因的存在[9]。
目前有研究表明雄激素也能诱导卵黄原蛋白和透明带蛋白基因的表达[10],且不同的内分泌干扰物对雌雄鱼卵黄原蛋白和透明带蛋白基因的诱导机制不同[11],而目前卵黄蛋白原是环境激素污染检测试剂盒中使用最为成功的生物标志物[12-13],也有观点认为需要将卵黄蛋白原和透明带蛋白联合起来使用更能增加鉴定的准确度[9]。本研究将比较F1、F2代雌核发育彭泽鲫(Carassiusauratusvar. Pengze)雌雄鱼特定器官(性腺和肝胰脏)中Vtg B和ZP2基因的表达差异,同时采用ELISA检测性腺和肝胰脏中卵黄蛋白原的含量,探究Vtg B和ZP2基因及卵黄蛋白原含量在不同养殖方式、密度下的表达模式,为雌核发育物种卵黄发生机制研究提供基础性资料。
1 材料与方法
1.1 试验材料
人工雌核发育彭泽鲫F1代(Pcc)操作于2011年4月20日在湖北荆州窑湾养殖基地进行(水温18 ℃),父本选择基地养殖池中3~5龄兴国红鲤(Cyprinuscarpiovar. red style) (1600 ± 175) g,母本选择2龄经雌核发育繁殖的彭泽鲫成鱼(450 ± 15) g (n=300),雌雄鱼采用腹部检查法分辨,本研究中试验用鱼采用1雄1雌进行繁殖并重复2次,人工催产雌鱼采用绒毛膜促性腺激素(400 IU/kg)、鱼用促黄体素释放激素类似物(6 μg/kg)和鲤垂体干粉(1 mg/kg, 用0.7%NaCl溶解)剂量配合进行,两次注射间隔时间为6~8 h,雄鱼减半。
人工雌核发育彭泽鲫F2代操作按文献[14]于2013年4月10日进行,母本选择2龄彭泽鲫F1代雌鱼,父本选择、催产与彭泽鲫F1代操作相同。彭泽鲫的受精卵是以红鲤的精子来激活彭泽鲫成熟卵细胞得到的,然后转入约20 ℃的孵化桶中。子代约3~4 d出膜,半月龄彭泽鲫F2代带回实验室采用125 L大玻璃缸养殖(600尾,120 cm×40 cm×80 cm),将彭泽鲫F2代按不同养殖密度分两个密度组进行养殖,分别在低密度养殖组,高密度养殖组各放置80,160尾彭泽鲫F2代,养殖时间直至能镜检分出雌雄为止(约7个月,雌雄鱼分别处于性腺发育的Ⅱ期)。1月龄内喂食蛋黄,1月龄—2月龄按0.1% (m/m)喂食卤虫(Artemia),之后选择商品化的鱼用饲料。卤虫孵化方法按NaCl质量浓度10~15 g/L,pH为7.5~8.5,水温为28 ℃,充氧培养第2 d收卵,喂食之前用清水洗净。彭泽鲫养殖条件:水温(25 ± 1) ℃;光周期14 h∶10 h;pH 7.1 ± 0.5; 溶解氧(7.16 ± 0.16) mg/L; 总磷(2.16 ± 0.17) mg/L; 总氮(0.52 ± 0.15) mg/L; 氨氮(0.44 ± 0.06) mg/L; 总硬度(194.3 ± 13.0) mg/L(按CaCO3算)。
1.2 彭泽鲫 F1、F2代雌雄鱼性腺、肝胰脏中总RNA的提取、质量检测及反转录试验
分别取实验室和池塘养殖F1代(雌雄鱼分别处于各自性腺发育的Ⅱ期),低、高密度养殖组中的彭泽鲫F2代雌、雄鱼(雌雄鱼分别处于各自性腺发育的Ⅱ期,各n=10)进行解剖,参照文献[14]进行性腺总RNA提取、质量检测及反转录操作。
1.3 彭泽鲫F1、F2代雌雄鱼性腺、肝胰脏中Vtg B和ZP2基因表达
按文献[15]对内参基因进行筛选,本研究中内参基因采用tubulin,检测彭泽鲫F1、F2代雌雄鱼性腺、肝胰脏中Vtg B和ZP2基因的表达。参照文献[14]进行荧光实时定量PCR的操作,前期研究获得了Vtg B(KF373229)和ZP2(KF373231)基因完整编码区,定量引物见表1。
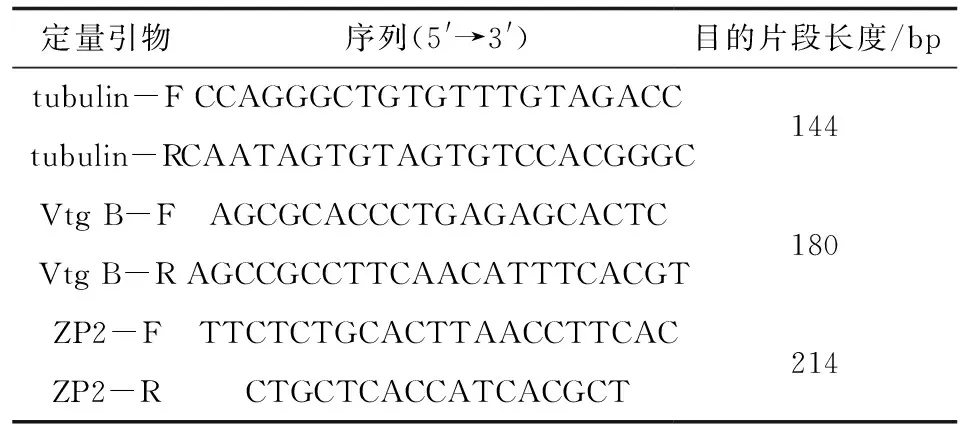
表1 定量引物
1.4 彭泽鲫F1、F2代雌雄鱼卵黄蛋白原含量测定
采取每尾鱼性腺、肝胰脏组织(实验室养殖彭泽鲫F1代因个体小取全鱼组织),用于卵黄蛋白原含量测定。用于卵黄蛋白原含量测定试验的组织先称量质量置于冰箱中80 ℃冻存,第2 d按照1∶20(m/V)添加0.1 mol/L磷酸盐缓冲液(pH 7.4),用塑料研磨棒在冰上研磨充分,4 ℃,3000 r/min离心10 min,取上清液分装后一份待检测,其余于冰箱中80 ℃冻存备用。抗体采用纯化的银鲫卵黄蛋白原抗体包被微孔板,检测按照上海恒远生物科技有限公司试剂盒说明书进行,检测限为3~150 ng/mL。
1.5 数据分析
应用SPSS 18.0软件对试验数据进行整理分析。试验数据采用相对表达量的计算方法,即相对表达量=2-ΔΔCt方法[15],数据结果均用“平均数±标准差”的表示方法。基因表达和卵黄蛋白原含量测定使用t检验,P<0.05表明差异显著,用1个星号表示,P<0.01表明差异极显著用2个星号表示。
2 结 果
2.1 实验室、池塘养殖彭泽鲫F1代雌雄鱼性腺中Vtg B和ZP2基因表达差异
彭泽鲫F1代实验室养殖精、卵巢中Vtg B相对表达量(与内参相比,下同)分别为35.08±11.76和3.97±2.77,精、卵巢中ZP2相对表达量分别为30.24±2.08和10.61±0.96,彭泽鲫F1代实验室养殖精巢Vtg B和ZP2表达分别极显著和显著高于卵巢中的表达(P<0.01,P<0.05)(图1a)。彭泽鲫F1代池塘养殖精、卵巢中Vtg B相对表达量分别为1.68±0.37和0.65±0.18,精、卵巢中ZP2相对表达量分别为1.69±0.20和1.94±0.48,彭泽鲫F1代池塘养殖精巢Vtg B和ZP2表达分别显著高于和低于卵巢中的表达(图1b)(P<0.05)。彭泽鲫F2代实验室养殖精、卵巢中ZP2相对表达量分别为2.39±0.13和1.73±0.11,彭泽鲫F2代实验室高、低密度养殖卵巢ZP2表达极显著低于高密度养殖组精巢中的表达(P<0.01)(图1c)。
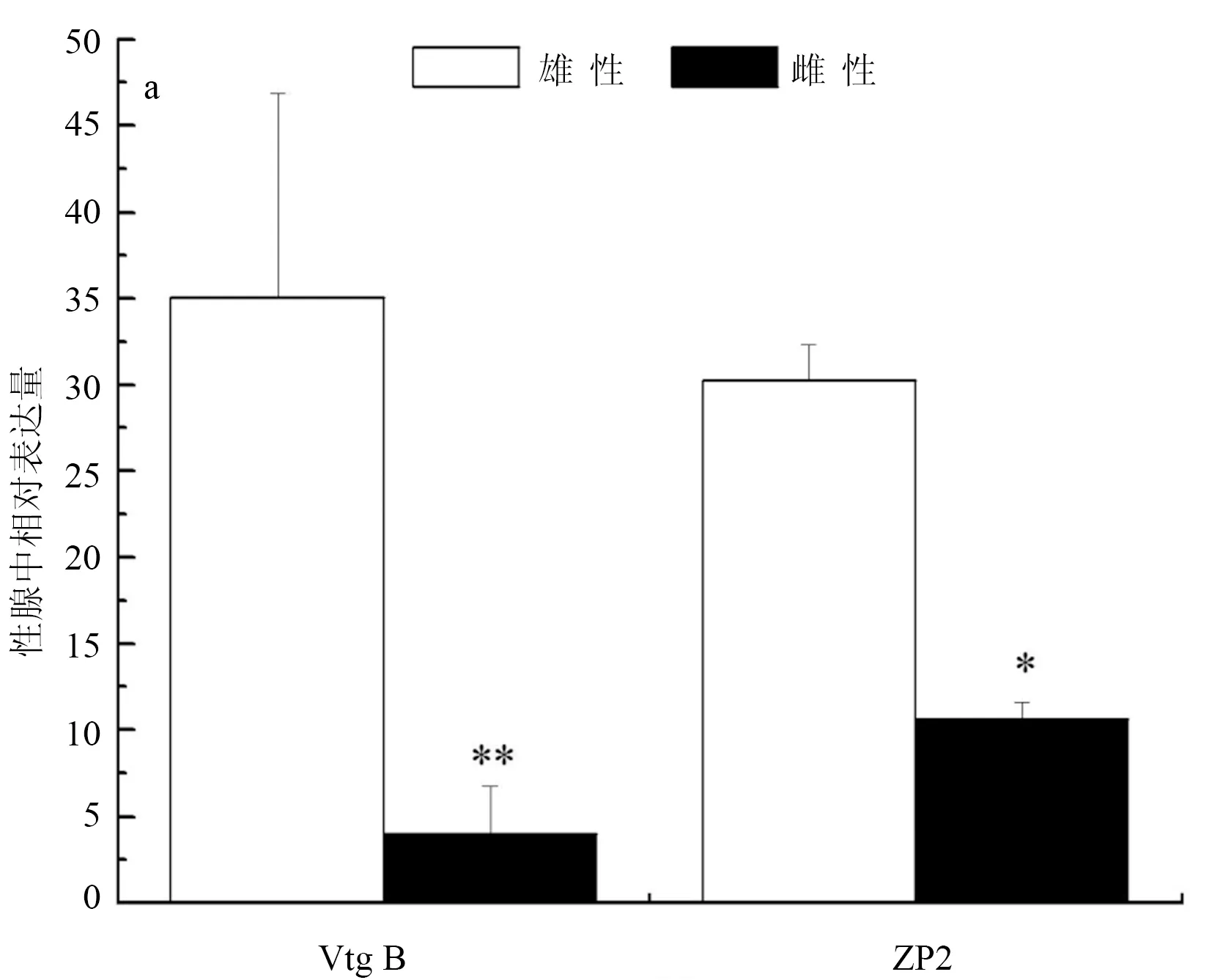
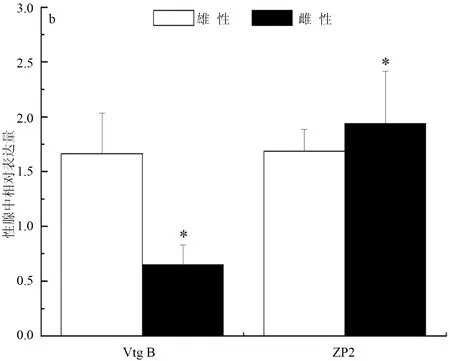

图1 彭泽鲫F1、F2代雌雄鱼性腺中vtgB和ZP2基因表达差异比较
注:a,实验室养殖彭泽鲫F1代; b,池塘养殖彭泽鲫F1代; c,实验室养殖彭泽鲫F2代. 1个星号表示差异显著(P<0.05), 2个星号表示差异极显著(P<0.01).下同.
2.2 实验室高、低密度养殖组彭泽鲫F2代雌雄鱼肝胰脏中Vtg B和ZP2基因表达差异
彭泽鲫F1代实验室养殖雄、雌鱼肝胰脏中Vtg B相对表达量分别为5592.27±314.24和148.42±17.16,雄、雌鱼肝胰脏中ZP2相对表达量分别为11.33±2.91和75.12±9.59,彭泽鲫F1代实验室养殖雄鱼肝胰脏中Vtg B和ZP2表达分别极显著高于和低于雌鱼中的表达(P<0.01)(图2a)。彭泽鲫F1代池塘养殖雄、雌鱼肝胰脏中Vtg B相对表达量分别为0.15±0.33和99.06±16.00,雄、雌鱼肝胰脏中ZP2相对表达量分别为0.98±0.11和25.16±4.60,彭泽鲫F1代池塘养殖雄鱼肝胰脏中Vtg B和ZP2表达分别极显著低于雌鱼中的表达(P<0.01)(图2b)。彭泽鲫F2代实验室养殖雄、雌鱼肝胰脏中Vtg B相对表达量分别为1.45±0.21和0.61±0.13,雄、雌鱼肝胰脏中ZP2相对表达量分别为2.60±0.23和0.82±0.10,彭泽鲫F2代实验室养殖雄鱼肝胰脏中Vtg B和ZP2表达均极显著高于雌鱼中的表达(P<0.01)(图2c)。
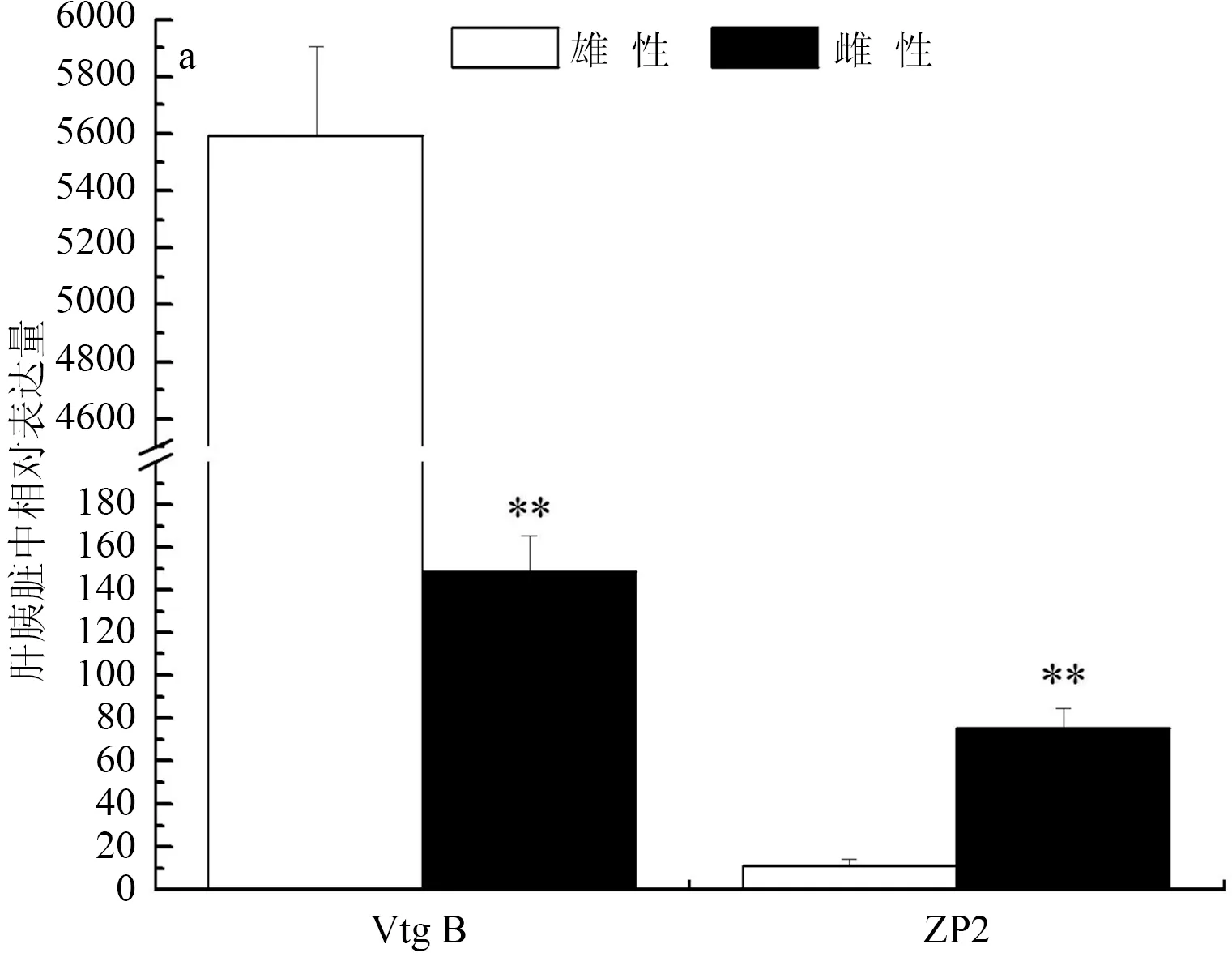
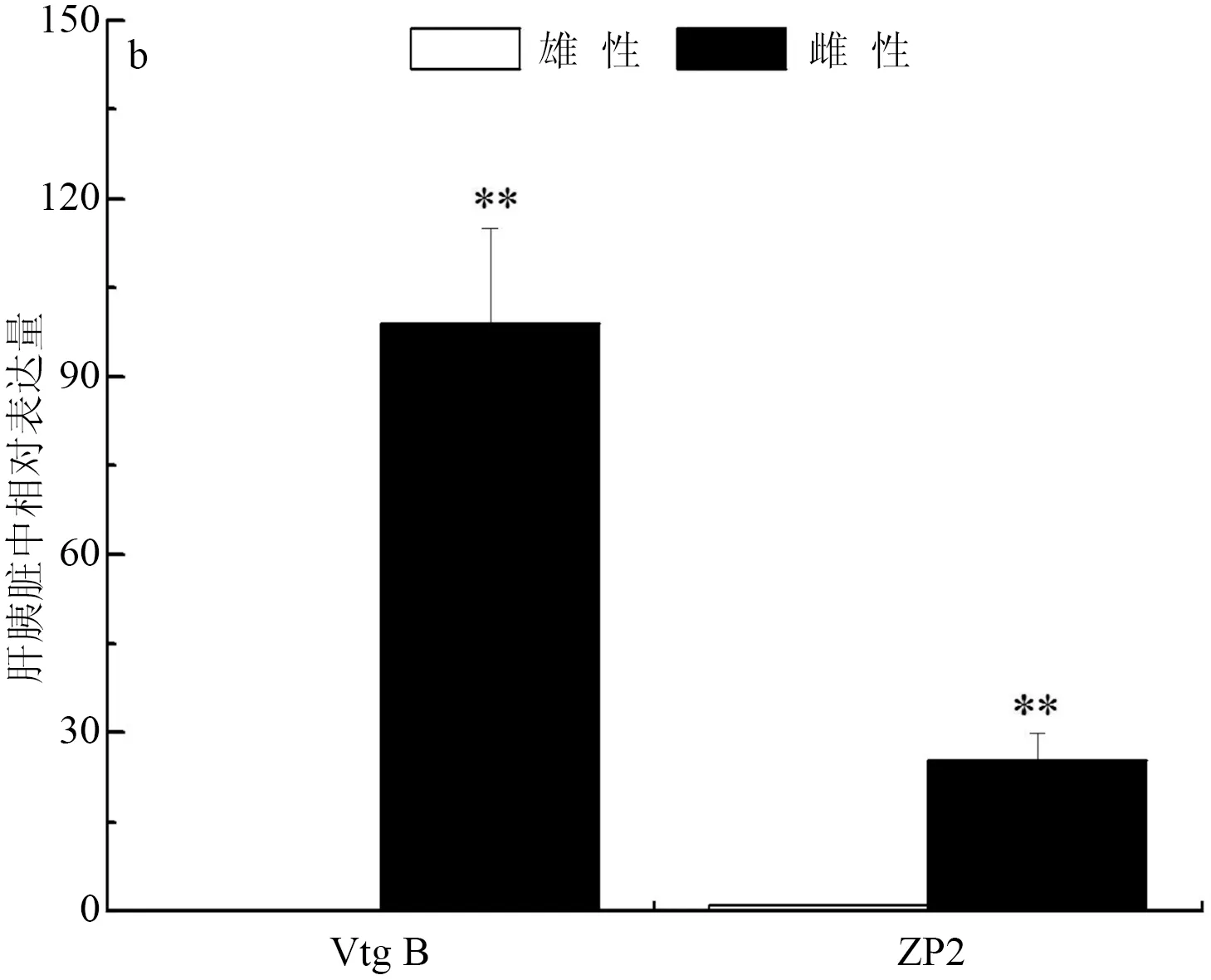
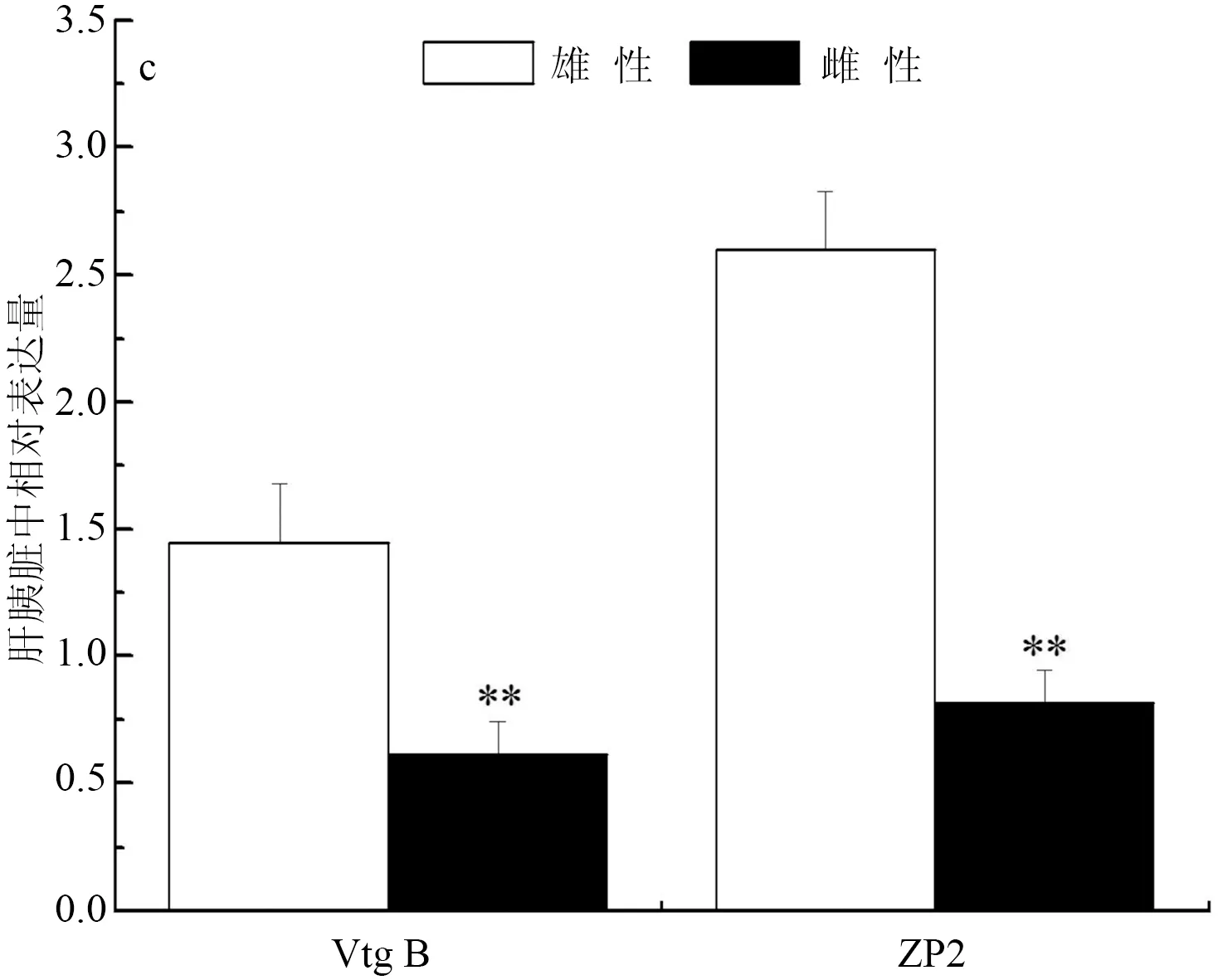
图2 彭泽鲫F1、F2代雌雄鱼肝胰脏中vtgB和ZP2基因表达差异比较
a,实验室养殖F1代; b,池塘养殖F1代; c,实验室养殖F2代.
2.3 彭泽鲫F1、F2代雌雄鱼卵黄蛋白原含量差异
卵黄蛋白原的标准曲线为y=67.574x-6.5429(r2=0.9981),可以用于后续试验的计算。实验室养殖彭泽鲫F1代雄、雌鱼全鱼组织中卵黄蛋白原含量分别为(127.38±23.71) ng/mL,(139.32±20.70) ng/mL,雌鱼卵黄蛋白原含量极显著高于雄鱼中的表达(P<0.01)(图3a)。池塘养殖彭泽鲫F1代精、卵巢组织中卵黄蛋白原含量分别为(140.16±17.26) ng/mL,(130.93±26.03) ng/mL,池塘养殖彭泽鲫F1代卵巢中的卵黄蛋白原含量极显著低于精巢中的表达(P<0.01)(图3b);但是池塘养殖彭泽鲫F1代雄、雌鱼肝胰脏组织中卵黄蛋白原含量分别为(111.44±8.34) ng/mL,(127.19±4.26) ng/mL,雌鱼肝胰脏中卵黄蛋白原含量极显著高于雄鱼中的表达(P<0.01)。实验室养殖彭泽鲫F2代精、卵巢组织中卵黄蛋白原含量分别为(141.51±5.82) ng/mL,(129.57±9.89) ng/mL,彭泽鲫F2代雄、雌鱼肝胰脏组织中卵黄蛋白原含量分别为(144.10±7.93)ng/mL,(111.78±8.46) ng/mL,彭泽鲫F2代雄鱼性腺、肝胰脏组织中卵黄蛋白原含量极显著高于雌鱼中的表达(P<0.01)(图3c)。
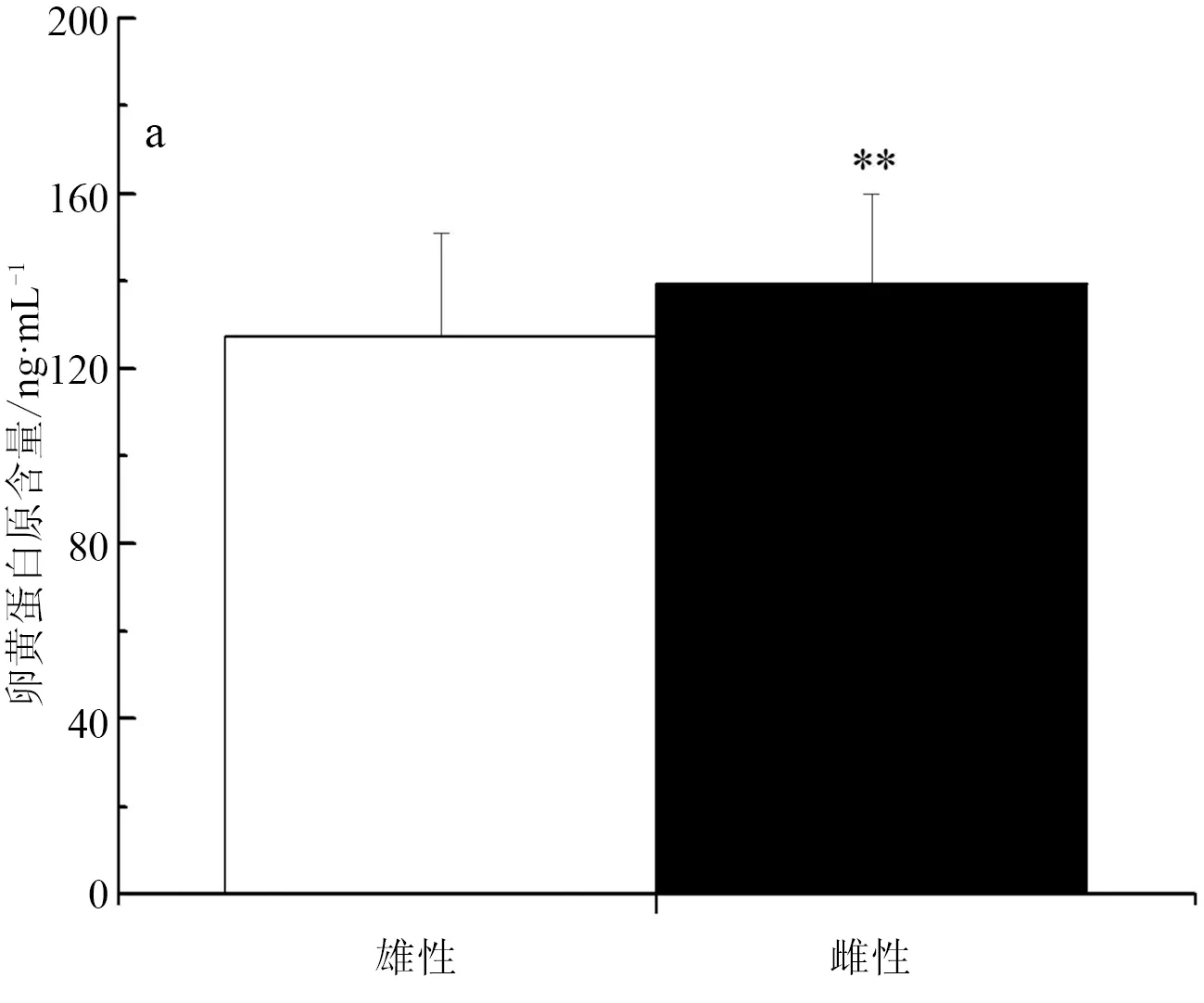
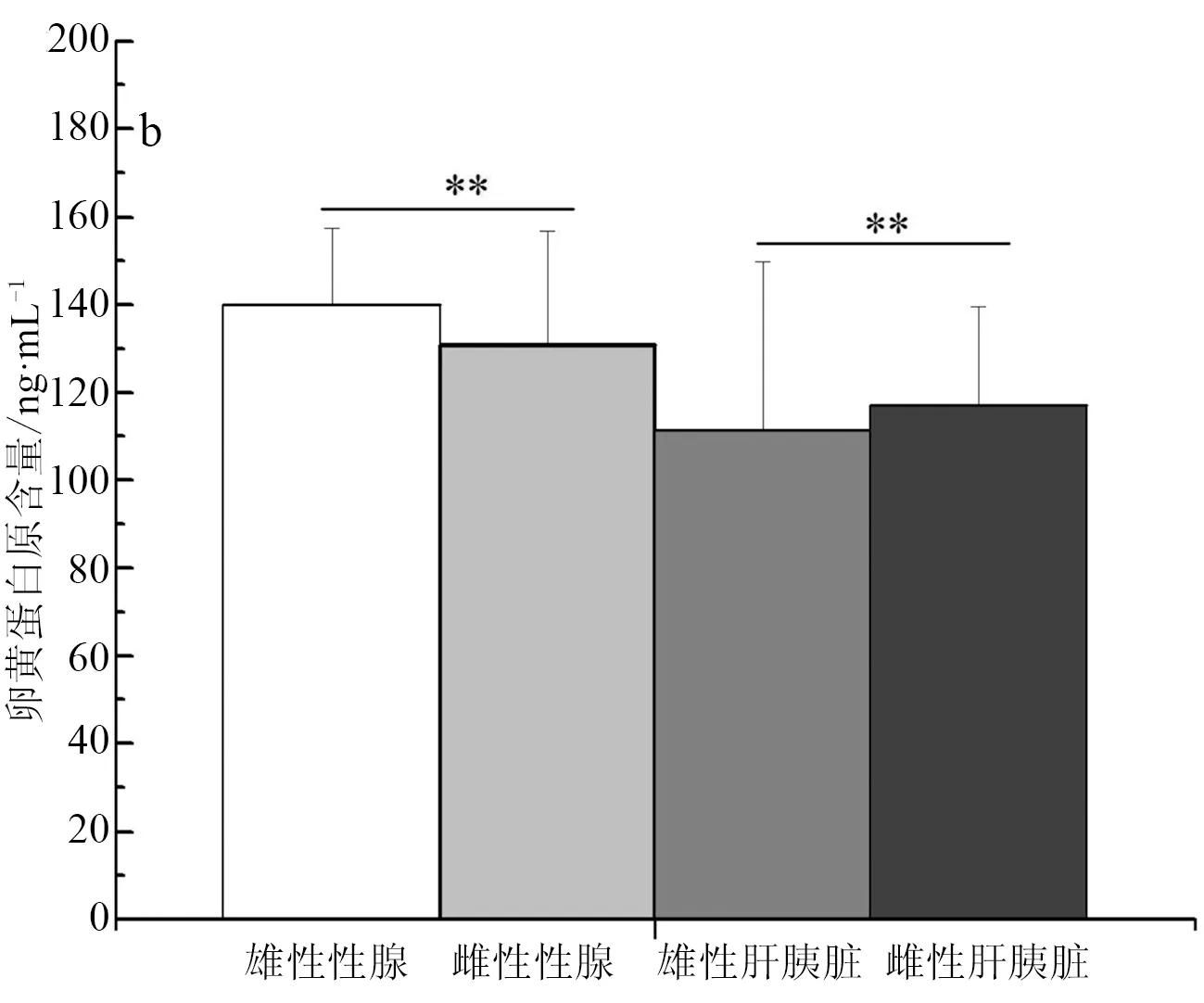
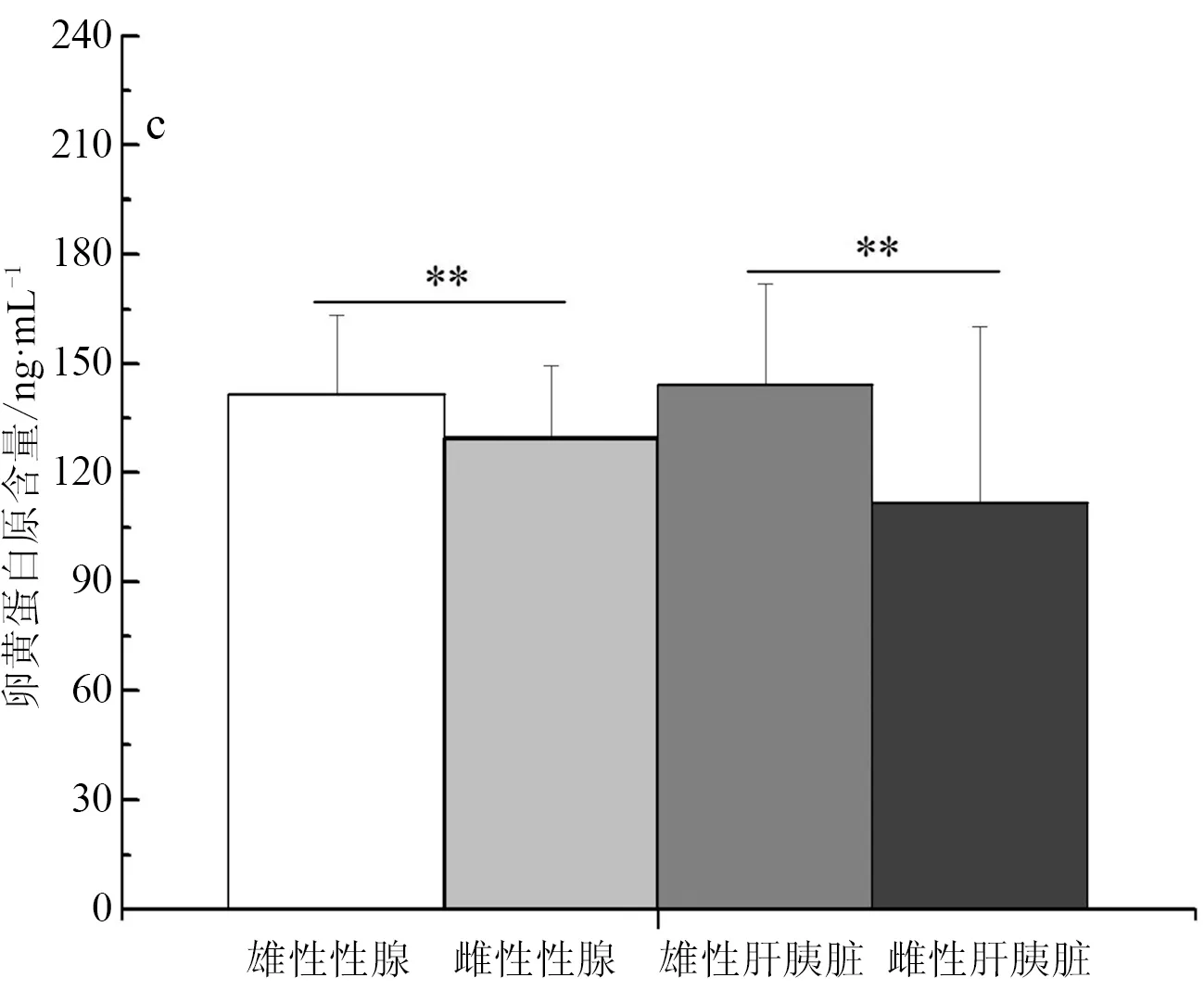
图3 彭泽鲫F1、F2代雌雄鱼卵黄蛋白原含量差异比较
a,实验室养殖F1代全鱼组织; b,池塘养殖F1代性腺、肝胰脏组织; c,实验室养殖F2代性腺、肝胰脏组织.
3 讨 论
Vtg B和ZP2都是在肝胰脏中合成并运送到性腺中发挥作用的[1]。本研究中池塘养殖彭泽鲫F1代雌鱼肝胰脏中的Vtg B和ZP2表达极显著高于雄鱼,与实验室养殖彭泽鲫F1代不同,原因可能在于鱼卵母细胞成熟程度不同,对卵黄蛋白原的需求不同。
实验室养殖彭泽鲫F1代雌鱼全鱼组织和池塘养殖彭泽鲫F1代雌鱼肝胰脏中卵黄蛋白原均极显著高于雄鱼较为容易理解:未发育成熟的雌鱼需要累积卵黄蛋白原为性腺发育提供能量供应[16];池塘养殖雌鱼采集样品时间正好是繁殖季节,肝胰脏中卵黄蛋白原较多可能与产卵有关。但池塘养殖彭泽鲫F1代,实验室养殖彭泽鲫F2代卵巢卵黄蛋白原极显著低于精巢,且彭泽鲫F2代雌鱼肝胰脏卵黄蛋白原极显著低于雄鱼肝胰脏,原因可能在于雄鱼没有像雌鱼一样的卵巢用来储存卵黄蛋白原和透明带蛋白[17],造成了合成的蛋白在肝脏中的积累。本研究中实验室养殖彭泽鲫F1代卵黄蛋白原水平采用全鱼组织,主要是因为鱼太小无法分离组织(<10 g),之前也有研究采用全鱼组织证实全鱼卵黄蛋白原含量和激素相关[18]。除不同发育时期对卵黄蛋白原需求不一致之外,这说明卵黄蛋白原跟血液循环到肝胰脏和性腺中的雌二醇浓度有关[19]。本研究表明彭泽鲫Vtg B和ZP2基因并非雌性特异性表达,且不同的养殖方式、密度影响雌雄鱼Vtg B和ZP2表达及卵黄蛋白原含量。
繁殖彭泽鲫F2代是为了验证密度是否跟雄鱼过多有关,不管是从彭泽鲫F1、F2代性腺、肝胰脏中Vtg B表达还是从卵黄蛋白原水平来看,雄鱼都要高于雌鱼,这说明实验室养殖雄鱼肝胰脏积累较多的卵黄蛋白原导致雄鱼精巢出现异常,肝脏肿大。除雌性卵生动物外,雄性及幼鱼[如斑马鱼、剑尾鱼(Xiphophorushehelleri)、孔雀鱼(Poeciliareticulata)等]肝脏也存在卵黄蛋白原基因,但只有在环境雌激素化学物的作用下才可以产生卵黄蛋白原[1,4,7,10,12-13]。因此,雄鱼或幼鱼经诱导产生的卵黄蛋白原可作为一个敏感的环境雌激素暴露标记物。而卵黄蛋白原的合成将消耗体内一定的能量,因而使原本应该用在性腺发育的能量大部分转向合成卵黄蛋白原,而致使性腺出现明显滞后现象[20]。也有研究表明孔雀鱼雄鱼性腺系数的下降幅度与卵黄蛋白原生成量呈负相关[21]。这些结果均表明体内激素含量可能影响Vtg B和ZP2表达,提示着实验室和池塘养殖的彭泽鲫雌、雄鱼体内激素含量上存在差异,这在之前的研究中得到证实[22]。
[1] Zhang S, Wang S, Li H, et al. Vitellogenin, a multivalent sensor and an antimicrobial effector [J]. Int J Biochem Cell B, 2011, 43(3):303-305.
[2] Skinner S M, Mills T, Kirchick H J, et al. Immunization with zona pellucida proteins results in abnormal ovarian follicular differentiation and inhibition of gonadotropin-induced steroid secretion [J]. Endocrinology, 1984, 115(6):2418-2432.
[3] Modig C, Modesto T, Canario A, et al. Molecular characterization and expression pattern of zona pellucida proteins in gilthead seabream (Sparusaurata) [J]. Biol Reprod, 2006, 75(5):717-725.
[4] Lee C, Jeon S H, Na J G, et al. Sensitivities of mRNA expression of vitellogenin, choriogenin and estrogen receptor by estrogenic chemicals in medaka,Oryziaslatipes[J]. J Health Sci, 2002, 48(5):441-445.
[5] Murata K, Sugiyama H, Yasumasu S, et al. Cloning of cDNA and estrogen-induced hepatic gene expression for choriogenin H, a precursor protein of the fish egg envelope (chorion) [J]. PNAS, 1997, 94(5):2050-2055.
[6] Ueno T, Yasumasu S, Hayashi S, et al. Identification of choriogenin cis-regulatory elements and production of estrogen-inducible, liver specific transgenic medaka [J]. Mech Develop, 2004, 121(7/8):803-815.
[7] Modig C, Raldúa D, Cerdà J, et al. Analysis of vitelline envelope synthesis and composition during early oocyte development in gilthead seabream (Sparusaurata) [J]. Mol Reprod Dev, 2008, 75(8):1351-1360.
[8] Liu X, Wang H, Gong Z. Tandem-repeated zebrafishzp3 genes possess oocyte-specific promoters and are insensitive to estrogen induction [J]. Biol Reprod, 2006, 74(6):1016-1025.
[9] Rotchell J M, Ostrander G K. Molecular markers of endocrine disruption in aquatic organisms [J]. J Toxicol Env Heal B, 2003, 6(5):453-496.
[10] Chikae M, Ikeda R, Hasan Q, et al. Effects of tamoxifen, 17α-ethynylestradiol, flutamide, and methyltestosterone on plasma vitellogenin levels of male and female Japanese medaka (Oryziaslatipes) [J]. Environ Toxicol Pharmacol, 2004,17(1):29-33.
[11] Ann Rempel M, Reyes J, Steinert S, et al. Evaluation of relationships between reproductive metrics, gender and vitellogenin expression in demersal flatfish collected near the municipal wastewater outfall of Orange County, California, USA [J]. Aquat Toxicol, 2006, 77(3):241-249.
[12] 顾海龙,陈彩芳,林志华,等. 水生生物卵黄蛋白原在内分泌干扰物检测中的应用[J]. 宁波大学学报:理工版, 2013,26(2):12-16.
[13] 温茹淑,方展强,陈伟庭. 17β-雌二醇对雄性唐鱼卵黄蛋白原的诱导及性腺发育的影响[J].动物学研究, 2008, 29(1):43-48.
[14] Zheng Y, Wang L, Li M, et al. Molecular characterization of five steroid receptors from pengze crucian carp and their expression profiles of juveniles in response to 17α-ethynylestradiol and 17α-methyltestosterone [J]. Gen Comp Endocrinol, 2013, 191:113-122.
[15] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod [J]. Methods, 2001, 25(4):402-408.
[16] 朱晓鸣,解绶启,崔奕波, 等.摄食水平和性别对稀有鮈鲫生长和能量收支的影响[J]. 海洋与湖沼, 2001, 32(3):240-247.
[17] Mommsen T P, Walsh P J. Metabolic and enzymatic heterogeneity in the liver of the ureogenic teleostOpsanusbeta[J]. J Exp Biol, 1991, 156(1):407-418.
[18] Kroon F J, Munday P L, Pankhurst N W. Steroid hormone levels and bidirectional sex change inGobiodonhistrio[J]. J Fish Biol, 2003, 62(1):153-167.
[19] Heidari B, Roozati S A, Yavari L. Changes in plasma levels of steroid hormones during oocyte development of Caspian kutum (Rutilusfrisiikutum, Kamensky, 1901) [J]. Anim Reprod, 2010, 7(4):373-381.
[20] Länge R, Hutchinson T H, Croudase C P, et al. Effects of the synthetic estrogen 17α-ethynylestradiol on the life-cycle of the fathead minnow (Pimephalespromelas) [J]. Environ Toxicol Chem, 2001, 20(6):1216-1227.
[21] Li M H, Wang Z R. Effect of nonylphenol on plasma vitellogenin of male adult guppies (Poeciliareticulata) [J]. Environ Toxicol, 2005, 20(1):53-59.
[22] 郑尧,张永泉,陈家长, 等. 彭泽鲫F1和F2代雌、雄鱼激素含量及芳香化酶活力差异研究[J]. 南京农业大学学报, 2015, 38(5):864-868.
AnalysisofDifferenceinVtgBandZP2TranscriptsandVtgContentbetweenMaleandFemaleF1andF2OffspringsinPengzeCrucianCarp
ZHENG Yao1, CHEN Jiazhang1, BING Xuwen1, WANG Zaizhao2
( 1.Key Open Laboratory of Ecological Environment and Resources of Inland Fisheries, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences; Key Laboratory of Genetic Breeding and Aquaculture Biology of Freshwater Fishes, Scientific Observing and Experimental Station of Fishery Resources and Environment in the Lower Reaches of the Changjiang River, Ministry of Agriculture, Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214081, China; 2. Shaanxi Key Laboratory of Molecular Biology for Agriculture, College of Animal Science and Technology, Northwest A&F University, Yangling 712100, China )
The offsprings of gynogenic Pengze crucian carp (Carassiusauratusvar. Pengze) (Pcc) is mono-female groups theoretically. The previous studies showed that a high proportion of gynogenic male Pcc fish occurred in F1progenies in laboratory culture compared with pond culture condition, and this phenomenon has been demonstrated in the high density groups of F2progenies later. In the present study, the different gene expression of Vtg B, and ZP2 as female-specific gene and Vtg contents were detected between male and female F1and F2progenies. Results showed that testical Vtg B and ZP2 transcripts of F1progenies were significantly higher than those in ovary under laboratory culture condition; testical Vtg B and ZP2 transcripts of F1progenies were significantly higher, lower than those in ovary under pond culture condition; and testical ZP2 transcript of F2progenies was very significantly higher than those in ovary under laboratory culture condition. Male hepatic Vtg B and ZP2 transcripts of F1progenies were very significantly higher, lower than those in ovary under laboratory culture condition; male hepatic Vtg B and ZP2 transcripts of F1progenies were very significantly lower than those in ovary under pond culture condition; and male hepatic Vtg B and ZP2 transcript of F2progenies was very significantly higher than those in ovary under laboratory culture. Male Vtg content of F1progenies was very significantly lower than those in ovary under laboratory culture; male gonadal and hepatic Vtg content of F1progenies were very significantly higher, lower than those in ovary under pond culture condition respectively; and male gonadal, hepatic Vtg content of F2progenies was very significantly higher than those in ovary under laboratory culture condition. The findings referred that Vtg B and ZP2 were not female-specific, and Vtg B, ZP2 transcripts and Vtg contents have been affected in various culture condition and stocking density.
gynogenic; Pengze crucian carp; vitellogenin; zona pellucida; gene expression
S965.199
A
1003-1111(2016)04-0370-06
10.16378/j.cnki.1003-1111.2016.04.010
2015-09-26;
2016-01-11.
国家自然科学基金资助项目(31270547).
郑尧(1986—), 男, 助理研究员,博士;研究方向:水产品质量安全及分子毒理学. E-mail: zhengy@ffrc.cn.通讯作者:王在照(1969—), 教授, 博士生导师;研究方向:鱼类内分泌干扰物. E-mail: zzwang@nwsuaf.edu.cn.

