温度、盐度和pH对仿刺参体腔细胞活性氧产生的影响
李 明,张 思,张建清,张 峰,翟 钰,卢亚楠
( 1. 大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023;2.青岛市产品质量监督检验研究院,山东 青岛 266101 )
温度、盐度和pH对仿刺参体腔细胞活性氧产生的影响
李 明1,张 思1,张建清1,张 峰1,翟 钰2,卢亚楠1
( 1. 大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023;2.青岛市产品质量监督检验研究院,山东 青岛 266101 )
无脊椎动物主要依靠天然免疫进行自身防御,而活性氧在保护宿主免受病原侵害方面发挥重要作用。本文研究了环境因子温度,盐度和pH对仿刺参体腔细胞吞噬过程中活性氧产生的影响。不同环境条件处理暂养7 d的仿刺参,于不同时间点抽取体腔液,然后用鲁米诺化学发光法检测仿刺参体腔细胞体外吞噬酵母细胞时活性氧的产生。试验结果表明,与对照组相比(17 ℃),6 ℃和26 ℃水温中的仿刺参分别从第1 d和第15 d极大地增加了活性氧的产生。盐度25和盐度35两组仿刺参体腔细胞比对照组吞噬过程产生更多的活性氧,而盐度16和40两组第1 d时活性氧的产生亦显著增强。较低pH同样极大增强了吞噬作用中活性氧的产生。研究结果表明,温度、盐度和pH均可影响仿刺参体腔细胞吞噬过程中活性氧的产生。该试验为进一步研究仿刺参在适应不同环境时的生理生化过程及无脊椎动物免疫机制奠定了基础。
温度;盐度;pH;活性氧;仿刺参
活性氧在无脊椎动物防御病原入侵方面发挥重要作用,其主要包括超氧阴离子,羟自由基和过氧化氢等,正常代谢和环境刺激均可产生[1]。在疾病控制方面,活性氧被认为是一把双刃剑[1]。一方面,研究表明活性氧在免疫应答和细胞凋亡等正常生理过程中发挥重要作用。例如体外刺激虾夷扇贝(Patinopectenyessoensis)变形细胞,可产生大量活性氧来清除非自身物质[2]。另一方面, 活性氧产生异常或调节紊乱又会造成机体的氧化损伤[3-4]。秀丽隐杆线虫(Caenorhabditiselegans)是一种研究衰老及衰老相关疾病的模式无脊椎动物,Labuschagne等[5]以其为研究对象综述了活性氧和氧化损伤的定量方法,有助于进一步理解活性氧引起的衰老和疾病。因此,活性氧的问题早已引起人们的关注。
仿刺参(Apostichopusjaponicus)被认为具有极高的营养价值,已成为中国重要的渔业资源,仿刺参的养殖带来了巨大的经济效益。仿刺参特殊的进化地位对于从比较免疫学角度阐述脊椎动物免疫进化具有重要意义。由于缺少获得性免疫机制,仿刺参等棘皮动物仅仅依靠天然免疫来进行自身防御[6]。其中,伴随着吞噬作用产生的活性氧在防御外源物质侵害的天然免疫中扮演重要角色。活性氧可以引起DNA损伤,脂质过氧化和酶活性丧失来消除外来微生物或颗粒[7]。但是仿刺参的先天性免疫易受水温、盐度和pH等几个环境因子的影响。因此,研究环境与仿刺参活性氧产生的关系对于进一步了解仿刺参等棘皮动物的免疫机制和预防养殖病害具有重要的意义。
笔者以仿刺参为研究对象,研究温度、盐度和pH骤变对仿刺参活性氧产生的影响。为进一步研究仿刺参在适应不同环境时的生理生化过程及免疫机制奠定了基础。
1 材料与方法
1.1 试验材料
1.1.1 试剂
鲁米诺为Sigma 公司产品,硼酸,KOH,HCl,NaOH均为国产分析纯试剂,所用纯水均为双蒸水。
1.1.2 仿刺参
健康仿刺参,平均体质量80 g,购自大连长兴水产品市场,暂养于循环充气水槽(60 cm×50 cm×40 cm)中,日换水1次,定时投喂配合饲料,清理残饵和粪便,试验前暂养7 d。
1.1.3 无菌海水
砂滤盐度29~31的海水,经0.45 μm醋酸纤维素膜抽滤,高压灭菌后置于锥形瓶内保存。
1.1.4 酵母悬液
取仿刺参体腔液于离心管中,4 ℃,5000 r/min离心5 min,留上清液。取100 mg干酵母,用仿刺参体腔上清液调理2 h(室温),离心弃上清液,过滤无菌海水离心洗两次,最后用无菌海水50 mL配成2.0 mg/mL的悬液,密度约108cfu/mL,分装于2 μL离心管中,冷冻贮存备用。
1.1.5 鲁米诺发光液
称取7.8 g氢氧化钾,6.18 g硼酸和0.14 g鲁米诺(5-氨基邻苯二甲基酰肼)粉剂,溶解在79 mL双重蒸馏水中,置于棕色瓶中,冰箱4 ℃保存。使用时将鲁米诺母液用无菌海水稀释10-1倍,即鲁米诺浓度10-3mol/L。
1.2 试验方法
1.2.1 试验组设计
分别设置6、12、17 ℃(对照组)和26 ℃共4个温度梯度;16、25、31(对照组)、35、40共5个盐度梯度(用自来水和海水晶分别将正常海水调整至目的盐度);6.8、7.3、7.9(对照组)、8.4、8.8共5个pH梯度(用NaOH和HCl调整正常海水)。采用条件骤变,将暂养仿刺参直接置于相应梯度设置的海水中。每个梯度组25只仿刺参。试验过程中,每日16:00投喂饵料1次,保证仿刺参饵料充足。每日用吸管清理残饵和粪便,全量换水1次,保持水质。温度和盐度组分别在第1、3、7、15 d和25 d取样,pH组在第1、2、3、4 d和5 d取样。
1.2.2 仿刺参体腔液采集
使用5 mL无菌注射器从仿刺参腹面口端身体1/3处扎入体腔,抽取体腔液约1 mL。为减少个体差异造成的影响,每个试验设置中随机挑选3只仿刺参抽取体腔液,将其混合装入5 mL无菌离心管中。用血球计数板计数,并用无菌海水稀释体腔液到细胞密度106个/mL。
1.2.3 化学发光测定
使用Centro XS3 LB960化学发光仪(德国Berthold Technologies公司),于96孔酶标板中每孔加入100 μL混合体腔液,50 μL酵母悬液,50 μL鲁米诺工作液,室温下反应,每10 min自动生成数值并记录(用相对光单位RLU表示),反应30 min时,记录发光强度并作图。
1.2.4 数据统计
试验数据使用SPSS 17.0统计软件进行统计分析,对每日相关梯度组试验结果进行单因素方差分析。结果均以平均值±标准差表示,用不同字母表示差异显著(P<0.05)。
2 结 果
与对照组相比(17 ℃),试验中温度6 ℃组,仿刺参体腔细胞体外吞噬过程中活性氧的产生显著增强,12 ℃组未受到明显影响,而26 ℃组从第15 d开始吞噬发光现象也明显增强。试验过程中,6 ℃组仿刺参吞噬发光现象逐渐增强,12 ℃组发光现象始终变化不大,26 ℃组第1 d吞噬发光现象增强,随后降低,第7 d达到最低值,而后又逐渐增强(图1)。
不同盐度处理第1 d,盐度40与盐度25及盐度16极大地增加了仿刺参体腔细胞的吞噬发光强度,随后逐渐降低,第12 d时达到最低峰,第25 d时,发光值稍有回升。而盐度35试验的,仿刺参的吞噬发光逐渐增强,第7 d时达到最高峰并保持稳定。整个试验中对照组(盐度31)发光值比较平稳(图2)。
第1 d,与对照组(pH 7.9)相比不同pH均抑制了体腔细胞的吞噬发光。在整个试验过程中偏碱性环境都起到了抑制作用。pH 8.8中的仿刺参吞噬发光现象受到抑制,且发光值逐渐减小,而第4和5 d发光值增大,但始终低于对照组。而较低的pH环境下从第2 d开始,吞噬发光值显著增强(P<0.05)(图3)。
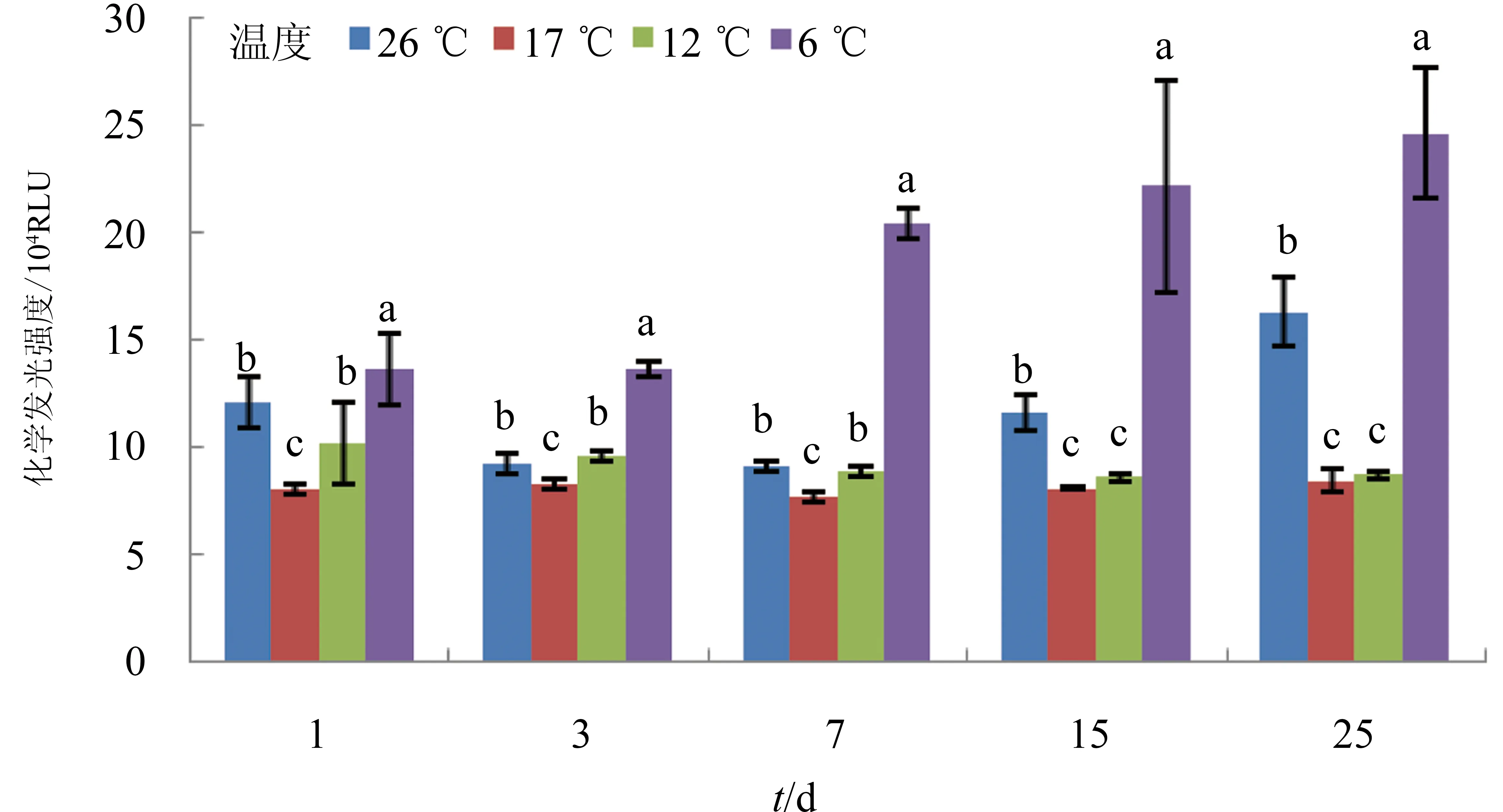
图1 不同温度条件下仿刺参体腔细胞的化学发光强度

图2 不同盐度下仿刺参体腔细胞化学发光强度

图3 不同pH环境下仿刺参体腔细胞的化学发光强度
3 讨 论
与脊椎动物不同,无脊椎动物只能通过非特异的先天性免疫进行自身防御。但是现存动物95%为无脊椎动物,这充分证明了先天性免疫系统的高效性。在无脊椎动物中,棘皮动物的体腔液细胞,尤其是吞噬细胞作为免疫的主要介导者在免疫反应中发挥重要作用。吞噬细胞对外来物质的杀伤和清除主要有两种机制:一是释放溶酶体酶和溶细胞因子,二是呼吸爆发产生活性氧自由基。因此,吞噬过程中产生的活性氧水平就成了衡量无脊椎动物免疫水平的重要指标。Allen于1972年首先发现吞噬细胞吞噬过程中的化学发光现象,就此开创了化学发光法简便快速的探测吞噬发光的新局面。加入酵母诱导剂后,皱纹盘鲍(Haliotisdiscushannai)血细胞出现化学发光现象(即检测活性氧),并在30 min左右出现一个峰值,随后降低,体现了整个吞噬过程[8]。本试验中酵母诱导仿刺参体腔细胞产生发光现象,同样在30 min处达到峰值。峰值主要反映体腔细胞的氧化杀菌能力,体现吞噬功能[9]。因此,本研究检测并记录各试验组加入酵母诱导30 min时,仿刺参体腔细胞的发光强度。
水温通常会刺激水生无脊椎动物产生免疫应答[10],例如无脊椎动物的双壳类[11]。近年来由于温度在调节生理过程和细胞中大分子物质结构完整性方面的作用被发现,其重要性再度成为人们关注的焦点[12]。盐度也是水生无脊椎动物中一个非常重要的环境因子,影响无脊椎动物渗透压调节。盐度对仿刺参免疫功能呼吸及排泄等方面的影响国内外已有报道,如盐度对仿刺参的呼吸代谢、营养需求、渗透调节、免疫力和抗逆性等方面的影响[13-15]。龚海滨等[16]的试验表明,仿刺参的盐度耐受范围为15~40,吕伟志等[17]发现在盐度为16的海水中仿刺参可生存30 d。近岸海水的pH值极易受到其他因素影响而波动,如淡水输入、酸雨、工业污染和浮游植物代谢。pH波动影响无脊椎动物生理生化过程和免疫反应。水生生物的正常生长繁殖pH一般为6.5~8.2之间[18]。仿刺参的适宜pH范围通常为7.8~8.7之间[19]。当pH值低于6.0或高于9.0时,仿刺参收缩呈球状濒于死亡。预试验中pH 8.8时第3 d出现化皮,第8 d时化皮数量达到一半。温度、盐度和pH等环境因子均可以影响无脊椎动物的免疫细胞活性和生理过程[20-23],对于水生无脊椎动物的生长和存活作用更强[24]。然而温度、盐度和pH等环境因子对仿刺参体腔细胞吞噬过程中活性氧产生的影响研究鲜有报道。本文基于所参考文献及预试验中的结果设计试验梯度进行试验。
3.1 温度对仿刺参体腔细胞活性氧产生的影响
Coteur等[22]发现无论在实验室还是在野外,水温均可影响海星活性氧的产生,与相对温度较高条件下的海星相比,低于6 ℃海水中的海星所产生的活性氧显著增加。本试验中,6 ℃试验的的仿刺参吞噬发光值同样显著提高并且在试验期间逐渐增强。低温下海水中的溶解氧饱和度明显提高,更有利于活性氧的产生[25],同时低温刺激仿刺参产生免疫反应可能是吞噬发光逐渐增强的主要原因。12 ℃组,试验第1 d温度骤变增强了仿刺参吞噬发光现象,随后逐渐恢复到正常水平,表明在一定温度变化范围内,活性氧的产生比较稳定。与对照组(17 ℃)相比,温度26 ℃组第15 d和25 d,仿刺参体腔细胞吞噬发光现象也有增强,此温度可能导致仿刺参进入夏眠[26],而这一过程中相关抗氧化酶活性也显著增加[27],可能与活性氧的产生能力增强有关。
3.2 盐度对仿刺参体腔细胞活性氧产生的影响
本试验表明,处于盐度40试验组,第12 d和25 d仿刺参吞噬过程中活性氧的产生受到抑制。这与Coteur等[22]发现的海星活性氧的产生随着盐度升高而减少的结果一致。然而盐度骤变到40、25和16时导致仿刺参渗透压失衡,生理平衡受到影响,可能是第1 d活性氧增多的主要原因。试验中,盐度25试验组中的仿刺参第1 d吞噬发光现象显著增强,其后逐渐降低最后基本与对照组达到一致水平,表明仿刺参对海水盐度小幅变化有一定的适应能力。盐度35试验组,吞噬发光现象逐步稳定增强,表明一定范围内提高盐度可能有利于仿刺参清除入侵外来物质,增强免疫反应。盐度16试验组中的仿刺参,24 h后吞噬发光现象显著增强,其后吞噬发光现象出现波动,可能是较强的盐度胁迫导致仿刺参渗透压严重失衡,体腔液及细胞内稳态被破坏,能量消耗过度,吞噬细胞的功能受到抑制[28]。
3.3 pH对仿刺参体腔细胞活性氧产生的影响
第1 d,pH骤变抑制了仿刺参体腔细胞吞噬过程中活性氧的产生,可能是剧烈变化的pH影响了体腔液的酸碱度从而增强了体腔液内部抗氧化酶的活性[31],清除了部分活性氧。低pH随后几天极大的促进体腔细胞吞噬过程中活性氧的产生。然而pH胁迫中国明对虾(Fenneropenaeuschinensis)24 h后抑制了其抗氧化系统的功能[29],本试验中,低pH可能会造成仿刺参的氧化损伤。pH 8.8中的仿刺参受到碱性环境胁迫,抑制了吞噬过程,吞噬发光值逐渐降低,然而第4 d和5 d又有所回升,可能是存活的仿刺参适应了环境。
活性氧的产生对仿刺参防御病害至关重要,然而过多的活性氧对机体自身也会造成损伤,吞噬过程活性氧产生减少又不利于抵抗外源物质的侵害。试验结果表明,环境因子温度、盐度和pH对仿刺参体腔细胞吞噬过程中活性氧的产生影响很大,但具体影响机制还有待深入研究。本文为进一步研究仿刺参在适应不同环境时的生理生化过程及免疫机制奠定了基础。
[1] Seifried H E, Anderson D E, Fisher E I, et al. A review of the interaction among dietary antioxidants and reactive oxygen species [J]. J Nutr Biochem, 2007, 18(9):567-579.
[2] Nakamura M, Mori K, Inooka S, et al. In vitro production of hydrogen peroxide by the amoebocytes of the scallop,Patinopectenyessoensis(Jay) [J]. Dev Comp Immunol, 1985, 9(3):407-417.
[3] Harman D. Aging: a theory based on free radical and radiation chemistry [J]. J Gerontol, 1956, 11(3):298-300.
[4] Kumaran S, Panneerselvam K S, Shila S, et al. Age-associated deficit of mitochondrial oxidative phosphorylation in skeletal muscle: role of carnitine and lipoic acid [J]. Mol Cell Biochem, 2005, 280(1/2):83-89.
[5] Labuschagne C F, Brenkman A B. Current methods in quantifying ROS and oxidative damage inCaenorhabditiselegansand other model organism of aging [J]. Ageing Research Reviews, 2013, 12(4):918-930.
[6] Glinski Z, Jarosz J. Immune phenomena in echinoderms [J]. Arch Immunol Ther Exp (Warsz), 2000, 48(3):189-193.
[7] Buechter D D. Free radicals and oxygen toxicity [J]. Pharm Res, 1988, 5(5):253-260.
[8] 张峰, 李光友. 皱纹盘鲍血细胞吞噬发光的研究 [J]. 海洋与湖沼, 2000, 31(4):386-391.
[9] 张强, 林立, 曾晓立, 等. 苯作业工人白细胞形态与吞噬发光功能的改变及其意义 [J]. 工业卫生与职业病, 2001, 27(2):80-82.
[10] Carballal M J, Villalba A, Lopez C. Seasonal variation and effects of age, food availability, size, gonadal development, and parasitism on the hemogram ofMytilusgalloprovincialis[J]. J Invertebr Pathol, 1998, 72(3):304-312.
[11] Leah M O W S F. Appraisal of prospective bivalve immunomarkers [J]. Biomarkers, 1999, 4(6):510-530.
[12] Hochachka P W, Somero G N. Biochemical adaptation:mechanism and process in physiological evolution [M]. New York:Oxford University Press, 2002.
[13] Asha P S, Muthiah P. Effects of temperature, salinity and pH on larval growth, survival and development of the sea cucumberHolothuriaspiniferaTheel [J]. Aquaculture, 2005, 250(3):823-829.
[14] Trotter J A, Salgado J P, Koob T J. Mineral content and salt-dependent viscosity in the dermis of the sea cucumberCucumariafrondosa[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1997, 116(4):329-335.
[15] Dong Y, Dong S, Meng X. Effects of thermal and osmotic stress on growth, osmoregulation and Hsp70 in sea cucumber (ApostichopusjaponicusSelenka) [J]. Aquaculture, 2008, 276(1/4):179-186.
[16] 龚海滨, 王耀兵, 邓欢, 等. 仿刺参对盐度的耐受能力研究 [J]. 水产科学, 2009, 28(5):284-286.
[17] 吕伟志, 戴晓军, 李东站. 刺参养殖技术之一:低盐度海水池塘养殖刺参技术探讨 [J]. 中国水产, 2006(1):42-43.
[18] 王国利. 生态因子对刺参(Apostichopusjaponicus)生长与行为的影响 [D].曲阜:山东师范大学, 2007.
[19] 郭成秀, 张士华, 刘志国. 黄河三角洲地区刺参养殖池塘pH值的作用及调节措施 [J]. 齐鲁渔业, 2010, 27(1):23.
[20] Brockton V, Smith V J. Crustin expression following bacterial injection and temperature change in the shore crab,Carcinusmaenas[J]. Dev Comp Immunol, 2008, 32(9):1027-1033.
[21] Volety A K. Effects of salinity, heavy metals and pesticides on health and physiology of oysters in the Caloosahatchee Estuary, Florida [J]. Ecotoxicology, 2008, 17(7):579-590.
[22] Coteur G, Danis B, Dubois P. Echinoderm reactive oxygen species (ROS) production measured by peroxidase, luminol-enhanced chemiluminescence (PLCL) as an immunotoxicological tool [J]. Prog Mol Subcell Biol, 2005(39):71-83.
[23] Dorey N, Lancon P, Thorndyke M, et al. Assessing physiological tipping point of sea urchin larvae exposed to a broad range of pH [J]. Glob Chang Biol, 2013, 19(11):3355-3367.
[24] Wang F, Yang H, Gao F, et al. Effects of acute temperature or salinity stress on the immune response in sea cucumber,Apostichopusjaponicus[J]. Comp Biochem Physiol A Mol Integr Physiol, 2008, 151(4):491-498.
[25] Regoli F, Nigro M, Bompadre S, et al. Total oxidant scavenging capacity (TOSC) of microsomal and cytosolic fractions from Antarctic, Arctic and Mediterranean scallops:differentiation between three potent oxidants [J]. Aquat Toxicol, 2000, 49(1/2):13-25.
[26] 李霞, 王霞. 仿刺参在实验性夏眠过程中消化道和呼吸树的组织学变化 [J]. 大连水产学院学报, 2007, 22(2):81-85.
[27] Wang F, Yang H, Gabr H R, et al. Immune condition ofApostichopusjaponicusduring aestivation [J]. Aquaculture, 2008, 285(1/4):238-243.
[28] 董晓亮, 李成林, 赵斌, 等. 低盐胁迫对刺参非特异性免疫酶活性及抗菌活力的影响 [J]. 渔业科学进展, 2013, 34(3):82-87.
[29] 王芸. pH、氨氮胁迫对中国对虾细胞凋亡和抗氧化系统影响机理的研究 [D].上海:上海海洋大学, 2011.
EffectsofWaterTemperature,SalinityandpHonProductionofROSbyCoelomocytesofSeaCucumber(Apostichopusjaponicus)
LI Ming1, ZHANG Si1, ZHANG Jianqing1, ZHANG Feng1, ZHAI Yu2, LU Yanan1
( 1. Key Laboratory of Mariculture & Stock Enhancement in North China′s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China; 2. Qingdao Products Quality Supervision and Inspection Institute, Qingdao 266101, China )
Reactive oxygen species (ROS) play important roles in protection of host from pathogen in invertebrates which rely heavily on innate immune mechanisms to defence themselves. Here, the effects of environmental factors such as water temperature, salinity and pH on production of ROS by coelomocytes were studied in sea cucumberApostichopusjaponicusmaintained under different environmental conditions. Coelomic fluid was extracted at different time points and then ROS production during in vitro phagocytosis of yeast cells by coelomocytes was measured 7 d after being acclimatization by the luminol chemiluminescence method. The results showed that the ROS production in sea cucumbers held in 6 ℃ and 26 ℃ was dramatically increased from the first day and the fifth day compared with the control group (17 ℃). There were in much more ROS in coelomocytes of the sea cucumbers cultured at salinity of 25 and 35 generations than in the control group, while the same went for sea cucumbers kept at salinity of 16 and 40 on the first day. Low pH also led to dramatically enhancement of the production of ROS during phagocytosis. In conclusion, water temperature, salinity and pH can influenced the production of ROS by the coelomocytes of sea cucumber during phagocytosis. Which lays a foundation for the further study of the physiological and biochemical processes of adaptation of sea cucumber to different environments as well as the innate immune mechanisms in invertebrates.
temperature; salinity; pH; ROS; sea cucumber
S968.9
A
1003-1111(2016)04-0346-06
10.16378/j.cnki.1003-1111.2016.04.006
2015-12-14;
2016-02-29.
国家自然科学基金资助项目(30471323);辽宁省教育厅一般项目(L2013278).
李明(1986—),男,硕士研究生;研究方向:海参免疫. E-mail:153835691@qq.com. 通信作者:卢亚楠(1977—),女,实验师,博士;研究方向:水产动物免疫学. E-mail: luyanan@dlou.edu.cn.

