原发性干燥综合征伴间质性肺病患者血清NF-κB和TGF-β1水平及其临床意义的研究*
白淑荣,王 艳,杨 静,杨 朝,李 萍,段学波
(宁夏回族自治区人民医院/西北民族大学第一附属医院呼吸内科,银川 750002)
论著·临床研究
原发性干燥综合征伴间质性肺病患者血清NF-κB和TGF-β1水平及其临床意义的研究*
白淑荣,王 艳,杨 静,杨 朝,李 萍,段学波
(宁夏回族自治区人民医院/西北民族大学第一附属医院呼吸内科,银川 750002)
目的 探讨原发性干燥综合征(PSS)伴间质性肺病(ILD)患者血清中核因子-κB(NF-κB)和转化生长因子-β1(TGF-β1)水平及其临床意义。方法 以该院2012年1月至2015年10月收治的82例PSS患者为研究对象,其中,单纯涎腺和(或)泪腺受累PSS患者39例(单纯PSS组),仅伴肺间质损害PSS患者43例(PSS+ILD组),以该院同期健康体检者31例为对照组,收集各组外周血标本检测分析NF-κB和TGF-β1水平和PSS相关生化指标。结果 各组血清NF-κB水平差异有统计学意义(P<0.05),其中,PSS+ILD组(70.49±25.64)ng/mL高于单纯PSS组(43.71±18.62)ng/mL和对照组(20.35±9.69)ng/mL(P<0.05),单纯PSS组高于对照组(P<0.05);各组血清TGF-β1水平差异有统计学意义(P<0.05),其中,PSS+ILD组(37.43±10.68)μg/L高于单纯PSS组(18.52±6.32)μg/L(P<0.05),而PSS+ILD组和单纯PSS组均低于对照组(49.61±15.19)μg/L(P<0.05)。结论 NF-κB和TGF-β1水平变化在PSS伴间质性肺病的发生、发展中起着重要作用。
原发性干燥综合征;间质性肺病;核因子-κB;转化生长因子-β1
原发性干燥综合征(primary Sjogren′s syndrome,PSS)是一种常见的慢性自身免疫性疾病,其靶器官除可累及涎腺、泪腺外,如甲状腺、肺脏、肝胆系统、血液系统、肾脏和神经系统等均可受累。研究表明,核因子-κB(NF-κB)和转化生长因子-β1(TGF-β1)在PSS发病过程中具有重要意义[1-2]。本研究主要分析PSS伴间质性肺病间质性肺病(interstitial lung disease,ILD)患者血清NF-κB和TGF-β1水平及其他临床指标的相关性,探讨NF-κB和TGF-β1水平在PSS伴ILD中的临床意义。
1 资料与方法
1.1 一般资料 以本院2012年1月至2015年10月收治的82例PSS患者为研究对象,其中,单纯涎腺和(或)泪腺受累PSS患者39例(单纯PSS组),仅伴肺间质损害PSS患者43例(PSS+ILD组)。纳入标准:符合中华医学会风湿病学分会制订的干燥综合征诊断及治疗指南(2010年)[3],所有患者均为初治,未接受过免疫抑制剂和糖皮质激素等其他药物治疗,伴间质性肺病患者不同时伴有血液系统、肝胆系统、肾脏等其他系统受累。ILD判断标准:肺高分辨率CT(HRCT)提示以下3项中任何情况,(1)肺网状结节斑片状影;(2)蜂窝状改变;(3)磨玻璃影,即可诊断为ILD。排除标准:不符合上述PSS诊断及治疗指南,接受过糖皮质激素和免疫抑制剂等其他药物治疗的患者。82例患者均为女性,单纯PSS组39例,年龄31~64岁,平均(50.35±9.42)岁;PSS+ILD组43例,年龄33~66岁,平均(51.08±10.30)岁;以本院同期健康体检者31例为对照组,对照组31例均为女性,年龄30~65岁,平均(49.90±9.21)岁,各组在年龄上差异无统计学意义(P>0.05),具有可比性。

表1 两组病程、CRP、免疫球蛋白和相关抗体比较
1.2 方法 酶联免疫吸附测定(ELISA)检测NF-κB和TGF-β1水平,严格按试剂盒说明书操作(试剂盒来自美国Santa Cruz 公司),分别测定各组外周血清NF-κB和TGF-β1的水平,酶标仪于450nm处读吸光度值,依据标准曲线计算NF-κB和TGF-β1浓度。记录所有患者的年龄、病程、C反应蛋白(CRP)、免疫球蛋白(Ig)A、IgG、IgM水平、相关抗体等指标。
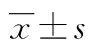
2 结 果
2.1 患者一般病程、CRP、免疫球蛋白和相关抗体的比较 单纯PSS组、PSS+ILD组之间各指标差异均无统计学意义(P>0.05),见表1。
2.2 各组血清NF-κB和TGF-β1水平比较 各组血清NF-κB水平差异有统计学意义(P<0.05),其中,PSS+ILD组高于单纯PSS组和对照组(P<0.05),单纯PSS组高于对照组(P<0.05);各组血清TGF-β1水平差异有统计学意义(P<0.05),其中,PSS+ILD组高于单纯PSS组(P<0.05),而PSS+ILD组和单纯PSS组均低于对照组(P<0.05),见表2。
2.3 血清NF-κB和TGF-β1水平与PSS相关指标的相关性分析 Pearson相关分析提示PSS患者(包括PSS+ILD组和单纯PSS组)血清NF-κB和TGF-β1水平与病程、CRP、IgA、IgG、IgM各指标间均无相关性(P>0.05),见表3。
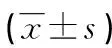
表2 各组血清NF-κB和TGF-β1水平比较
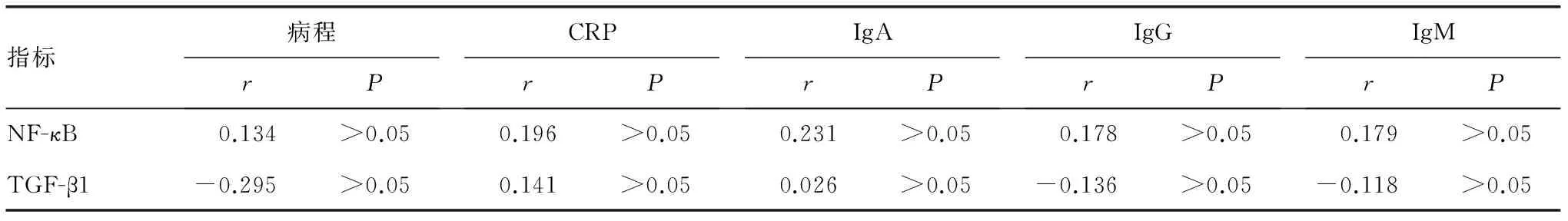
表3 PSS相关指标与比较血清NF-κB和TGF-β1水平相关性分析
3 讨 论
ILD是PSS常见的并发症之一,也是其重要的死亡原因之一,其发病机制可能与多种炎性因子的释放导致肺泡炎症有关,而炎症因子又可促进成纤维细胞增生及细胞外基质的合成,促进肺纤维化的发生、发展。大部分PSS合并ILD者起病较隐匿,在病程早期往往无明显临床症状和体征而被忽略,晚期可出现肺纤维化,因感染或呼吸衰竭而死亡。因此,PSS合并ILD早期诊断和积极治疗对改变病情和预后有着重要的意义[4]。
NF-κB是调控基因表达的DNA结合蛋白,具有多向性转录调节作用,通过调控重要的细胞因子、黏附分子及趋化因子的表达,参与机体的多种病理生理过程,包括免疫应答、炎症反应和细胞分化等。NF-κB信号途径的激活在PSS的病理生理过程中发挥着重要的作用,通过抑制NF-κB信号通路可有效地治疗PSS[5]。NF-κB通路活化可能在成纤维细胞向肌成纤维细胞表型转化中发挥关键作用[6],因此与肺间质纤维化的发生、发展关系密切,阻断NF-κB通路活化可能是治疗肺间质纤维化的重要手段[7]。本研究中各组血清NF-κB水平差异有统计学意义(P<0.05),其中PSS+ILD组高于单纯PSS组和对照组,单纯PSS组高于对照组,提示NF-κB在PSS继发ILD变过程中可能发挥着重要的作用。
TGF-β1是一种负性免疫调节因子,作用于免疫系统的各个环节,如抑制多种免疫细胞的分化及细胞因子的生成,抑制B细胞分泌IgG、IgM,抑制抗原递呈细胞表面MHC Ⅰ类和Ⅱ类分子的表达等[8]。体外研究发现TGF-β1可抑制T、B淋巴细胞的增殖分化,TGF-β1水平降低促使淋巴细胞激活,导致致敏T细胞及多种自身抗体的产生,从而发生自身免疫性疾病[9]。小鼠敲除TGF-β1基因后的症状与人干燥综合征类似,出现多脏器炎性细胞浸润,外周血可检测到抗dsDNA、抗ssDNA和其他抗核抗体等[10]。因此,TGF-β1的免疫抑制功能在自身免疫疾病的发病中起到一定作用。TGF-β1在弥漫性肺泡损害、肺泡内皮细胞坏死和肺纤维化的发生、发展中发挥着关键作用,TGF-β1水平在各种动物模型及临床纤维化疾病中常持续上升,可促进成纤维细胞分裂增殖并趋向成熟分化,刺激成纤维细胞合成大量的Ⅰ、Ⅱ、Ⅳ型胶原蛋白,从而导致肺间质病变形成[11-15]。磷酸化的Smad2介导的TGF-β信号可诱导成纤维细胞增殖、分化为肌成纤维细胞,肌成纤维细胞能产生大量基质蛋白成分并分泌到细胞外基质中,如胶原蛋白等在TGF-β的刺激下合成增多并促使其在细胞外基质中沉积,加速肺纤维化的发展,而PSS等风湿类疾病存在TGF-β/Smad信号通路的激活。本研究中各组血清TGF-β1水平差异有统计学意义(P<0.05),其中PSS+ILD组高于单纯PSS组,而PSS+ILD组和单纯PSS组均低于对照组,提示TGF-β1水平的降低在PSS的发生、发展中起着重要作用,而TGF-β1与肺纤维化的发生密切相关,因此, PSS+ILD组TGF-β1水平比单纯PSS组高,但仍低于对照组。本研究中,PSS患者血清NF-κB和TGF-β1水平与病程、CRP、IgA、IgG、IgM各指标间均无相关性,提示二者与PSS相关指标间无明显相关性。
综上所述,NF-kB和TGF-β1水平的变化在PSS伴肺间质病变过程中发挥重要作用,监测二者的水平变化可能对PSS伴间质性肺病的诊断具有重要的意义,但二者变化与PSS伴间质性肺病的病情严重程度的相关性还有待于更进一步研究。
[1]Nordmark G,Wang C,Vasaitis L,et al.Association of genes in the NF-κB pathway with antibody-positive primary Sjogren′s syndrome[J].Scand J Immunol,2013,78(5):447-454.
[2]Zhang L,Mo H,Zhu M,et al.Effect of cyclophosphamide on cytokines in patients with primary Sjogren′s syndrome-associated interstitial lung disease in South China[J].Rheumatol Int,2013,33(6):1403-1407.
[3]中华医学会风湿病学分会.干燥综合征诊断及治疗指南[J].中华风湿病学杂志,2010,14(11):766-772.
[4]石宇红,周润华,莫汉有,等.145例原发性干燥综合征肺间质病变的危险因素分析[J].重庆医学,2012,41(11):1111-1113.
[5]Chen W,Lin J,Cao H,et al.Local and systemic IKKε and NF-κB signaling associated with sjogren′s syndrome immunopathogenesis[J].J Immunol Res,2015(2015):534648.
[6]Krug LT,Torres-González E,Qin Q,et al.Inhibition of NF-κB signaling reduces virus load and gammaherpesvirus-induced pulmonary fibrosis[J].Am J Pathol,2010,177(2):608-621.
[7]Zong C,Zhang X,Xie Y,et al.Transforming growth factor-β inhibits IQ motif containing guanosine triphosphatase activating protein 1expression in lung fibroblasts via the nuclear factor-κB signaling pathway[J].Mol Med Rep,2015,12(1):442-448.
[8]Kawanami T,Sawaki T,Sakai T,et al.Skewed production of IL-6and TGFβ by cultured salivary gland epithelial cells from patients with Sjogren′s syndrome[J].PLoS One,2012,7(10):e45689.
[9]Hall BE,Zheng C,Swaim WD,et al.Conditional overexpression of TGF-beta1disrupts mouse salivary gland development and function[J].Lab Invest,2010,90(4):543-555.
[10]Mieliauskaite D,Venalis P,Dumalakiene I,et al.Relationship between serum levels of TGF-beta1and clinical parameters in patients with rheumatoid arthritis and Sjogren′s syndrome secondary to rheumatoid arthritis[J].Autoimmunity,2009,42(4):356-358.
[11]张晓,林莉,张光峰.肿瘤坏死因子及转化生长因子在肺间质病变发病机制中的作用[J].中华风湿病杂志,2010(14):13-16.
[12]Zhang G,Xu T,Zhang H,et al.Randomized control multi-center clinical study of mycophenolate mofetil and cyclophosphamide in the treatment of connective tissue disease related interstitial lung disease[J].Zhonghua Yi Xue Za Zhi,2015,95(45):3641-3645.
[13]Calisti R.Interstitial lung disease in a female worker sensitized to epoxy resins:a case report submitted for discussion[J].Med Lav,2016,107(1):71-73.
[14]Chartrand S,Swigris JJ,Peykova L,et al.Rituximab for the treatment of connective tissue disease-associated interstitial lung disease[J].Sarcoidosis Vasc Diffuse Lung Dis,2016,32(4):296-304.
[15]Salvatore M,Henschke CI,Yip R,et al.JOURNAL CLUB:evidence of interstitial lung disease on Low-Dose chest CT images:prevalence,patterns,and progression[J].AJR Am J Roentgenol,2016,206(3):487-494.
The level and clinical significance of NF-κB and TGF-β1in primary Sjogren′s syndrome patients with interstitial lung disease*
Bai Shurong,Wang Yan,Yang Jing,Yang Zhao,Li Ping,Duan Xuebo
(Department of Respiratory Medicine,Ningxia Hui Autonomous Region People′s Hospital/the FirstAffiliated Hospital of Northwest University for Nationalities,Yingchuan,Ningxia 750002,China)
Objective To explore the levels of NF-κB and TGF-β1and clinical significance in primary Sjogren′s syndrome (PSS) patients with interstitial lung disease (ILD).Methods Totally 82cases with PSS were collected from January 2012to October 2015in our hospital for the study,in which 39patients with only lacriminal and/or salivary gland involvement(PSS group),43patients with ILD involvement(PSS+ILD group),31cases of healthy people were colleted as the control group,peripheral blood samples were collected and analyzed,NF-κB and TGF-β1levels and PSS biochemical indexes were detected.Results The difference of NF-κB was statistically significant in different groups(P<0.05),which in PSS+ILD group (70.49±25.64)ng/mL was significantly higher than PSS group (43.71±18.62)ng/mL and the control group (20.35±9.69)ng/mL(P<0.05),PSS group was significantly higher than the control group (P<0.05).The difference of TGF-β1was statistically significant in different groups(P<0.05),which in PSS+ILD group (37.43±10.68)μg/L was significantly higher than PSS group (18.52±6.32)μg/L(P<0.05),PSS+ILD group and the PSS group were significantly lower than the control group (49.61±15.19)μg/L(P<0.05).Conclusion NF-κB and TGF-β1levels plays an important role in PSS patients with interstitial lung disease.
primary Sjogren′s syndrome;interstitial lung disease;NF-κB;TGF-β1
10.3969/j.issn.1671-8348.2016.29.008
宁夏自然科学基金资助项目(NZ15184)。 作者简介:白淑荣(1973-),副主任医师,硕士,主要从事间质性肺疾病研究。
R563.9
A
1671-8348(2016)29-4056-03
2016-02-25
2016-04-14)

