消银汤对寻常型银屑病血热证疗效及对外周血Th17细胞相关细胞因子表达水平的影响*
宋红霞,薛晓东
(1.重庆三峡医药高等专科学校药理教研室,重庆 404000;2.重庆三峡医药高等专科学校附属医院皮肤科,重庆 404000)
·经验交流·
消银汤对寻常型银屑病血热证疗效及对外周血Th17细胞相关细胞因子表达水平的影响*
宋红霞1,薛晓东2△
(1.重庆三峡医药高等专科学校药理教研室,重庆 404000;2.重庆三峡医药高等专科学校附属医院皮肤科,重庆 404000)
目的 探讨消银汤治疗寻常型银屑病血热证疗效和对外周血白细胞介素(IL)-17、IL-22、IL-23表达水平的影响。方法 将105例寻常型银屑病血热证患者分为治疗组和对照组,治疗组口服消银汤,对照组口服复方青黛胶囊,疗程共8周。记录治疗前与治疗后第4、8周银屑病皮损面积和严重程度指数(PASI)评分,并且评价临床疗效,检测两组患者治疗前后IL-17、IL-22、IL-23的表达水平。结果 治疗组治疗有效率优于对照组(P<0.01)。治疗组治疗后PASI评分低于对照组(P<0.05)。治疗组和对照组治疗后IL-17、IL-22、IL-23水平均低于治疗前(P<0.05);治疗组治疗后上述各指标均低于对照组(P<0.05)。治疗组和对照组IL-17、IL-22、IL-23水平与 PASI 评分呈正相关(P<0.01)。结论 消银汤治疗寻常型银屑病血热证有较好的疗效,可能与降低患者血清中IL-17、IL-22、IL-23表达水平有关。
银屑病;消银汤;白细胞介素-17;白细胞介素-22;白细胞介素-23
银屑病是一种常见并且容易复发的以红斑鳞屑为主要症状的慢性炎症性皮肤病,该病病程较长,对患者的精神及身体健康影响很大,是目前皮肤科领域里重点研究的疾病之一[1]。银屑病的病因和发病机制不明,多数学者认为与免疫因素有关。近期研究表明,一类新型的CD4+T细胞亚群Th17细胞在银屑病发病过程中发挥了重要作用[2]。消银汤是本课题组在临床上实践发现,能有效地治疗中医辨证为血热证的寻常型银屑病。本研究观察了消银汤对寻常型银屑病血热证患者的临床疗效及对患者治疗前后血清Th17细胞相关细胞因子白细胞介素(IL)-17、IL-22、IL-23水平的影响,旨在探求消银汤治疗银屑病的机制。
1 资料与方法
1.1 一般资料 收集2013年9月至2015年3月在重庆三峡医药高等专科学校附属医院皮肤科门诊收治105例寻常型银屑病血热证患者。其中,男54例,女51例;年龄18~60岁,平均(34.7±6.9)岁;病程 3个月至18 年,平均(38.6±11.3)个月。患者分为治疗组及对照组,其中治疗组53例,对照组52例。试验过程中脱落病例5例:治疗组脱落3例,脱落率为5.66%;对照组脱落2例,脱落率为3.85%;两组观察病例中脱落率差异无统计学意义(P>0.05)。本试验完成有效病例100例,治疗组和对照组均为50例,患者在年龄、性别、病程及银屑病皮损面积和严重程度指数(PASI)评分方面差异均无统计学意义(P>0.05)。另外选取50例志愿者组成健康对照组,他们均来自于该院体检中心。各组在性别、年龄等各方面差异均无统计学意义(P>0.05),具有可比性。本研究得到了医院伦理委员会的批准并且与受试者签署了知情同意书。
1.2 方法
1.2.1 诊断标准 寻常型银屑病西医诊断标准参照赵辨主编的《中国临床皮肤病学》[1],银屑病血热证的诊断标准参照中华中医药学会颁布的《中医皮肤科常见病诊疗指南》[3]中白疕的中医辨证标准。
1.2.2 纳入标准 所有病例均符合寻常型银屑病血热型辨证标准;年龄为18~65 岁,性别不限;3个月内无系统应用免疫抑制剂、维A酸类或糖皮质激素类药物,近2周内未使用外用药物;身体健康,无其他内科疾患,血、便、尿常规及肝功能、肾功能均正常。
1.2.3 排除标准 不符合银屑病血热证辨证标准;合并有严重心、肝、肾疾患者;患有高血压、糖尿病、高血脂、恶性肿瘤等系统疾病患者;妊娠或哺乳期妇女;精神病患者;对本中药过敏或对药物成分过敏者。
1.2.4 治疗方法 治疗组给予消银汤。方药为黄芩10 g,牡丹皮12 g,生地15 g,半枝莲30 g,赤芍15 g,白花蛇舌草15 g,槐花10 g,紫草10 g,玄参15 g,丹参15 g,鸡血藤15 g和甘草6 g。服药方法为每天1剂,水煎3次,取汁500 mL,分3次服用。对照组给予复方青黛胶囊(陕西天宁制药有限责任公司)。服药方法为每次4 粒,每日 3 次,餐后半小时服用。4周为1个疗程,连续治疗2个疗程,治疗期间忌生冷、辛辣、腥膻等食物,治疗前、后做血便尿常规及肝功能、肾功能检查。患者每 2 周复诊1次,进行疗效评价和不良反应观察,并于治疗前及治疗后第4、8周时进行 PASI评分。
1.2.5 血清细胞因子检测 采集各组患者治疗前后及健康对照组清晨空腹外周血5 mL,室温血液自然凝固10~20 min后3 000 r/min离心15 min,收集上清液(如有沉淀形成,应再次离心)保存,采用酶联免疫吸附试验(ELISA)法检测各组血清中IL-17、IL-22、IL-23细胞因子的表达水平。具体操作步骤按照试剂盒说明书进行,该试剂盒购于深圳晶美生物公司。
1.2.6 疗效评价标准[4]按照皮损面积和皮损的严重程度对患者治疗前、后的症状和体征进行PASI评分,疗效指数=(治疗前 PASI值-治疗后 PASI值)/治疗前 PASI值×100%。痊愈为皮损全部消退,PASI评分减少大于或等于90%;显效为皮损大部分消退,PASI评分减少60%~<90%;有效为皮损部分消退,PASI评分减少30%~<60%;无效为皮损消退不明显,未减轻或反见加重,PASI评分减少小于30%。有效率=(痊愈例数+显效例数)/总例数×100%。

2 结 果
2.1 两组临床疗效比较 治疗4周时,治疗组与对照组疗效比较差异无统计学意义(Z=-1.767,P>0.05);治疗8周时,治疗组与对照组比较,差异有统计学意义(Z=-2.953,P<0.01),治疗组临床疗效优于对照组,见表1。
2.2 两组治疗前后PASI评分比较 两组治疗前PASI评分比较差异无统计学意义(P>0.05),在治疗4周和8周时PASI评分均明显低于治疗前(P<0.01)。治疗8周后,治疗组PASI评分与对照组比较,差异有统计学意义(P<0.05),见表2。
2.3 两组治疗前后细胞因子水平比较 两组治疗前血清IL-17、IL-22和IL-23水平均高于健康对照组(P<0.01)。两组治疗后血清IL-17、IL-22和IL-23水平均较治疗前降低,差异有统计学意义(P<0.05);两组治疗后比较前述各项指标差异均有统计学意义(P<0.05),见表3。
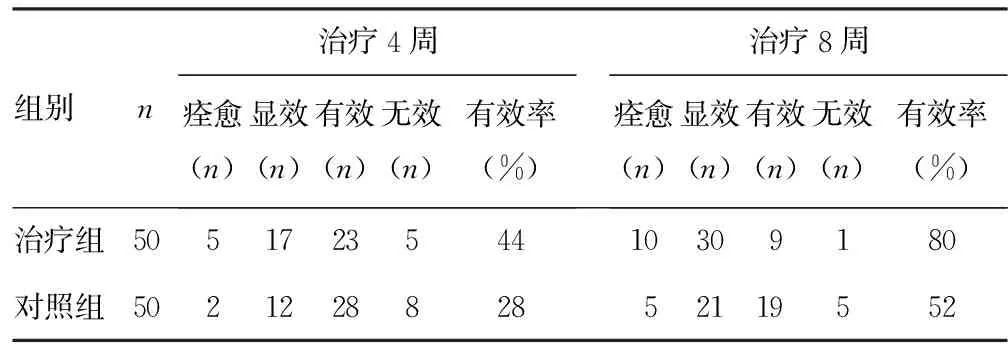
表1 治疗组与对照组临床疗效比较

表2 两组治疗前后PASI评分比较,分)
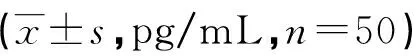
表3 各组患者治疗前后血清IL-17、IL-22和IL-23水平比较
2.4 血清细胞因子水平与PASI评分的相关性分析 将两组患者血清IL-17、IL-22、IL-23检测结果与患者PASI评分进行Spearman相关性分析,结果显示,两组患者血清各细胞因子表达水平与PASI评分均呈正相关(P<0.01),见表4。

表4 血清细胞因子水平与PASI评分相关性分析表
2.5 治疗过程中不良反应情况 治疗组有5例患者在用药初期出现了轻微的腹泻,考虑可能与组方中过多的清热药物有关系;对照组有4例患者在治疗过程中出现了胃部不适。嘱患者服药时间严格按照饭后半小时或者少量频服后症状逐渐消失,并且均坚持服完整个疗程。其余患者均未见明显不良反应。治疗过程中未见血、便、尿常规和肝功能、肾功能异常反应病例。
3 讨 论
银屑病是一种多基因遗传背景下T细胞介导的自身免疫性疾病[5],大部分学者认为Th1/Th2比例平衡失调是引起银屑病的重要原因,且表现为典型的Th1优势应答[6]。随着免疫学的研究进展,近年发现了一类新型的CD4+T细胞亚群,该细胞亚群不同于Th1和Th2,它能够分泌IL-17、IL-22、IL-23等细胞因子,被称为Th17细胞[7]。目前研究认为Th17细胞可能在银屑病发病机制中发挥着重大作用,该细胞及其相关细胞因子已经成为了当前研究的热点内容[8]。
转化生长因子β1(TGF-β1)、IL-6、IL-23、IL-21等炎症因子共同作用下,初始CD4+T细胞被诱导分化成Th17细胞并且增殖并活化[9-10]。Th17细胞被异常活化后会释放出大量的细胞因子,这些细胞因子使角质形成细胞和内皮细胞增殖,从而形成银屑病的病理表现。在这个过程中,炎性因子又会相互作用,最终演变为皮肤的慢性炎症损害[11]。IL-17被认为是Th17细胞产生的最主要的细胞因子,它参与了炎症反应的发生和机体防御功能等[12]。IL-17家族有IL-17A~F 6个成员,其中IL-17A、IL-17F在银屑病的发病过程中起着重要作用[13]。IL-22是IL-10细胞因子家族成员之一,它可以促进银屑病样表皮改变,抑制角质形成细胞增殖与迁移,诱导炎症因子产生并且与之发挥协同作用,从而引发银屑病皮损[14]。IL-23是促进Th17细胞分化的重要细胞因子,Cai等[12]发现IL-23通过刺激真皮层γδT细胞释放IL-17,引起了银屑病的发生。
银屑病俗称“牛皮癣”,中医称之为“白疕”,由于患者营血亏损,血热内蕴,化燥生风,肌肤失养而成。寻常型银屑病血热证是临床常见的证型,清热凉血法被认为是治疗该证型有效的治疗方法。消银汤是临床经验方,治疗血热证有显著疗效。方中生地、丹皮、赤芍、紫草、玄参清热凉血;生地、玄参滋阴润燥;丹皮、赤芍、丹参、鸡血藤凉血活血;白花蛇舌草、半枝莲、玄参清热解毒;黄芩清肺热,槐花清大肠热;甘草调和诸药。诸药配伍,共奏清热解毒、凉血消斑,同时还兼有滋阴润燥的功效,使清热不伤阴,凉血不留瘀。
本研究结果显示,消银汤治疗寻常型银屑病血热证临床效果显著。治疗4周时,治疗组和对照组临床疗效和PASI评分没有明显区别;治疗8周后,治疗组临床疗效明显优于对照组(P<0.01),同时治疗后PASI评分低于对照组(P<0.05);治疗组治疗后IL-17、IL-22、IL-23水平和对照组比较,更接近于正常水平,说明消银汤组疗效优于复方青黛胶囊组。进一步研究发现,两组寻常型银屑病血热证患者治疗前,其血清IL-17、IL-22、IL-23水平均明显高于健康对照组(P<0.01),治疗后,IL-17、IL-22、IL-23水平出现相应下降(P<0.05),并且血清IL-17、IL-22、IL-23表达水平与PASI评分呈正相关,此结果与之前报道一致[14-15],提示IL-17、IL-22、IL-23水平可以反映寻常型银屑病血热证患者病情的严重程度,也表明其在银屑病发病机制中的重要作用。消银汤对IL-17、IL-22、IL-23均有抑制作用,推测消银汤可能是通过抑制患者血清中Th17细胞,从而抑制细胞因子IL-17、IL-22、IL-23水平来发挥治疗寻常型银屑病血热证的作用的。至于消银汤是通过何种机制来抑制Th17细胞及其相关细胞因子水平还有待进一步的研究。
[1]赵辨.中国临床皮肤病学[M].南京:江苏科学技术出版社,2009:1008-1009.
[2]Pan HF,Leng RX,Feng CC,et al.Expression profiles of Th17 pathway related genes in human systemic lupus erythematosus[J].Mol Biol Rep,2013,40(1):391-399.
[3]中华中医药学会.中医皮肤科常见病诊疗指南[M].北京:中国中医药出版社,2012:1-7.
[4]徐蓉,王洁,李福伦,等.加味芩珠凉血方及辨证加减治疗寻常型银屑病(血热证)的临床疗效观察[J].时珍国医国药,2012,23(2):424-426.
[5]Kastelan M,Massari LP,Pasic A,et al.New trends in the immunopathogenesis of psoriasis[J].Acta Dermatovenerol Croat,2004,12(1):26-29.
[6]盛国荣,谢勇,刘海琴.退银汤联合窄谱中波紫外线治疗寻常型银屑病的疗效及对外周血相关细胞因子表达水平的影响[J].中国医院药学杂志,2014,34(7):576-580.
[7]Annunziato F,Cosmi L,Santarlasci V,et al.Phenotypic and functional features of human Th17 cells[J].J Exp Med,2007,204(8):1849-1861.
[8]叶萍,黄伟林,郑力.Th17细胞相关因子与寻常型银屑病的相关性研究[J].重庆医学,2013,42(15):1706-1707,1710.
[9]Lee YK,Turner H,Maynard CL,et al.Late developmental plasticity in the T helper 17 lineage[J].Immunity,2009,30(1):92-107.
[10]苏彤,陈宏,李璐,等.寻常性银屑病患者外周血白介素17,白介素23 mRNA的表达及与病情相关性研究[J].中华皮肤科杂志,2014,47(4):278-281.
[11]范斌,李峰,李欣,等.血热证银屑病患者Th17细胞与相关转导因子的表达[J].时珍国医国药,2012,23(10):2612-2614.
[12]Cai Y,Shen X,Ding C,et al.Pivotal role of dermal IL-17-producing γδ T cells in skin inflammation[J].Immunity,2011,35(4):596-610.
[13]丁文媛,乌日娜.银屑病中 Th17相关细胞因子的研究进展[J].医学综述,2015,21(4):591-592.
[14]刘军麟,邹循辉,殷梅.寻常型银屑病患者IL-22水平的变化及其临床意义[J].重庆医学,2014,43(21):2809-2810,2829.
[15]张宇虹,郭在培,焦晓燕,等.白芍总苷对轻、中度寻常性银屑病患者血清中IL-17和IL-23的影响[J].中国皮肤性病学杂志,2012,26(5):391-392,398.
重庆市万州区科技计划项目(201303042)。 作者简介:宋红霞(1981-),硕士,讲师,主要从事中医药治疗皮肤病的基础方面研究。△
10.3969/j.issn.1671-8348.2016.23.035
R758.63
B
1671-8348(2016)23-3267-03
2016-04-19
2016-06-12)

