化学发光微粒子免疫分析在丙型肝炎诊断中的应用价值*
葛金莲,唐 婧,罗德梅,孟存仁
(新疆医科大学第一附属医院医学检验中心,乌鲁木齐 830054)
化学发光微粒子免疫分析在丙型肝炎诊断中的应用价值*
葛金莲,唐 婧,罗德梅,孟存仁△
(新疆医科大学第一附属医院医学检验中心,乌鲁木齐 830054)
目的 研究化学发光微粒子免疫分析(CMIA)在丙型肝炎诊断中的应用价值。方法 收集2014年4月至2015年4月该院住院患者350例血清标本,依照临床诊断分为丙型肝炎病例组(128例)和非丙型肝炎对照组(222例),分别用酶联免疫吸附试验(ELISA)、CMIA、PCR-荧光探针法和重组免疫印迹法(RIBA)检测,并对结果进行比较。结果 丙型肝炎病例组的ELISA,CMIA及PCR-荧光探针法检测阳性率高于非丙型肝炎对照组,RIBA则较低。CMIA的灵敏度、特异度、阳性预测值、阴性预测值、符合率和约登指数分别为95.3%、95.5%、92.4%、97.3%、95.4%和90.8%。CMIA与ELISA比较,CMIA的特异度、阳性预测值、符合率和约登指数比ELISA高,差异有统计学意义(P<0.05)。CMIA与PCR比较,CMIA的灵敏度、阴性预测值、符合率和约登指数比PCR-荧光探针法高,差异有统计学意义(P<0.05),特异度比PCR-荧光探针法低,差异有统计学意义(P<0.05)。CMIA与RIBA比较,CMIA的灵敏度、阴性预测值和约登指数比RIBA高,差异有统计学意义(P<0.05),特异度比RIBA低,差异有统计学意义(P<0.05)。结论 CMIA具有高的灵敏度和阴性预测值,较高的特异度和阳性预测值,符合率高,约登指数高且诊断价值高。
肝炎,丙型;分子探针;聚合酶链反应;酶联免疫吸附测定;化学发光微粒子免疫分析;PCR-荧光探针法
丙型肝炎病毒(HCV)慢性感染可导致肝脏慢性炎症坏死和纤维化,部分可发展为肝硬化甚至肝细胞癌,对健康和生命危害极大,已成为严重的社会和公共卫生问题[1]。目前,HCV感染的诊断方法主要是HCV抗体和HCV-RNA检测。 其中HCV抗体的检测方法主要是酶联免疫吸附试验(ELISA)、化学发光微粒子免疫分析(CMIA)和重组免疫印迹法(RIBA)。HCV-RNA检测方法主要是PCR-荧光探针法。本试验采用CMIA对350例血清标本进行检测,并同时采用ELISA、PCR-荧光探针法和RIBA检测,将结果进行比较分析,以研究CMIA在丙型肝炎检测方面的临床应用价值。
1 资料与方法
1.1 一般资料 收集2014年4月至2015年4月本院住院患者350例。根据临床诊断将其分为丙型肝炎病例组和非丙型肝炎对照组。其中丙型肝炎病例组128例,其中男68例,女60例;年龄1~78岁,平均年龄45岁。非丙型肝炎对照组222例,其中男100例,女122例;年龄3~80岁,平均年龄38岁。符合下列任何一项即可诊断为临床诊断丙型肝炎病例:(1)符合血清丙型肝炎抗体阳性和流行病学史;(2)符合血清丙型肝炎抗体阳性和临床表现;(3)符合血清丙型肝炎抗体阳性和血清丙氨酸氨基转移酶和门冬氨酸氨基转移酶升高。纳入标准:(1)年龄1~78岁,性别不限;(2)符合丙型肝炎的诊断标准。排除标准:肝硬化;重叠乙型肝炎病毒(HBV)感染;自身免疫性肝炎。本研究对象为人血清,其遵循的程序符合本院伦理委员会的伦理认证。
1.2 方法
1.2.1 试剂和仪器
1.2.1.1 ELISA TECAN加样系统(瑞士帝肯公司);FAME后处理系统(瑞士哈美顿公司);HCV抗体诊断试剂盒:ELISA(北京万泰生物药业股份有限公司,批号:C20130406)。
1.2.1.2 CMIA ARCHITECT i2000全自动化学发光免疫分析仪(美国雅培贸易上海有限公司);HCV抗体测定试剂盒:化学发光微粒子免疫检测法(美国雅培贸易上海有限公司,批号:50368LI00)。
1.2.1.3 PCR-荧光探针法 ABI Prism 7300检测仪(美国ABI公司);HCV核酸定量检测试剂盒:PCR-荧光探针法(中山大学达安基因股份有限公司,批号:2015002 )
1.2.1.4 RIBA 加样枪(Eppendorf);摆动摇床(上海智城);HCV抗体确证试剂盒:RIBA(北京万泰生物药业股份有限公司,批号:RC20130101)。
1.2.2 检测方法 (1)ELISA:本试剂盒采用间接法ELISA原理。在微孔条上预包被基因重组HCV结构和非结构区抗原,配以酶标记免疫球蛋白G(IgG)抗体及TMB显色剂等其他试剂,检测人血清或血浆中的HCV抗体。(2)CMIA:ARCHITECT人类免疫缺陷病毒(HIV)抗原抗体联合检测是采用两步法免疫检测, 通过CMIA技术与灵活的检测模式相结合,检测人血清和血浆中的HIV p24抗原及HIV 1(M组和O组)/HIV-2抗体。(3)PCR-荧光探针法:本试剂盒利用吸附柱法提取血清/血浆样本中的HCV-RNA;采用TaqMan荧光探针检测技术结合PCR扩增法进行检测,选择HCV保守区域作为检测靶基因,设计特异性的检测引物和荧光检测探针,探针5′标记为FAM荧光基团,3′BHQ1淬灭基团。同时检测体系中含有内参对照品,内参对照品检测的探针5′标记为VIC荧光基团。提取的RNA经逆转录为cDNA,利用实时荧光定量PCR检测技术,通过PCR过程中荧光信号的变化和RNA标准品扩增的荧光信号值的变化,实现对样本中的核酸进行定量检测;通过检测内参对照品扩增是否正常來监测待测样本的处理过程及检测中是否存在PCR抑制反应,避免检测的假阴性。(4)RIBA:本试剂盒采用RIBA法原理,在硝酸纤维素膜条上预包被HCV合成抗原、重组抗原(Core、NS3、NS4、NS5)及对照线蛋白。将血清或血浆样品稀释,硝酸纤维素膜条浸泡在其中,与其反应,加入酶标记的抗人IgG抗体,与其反应,温育,如样品中含有HCV特异性抗体,则会形成“抗原-抗体-酶标二抗”复合物,加入底物,与其反应,显色,加入终止液,终止反应,判断结果。
1.3 统计学处理 采用SPSS17.0统计软件进行分析。灵敏度、特异度、阳性预测值和阴性预测值用率表示,组间采用χ2检验,符合率和约登指数的差异比较用z检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
丙型肝炎病例组ELISA、CMIA及PCR-荧光探针法测阳性率高于非丙型肝炎对照组,RIBA则较低,见表1。CMIA与ELISA比较,CMIA的特异度、阳性预测值、符合率和约登指数比ELISA高,差异有统计学意义(P=0.028、0.041、0.033、0.000)。CMIA与PCR-荧光探针法比较,CMIA的灵敏度、阴性预测值、符合率和约登指数比PCR-荧光探针法高,差异有统计学意义(P=0.000、0.000、0.033、0.000),特异度比PCR低,差异有统计学意义(P=0.019)。CMIA与RIBA比较,CMIA的灵敏度、阴性预测值和约登指数比RIBA-荧光探针法高,差异有统计学意义(P=0.001、0.003、0.000),特异度比RIBA低,差异有统计学意义(P=0.049),见表1、2。
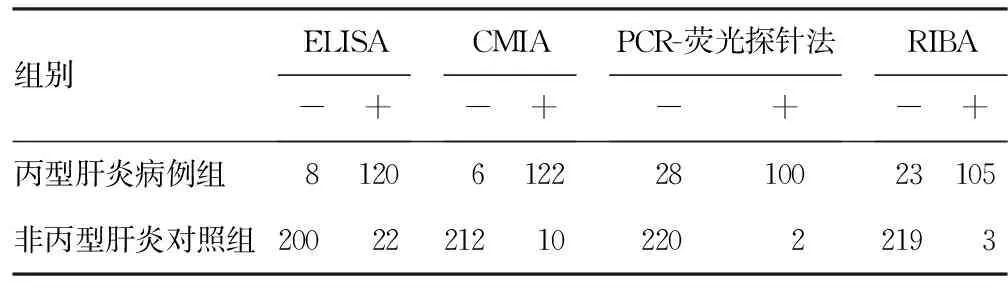
表1 ELISA、CMIA、PCR和RIBA的检测结果(n)
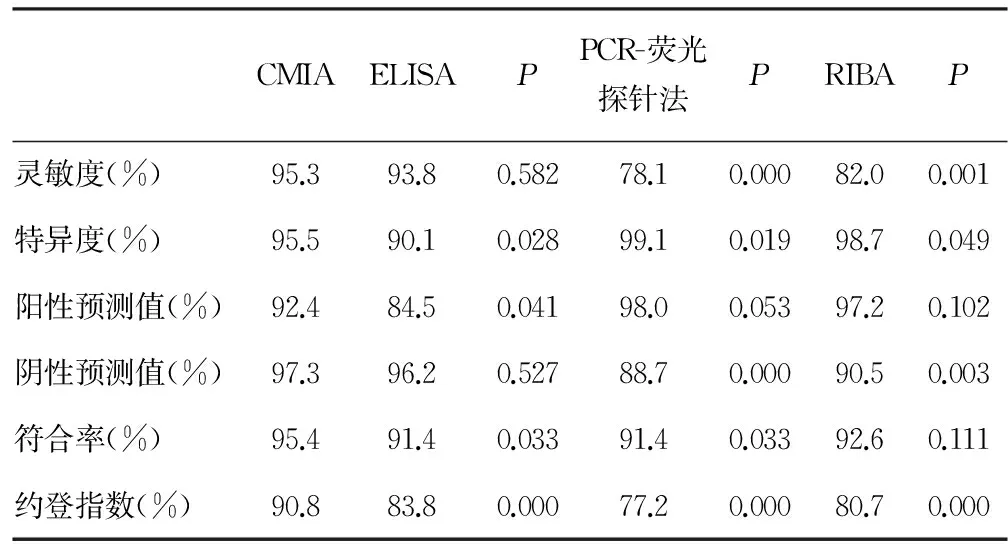
表2 CMIA和ELISA、PCR、RIBA检测结果比较
3 讨 论
丙型肝炎由HCV感染引起,全球每年有300~400万人感染HCV,超过35万人死于与HCV相关的肝脏疾病。全球约有1.7亿 HCV感染者,其中约1.5亿人为慢性丙型肝炎患者。我国的HCV慢性感染率居全球第3(3.2%),仅次于埃及和巴基斯坦[2]。目前,临床上检测HCV感染的方法主要有血清学方法和分子生物学方法。分子生物学方法技术较为复杂且试剂费用较昂贵;而血清学技术操作简单,费用也较低廉。因此,临床上多采用血清学技术[3]。
本研究结果显示,CMIA与ELISA比较,CMIA的特异度、阳性预测值、符合率和约登指数比ELISA高,表明CMIA检测抗-HCV相对于ELISA误诊率较低,即假阳性率较低,准确度较高,其诊断价值较高。ELISA具有简单、快速、方便的特点,但对灰区结果判读的可靠性通常较差。ELISA试剂为筛检试剂,存在一定数量的假阴性和假阳性结果[4-5]。汤巧等[3]研究表明CMIA法敏感性和特异性均高于ELISA,ELISA结果边缘值较多,判断结果较为困难,而CMIA干扰较小,特异性高,对HCV抗体的检测更准确和灵敏。用ELISA法检测血清中抗HCV的过程中,HCV抗体的检测结果影响因素较多,易出现假阳性[6-8],同时因敏感度不够,可能出现假阴性[9]。CMIA法采用苯并荧葱为发光底物,且洗涤液的特殊配方可有效排除其他因素的干扰,能高度敏感地检测出HCV抗体。汪欣等[10]研究表明CMIA法检测的灵敏度高于ELISA法,但经统计学比较,二者差异无统计学意义(P>0.05),说明目前ELISA法检测抗HCV诊断试剂盒已较为成熟,同样具有较高的灵敏度。
酶联免疫HCV抗体检测虽然简便易行,但检测局限,易将窗口期标本漏检,而CMIA检测的应用缩短了HCV感染诊断的窗口期,也使抗病毒治疗的监测成为可能。CMIA以微粒替代平板,增加了免疫承载反应表面和速度,粒子与液态中的分子的双向运动代替了ELISA中液态分子的单项扩散。同时,由于微粒子的分离、洗涤均较平板方便,所以有利于提高自动化程度。在微粒子基础上应用发光放大系统,使检测敏感度得到进一步提高,理论上微粒子发光检测的敏感度比ELISA提高数百至上千倍。综上技术优势,CMIA较之ELISA在敏感性、准确性、重复性和自动化程度上均有提高[11]。
本研究结果显示,CMIA与PCR比较,灵敏度、阴性预测值、符合率和约登指数比PCR高,特异度比PCR低,表明CMIA检测抗-HCV相对于PCR漏诊率较低,即假阴性率较低,准确度较高,其诊断价值较高,误诊率较高,即假阳性率较高。实时荧光定量PCR技术是实时监测整个PCR进程,并且将荧光基团加入在PCR反应引物序列上。目前国外应用磁珠技术和TaqMan,实现了从核酸提取到结果分析的全自动化,其全自动化流程减少了来自气溶胶的污染,因而定量检测的效率和精密度有了明显提高。但是国内尚未大规模应用,因其全套设备和试剂价格昂贵。实时荧光定量PCR技术的最低检测限可达12~15 IU/mL,敏感性高于定性试验。其线性范围可达(4.3~6.9)×107IU/mL,并且可以检出HCV所有基因型。由于HCV-RNA定量检测无法反映HCV肝内复制情况,因此HCV-RNA检测阴性结果并不能排除HCV感染。同时,检测存在漏检的可能,因此需要随访RNA阳性者[12]。
本研究结果显示,CMIA与RIBA比较,灵敏度、阴性预测值和约登指数比RIBA高,特异度比RIBA低,表明CMIA检测抗-HCV相对于RIBA漏诊率较低,即假阴性率较低,其诊断价值较高,误诊率较高,即假阳性率较高。RIBA是HCV感染的确证试验,主要解决ELISA中的假阳性问题。伴随着检测技术的提高,出现了第3代ELISA试剂,其敏感性和特异性均有较大的提高,对于抗-HCV强阳性者,RIBA并不能提供更多的有关HCV感染的信息,对于抗-HCV弱阳性者,RIBA可为阳性、不确定或阴性结果,对丙型肝炎的诊断没有帮助。从费用和效益的角度考虑,临床上诊断HCV感染,作ELISA即可,没有必要再作RIBA确证试验。RIBA也可应用于HCV血清型分型,但印迹法操作起来较为繁琐,限制了其在临床上的普遍应用[13]。RIBA的诊断试剂可降低假阳性反应,可降低阳性率达80%,因此丙型肝炎抗体阳性者需要补作RIBA确证试验。
综上所述,CMIA具有高的灵敏度和阴性预测值,较高的特异度和阳性预测值,符合率高,约登指数高且诊断价值高,更有助于HCV的协助诊断,具有广泛临床应用和推广意义。有助于医生对患者病情的掌握,是早期临床诊断有效控制丙型肝炎发生的重要手段;同时也是安全输血的需要,对保障临床输血和手术安全起到积极作用,可有效避免医疗纠纷[14]。
[1]柳丽娟,谢玉玲,戴振贤,等.丙型肝炎病毒抗体化学发光免疫检测方法的建立及其临床应用[J].生物技术通讯,2014,25(1):97-99.
[2]WHO.Hepatitis C[EB/OL].http://www.who.int/mediacentre/contacts/en.[2015-09-17].
[3]汤巧,吴文静,夏永祥.化学发光法和酶联免疫吸附法检测丙型肝炎病毒抗体的比较分析[J].国际检验医学杂志,2011,32(8):834-835.
[4]王福生.ELISA和PCR法筛查无偿献血者结果的分析[J].细胞与分子免疫学杂志,2010,26(4):398.
[5]叶燕芹,许文龙.丙型肝炎病毒感染试验室诊断进展[J].标记免疫分析与临床,2011,18(4):286-288.
[6]冯秀河,朱峰,王凤玲.酶联免疫吸附试验检测假阳性结果分析[J].中国误诊学杂志,2008,8(20):4870-4871.
[7]高艳,陈志强,麦永平,等.3组国产ELISA抗-HCV初复检试剂的检测效果评价[J].国际检验医学杂志,2010,31(7):743-744.
[8]刘文玉.酶联法检测丙型肝炎病毒抗体阳性分析[J].白求恩军医学院学报,2008,6(3):178-179.
[9]李瑞兰,李忠平,樊忠杰,等.HCV抗体检测临界值附近样本传播HCV风险的研究[J].临床输血与检验,2008,10(1):31-35.
[10]汪欣,吴旋,赵素萍,等.4种检测HCV抗体方法的应用评价[J].中国社区医师(医学专业),2012,14(29):205-206.
[11]周德众.化学发光微粒子免疫分析法与酶联免疫吸附法检测感染性疾病抗原抗体的比较[J].中外健康文摘,2012,9(38):236.
[12]毛远丽,王晗,李伯安.HCV试验室检测方法与临床应用[J].传染病信息,2012,25(2):75-79.
[13]尹秀华.丙型肝炎检测方法的研究进展[J].医学理论与实践,2013,26(2):171-173.
[14]高志峰,胡丽华,雒维.2种方法检测患者血清中丙肝抗体的对比分析[J].临床血液学杂志(输血与检验版),2011,24(4):456-457.
Application value of chemiluminescence microparticle immunoanalysis in the diagnosis of Hepatitis C*
GeJinlian,TangJing,LuoDemei,MengCunren△
(DepartmentofLaboratoryMedicine,theFirstAffiliatedHospital,XinjiangMedicalUniversity,Urumqi,theXinjiangUygurAutonomousRegion830054,China)
Objective To research the application value of chemiluminescent microparticle immunoassay in the diagnosis of Hepatitis C.Methods From April 2014 to April 2015,we collected 350 cases of serum samples from the first affiliated hospital of Xinjiang medical university.According to the clinical diagnosis,the patients were divided into observation group (128 cases) and the control group(222 cases).Eenzyme linked immunosorbent assay (ELISA),chemiluminescence microparticle immunoanalysis (CMIA),PCR fluorescence probe method and recombinant immunoblotting (RIBA) detection were used in this experiment.Results The positive of RIBA in control group was higher than that of observation group,while other measures turned to be the opposite.The sensitivity,specificity,PV+,PV-,coincidence rat and Youden index of CMIA method were 95.3%,95.5%,92.4%,97.3%,95.4% and 90.8% respectively.The specificity,PV+,coincidence rate and Youden index of CMIA were higher than those of ELISA,and the difference was statistically significant (P<0.05).The sensitivity,PV-,coincidence rate and Youden index of CMIA were higher than those of PCR,and the difference was statistically significant (P<0.05).The specificity of CMIA was lower than that of PCR,and the difference was statistically significant (P<0.05).Compared with RIBA,the sensitivity,PV- and Youden index were higher,and the difference was statistically significant (P<0.05);the specificity were lower,and the difference was statistically significant (P<0.05).Conclusion Chemiluminescent microparticle immunoassay analysis has high sensitivity,negative predictive value,higher specificity and positive predictive value,high coincidence rate,Youden index,and diagnostic value.
Hepatitis C;molecular probes;polymerase chain reaction;enzyme-linked immunosorbent assay;chemiluminescent microparticle immunoassay;PCR-fluorescence probing
卫生部医药卫生科技发展研究中心专项课题(28-1-13)。 作者简介:葛金莲(1968-),主管技师,本科,主要从事临床免疫学检验研究。△
论著·临床研究
10.3969/j.issn.1671-8348.2016.23.020
R446.9
A
1671-8348(2016)23-3226-03
2016-04-13
2016-06-26)

